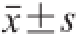 表示,数据采用统计分析软件SPSS 18.0进行统计分析,均值间比较采用Tukey’s多重比较,在0.05水平上进行显著性检验。
表示,数据采用统计分析软件SPSS 18.0进行统计分析,均值间比较采用Tukey’s多重比较,在0.05水平上进行显著性检验。
尹永祺 1,2,吴进贤 1,刘春泉 3,李大婧 3,杨润强 1,顾振新 1,*
(1.南京农业大学 农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095;2.扬州大学食品科学与工程学院,江苏 扬州 225127;3.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
摘 要:以玉米籽粒为实验材料,研究低氧胁迫下发芽时间、低温胁迫与回温解冻下的温度及时间对发芽玉米中γ-氨基丁酸(γ-aminobutyric acid,GABA)含量的影响,对其低氧和低温胁迫工艺进行了优化,同时对胁迫期间发芽玉米籽粒中GABA代谢酶活性的变化进行了研究。结果表明:玉米经低氧胁迫发芽72 h后,在-18 ℃冷冻6 h和25 ℃回温4 h条件下,发芽玉米中GABA含量增加29.9 倍,达到1.52 mg/g(以干质量计);低氧胁迫下发芽玉米籽粒主要是通过GABA支路富集GABA的。玉米籽粒是富集GABA的良好原料,且低氧与低温胁迫是富集发芽玉米中GABA的有效方式。
关键词:发芽玉米;低氧胁迫;低温胁迫;γ-氨基丁酸;富集
γ-氨基丁酸(γ-aminobutyric acid,GABA)是哺乳动物中枢神经系统中主要的抑制性神经递质,已被国家卫生部批准为新资源食品,其具有改善大脑血液循环、降低血压、治疗癫痫和增强肝肾功能等作用 [1-2]。近年来,植物富集GABA受到国内外食品科学工作者的高度关注。植物正 常生长条件下GABA含量仅为0.3~32.5 μmol/g [3],而在受到低氧、冷激、热激、盐胁迫和机械伤害等逆境时,其GABA含量显著增加 [4]。目前,国内外已对GABA在粟谷 [5]、蚕豆 [6]、大豆 [7]和糙米 [8]等植物性食品原料中的富集技术及其产品开发进行了大量研究,以玉米为原料富集GABA主要通过酶法富集玉米中GABA [8],而以玉米籽粒为原料通过逆境胁迫发芽富集发芽玉米中GABA的研究未见报道。
低氧与低温胁迫均是安全环保、操作方便的GABA富集方式,二者均能激活有利于GABA合成的谷氨酸脱羧酶(glutamate decarboxylase,GAD,EC 4.1.1.15)、二胺氧化酶(diamine oxidase,DAO,EC 1.4.3.6)和氨基醛脱氢酶(aminoaldehyde dehydrogenase,AMADH,EC 1.2.1.19)活性。低氧胁迫下,植物细胞中H +浓度提高,引起植物细胞质酸化,为GABA合成提供条件 [9]。低温胁迫可促使细胞中Ca 2+释放,提高钙调蛋白表达水平,从而激活谷氨酸脱羧酶,以促进GABA积累 [10]。
本研究以玉米为试材,研究低氧胁迫下发芽时间、低温胁迫与回温解冻下的温度及时间对发芽玉米中GABA生成的影响,对低氧和低温胁迫工艺进行了优化,探讨了胁迫期间发芽玉米籽粒中GABA代谢酶活性的变化,旨在探索低氧及低温胁迫下发芽玉米中GABA富集规律,为开发功能性玉米食品提供理论依据。
1.1 材料与试剂
玉米籽粒品种为京甜紫花糯,2012年收获,由北京燕禾金农业科技发展中心提供,原料封装于聚乙烯塑料袋中,4 ℃保存;GABA标准品、对二甲氨基苯磺酰氯、NAD +和4-氨基丁醛 美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Agilent 1200 Series高效液相色谱仪 美国Agilent公司;UV-2802型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;BCD-185HFA型冰箱 澳柯玛股份有限公司;Orion818型pH测试仪 美国Orion科学仪器公司。
1.3 方法
1.3.1 玉米浸泡处理
称取成熟饱满未破损的玉米籽粒20 g,经体积分数1%的次氯酸钠溶液浸泡消毒30 min,用离子水冲洗至pH值中性后,置于培养箱中于30 ℃黑暗条件下浸泡12 h。
1.3.2 低氧胁迫
浸泡后的玉米籽粒用去离子水润洗数次后,以200 mL去离子水为培养液,通入空气(通气量1.0 L/min,即溶氧量为4.6 mg/L),于30 ℃浸泡发芽4 d,每隔12 h取样测定GABA含量和酶活力。玉米发芽期间,每隔12 h更换培养液,直至培养结束。
1.3.3 低温胁迫
低温胁迫温度和时间实验:取经低氧胁迫发芽72 h的发芽玉米,除去表面水分后,分别于5、-5、-18 ℃贮存10 h,每隔2 h取样并将其置于密封袋中,于25 ℃解冻4 h,测定发芽玉米中GABA含量及GAD酶活力。
回温解冻温度和时间实验:取经低氧胁迫发芽72 h的发芽玉米,除去表面水分,分别于5、-5、-18 ℃贮存12 h后,将玉米置于密封袋中,于25 ℃解冻8 h,解冻期间每隔1 h取样,测定测定发芽玉米中GABA含量及GAD酶活力。
1.3.4 指标测定
GABA含量:参照Yang Runqiang等 [11]方法测定,结果以干质量计;GAD活力:参照Li Yan等 [6]的方法测定,结果以干质量计。
DAO活力:参照何生根等 [12]的方法,并略作修改。取待测玉米2 g,加入6 mL酶提取液(70 mmol/L磷酸钾缓冲液pH 6.5,体积分数10%甘油),冰浴研磨成浆后10 000 r/min冷冻离心15 min,上清液即为DAO酶粗提液。DAO活力测定的反应混合液含2 mL磷酸钾缓冲液(70 mmol/L,pH 6.5)、0.2 mL愈创木酚(25 mmol/L)、0.1 mL过氧化物酶溶液(250 U/mL)及0.5 mL DAO提取液。混合液于37 ℃水浴预保温3 min后分别加入0.1 mL 腐胺(50 mmol/L)启动反应,于555 nm波长处连续测定吸光度5 min。以每分钟A 555 nm变化0.01 个单位为1 个酶活力单位(U),结果以干质量计。
AMADH活力:称取1 g玉米,加入5 mL预冷酶提取液(0.1 mol/L pH 8.0 磷酸钾缓冲液,5 mmol/L 二硫苏糖醇,1mmol/L乙二胺四乙酸二钠,10 g/100 mL蔗糖),冰浴研磨成浆后于12 000 r/min冷冻离心30 min;上清液即为粗酶液。取适量酶液加入0.1 mol/L pH 8.0 Tris-盐酸缓冲液,内含1 mmol/L NAD +,加入终体积为1 mmol/L的4-氨基丁醛启动反应,37 ℃于340 nm波长处连续测定吸光度,以每分钟A 340 nm变化0.01 个单位为1 个酶活力单位(U) [13],结果以干质量计。
1.4 数据处理与统计分析
实验设3 次重复,结果以
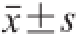 表示,数据采用统计分析软件SPSS 18.0进行统计分析,均值间比较采用Tukey’s多重比较,在0.05水平上进行显著性检验。
表示,数据采用统计分析软件SPSS 18.0进行统计分析,均值间比较采用Tukey’s多重比较,在0.05水平上进行显著性检验。
2.1 低氧胁迫发芽时间对GABA含量的影响
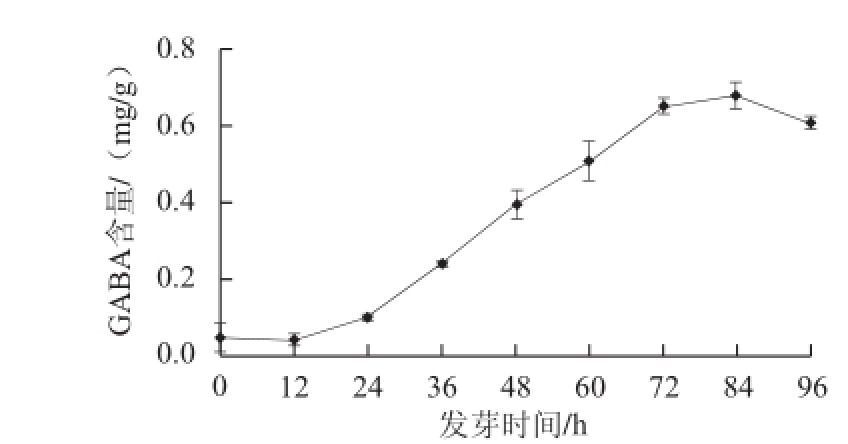
图1 玉米低氧胁迫发芽期间GABA含量的变化
Fig.1 Changes in GABA contents of maize during germination under hypoxia
由图1可知,玉米在低氧条件下发芽0~96 h期间,GABA含量呈先增加后减少趋势。发芽0~24 h阶段GABA含量增加缓慢,其后GABA含量快速增加,72~84 h时GABA含量最高。发芽72 h时其GABA含量是发芽初始的13.15 倍。
2.2 低氧胁迫发芽过程中GAD活力变化
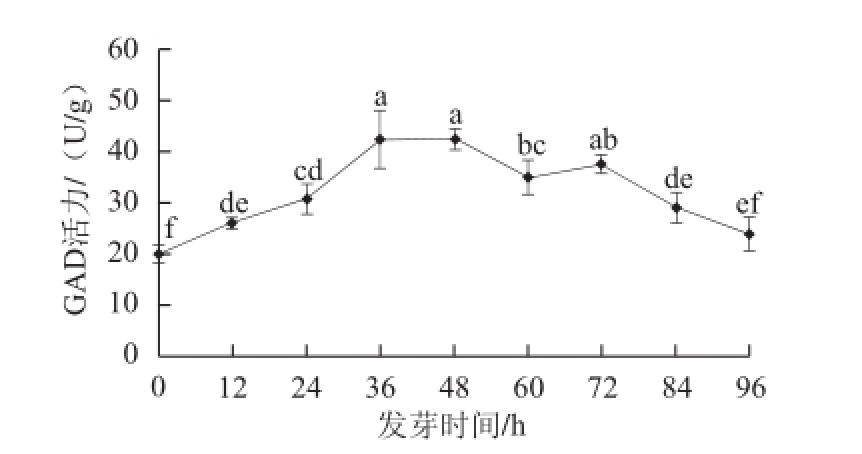
图2 玉米低氧胁迫发芽期间GAD活力变化
Fig.2 Changes in GAD activity of maize during germination under hypoxia
小写字母不同表示处理间GAD活力差异达显著水平(P<0.05)。下同。
由图2可知,低氧胁迫发芽期间,GAD活力呈先增加后降低趋势。在发芽36~48 h阶段GAD活力最高,是发芽0 h的2.14 倍,发芽48~72 h内GAD活力维持在较高水平,其后酶活力显著下降。
2.3 低氧胁迫发芽过程中DAO和AMADH活力变化
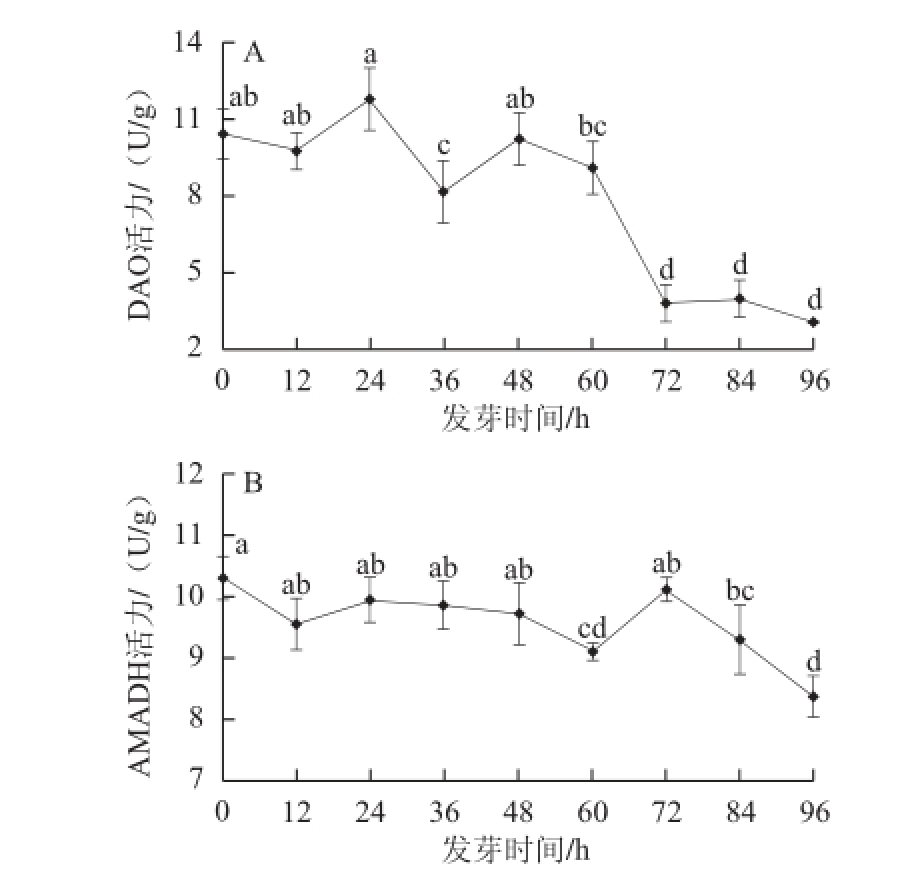
图3 玉米低氧胁迫发芽期间GAD(A)和AMADH(B)活力变化
Fig.3 Changes in GAD (A) and AMADH (B) activities in maize during germination under hypoxia
由图3A可知,在玉米低氧胁迫发芽96 h期间,多胺降解途径中合成GABA的限速酶——DAO活力总体呈下降趋势,72 h时其酶活力仅为发芽初始36.8%,其后无显著性变化。
AMADH是多胺降解途径合成GABA最后一步反应的酶。图3B显示,玉米中AMADH活力在低氧胁迫发芽72 h内呈较稳定趋势,72 h后其酶活力显著下降。
2.4 低温胁迫及回温解冻的温度和时间对GABA含量的影响
由图4A可知,玉米低温胁迫0~10 h后,在常温条件(25 ℃)回温解冻4 h时GABA含量呈现逐渐增加而后降低的趋势。其中-18 ℃冷冻玉米0~6 h再解冻4 h后发芽玉米GABA含量显著增加,直至达到峰值(1.38 mg/g),是未低温处理者的2.3 倍,其后无显著变化。5 ℃低温处理的效果最差,但低温处理后GABA含量比未处理者增加0.91 倍。-5 ℃低温处理8 h后GABA富集量达到1.19 mg/g。
由图4B可知,玉米低温胁迫12 h后在常温条件(25 ℃)回温解冻0~8 h,GABA含量呈现逐渐增加的趋势,其中以在-18 ℃条件下冷冻后回温解冻的玉米GABA含量最高,回温4 h后为未低温处理者的1.44 倍,含量高达1.57 mg/g,其后无显著增加。-5 ℃冷冻后回温处理的GABA含量达到1.42 mg/g。5 ℃处理的玉米效果较差,但其GABA含量比未低温处理的增加36.5%。解冻4 h后玉米中GABA含量无显著变化。

图4 玉米低温胁迫(A)及回温解冻(B)对GABA含量的影响
Fig.4 Effect of freezing-thawing (A) or chilling-warming (B) on GABA contents of maize
2.5 低温胁迫及回温解冻过程中GAD活力变化
如图5A所示,发芽玉米经过不同程度低温胁迫并经历不同时间后,在常温(25 ℃)下回温解冻4 h后,GAD活力对比未处理组均有提高,且其变化趋势与GABA变化趋势一致。对比3 种低温处理,以-18 ℃处理GAD活力提高效果最好,其GAD活力在处理过程中一直高于-5 ℃和5 ℃处理,冷冻6 h、解冻4 h后,玉米GAD活力是未冷冻常温放置4 h玉米的2.13 倍。其次为-5 ℃处理,冷冻4 h后再解冻后其GAD活力均能保持7.5 U/g的水平,5 ℃处理条件下玉米GAD活力增加最少。
由图5B可知,发芽玉米经低温处理并解冻后其GAD活力变化趋势一致,均呈先下降后趋于稳定趋势。-18 ℃条件下冷冻的玉米解冻过程中其GAD活力持续高于-5 ℃和5 ℃处理。
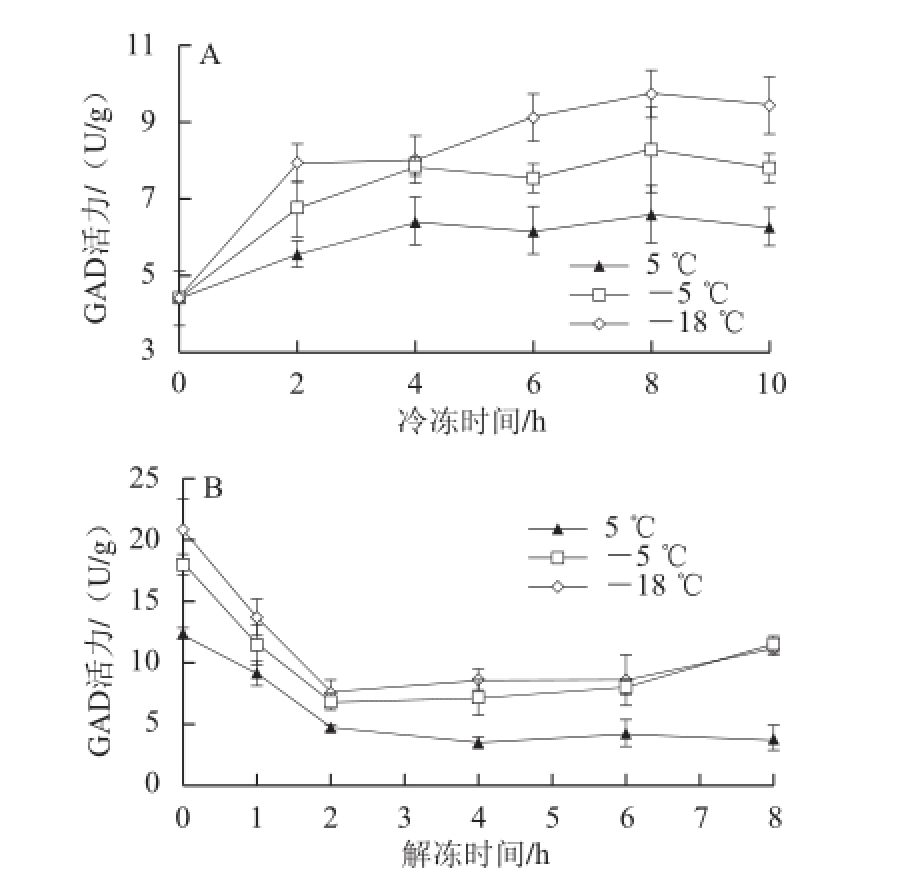
图5 低温胁迫(A)及回温解冻过程(B)中玉米GAD活力的变化
Fig.5 Changes in GAD activity of maize during freezing-thawing (A) or chilling-warming (B)
2.6 低氧和低温胁迫对发芽玉米GABA富集作用的影响
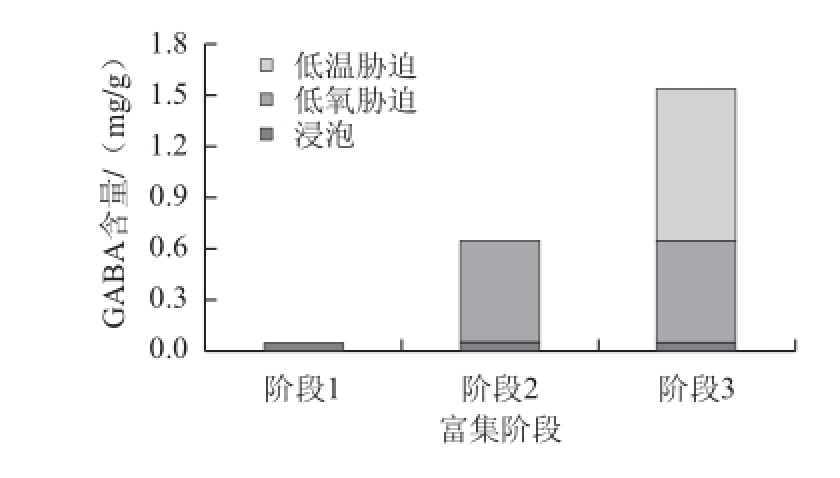
图6 低氧与低温胁迫对GABA含量的影响
Fig.6 Effect of hypoxia stress and cold stress on GABA content
由图6可知,玉米经低氧胁迫和低温胁迫处理后其GABA含量达1.52 mg/g,是浸泡后玉米的30.9 倍,其中低氧胁迫和低温胁迫阶段产生的GABA含量分别占玉米富集GABA总含量的37.4%和59.4%。
植物受到洪涝缺氧、干旱、盐胁迫、冷激和热激等逆境胁迫时,体内GABA含量显著增加 [4],其中以低氧胁迫诱导植物积累GABA量最大 [14]。植物在低氧环境中呼吸受到抑制,氧的亏缺造成代谢过程电子传递中断,糖类多转化为丙酮酸,最终分解为乳酸和乙醇,导致细胞质酸化。存在于植物细胞质中的GAD在酸性条件下被激活,催化Glu脱羧生成GABA,从而达到富集GABA的效果 [4]。玉米ZHN在低氧胁迫发芽0~96 h期间GABA含量呈现先增加后下降的变化趋势。从萌发至发芽24 h阶段,GABA增加缓慢,这可能是玉米在此萌发阶段需氧量小、低氧环境对其发芽胁迫不显著的缘故,其后GABA含量显著增加,直至72 h;玉米发芽84 h后GABA含量下降,可能是内部营养物质逐渐消耗,导致合成GABA的底物不足,同时,GABA合成时消耗用于合成其他蛋白质和氨基酸 [15],进而影响GABA的富集。
高等植物主要通过GABA支路和多胺降解途径合成GABA。GAD作为GABA支路中合成GABA的限速酶 [16],在玉米籽粒发芽早期其活力显著提高,由此GABA含量逐步提高。GAD活力在36~72 h阶段保持较高水平,同期GABA含量成倍增加。姚森等 [17]在研究糙米后均指出,GABA和GAD呈显著正相关。DAO是多胺降解途径富集GABA的关键酶 [18],AMADH则是该途径的限速酶。本研究显示低氧胁迫下玉米发芽过程中DAO活力一直处于低水平,这与Yang Runqiang等 [11]低氧胁迫下发芽蚕豆富集GABA研究中的DAO活力有两个数量级的差距,而与陈惠等 [19]采用DAO专一抑制剂——氨基胍抑制低氧联合盐胁迫蚕豆发芽后DAO活力相当。由此推测,多胺降解途径对于低氧胁迫下玉米发芽富集GABA贡献率不高。AMADH活力水平低也证实多胺降解途径对玉米富集GABA影响有限。
Mazzucotelli等 [10]在阐述低温胁迫对大麦幼苗GABA积累的影响机制时表明,-3 ℃处理大麦幼苗16 h后正常发芽48 h时,GABA含量比对照提高30 倍。本研究中-18、-5 ℃和5 ℃处理低氧胁迫发芽的玉米后GABA含量均有提高,其中以-18 ℃处理8 h再常温解冻4 h后的玉米中GABA含量最高。低温处理及回温解冻后增加的GABA含量主要在解冻0~2 h内完成,同期GAD活力较高但快速下降。这表明低温处理是富集GABA的预处理,解冻过程才是GABA的富集阶段。推测其原因是低温冷冻过程中细胞内形成冰晶并不断“长大”,以至严重损伤细胞膜结构,当回温解冻后,冰晶消融,细胞液流动性增加,此时Ca 2+和H +迅速进入细胞质,激活GAD,催化底物谷氨酸脱羧形成GABA。
本研究中,玉米籽粒经低氧胁迫发芽72 h后,在-18℃冷冻6 h和25℃回温4 h条件下,发芽玉米中GABA含量达1.52 mg/g,较原料中其含量增加29.9 倍。据报道,发芽粟谷 [5]、发芽大豆 [20]和发芽蚕豆 [19]中GABA含量分别为 0.24、1.20、6.14 mg/g。经富集后原料中GABA含量有所不同可能是由于物种差异导致,但玉米经胁迫处理后其GABA含量是原料中的30.9 倍,这提示玉米籽粒是富集GABA的良好原料,且低氧与低温胁迫是富集发芽玉米中GABA的有效方式。
参考文献:
[1] COHEN B I. The significance of ammonia/gamma-aminobutyric acid (GABA) ratio for normality and liver disorders[J]. Medical Hypotheses, 2002, 59(6): 757-758.
[2] NEJATI F, RIZZELLO C G, DI CAGNO R, et al. Manufacture of a functional fermented milk enriched of angiotensin-I converting enzyme (ACE)-inhibitory peptides and gamma-amino butyric acid (GABA)[J]. LWT-Food Science and Technology, 2013, 51(1): 183-189.
[3] SHELP B J, BOWN A W, MCLEAN M D. Metabolism and functions of gamma-aminobutyric acid[J]. Trends Plant Science, 1999, 4(11): 446-452.
[4] KINNERALEY A M. Gamma aminobutyric acid (GABA) and plant responses to stress[J]. Critical Reviews in Plant Sciences, 2000, 19(6): 479-509.
[5] 白青云, 曾波, 顾振新. 低氧通气对发芽粟谷中γ-氨基丁酸含量的影响[J]. 食品科学, 2010, 31(9): 49-53.
[6] LI Yan, BAI Qingyun, JIN Xinjiang, et al. Effects of cultivar and culture conditions on gamma-aminobutyric acid accumulation in germinated fava beans (Vicia faba L.)[J]. Journal of the Science of Food and Agriculture, 2010, 90(1): 52-57.
[7] GUO Yuanxin, YANG Runqiang, CHEN Hui, et al. Accumulation of γ-aminobutyric acid in germinated soybean (Glycine max L.) in relation to glutamate decarboxylase and diamine oxidase activity induced by additives under hypoxia[J]. European Food Research Technology, 2012, 234(4): 679-687.
[8] 王玉萍, 韩永斌, 顾振新, 等. 谷氨酸钠和抗坏血酸对发芽糙米中GABA富积效果的影响[J]. 南京农业大学学报, 2006, 29(2): 94-97.
[9] SOUSA C A F D, SODEK L. The metabolic response of plants to oxygen defi ciency[J]. Brazilian Plant Physiology, 2002, 14(2): 83-94.
[10] MAZZUCOTELLI E, TARTARI A, CATTIVELLI L, et al. Metabolism of γ-aminobutyric acid during cold acclimation and freezing and its relationship to frost tolerance in barley and wheat[J]. Journal of Experimental Botany, 2006, 57(14): 3755-3766.
[11] YANG Runqiang, GUO Qianghui, GU Zhenxin. GABA shunt and polyamine degradation pathway on gamma-aminobutyric acid accumulation in germinating fava bean (Vicia faba L.) under hypoxia[J]. Food Chemistry, 2013, 136(1): 152-159.
[12] 何生根, 黄学林, 傅家瑞. 豇豆种子萌发过程中多胺氧化酶活性的变化及其影响因素[J]. 园艺学报, 2002, 29(2): 153-157.
[13] PETRIVALSKY M, BRAUNER F, LUHOVA L, et al. Aminoaldehyde dehydrogenase activity during wound healing of mechanically injured pea seedlings[J]. Journal of Plant Physiology, 2007, 164(11): 1410-1418.
[14] REGGIANI R, CANTU C A, BRAMBILLA I, et al. Accumulation and interconversion of amino acids in rice roots under anoxia[J]. Plant and Cell Physiology, 1988, 29(1): 981-987.
[15] NARAYAN V S, NAIR P. Metabolism, enzymology and possible roles of 4-aminobutyrate in higher plants[J]. Phytochemistry, 1990, 29(2): 367-375.
[16] BAUM G, LEV-YADUN S, FRIDMANN Y, et al. Calmodulin binding to glutamate decarboxylase is required for regulation of glutamate and GABA metabolism and normal development in plants[J]. Embo Journal, 1996, 15(12): 2988-2996.
[17] 姚森, 杨特武, 赵莉君, 等. 发芽糙米中γ-氨基丁酸含量的品种基因型差异分析[J]. 中国农业科学, 2008, 41(12): 3974-3982.
[18] CARSOL M A, MASCINI M. Diamine oxidase and putrescine oxidase immobilized reactors in fl ow injection analysis: a comparison in substrate specifi city[J]. Talanta, 1999, 50(1): 141-148.
[19] 陈惠, 杨润强, 李岩, 等. 氯化盐和激素对发芽蚕豆中γ-氨基丁酸富集的影响[J]. 南京农业大学学报, 2012, 35(1): 119-124.
[20] 郭元新, 杨润强, 陈惠, 等. 盐胁迫富集发芽大豆γ-氨基丁酸的工艺优化[J]. 食品科学, 2012, 33(10): 1-5.
Effects of Hypoxia and Cold Stress on γ-Aminobutyric Acid Accumulation in Germinating Maize
YIN Yongqi 1,2, WU Jinxian 1, LIU Chunquan 3, LI Dajing 3, YANG Runqiang 1, GU Zhenxin 1,*
(1. Key Laboratory of Agricultural and Animal Products Processing and Quality Control, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China; 2. College of Food Science and Technology, Yangzhou University, Yangzhou 225127, China; 3. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract:The effects of hypoxia and cold stress on γ-aminobutyric acid (GABA) accumulation of germinating maize were investigated. The GABA content in germi nating maize was monitored with respect to germination time under hypoxia stress and freezing or chilling followed by exposure to room temperature (25 ℃). Results suggested that the optimal conditions for GABA accumulation in 72 h-germinated maize during cold stress were freezing at -18 ℃ for 6 h followed by thawing for 4 h at 25 ℃. Under these conditions, the maximum GABA level (1.52 mg/g DW) was obtained, which was 30.9 folds higher than that of the control. Moreover, it was also indicated that GABA synthesis in germinating maize was mainly achieved by the GABA shunt. Maize can be used as a good raw material to accumulate GABA. Besides, hypoxia stress and cold stress are confi rmed as an effective way to accumulate GABA content in germinated maize.
Key words:germinating maize; hypoxia stress; cold stress; γ-aminobutyric acid; accumulation
中图分类号:TS210.2
文献标志码:A
文章编号:1002-6630(2015)01-0089-05
doi:10.7506/spkx1002-6630-201501017
收稿日期:2014-01-19
基金项目:江苏高校优势学科建设工程项目;江苏省农业科技自主创新资金项目(CX(11)2067)
作者简介:尹永祺(1988—),男,博士研究生,研究方向为食品中功能成分的富集技术。E-mail:2011208009@njau.edu.cn
*通信作者:顾振新(1956—),男,教授,博士,研究方向为生物技术与功能食品。E-mail:guzx@njau.edu.cn