何中秋,程志强,康立娟 *,杨桂霞,许晓娟
(吉林农业大学资源与环境学院,吉林 长春 130118)
摘 要:分别用0.01~0.11 g的明胶吸附25 mL 900 mg/L单宁酸模拟溶液,根据明胶吸附量和单宁酸去除率得到明胶的最佳用量,然后研究最佳用量的明胶对25 mL 900 mg/L单宁酸模拟溶液的吸附动力学方程和吸附等温线方程,最后研究明胶对单宁酸质量浓度为900 mg/L的25 mL蓝莓汁的脱涩效果。结果表明:吸附25 mL 900 mg/L单宁酸模拟溶液时,明胶最佳用量为0.03 g,其明胶吸附量为527.5 mg/g,单宁酸去除率为70.33%。明胶吸附单宁酸的过程符合准二级动力学方程,其吸附等温线符合Langmuir吸附方程,为单分子层吸附。当脱除单宁酸含量为900 mg/L的25 mL蓝莓汁的涩味时,明胶用量0.03 g、温度15 ℃、振荡时间20 min,在该条件下,其明胶吸附量为420.8 mg/g,单宁酸去除率为56.11%,脱涩效果良好。
关键词:蓝莓汁;明胶;单宁酸;吸附
单宁酸又称植物多酚,是广泛存在于蔬菜和水果中的一类多元酚类化合物。从化学结构上看,单宁酸可分为水解类和缩合类两大类型,前者是没食子酸及其衍生物与葡萄糖或多元酚通过酯键形成的化合物,如五倍子单宁酸;后者是以黄烷-3-醇为基本结构单元的缩合物,如葡萄籽中所含的单宁酸。苹果、葡萄、柿子、猕猴桃、黑加仑、黑莓、蓝莓、柚柑、香蕉、山楂、枇杷、石榴、橄榄等水果中单宁酸含量较高,尤其在果实的果皮和果核中含量较其他部位高得多 [1]。果汁生产过程中,由于果皮和果核不能去除或去除不完全,很容易使其中的单宁酸进入果汁中,而单宁酸会对果汁风味造成不良影响,单宁酸与口腔黏膜或唾液蛋白结合并生成沉淀,引起粗糙折皱的收敛感和干燥感,即涩味 [2]。
明胶是动物皮或骨经严格复杂的化学处理而从中提取的可食性胶原蛋白,是胶原三链螺旋体结构水解产物 [3]。明胶与蛋白质的结合反应是植物多酚最具特征性的反应之一,利用此反应,可用明胶脱除果汁中的单宁酸物质。明胶与单宁酸的结合反应是两者间多点疏水键和氢键共同作用的结果。首先,含疏水基的单宁酸分子以疏水反应形式与明胶结合。然后,单宁酸的酚羟基与明胶的极性基(主要是肽基),发生两点氢键结合,酚羟基作为氢键H供体,肽基上的羰基氧作为H受体。明胶与单宁酸间多点疏水键和氢键的共同作用,形成明胶-单宁酸络合物沉淀 [4],使果汁中的单宁酸随沉淀而去除。
目前,一些研究者对果汁的涩味去除研究了一些方法,如Bao Yani等 [5]采用大孔吸附树脂对椪柑汁进行吸附脱苦,Puri等 [6]使用海藻酸钠包埋的柚皮苷酶对金诺橘汁进行脱涩,罗昱等 [7]探讨了单宁酶对刺梨果汁中单宁酸的脱除效果。也有许多文献报道了明胶对果蔬加工产品的脱涩,如姬长新等 [8]为脱除山茱萸汁的涩味,将山茱萸汁采用明胶进行处理,研究了明胶添加量、脱涩温度、脱涩时间对山茱萸汁脱涩效果的影响;解利利等 [9]采用明胶降低蓝莓果汁单宁酸含量。
但从动力学角度研究明胶对单宁酸吸附过程的机理还少见报道。因此,本实验采用明胶对单宁酸进行吸附,研究其吸附动力学和吸附等温线,并研究了明胶对蓝莓汁的脱涩效果。
1.1 材料与试剂
蓝莓,采自吉林省吉林农业大学蓝莓基地。
单宁酸(分析纯) 西陇化工股份有限公司;Folin-Ciocalteu(分析纯) 上海荔达生物有限公司;明胶(食品级) 连云港友进食品添加剂技术开发有限公司;Na 2CO 3、抗坏血酸、葡萄糖、蒽酮、硫酸、氢氧化钠等试剂均为分析纯 天津市塘沽鹏达化工厂。
1.2 仪器与设备
AUY-220型电子天平 上海岛津国际贸易有限公司;SP-722E型紫外-可见光分光光度计 上海光谱仪器有限公司;SHZ-B型水浴恒温振荡器 上海龙跃仪器设备有限公司;TDL-60B型离心机 上海安亭科学仪器厂;HV-200型榨汁机 青岛东亚电子有限公司;PHS-3C型酸度计 上海盛磁仪器有限公司;WYT-I型手持式糖量计 无锡建仪实验器材有限公司。
1.3 方法
1.3.1 蓝莓汁及单宁酸模拟溶液的制备
蓝莓汁:取冷藏的蓝莓果200 g,清洗干净后用榨汁机榨汁,于4 ℃冰箱中自然澄清24 h [10],最后用两层纱布过滤榨汁所得果汁,去除果渣,得清汁备用。
单宁酸模拟溶液:用蒸馏水配制含单宁酸的溶液模拟蓝莓汁。准确称取单宁酸(分析纯)0.9 g于1 000 mL容量瓶中,用蒸馏水定容至标线,溶解后即为质量浓度为900 mg/L的单宁酸模拟溶液。
1.3.2 Folin-Ciocalteu法测定单宁含量 [11]
标准曲线绘制:准确称取单宁酸5 mg,溶解后移入50 mL容量瓶中,蒸馏水定容至刻度,混匀。即得0.1 mg/mL单宁酸标准溶液。取5 个15 mL比色管,分别加入单宁酸标准液0.3、0.6、0.9、1.2、1.5 mL,而后加入0.6 mL的Folin-Ciocalteu试剂和3.0 mL 75 g/L饱和Na 2CO 3溶液,加水定容至刻度,室温避光放置l h,760 nm波长处测定吸光度,做3 次平行实验,取平均值,以单宁酸质量浓度为横坐标,以吸光度为纵坐标绘制标准曲线,得到回归方程为y=78.028x+0.023 1(R 2=0.992 3)。以蒸馏水做空白实验。以蓝莓果汁(或吸附处理后的单宁酸溶液)0.15 mL代替单宁酸标准液测定其吸光度,并代入标准曲线方程计算单宁酸含量。
1.3.3 蓝莓汁各指标测定
采用pH计测定pH值;手持式糖量计 [12]测定可溶性固形物含量;pH示差法 [13]测定花色苷含量;Fe-菲啰啉分光光度计 [14]法测定抗坏血酸含量;电位滴定法 [15]测定杨梅浊汁中的可滴定酸含量(以柠檬酸计);蒽酮-硫酸比色法 [16]测定总糖含量。所有指标测定重复3 次,取平均值。
1.3.4 明胶用量对吸附单宁酸实验的影响
分别称取0.01、0.03、0.05、0.07、0.09、0.11 g的明胶放入一系列50 mL锥形瓶中,分别加入25 mL 900 mg/L单宁酸模拟溶液,以保鲜膜密封,置于水浴恒温振荡器内于15 ℃条件下振荡20 min,5 000 r/min离心10 min分离出沉淀,取上清液于760 nm波长处测定吸光度,每次测定重复3 次,取平均值。根据单宁酸标准曲线,计算出上清液中单宁酸的含量。
明胶对单宁酸的平衡吸附量 [17]和单宁酸去除率 [18]通过下式计算:
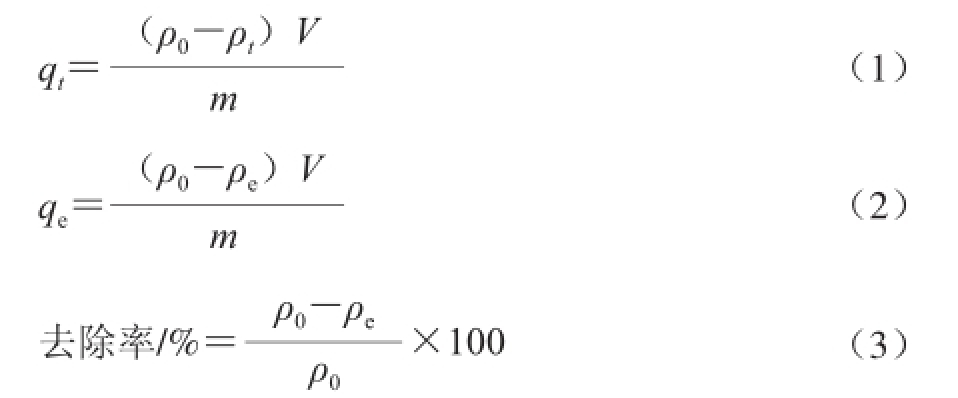
式中:q t为t时刻明胶对单宁酸的吸附量/(mg/g);q e为吸附平衡时明胶对单宁酸的吸附量/(mg/g);ρ 0为溶液中单宁酸的初始质量浓度/(mg/L);ρ t为t时刻溶液中单宁酸的质量浓度/(mg/L);ρ e为吸附平衡时溶液中单宁酸的质量浓度/(mg/L);V为溶液体积/L;m为吸附剂的质量/g。
1.3.5 吸附动力学和吸附等温线
吸附动力学:分别取25 mL 900 mg/L的单宁酸模拟溶液6 份加入50 mL锥形瓶中,并加入0.03 g明胶,以保鲜膜密封,然后置于水浴恒温振荡器内15 ℃振荡不同时间(3、6、9、12、15、18 min),5 000 r/min离心10 min分离出沉淀,取上清液于760 nm波长处测定吸光度,每次测定重复3 次,取平均值。
吸附动力学模型采用准一级动力学模型(公式(4))和准二级动力学模型(公式(5)) [19],以分析吸附过程的动力学机制。

式中:k 1为准一级速率常数/min -1;k 2为准二级速率常数/(g/(mg·min))。
吸附等温线:分别取25 mL不同质量浓度(200、400、600、800、1 000、1 200 mg/L)的单宁酸模拟溶液于一系列50 mL锥形瓶中,并加入0.03 g明胶,以保鲜膜密封,置于水浴恒温振荡器内15 ℃条件下振荡20 min,5 000 r/min离心10 min分离出沉淀,取上清液于760 nm波长处测定吸光度,每次测定重复3 次,取平均值。
吸附等温线模型采用Langmuir模型(公式(6))和Freundlich模型(公式(7))来描述 [20]。
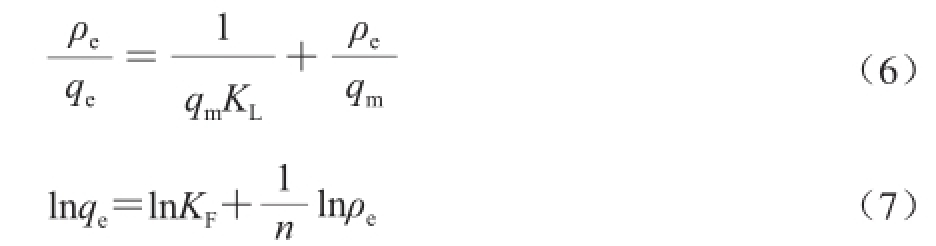
式中:q m为饱和吸附量/(mg/g);K L是 Langmuir吸附特征常数/(L/mg);K F为Freundlic常数/((mg/g)·(L/mg)) 1/n,1/n为Freundlich 吸附指数。
1.3.6 明胶对蓝莓汁的脱涩实验
取25 mL蓝莓汁(其中单宁酸的质量浓度为900 mg/L)于50 mL锥形瓶中,并加入0.03 g明胶,以保鲜膜密封,然后置于水浴恒温振荡器内15 ℃条件下振荡20 min,5 000 r/min离心10 min分离出沉淀,取上清液于760 nm波长处测定吸光度,每次测定重复3 次,取平均值。按公式(1)~(3)计算明胶对单宁酸的吸附量和单宁酸去除率。
2.1 明胶用量对单宁酸吸附的影响
不同的吸附剂用量会对吸附效果产生显著影响。为确定最佳用量,在设定的实验条件下,考察0.01~0.11 g范围内明胶用量对吸附单宁酸的影响,结果如图1所示。随着明胶用量的增加,单宁酸的去除率逐渐升高,在用量为0.05 g时达到最大,为81.11%,当用量大于0.05 g时,单宁酸的去除率逐渐减小。单位质量明胶的吸附量随着其用量的增加逐渐降低,由1 250 mg/g 减少为102.5 mg/g,其降低速率也逐渐变慢。
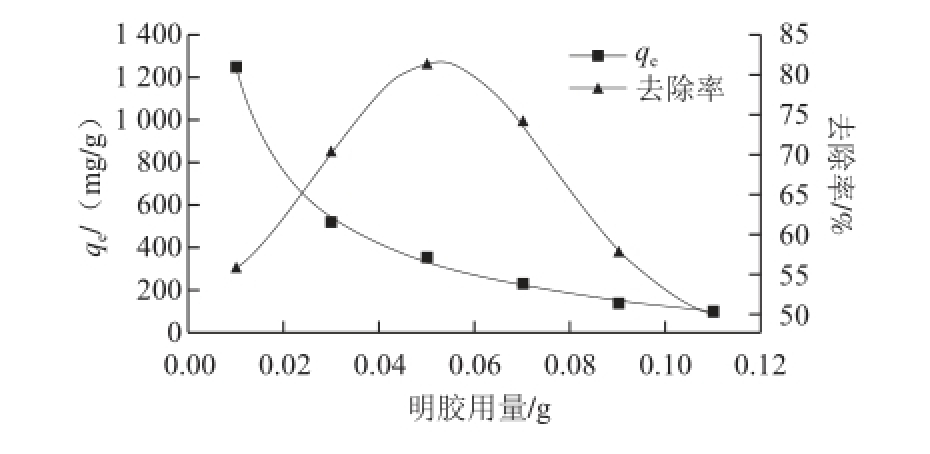
图1 明胶添加量对吸附单宁酸的影响
Fig.1 Effects of different gelatin dosages on the adsorption of tannic acid
随着明胶用量增加,可用来吸附单宁酸的明胶表面活性位点的总数增多,使得去除率升高,继续增加明胶用量,由于溶液中明胶比例增加,明胶分子间产生了交联,即明胶分子被单宁酸分子连接成聚集体,其结果是明胶更易沉淀,但提供给单宁酸分子结合的表面积降低,因而单宁酸的去除率反而降低 [21-22];同时,明胶的用量增加后,由于单宁酸总量不变,更多的可吸附位置不能被充分利用,使得其单位质量吸附量降低。因此,从节约原料和去除效果两个角度考虑,选择0.03 g为明胶吸附单宁酸的最佳用量,此时明胶吸附量为527.5 mg/g,单宁去除率为70.33%。
2.2 吸附动力学和吸附等温线
2.2.1 吸附动力学
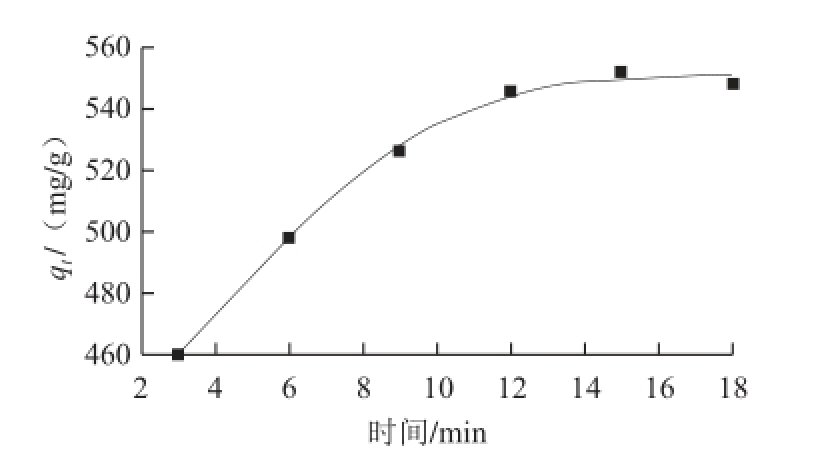
图2 明胶对单宁酸的吸附动力学曲线
Fig.2 Adsorption kinetic curves of tannin by gelatin
由图2可知,在初始阶段,明胶对单宁酸的吸附量随着时间的延长而增大,在15~18 min之间缓慢达到平衡。在明胶吸附单宁酸过程中,一般经历两个过程:初始阶段,在扩散作用下明胶快速吸附单宁酸;随后,因被吸附的单宁酸在明胶表面先要进行重排,才能继续吸附溶液中的单宁酸,导致第二个过程的吸附十分缓慢以至趋于平缓。
根据准一级动力学方程和准二级动力学方程对数据进行拟合,结果图见图3。对于质量浓度为900 mg/L的单宁酸模拟溶液,准二级动力学方程的R 2值大于0.990 0,表明明胶对单宁酸的吸附行为符合准二级动力学方程。

图3 明胶对单宁酸的吸附动力学方程拟合图
Fig.3 Linear fi tting of adsorption kinetic equation
2.2.2 吸附等温线
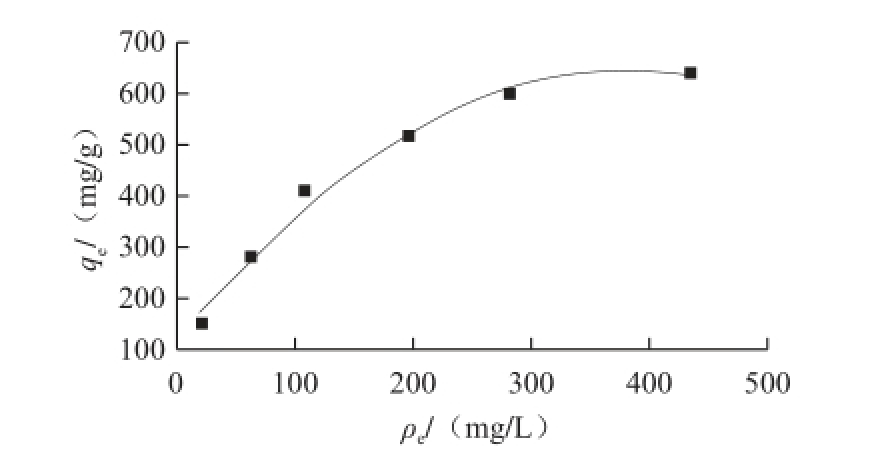
图4 明胶对单宁酸的吸附等温线
Fig.4 Adsorption isotherm of tannin by gelatin
由图4可知,明胶平衡吸附量随着单宁酸溶液平衡质量浓度的增大而快速增加,其增大幅度随着单宁酸溶液平衡质量浓度的增加逐渐减小,在高质量浓度时达到饱和,此时明胶平衡吸附量基本保持不变。这表明当单位明胶分子结合到一定数量的单宁酸分子(可以使其沉淀)后,即使反应体系中有过量的单宁酸分子,也难于再找到稳定的结合点 [23],此时明胶吸附量不再增加。
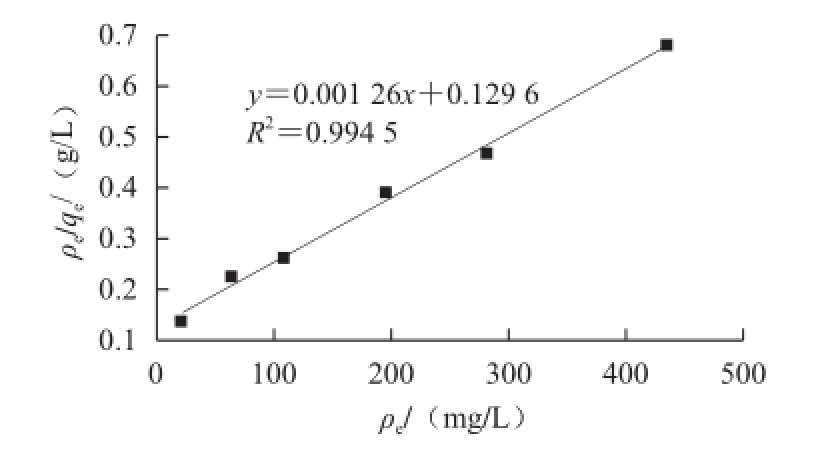
图5 Langmuir方程的线性拟合
Fig.5 Linear fi tting of Langmuir equation
根据Langmuir吸附模型吸附等温式,以ρ e/q e对ρ e作图,结果如图5所示,Langmuir方程线性拟合的相关系数R 2值较高(>0.990 0)。
根据Freundlich 吸附模型,以lnq e对lnρ e作图,如图6所示。Freundlich吸附等温式对明胶吸附单宁酸的适用性一般,其相关系数R 2(<0.990 0)小于Langmuir吸附等温式的相关系数。因此明胶对单宁酸的吸附符合Langmuir吸附模型,属于单分子层吸附。

图6 Freundlich方程线性拟合
Fig.6 Linear fi tting of Freundlich equation
2.3 明胶对蓝莓汁的脱涩实验
表1 蓝莓汁的理化指标(±s,n=3)
Table 1 Physico-chemical characteristics of blueberry juice(±s,n=3)
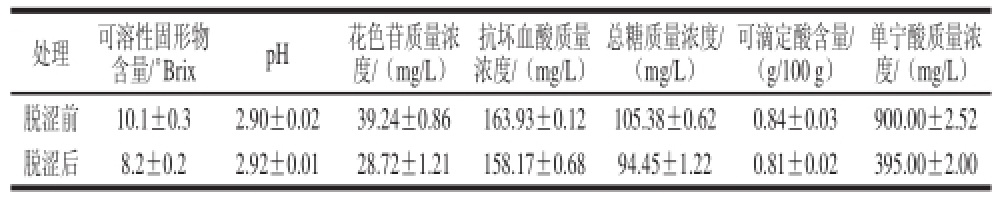
单宁酸质量浓度/(mg/L)脱涩前10.1±0.32.90±0.0239.24±0.86163.93±0.12105.38±0.620.84±0.03900.00±2.52脱涩后8.2±0.22.92±0.0128.72±1.21158.17±0.6894.45±1.220.81±0.02395.00±2.00处理可溶性固形物含量/°Br ixpH花色苷质量浓度/(mg/L)抗坏血酸质量浓度/(mg/L)总糖质量浓度/(mg/L)可滴定酸含量/(g/100 g)
由表1可知,使用明胶脱涩处理后,蓝莓汁的pH值、抗坏血酸含量和可滴定酸含量并没有呈现出明显的变化趋势,而可溶性固形物含量、花色苷含量和总糖含量分别减少了18.81%、26.81%和10.37%。单宁酸质量浓度由900 mg/L变为395 mg/L,此时明胶对单宁酸吸附量和单宁酸去除率分别为420.8 mg/g和 56.11%,果汁涩味较淡。这表明明胶对单宁酸的吸附效果良好,且少量吸附如可溶性固形物、花色苷等营养成分。
但在蓝莓汁中明胶对单宁酸的吸附量和单宁酸去除率小于单宁酸模拟溶液的明胶吸附量(527.5 mg/g)和单宁酸去除率(70.33%),这可能是因为蓝莓汁的pH值和黏度会影响明胶吸附单宁酸的过程。此外明胶吸附蓝莓汁单宁酸的过程中,明胶还少量吸附了可溶性固形物、花色苷等营养成分,导致明胶提供给单宁酸分子结合的表面积降低,因此蓝莓汁中明胶对单宁酸的吸附量和单宁酸去除率降低。
吸附25 mL 900 mg/L的单宁酸模拟溶液,明胶用量分别为0.01~0.11 g,15 ℃振荡20 min,此时得出最佳明胶用量为0.03 g,其明胶吸附量为527.5 mg/g,单宁去除率为70.33%。
吸附25 mL 900 mg/L的单宁酸模拟溶液,明胶用量为0.03 g,15 ℃振荡15~18 min可达到平衡,吸附过程符合准二级动力学方程。
吸附25 mL不同质量浓度(200~1 200 mg/L)的单宁酸模拟溶液,明胶用量为0.03 g,15 ℃振荡20 min。其吸附等温线符合Langmuir吸附方程,为单分子层吸附。
吸附25 mL单宁酸含量为900 mg/L的蓝莓汁,明胶用量0.03 g,15 ℃振荡20 min,其明胶吸附量为420.8 mg/g,单宁去除率为56.11%。
研究结果表明,明胶对蓝莓汁的脱涩效果良好,而且对其他营养物质的影响较小。但在蓝莓汁中明胶对单宁酸的吸附量和单宁酸去除率小于单宁酸模拟溶液中明胶吸附量和单宁酸去除率,这可能是因为蓝莓汁的pH值和黏度会影响明胶吸附单宁酸,影响机理仍需进一步研究。
参考文献:
[1] 张磊, 吕远平. 果汁中单宁脱除方法的研究进展[J]. 食品科学, 2010, 31(3): 312-315.
[2] 张宝善, 陈锦屏, 卢勇. 水果的涩味研究[J]. 食品研究与开发, 1998, 19(1): 31-34.
[3] 陈功. 鞣质明胶吸附法解决白酒降度混浊[J]. 酿酒科技, 1988, 2(2): 21-22.
[4] 狄莹, 石碧. 植物单宁化学研究进展[J]. 化学通报, 1999(3): 2-6.
[5] BAO Yani, YUAN Fang, ZHAO Xin, et al. Equilibrium and kinetic studies on the adsorption debittering process of ponkan (Citrus reticulata Blanco) juice using macroporous resins[J]. Food and Bioproducts Processing, 2014. doi: 10.1016/j.fbp.2013.12.009.
[6] PURI M, MARWAHA S, KOTHARI R. Studies on the applicability of alginate-entrapped naringiase for the debittering of kinnow juice[J]. Enzyme and Microbial Technology, 1996, 18(4): 281-285.
[7] 罗昱, 梁芳, 李小鑫, 等. 单宁酶对刺梨果汁单宁的脱除作用[J]. 食品科学, 2013, 34(18): 41-44.
[8] 姬长新, 袁贵英, 焦镭, 等. 明胶对山茱萸汁脱涩效果的影响[J]. 食品工业科技, 2013, 34(6): 313-314; 319.
[9] 解利利, 张慜, 孙金才. 化学吸附法脱除蓝莓汁中单宁的研究[J]. 食品与生物技术学报, 2010, 29( 6): 847-853.
[10] 郭庆启, 张娜. 树莓果汁中花色苷降解动力学的研究[J]. 中国林副特产, 2011(5): 35-37.
[11] BAJAJ K L, KAUR G. Colorimetric determination of capsaicin in capsicum fruits with the Folin-Ciocalteu reagent[J]. Microchimica Acta, 1979, 71(1/2): 81-86.
[12] 鲁周民, 张丽, 尹蓉, 等. 酶解条件对红枣汁主要成分的影响[J]. 农业工程学报, 2009, 25(1): 300-302.
[13] 孙婧超, 刘玉田, 赵 玉平, 等. pH示差法测定蓝莓酒中花色苷条件的优化[J]. 中国酿造, 2012(11): 171-174.
[14] 王丽琴, 党高潮, 黄兆志. 饮料和水果中Vc的快速灵敏测定法[J]. 食品科学, 1993, 14(10): 66-69.
[15] POYRAZOĞLU E, GÖKMEN V, ARTIK N. Organic acids and phenolic co mpounds in pomegranates (Punica granatum L.) grown in turkey[J]. Journal of Food Composition a nd Analysis, 2002, 15(5): 567-575.
[16] 刘晓涵, 陈永刚, 林励, 等. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技, 2009, 34(9): 270-272.
[17] 王雪, 孟令友, 代莹, 等. Fe 3O 4@SiO 2-NH 2磁性复合材料对水中单宁酸的吸附性能研究[J]. 环境科学学报, 2013, 33(8): 2193-2198.
[18] 于海琴. 膨润土基吸附材料的制备、表征及其吸附性能研究[D]. 青岛: 中国海洋大学, 2012: 1-146.
[19] 刘芳. 活性炭吸附法处理苯系物及MTBE微污染 废水的实验研究[D].长春: 吉林大学, 2012: 1-70.
[20] 欧阳玉祝, 张辞海, 魏燕. 大孔树脂对倍花单宁酸的吸附特性及其动力学模型[J]. 食品科学, 2013, 34(11): 122-125.
[21] BICKLEY J. Vegetable tannins and tanning[J]. J ournal of the Society of Leather Technologists and Chemists, 1992, 76: 1-5.
[22] HASLAM E, LILLEY T, CAI Y, et al. Traditional herbal medicinesthe role of polyphenols[J]. Planta Medica, 1989, 55(1): 1-8.
[23] 石碧, 何先祺, 爱德华·哈斯兰姆. 水解类植物鞣质性质及其与蛋白质反应的研究[J]. 皮革科学与工程, 1994, 4(2): 4-10.
Mechanism of Adsorption of Tannic Acid by Gelatin and Its Application to Astringency Removal of Blueberry Juice
HE Zhongqiu, CHENG Zhiqiang, KANG Lijuan*, YANG Guixia, XU Xiaojuan
(College of Resources and Environment, Jilin Agricultural University, Changchun 130118, China)
Abstract:In order to investigate the effect of gelatin dosage on the adsorption of tannic acid, 0.01–0.11 g of gelatin was used to adsorb 25 mL of 900 mg/L tannic acid model solution. The gelatin dosage was optimized for the adsorption capacity of gelatin and the removal rate of tannic acid. The adsorption kinetics and adsorption isotherms of tannic acid by gelatin were explored as well. In addition, the effect of gelatin adsorption on blueberry juice astringency was examined. The results showed the optimal gelatin dosage was 0.03 g, leading to an adsorption capacity of 527.5 mg/g and a removal rate of tannic acid of 70.33%. The adsorption of tannic acid by gelatin was described by pseudo-second order adsorption kinetics; the adsorption isotherm was described by Langmuir adsorption model and it was monolayer adsorption. When 25 mL of blueberry juice containing 900 mg/L tannic acid was shaken at 15 ℃ for 20 min after addition of 3 g of gelatin, the adsorption capacity was 420.8 mg/g and the removal rate of tannic acid was 56.11%.
Key words:blueberry juice; gelatin; tannic acid; adsorption
中图分类号:TS255.3
文献标志码:A
文章编号:1002-6630(2015)01-0104-05
doi:10.7506/spkx1002-6630-201501020
收稿日期:2014-03-17
基金项目:吉林省科技发展计划项目(20140411002XH);长春市科技计划项目(12XN19)
作者简介:何中秋(1987—),男,硕士研究生,研究方向为农产品化学。E-mail:2485545532@qq.com
*通信作者:康立娟(1961—),女,教授,硕士,研究方向为农产品化学。E-mail:kanglijuan61@126.com