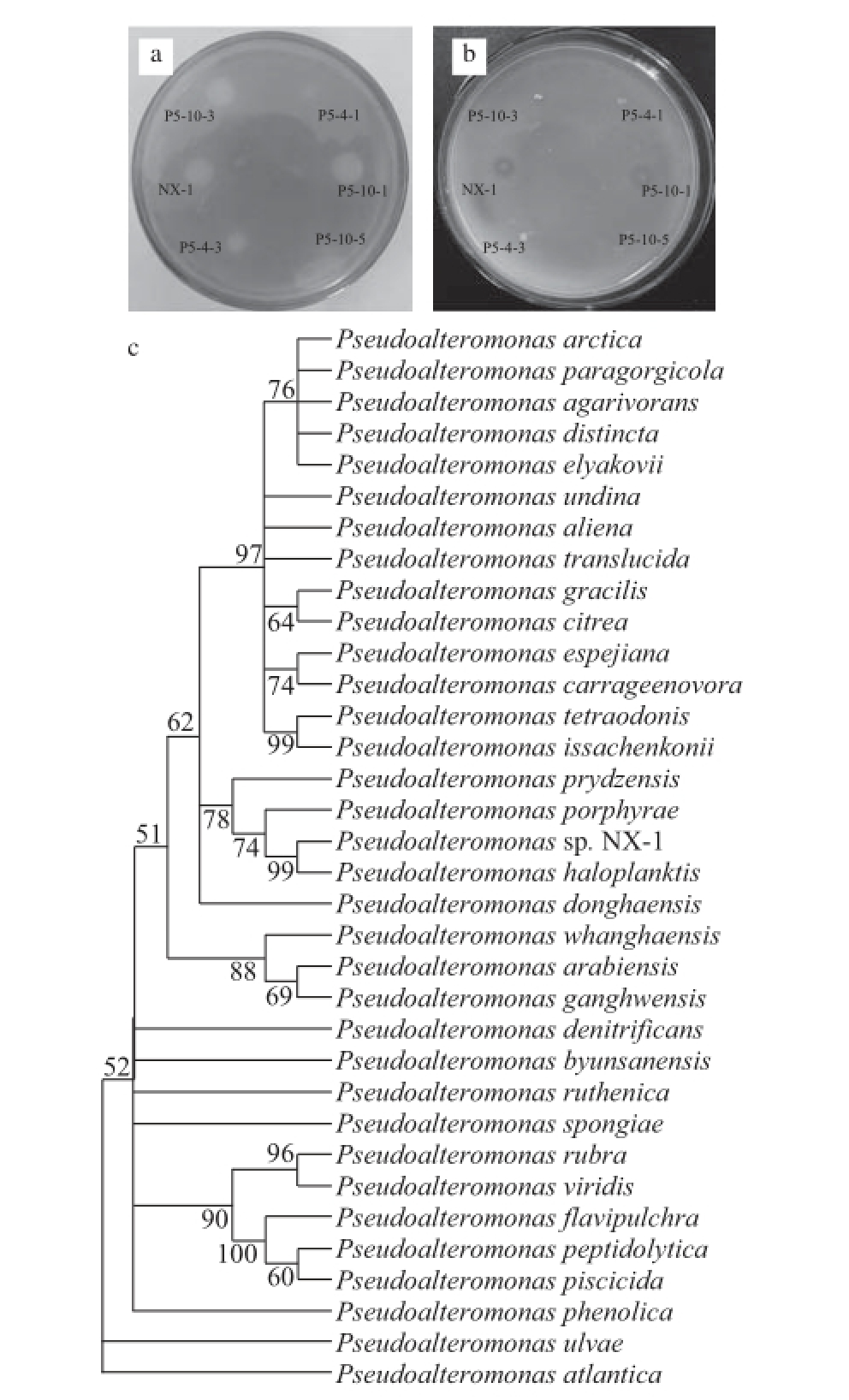
图1 菌株NX-1的分离鉴定结果
Fig.1 Isolation and identifi cation of strain NX-1
a.鲁格氏碘液鉴别结果;b.无水乙醇鉴别结果;c.假交替单胞菌属16S rRNA系统发育树。
康怀彬 1,肖天天 1,李净净 1,杨 桥 2,杨华田 1,尤晓颜 1,*
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.中国水产科学研究院东海水产研究所,上海 200090)
摘 要:从南极海泥样品中分离得到一株产嗜冷普鲁兰酶的假交替单胞菌菌株(Pseudoalteromonas sp.)NX-1。以菌株NX-1为研究对象,对菌株NX-1产嗜冷普鲁兰酶的酶学性质进行了初步研究,并通过单因素试验和正交试验对其产嗜冷普鲁兰酶的最佳培养条件进行研究。结果显示,菌株NX-1所产嗜冷普鲁兰酶的最适作用温度为20 ℃,最适作用pH值为7.0,在最适条件下,酶的半衰期约为120 min;菌株NX-1的最适产酶条件为:培养温度20 ℃、接种量1%、培养基各组分含量分别为蔗糖15 g/L、蛋白胨15 g/L、CaCl 20.5 g/L、Na 2HPO 46 g/L。优化后菌株产酶可达25.172 U/mL,相比优化前提高25.1%。
关键词:嗜冷普鲁兰酶;假交替单胞菌;发酵;正交试验
淀粉作为一种重要原料被广泛应用于食品加工、生物能源等工业领域 [1]。工业用淀粉质原料中通常含有75%~85%的支链淀粉,支链淀粉中α-1,6-糖苷键的水解程度将直接影响到淀粉质原料的利用效率 [2]。为此,在淀粉制糖工业中,通常通过添加一定量的普鲁兰酶来提高支链淀粉的利用效率。该酶可以特异性地水解普鲁兰糖、支链淀粉等分枝多糖分子内的α-1,6-糖苷键,生成相应的麦芽三糖和直链多糖 [3]。研究表明,在淀粉糖化过程中,添加一定量的普鲁兰酶,不仅可以降低糖化酶的用量,还可以显著提高淀粉的糖化效率、缩短反应时间,因此在淀粉深加工和生物能源等工业部门具有广泛的应用前景 [4-5]。
普鲁兰酶最早从肺炎克雷伯菌(Klebsiella pneumoniae)中分离得到 [6],其独特的性状及其在食品工业生产中的应用潜能,使得不同类型的普鲁兰酶相继从不同类型的微生物中分离得到 [1,3-4]。一些普鲁兰酶的基因也不断被克隆、鉴定,以及异源表达 [4,7-9],少数普鲁兰酶的晶体结构也得到了解析 [10-12],为开展普鲁兰酶的工业化应用提供了理论指导。在淀粉加工工业中,由于淀粉液化和糖化的温度不同,液化转入糖化时还需要降温等工序,因此研究人员希望筛选得到耐热性好的普鲁兰酶,将糖化和液化过程统一起来,从而简化工艺、降低成本 [13]。目前关于普鲁兰酶的研究主要集中于嗜热、超嗜热普鲁兰酶 [14-16],而对于嗜冷普鲁兰酶的研究国内目前还尚未开展,国外近期才有相关研究报道 [17-18]。嗜冷普鲁兰酶能够在低温条件下水解支链淀粉中的α-1,6-糖苷键,如果与低温淀粉酶配合使用可以有效减少淀粉糖化过程中的能源消耗,在淀粉加工工业自身节能降耗要求的背景下,开展嗜冷普鲁兰酶的应用研究具有重要的研究价值。本研究从南极低温环境样品中,以普鲁兰糖为唯一碳源筛选得到一株产低温普鲁兰酶菌株(Pseudoalteromonas sp.)NX-1,实验不仅对菌株所产低温普鲁兰酶的酶学性质行了测定,并且通过正交试验优化了菌株的最适产酶条件,为开展低温普鲁兰酶的工业化应用提供理论指导。
1.1 材料、培养基与试剂
南极海泥样品来自雪龙号第29次科考取样,由中国水产科学院东海水产研究所提供。样品编号为P5-10和P5-4,取样点位置坐标分别为59°30″S/043°00″W和60°00″S/042°00″W。
普鲁兰糖(生物纯(C 37H 62O 30) n) 生工生物工程(上海)股份有限公司;API 50CH试剂盒 法国梅里埃公司;其他试剂均为分析纯。
鉴别培养基:普鲁兰糖3 g/L、蛋白胨10 g/L、人工海水1 000 mL、琼脂2.0%,pH值自然。发酵培养基:蔗糖15 g/L、蛋白胨15 g/L、CaCl 20.5 g/L、Na 2HPO 46 g/L、人工海水1 000 mL,pH 7.0。
1.2 仪器与设备
GeneAmp ®9700 PCR仪 美国生命技术公司;UV-1800型紫外分光光度计 日本岛津公司;D-37520型高速离心机 美国Sigma公司;HYL-C型组合式温控摇床太仓市强乐实验设备有限公司;SW-CJ-2D洁净工作台苏州苏洁净化设备有限公司。
1.3 方法
1.3.1 菌株的筛选
称取1 g南极海底沉积物泥样,加入到10 mL灭菌人工海水中,超声分散(200 W,超声1 s,停4 s,共15 个循环)后取1 mL培养液做梯度稀释,涂布于筛选培养基的平皿中,置于20 ℃培养箱中培养48 h。挑取平皿中长出的菌株,采用影印接种法将菌株转接入筛选培养基平皿中,在平皿中分别喷洒鲁格氏碘液和无水乙醇并观察水解圈情况,挑取有水解圈的菌株接入摇瓶发酵培养基中进行培养,20 ℃振荡培养24 h,测定发酵液中普鲁兰酶活力。
1.3.2 菌株的鉴定及进化分析
采用酚-氯仿法人工提取基因组DNA [19],采用通用引物27F和1492R扩增能菌株16S rRNA基因序列,引物序列为:27F:AGAGTTTGATCCTGGCTCAG和1492R:AAGGAGGTGATCCAAGCC。聚合酶链式反应(polymerase chain reaction,PCR)扩增条件为:94 ℃预变性4 min,94 ℃变性60 s,58 ℃退火,40 s;72 ℃延伸1 min,30 个循环。PCR产物切胶纯化后,送北京六合华大基因科技股份有限公司测序。测序后的序列与NCBI数据库进行比对鉴定种属类别,并使用Mega 5软件采用邻接法聚类构建16S rRNA系统发育树。采用API 50CH试剂盒(法国梅里埃)鉴定菌株对不同碳源的利用情况,按照说明书进行操作。
1.3.3 嗜冷普鲁兰酶活力的测定
采用粗酶液测定嗜冷普鲁兰酶活力,收集发酵液,8 000 r/min离心20 min,上清液即为粗酶液。采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定酶活力 [20]。酶活力单位定义:在pH 7.0、温度20 ℃条件下,每分钟从普鲁兰糖底物释放相当于1 μmol葡萄糖还原量所需的酶量定义为一个酶活力单位(U)。
1.3.4 嗜冷普鲁兰酶的酶学性质分析
在温度为10、15、20、28、37、42 ℃条件下分别测定嗜冷普鲁兰酶的酶活力和菌悬液光密度(OD 600 nm)值,确定其最适反应温度;在最适温度下,测定不同pH 值(4~9)条件下嗜冷普鲁兰酶的酶活力,确定其最适反应pH值,pH 4~6.5采用柠檬酸-柠檬酸钠缓冲液(0.1 mol/L),pH 7~9采用Tris-HCl缓冲液(1 mol/L);在最适pH值条件下,将酶液分别置于10、20、28、37、42 ℃条件下维持0、20、40、60、80、100、120 min,测定嗜冷普鲁兰酶在不同温度下的热稳定性。
1.3.5 单因素试验设计及方法
选取不同碳源、氮源、金属离子及磷酸根离子加入含有100 mL无菌人工海水溶液的250 mL锥形瓶中,以1%的接种量接入发酵培养液,在20 ℃、150 r/min的条件下培养24 h。固定其他条件不变,分别考察碳源(蔗糖、玉米淀粉、马铃薯淀粉、可溶性淀粉、甘油、葡萄糖、乳糖、糊精等)及碳源质量浓度(蔗糖5~40 g/L)、氮源(蛋白胨、玉米浆、酵母膏、牛肉膏、硫酸铵等)及氮源质量浓度(蛋白胨5~40 g/L)、金属离子(氯化钙、氯化镁、氯化钾、氯化铁等)及金属离子质量浓度(钙离子0~0.8 g/L)、磷酸根离子质量浓度(0~16 g/L)对菌株NX-1产嗜冷普鲁兰酶的影响。
1.3.6 正交试验设计及方法
根据L 9(3 4)正交表选取不同质量浓度的蔗糖、蛋白胨、钙离子及磷酸根离子组合配制发酵培养基。向含有100 mL人工海水溶液的250 mL锥形瓶中分别加入各组成分,以1%的接种量接入发酵培养液,在20 ℃、150 r/min的条件下培养24 h,分别考察各组发酵培养基组分对低温普鲁兰酶发酵效果的影响。
2.1 菌株的分离鉴定及生理生化性质

图1 菌株NX-1的分离鉴定结果
Fig.1 Isolation and identifi cation of strain NX-1
a.鲁格氏碘液鉴别结果;b.无水乙醇鉴别结果;c.假交替单胞菌属16S rRNA系统发育树。
初筛共分离得到10 株产普鲁兰酶菌株(图1),通过摇瓶发酵实验对初筛得到的菌株的产酶活力进行测定,其中6 株菌株能够检测到普鲁兰酶的活性,表明这些菌株能够合成外泌型普鲁兰酶分泌到细胞外的培养基中。这6 株菌株中,菌株NX-1的产酶活力最高(20.12 U/mg),通过16S rRNA测序比对后,发现菌株NX-1与假交替单胞菌属(Pseudoalteromonas)物种相近,16S rRNA进化关系表明菌株NX-1与游海假交替单胞菌株(Pseudoalteromonas haloplanktis)最为接近,并与紫菜假交替单胞菌株(Pseudoalteromonas porphyrae)聚为独立分枝(图1c),表明菌株NX-1是属于假交替单胞菌属的一个物种,将菌株NX-1命名为Pseudoalteromonas sp. NX-1。菌株NX-1的最适生长温度为20 ℃(图2c),形态为短杆状,革兰氏染色结果为阴性菌,菌落呈乳白色凸起、光滑湿润、不透明、边缘整齐。采用梅里埃金标准微生物生理生化检测试剂盒(API 50CH)对菌株NX-1的碳源利用情况进行了定性测定,结果表明菌株NX-1可以利用阿拉伯糖、核糖、木糖、半乳糖、松二糖等多种碳源进行生长,但不能利用葡萄糖、果糖、甘露糖生长。
2.2 嗜冷普鲁兰酶的酶学性质

图2 菌株NX-1所产普鲁兰酶酶学性质分析
Fig.2 Enzymatic properties of pullulanase from the psychrophilic strain
由图2可知,在实验条件下(pH 4~9,温度10~42 ℃)均可以检测到普鲁兰酶的酶活力,该酶的最适pH值为7.0,与之前报道的一些普鲁兰酶相近,如枯草芽孢杆菌(Bacillus subtilis)菌株TU、蜡样芽孢杆菌(Bacillus cereus)菌株FDTA-13、芽孢杆菌(Bacillus fl avocaldarius)菌株KP122以及Rhodothermus marines [3]。菌株NX-1所产普鲁兰酶的最适催化温度为20 ℃,按照文献对于低温酶的分类 [21],其属于嗜冷酶的范畴,因此确定该酶为嗜冷普鲁兰酶。对该嗜冷普鲁兰酶在不同温度下的热稳定性进行测定(图2d),结果表明,随着时间的延长,酶在不同温度下的稳定性均呈下降趋势,在120 min后,相对酶活力降低超过36.1%;在不同处理温度下,随着温度的升高,酶的稳定性呈快速下降趋势,42 ℃保持120 min后,相对酶活力降低超过61.3%。在最适作用温度条件下(20 ℃),酶的半衰期约为120 min(图2d)。
2.3 培养基组分对菌株NX-1产酶的影响
2.3.1 不同种类碳源对菌株产酶的影响
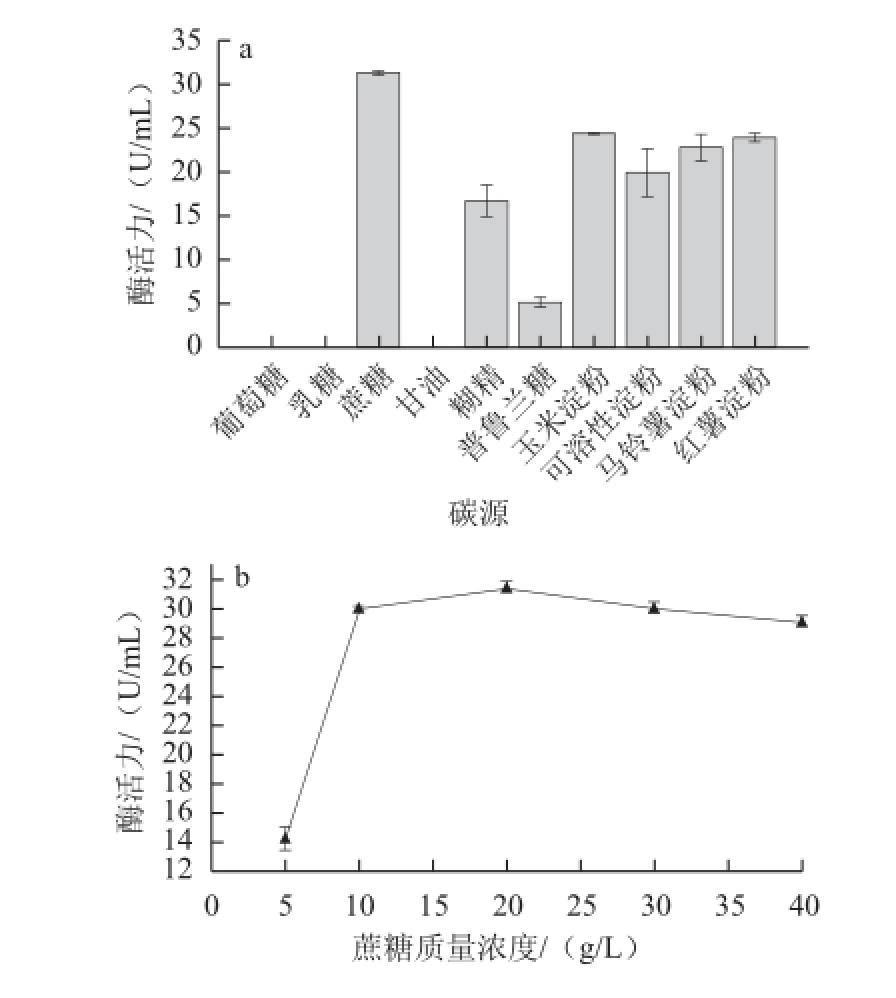
图3 不同碳源对菌株NX-1产普鲁兰酶的影响
Fig.3 Effect of different carbon sources on the yield of pullulanase
由图3a可知,菌株NX-1不能利用单糖葡萄糖、二碳糖乳糖和三碳糖甘油为碳源生长产普鲁兰酶,但可以利用二碳糖蔗糖,并且在所有碳源中蔗糖对菌株NX-1产酶影响最大,在以蔗糖为唯一碳源的条件下,普鲁兰酶活力可达31.29 U/mL。对于所选取的4 种不同类型的淀粉,结果显示玉米淀粉、红薯淀粉和马铃薯淀粉对菌株NX-1产普鲁兰酶的影响接近,而可溶性淀粉效果要低于上述3 种淀粉。在这4 种淀粉质碳源中,玉米淀粉要略优于其他3 种淀粉,在实验条件下产生的普鲁兰酶活力可达24.29 U/mL。因此,蔗糖是最适合菌株NX-1产酶的碳源。实验还考察了不同蔗糖用量对菌株NX-1产酶的影响(图3b),结果表明当蔗糖质量浓度为20 g/L时,普鲁兰酶活力最高,为31.41 U/mL。
2.3.2 不同氮源对菌株NX-1产酶的影响
以蔗糖(20 g/L)为碳源,通过在培养基中分别添加不同种类的氮源(10 g/L),测定发酵液中普鲁兰酶的活力,考察不同氮源对菌株NX-1产普鲁兰酶的影响。结果表明(图4a),菌株NX-1可以利用有机氮源和无机氮源生长产普鲁兰酶,但有机氮源要优于无机氮源硫酸铵。在6 种有机氮源中,蛋白胨对菌株产酶的影响最大,玉米浆次之,大豆蛋白胨和牛肉膏作用相近,酵母膏对产酶影响最小。实验条件下,以蛋白胨为唯一氮源,发酵液普鲁兰酶酶活力可达25.26 U/mL,是菌株NX-1产普鲁兰酶的最适氮源。考察不同蛋白胨用量对菌株NX-1产普鲁兰酶的影响(图4b),发现当蛋白胨质量浓度为10 g/L时,对促进菌株产普鲁兰酶作用最好。

图4 不同氮源对菌株NX-1产普鲁兰酶的影响
Fig.4 Effect of different nitrogen sources on the yield of pullulanase
2.3.3 不同金属离子对菌株NX-1产酶的影响
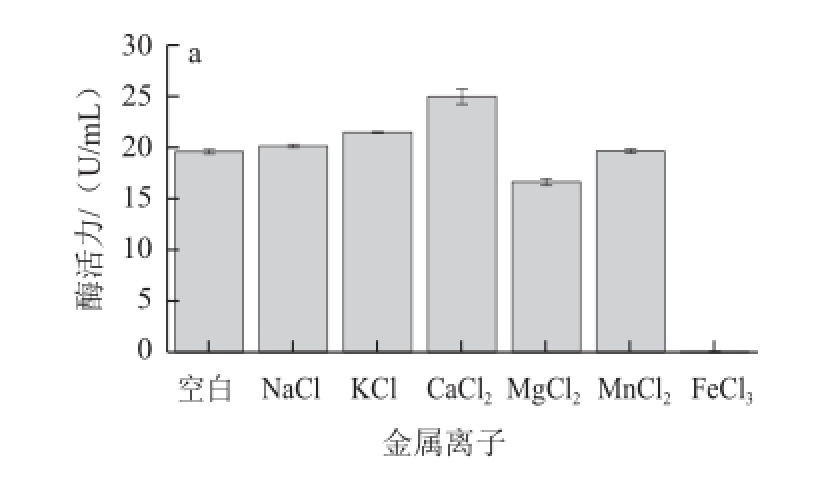

图5 不同金属离子对菌株NX-1产普鲁兰酶的影响
Fig.5 Effect of different metal ions on the yield of pullulanase
以蔗糖(20 g/L)为碳源、蛋白胨(10 g/L)为氮源,通过在培养基中添加质量浓度为0.4 g/L的不同种类的金属盐(CaCl 2、MgCl 2、FeCl 3、NaCl、KCl、MnCl 2),以不加金属盐离子作为对照,考察不同金属离子对产普鲁兰酶的影响。结果表明(图5a),与对照相比,Na +、K +、Ca 2+、Mn 2+对菌株NX-1产普鲁兰酶均有一定的促进作用,其中钙离子对菌株NX-1的产酶促进作用最高,酶活力增加27%;Mn 2+促进作用最低,仅为0.26%。相比较以上金属离子,Mg 2+和Fe 3+在该质量浓度下对菌株产酶具有抑制作用,其中Fe 3+完全抑制菌株产酶。根据以上结果确定Ca 2+是最适合菌株NX-1产普鲁兰酶的金属离子。考察不同Ca 2+质量浓度对菌株产酶的影响(图5b),发现当培养基中CaCl 2质量浓度为0.4 g/L时,对促进菌株产普鲁兰酶作用最好。
2.3.4 磷酸盐质量浓度对菌株NX-1产普鲁兰酶的影响
刘逸寒等 [2]研究表明,磷酸盐对枯草芽孢杆菌工程菌株产普鲁兰酶具有促进作用,基于此,本实验以蔗糖(20 g/L)为碳源、蛋白胨(10 g/L)为氮源,在培养基中添加0.4 g/L的氯化钙,考察不同质量浓度Na 2HPO 4对菌株NX-1产嗜冷普鲁兰酶的影响。由图6可知,磷酸根对菌株NX-1产嗜冷普鲁兰酶具有一定的影响,当磷酸盐质量浓度为4 g/L时,对菌株NX-1产酶促进效应最强,发酵液中普鲁兰酶活力达到最高(32.322 U/mL),此后随着磷酸盐质量浓度的升高,发酵液中普鲁兰酶活力逐渐降低。
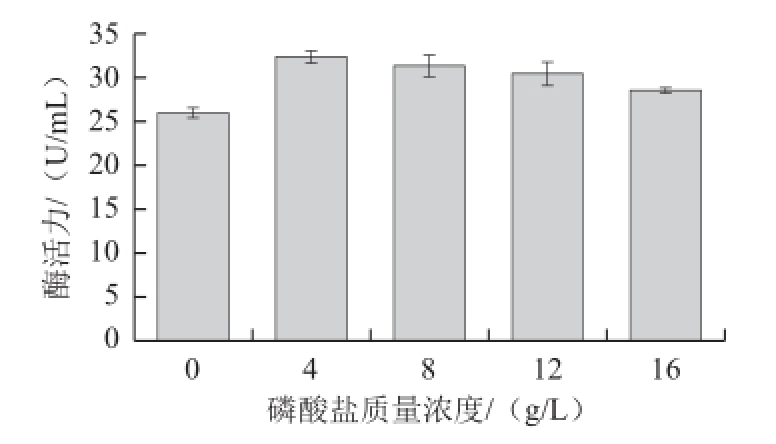
图6 磷酸盐质量浓度对菌株NX-1产普鲁兰酶的影响
Fig.6 Effect of phosphate concentration on the yield of pullulanase
2.4 菌株NX-1产普鲁兰酶最佳培养基组分优化
由单因素试验可知,培养基中蔗糖、蛋白胨、CaCl 2和磷酸盐的用量对菌株NX-1产普鲁兰酶有促进作用。为进一步考察各因素之间的相互作用及最佳组合,采用L 9(3 4)的设计方案进行正交试验。正交试验结果表明(表1),接种量1%、培养温度20 ℃的条件下,蔗糖和蛋白胨为菌株NX-1产普鲁兰酶的主要影响因素,4 个因素的影响程度依次为:蔗糖质量浓度>蛋白胨质量浓度>Na 2HPO 4质量浓度>CaCl 2质量浓度。各因素的最优组合为:蔗糖15 g/L、蛋白胨15 g/L、CaCl 20.5 g/L、Na 2HPO 46 g/L,此时普鲁兰酶活力可达25.172 U/mL,较优化前提高25.1%。
表1 培养基各组分正交试验结果及极差分析
Table 1 Results and variance analysis of orthogonal array experiments for optimization of medium components

试验号A蔗糖质量浓度/(g/L)B蛋白胨质量浓度/(g/L)C CaCl 2质量浓度/(g/L)D Na 2HPO 4质量浓度/(g/L)酶活力/(U/mL)11(15)1(5)1(0.3)1(2)21.950 2 12(10)2(0.4)2(4)21.000 3 13(15)3(0.5)3(6)25.172 42(20)12322.511 5 2 2 3 120.283 6 223.306 73(25)13216.583 8 3 2 1 316.278 2 3 1 119.778 k 122.70720.34820.51120.670 k 222.03319.18720.67920.296 k 317.54622.75221.09621.320极差R4.6483.2110.5270.922最优组合A 1B 3C 3D 39 3 3 2
嗜冷酶在低温下可以保持较高的催化效率,能够减少生产过程中的能耗、降低生产成本;此外在低温条件下食品经嗜冷酶处理有助于保持其品质和风味,并降低中温菌污染的风险;在处理结束后嗜冷酶经过温和的热处理即可失活,不需要复杂的后续处理手段。嗜冷酶的这些特性使其在乳品、果汁、肉类加工等食品工业中得到了广泛的应用。近年来,嗜冷酶资源的开发和应用成为食品工业的一个重要研究方向 [21-23]。本研究从南极海泥样品中分离得到一株产嗜冷普鲁兰酶假交替单胞菌菌株NX-1,并对菌株所产嗜冷普鲁兰酶的酶学性质进行了初步研究,同时利用L 9(3 4)正交试验对菌株产嗜冷普鲁兰酶的产酶条件进行了优化,结果表明,菌株NX-1所产嗜冷普鲁兰酶的最适作用温度为20 ℃,最适作用pH值为7.0,在最适条件下,酶的半衰期约为120 min;影响菌株NX-1产嗜冷普鲁兰酶的主要因素依次为蔗糖、蛋白胨、Na 2HPO 4和CaCl 2,菌株NX-1产嗜冷普鲁兰酶的最佳培养条件为蔗糖15 g/L、蛋白胨15 g/L、CaCl 20.5 g/L、Na 2HPO 46 g/L,在此条件下所得普鲁兰酶活力可达25.172 U/mL,较优化之前提高25.1%。通过对嗜冷普鲁兰酶的研究可为进一步研究其嗜冷机制、提高热稳定性、以及开展低温普鲁兰酶的工业化应用提供研究材料和理论指导。
参考文献:
[1] 姜楠, 宋诙, 王萍. 普鲁兰酶及其分泌相关蛋白的研究进展[J]. 微生物学报, 2011, 51(6): 725-731.
[2] 刘逸寒, 薄嘉鑫, 王亚品, 等. 枯草芽孢杆菌工程菌株产普鲁兰酶发酵条件的优化[J]. 食品研究与开发, 2012, 33(7): 136-139.
[3] 聂尧, 严伟, 徐岩. 工业属性普鲁兰酶的开发及其催化性能改善的研究进展[J]. 生物加工过程, 2013, 11(1): 104-112.
[4] CHEN Wenbo, NIE Yao, XU Yan. Signal peptide-independent secretory expression and characterization of pullulanase from a newly isolated Klebsiella variicola SHN-1 in Escherichia coli[J]. Applied Biochemistry and Biotechnology, 2013, 169(1): 41-54.
[5] ROY I, GUPTA M N. Hydrolysis of starch by a mixture of glucoamylase and pullulanase entrapped individually in calcium alginate beads[J]. Enzyme and Microbial Technology, 2004, 34(1): 26-32.
[6] RACHED J R. Pullulanase from Aerobacter aerogenes: production in a cell-bound state purifica- tion and properties of the enzyme[J]. Biochemical and Biophysical Research Communications, 1966, 22(3): 254-261.
[7] DUAN Xuguo, CHEN Jian, WU Jing. Optimization of pullulanase production in Escherichia coli by regulation of process conditions and supplement with natural osmolytes[J]. Bioresource Technology, 2013, 146: 379-385.
[8] WU Hawei, YU Xinxin, CHEN Libing, et al. Cloning, overexpression and characterization of a thermostable pullulanase from Thermus thermophilus HB27[J]. Protein Expression and Purifi cation, 2014, 95: 22-27.
[9] NIE Yao, YAN Wei, XU Yan, et al. High-level expression of Bacillus naganoensis pullulanase from recombinant Escherichia coli with autoinduction: effect of lac operator[J]. PLoS One, 2013, 8(10): e78416. doi: 10.1371/journal.pone.0078416.
[10] MIKAMI B, IWAMOTO H, MALLE D, et al. Crystal structure of pullulanase: evidence for parallel binding of oligosaccharides in the active site[J]. Journal of Molecular Biology, 2006, 359(3): 690-707.
[11] MALLE D, ITOH T, HASHIMOTO W, et al. Overexpression, purification and preliminary X-ray analysis of pullulanase from Bacillus subtilis strain 168[J]. Aata Crystallographica Section F-structural Biology Communications, 2006, 62(4): 381-384.
[12] TURKENBURG J P, BRZOZOWSKI A M, SVENDSEN A, et al. Structure of a pullulanase from Bacillus acidopullulyticus[J]. Proteins, 2009, 76(2): 516-519.
[13] YU Liangjiao, WANG Shujun, LÜ Mingsheng, et al. A GH57 family amylopullulanase from deep-sea Thermococcus siculi: expression of the gene and characterization of the recombinant enzyme[J]. Current Microbiology, 2011, 62(1): 222-228.
[14] BERTOLDO C, ARMBRECHT M, BECKER F, et al. Cloning, sequencing, and characterization of a heat-and alkali-stable type I pullulanase from Anaerobranca gottschalkii[J]. Applied and Environmental Microbiology, 2004, 70(6):3407-3416.
[15] DUAN Xuguo, CHEN Jian, WU Jing. Improving the thermostability and catalytic efficiency of Bacillus deramificans pullulanase by site-directed mutagenesis[J]. Applied and Environmental Microbiology, 2013, 79(13): 4072-4077.
[16] 王淑军, 吕明生, 李华钟, 等. 深海古菌Thermococcus siculi HJ21 高温普鲁兰酶基因的克隆及表达[J]. 食品科学, 2010, 31(19): 309-312.
[17] RAJAEI S, HEIDARI R, SHAHBANI Z H, et al. A novel cold-adapted pullulanase from Exiguobacterium sp. SH3: production optimization, purifi cation, and characterization[J]. Starch-Stärke, 2014, 66(3/4): 225-234.
[18] QOURA F, ELLEUCHE S, BRUECK T, et al. Purification and characterization of a cold-adapted pullulanase from a psychrophilic bacterial isolate[J]. Extremophiles, 2014, 18(6): 1095-1102.
[19] MARMUR J. A procedure for the isolation of deoxyribonucleic acid from microorganisms[J]. Journal of Molecular Biology, 1961, 3(2): 208-218.
[20] 朱梦, 孙海彦, 彭明. 普鲁兰酶产生菌的筛选鉴定与发酵条件的研究[J]. 食品研究与开发, 2011, 32(7): 136-140.
[21] 辛明秀, 周培瑾. 冷适应微生物产生的冷活性酶[J]. 微生物学报, 2000, 40(6): 661-664.
[22] 吕明生, 王淑军, 李华钟, 等. 海洋细菌Pseudoalteromonas fl avipulchra HH407产低温碱性蛋白酶的发酵条件和酶学性质研究[J]. 食品科学, 2010, 31(20): 298-303.
[23] SWATI J, TULASI S. Biotechnology of cold-active proteases[J]. Biology, 2013, 2(2): 755-783.
Screening of Psychrophilic Strain NX-1, a Pullulanase-Producing Bacterium and Optimization of Culture Conditions for Pullulanase Production
KANG Huaibin
1, XIAO Tiantian
1, LI Jingjing
1, YANG Qiao
2, YANG Huatian
1, YOU Xiaoyan
1,*
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China; 2. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China)
Abstract:In the present study, a psychrophilic pullulanase-producing strain, Pseudoalteromonas sp. NX-1, was isolated from Antarctic marine sediment samples with optimum growth temperature of 20 ℃. The enzymatic properties of pullulanase from strain NX-1 were investigated. The medium composition and culture conditions for pullulanase production by NX-1 were optimized by single factor and orthogonal array experiments. The results showed the optimum catalytic pH of the pullulanase was 7.0, and the half-life was 120 min at optimal catalytic conditions. The pullulanase activity of this isolate was infl uenced in decreasing order by the following medium components sugar, peptone, CaCl 2and Na 2HPO 4. The optimal culture conditions were 20 ℃ and an inoculum size of 1% using a medium consisting of 15 g/L sugar, 15 g/L peptone, 0.5 g/L CaCl 2and 6 g/L Na 2HPO 4. The yield of pullulanase was improved by 25.1% when compared to that obtained before optimization that before.
Key words:psychrophilic pullulanase; Pseudoalteromonas; fermentation; orthogonal experiments
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2015)01-0118-06
doi:10.7506/spkx1002-6630-201501023
收稿日期:2014-08-17
基金项目:国家自然科学基金青年科学基金项目(31200035);河南科技大学博士启动基金项目(090061608);河南科技大学研究生创新基金项目(CXJJ-YJS-Z008);河南科技大学大学生训练计划项目(2013122)
作者简介:康怀彬(1963—),男,教授,硕士,研究方向为农产品加工及质量控制。E-mail:khbin001@163.com
*通信作者:尤晓颜(1979—),男,副教授,博士,研究方向为食品生物技术。E-mail:xiaoyanyou@hasust.edu.cn