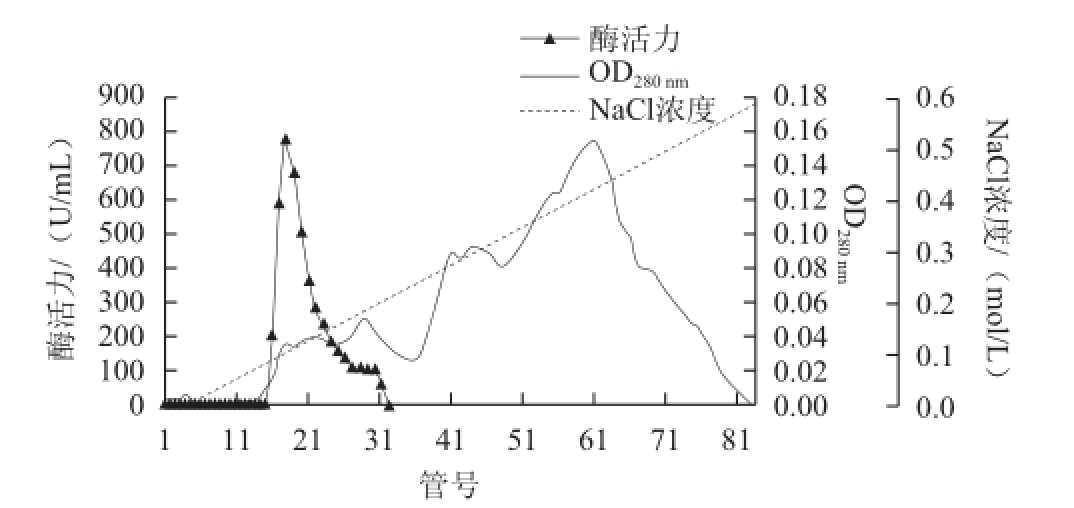
图1 大豆CAT的DEAE-Sepharose离子交换层析
Fig.1 DEAE-sepharoseion-exchange chromatography profi le of crude CAT solution
方 玲,孙才云,唐云明 *
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
摘 要:新鲜大豆芽经匀浆、磷酸缓冲液抽提、硫酸铵分级沉淀、DEAE-Sepharose离子交换层析、Superdex-200凝胶过滤层析,获得电泳纯的过氧化氢酶。该酶酶活回收率为30.92%,纯化倍数为293.09,酶比活力达到26 322.43 U/mg。该酶全分子质量为234.9 kD,亚基分子质量为57.42 kD;最适pH值为7.2,最适温度为30 ℃,在pH 4.0~10.6及25~35 ℃范围内有较好的稳定性;在30 ℃、pH 7.2条件下测得该酶对过氧化氢的K m值为31.82 mmol/L;十二烷基硫酸钠、草酸、Ag +、Cu 2+对该酶有强烈的抑制作用,Pb 2+对该酶有双重作用,低浓度时有激活作用而高浓度时抑制酶活性。
关键词:大豆;过氧化氢酶;分离纯化;性质
过氧化氢酶(catalase,CAT;EC 1.1 1.1.6)又称触酶,是一类广泛存在于动植物及需氧微生物体内的末端氧化还原酶,主要功能是催化过氧化氢发生歧化反应生成水和氧气,清除体内的过氧化氢,从而使细胞免于遭受H 2O 2的毒害 [1]。其酶促活性为机体提供了抗氧化防御机理,是生物防御体系的关键酶之一 [2]。它在农业、医药、食品加工、纺织、印染、环保等方面有十分重要的应用价值 [3-10]。因此,获得来源广泛且成本低廉的CAT在理论和实践方面有十分重要的意义。大豆(Glycine max),别名黄豆,一年生草本植物,起源于我国,至今已有5 000 年的种植史,具有美容养颜、抗癌、增强人体组织机能等作用 [11-12]。大豆来源广泛,成本低廉,四季均可取材,经实验发现大豆中CAT含量十分丰富,且从大豆中分离纯化CAT还未见报道,故本实验尝试以大豆为材料从中分离纯化CAT,并对部分酶学性质进行研究,旨在为该酶更深入研究、开发及应用提供参考。
1.1 材料与试剂
以新鲜大豆芽为材料,购自重庆市北碚区永辉超市。
DEAE-Sepharose、Superdex-200、凝胶过滤层析分子质量标准品、蛋白质SDS-PAGE标准品 美国GE Healthcare公司;丙烯酰胺、甲叉双丙烯酰胺 瑞士Fluka公司;三羟甲基氨基甲烷、考马斯亮蓝R-250美国Bio-Rad公司;其他试剂均为国产分析纯。
1.2 仪器与设备
精密电子天平 瑞士Mettler-Toledo公司;PHS-32W微电路pH计 上海理达仪器厂;Mill-Q plus超纯水仪美国Millipore公司;GL-21M高速冷冻离心机 湖南湘仪公司;蛋白核酸定量仪 日本岛津公司;蛋白质纯化系统 美国GE Healthcare公司;垂直板电泳槽和电泳仪 美国Bio-Rad公司;MC4L冷冻干燥机 德国Uni Equip公司。
1.3 方法
1.3.1 大豆CAT粗酶液的制备
取新鲜的大豆芽的子叶部分30 g,用蒸馏水洗净,按1∶15的比例加入预冷的磷酸盐缓冲液(0.0 5 mol/L、pH 7.2、含1 mmol/L乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)),匀浆后放于4 ℃冰箱中静置抽提2 h后,纱布过滤,将滤液离 心40 min(4 ℃,12 000 r/min), 收集上清液即为粗酶液。
1.3.2 硫酸铵分级盐析
于粗酶液中加入硫酸铵粉末至30%饱和度,4 ℃静置盐析2 h,10 000 r/min离心0.5 h,收集上清液;再向其中加入硫酸铵粉末至40%饱和度,4 ℃静置盐析2 h,6 000 r/min离心0.5 h,收集沉淀,沉淀用抽提缓冲液(0.05 mol/L,pH 7.2,含1 mmol/L EDTA)溶解,4 ℃条件下用0.25 mol/L磷酸盐缓冲液(pH 7.2,含1 mmol/L EDTA)透析12 h后即为初酶液。
1.3.3 DEAE-Sepharose离子交换层析
先用 0.05 mol/L磷酸盐缓冲液(pH 8.0,含1 mmol/L EDTA)平衡DEAE-Sepha rose离子交换层析柱后,取初酶液10 mL上柱,用0~0.5 mol/L的NaCl溶液(含0.05 mol/L,pH 8.0的磷酸缓冲液,1 mmol/L的EDTA)进行线性梯度洗脱,流速0.65 mL/min,每管收集6.5 mL;测定各管CAT活性和蛋白含量,收集活性较高的各管酶液,于4 ℃冰箱中保存备用。
1.3.4 Superdex-200凝胶过滤层析
先用0.05 mol/L磷酸盐缓冲液(pH 8.0,含1 mmol/L EDTA)平衡Superdex-200层析柱后,取在1.3.3节中收集的活力较高的CAT酶液4 mL上柱,用0.05 mol/L pH 8.0磷酸缓冲液(含1 mmol/L的EDTA)洗脱,流速0.3 mL/min,每管收集10 min;测定各管CAT活性和蛋白含量;收集活性较高的酶液,4 ℃超纯水透析脱盐12 h,冷冻干燥后于-20 ℃冰箱保存备用。
1.3.5 CAT活力的测定
以H 2O 2为底物,采用钼酸铵终止法 [13]进行测定。酶活力单位定义为:在测定条件下,每分钟催化分解1 μmol H 2O 2所需的酶量为一个酶活力单位(U)。
1.3.6 CAT纯度鉴定与分子质量测定 [14]
用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)对大豆CAT进行纯度鉴定,采用质量分数为12%的分离胶和5%的浓缩胶,上样量8 μL。该酶亚基分子质量用SDS-PAGE测定,全分子质量用Superdex-200凝胶过滤层析测定。
1.3.7 蛋白质含量的测定
用Bradford染料法与紫外分光光度法进行测定 [14]。
1.3.8 大豆CAT部分性质研究
1.3.8.1 CAT最适pH值及pH值稳定性
用不同pH值(3.0~10.6)的缓冲液配制底物过氧化氢溶液,在37 ℃条件下,测定CAT在pH 3.0~10.6反应底物中的酶活力,每组实验重复3 次,取平均值(以下实验重复次数相同)。以酶活力最高值为100%,计算相对酶活力,以研究CAT最适pH值。将酶液置于不同pH值(3.0~10.6)的缓冲溶液中,室温放置90 min后,测定CAT酶活力,以酶活力最高值为100%,计算该酶在不同pH值条件下的相对酶活力,研究该酶的pH值稳定性。
1.3.8.2 CAT最适温度和热稳定性
测定CAT在不同温度(15~75 ℃),pH 7.2条件下的酶活力,以酶活力最高值为100%,计算相对酶活力,以研究CAT最适反应温度。将酶液分别置于不同温度(25~65 ℃)下保温不同时间(1~5 h)后,在pH 7.2、37 ℃条件下测定其酶活力,以酶液不保温时的酶活力为100%,计算其相对酶活力,以研究CAT的热稳定性。
1.3.8.3 CAT米氏常数(K m)的测定
在最适条件下(30 ℃、pH 7.2),测定大豆CAT以不同浓度的过氧化氢(5、10、20、30、40、50 mmol/L)为底物时的酶活力,采用双倒数法(Lineweaver-Burk法) [15],计算出该酶的K m值。
1.3.8.4 不同化合物对CAT活 性的影响
分别将不同化合物配成200 mmol/L母液,按一定比例与磷酸盐抽提缓冲液和酶液混合,使得各化合物终浓度分别为5、10、15、20、25、30 mmol/L,在4 ℃条件下作用30 min后,测酶活力,以不加化合物时的酶活力为100%,计算CAT的相对酶活力。
1.3.8.5 不同有机溶剂对CAT活性的影响
分别将甲醇、乙醇、异丙醇按一定比例与磷酸盐抽提缓冲液和酶液混合,使得各有机溶剂终体积分数分别为10%、20%、30%、40%、50%、60%,在4 ℃条件下作用30 min后,测酶活力,以不加有机物时的酶活力为100%,计算CAT的相对酶活力。
1.3.8.6 金属离子对CAT活性的影响
分别将不同金属离子(K +、Mn 2+、Co 2+、Mg 2+、Pb 2+、Ca 2+、Li +、Ba 2+、Cd 2+、Cu 2+、Ag +)配成50 mmol/L母液,按一定比例与磷酸盐抽提缓冲液和酶液混合,使得各金属离子的终浓度分别为1、2、3、4、5 mmol/L,在4 ℃条件下作用30 min后,测酶活力,以不加金属离子时的酶活力为100%,计算CAT的相对酶活力。
2.1 大豆CAT的分离纯 化

图1 大豆CAT的DEAE-Sepharose离子交换层析
Fig.1 DEAE-sepharoseion-exchange chromatography profi le of crude CAT solution
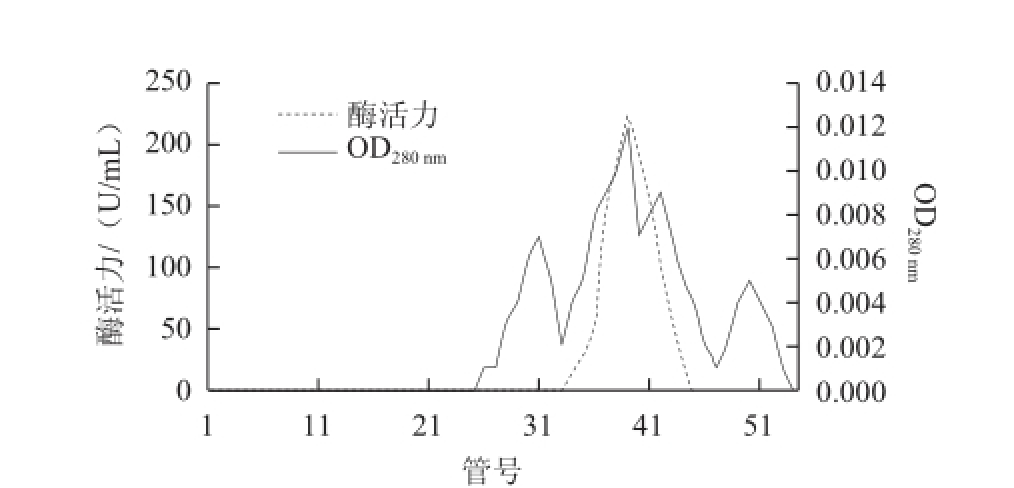
图2 大豆CAT的Superdex-200凝胶过滤层析
Fig.2 Superdex-200 gel fi ltration chromatography of catalase from Glycine max
表1 大豆CAT的分离纯化
Table 1 Summary of isolation and purifi cation of catalase from soybean

纯化步骤总蛋白质含量/mg总酶活力/U酶比活力/(U/mg)酶活回收率/%纯化倍数粗酶液8 837.478793 69289.81100.001.00硫酸铵分级沉淀1 282.057547 171.2426.7968.944.75 DEAE-Sepharose30.24273 931.079 059.4734.51100.87 Superdex-2009.324245 430.3526 322.4330.92 293.09
大豆CAT的初酶液经DEAE-Sepharose离子交换层析的结果如图1所示,酶活性主要集中在18~22 管,收集酶活性较高管的洗脱液直接用于凝胶层析,经Superdex-200凝胶层析后的洗脱图谱如图2所示,酶活性主要集中在37~41 管,收集酶活性较高管的酶液,蒸馏水透析、冷冻干燥后,经SDS-PAGE电泳,显示为单一条带(图3),说明该酶经过分离纯化后已达到了电泳纯。酶的整个分离纯化结果如表1所示,最终得到大豆CAT的回收率为30.92%,酶比活力为26 322.43 U/mg,纯化倍数为293.09。
2.2 大豆CAT的分子质量
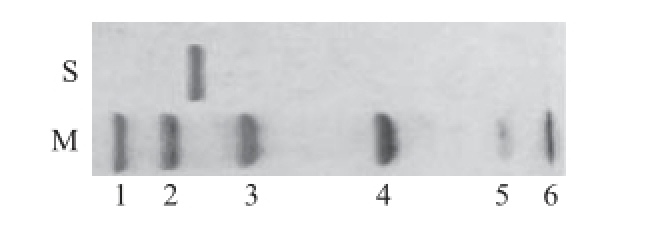
图3 大豆CAT的SDS-PAGE电泳图谱
Fig.3 SDS-PAGE of purified catalase from soybean
M. 分子质量标准品;S. 大豆CAT 57.42 kD;1. 兔磷酸化酶B 97.0 kD;2. 牛血清白蛋白66.0 kD;3. 鸡卵清蛋白45.0 kD;4. 牛碳酸酐酶30.0 kD;5. 胰蛋白酶抑制剂20.1 kD;6. α-牛乳 清蛋白14.4 kD。
纯化后的CAT用SDS-PAGE电泳分析为单一条带(图3),测得大豆CAT的亚基分子质量为57.42 kD用Superdex-200凝胶过滤层析测得全酶的分子质量为234.9 kD(图4),由此可以推断该酶由4 个相同的亚基组成。
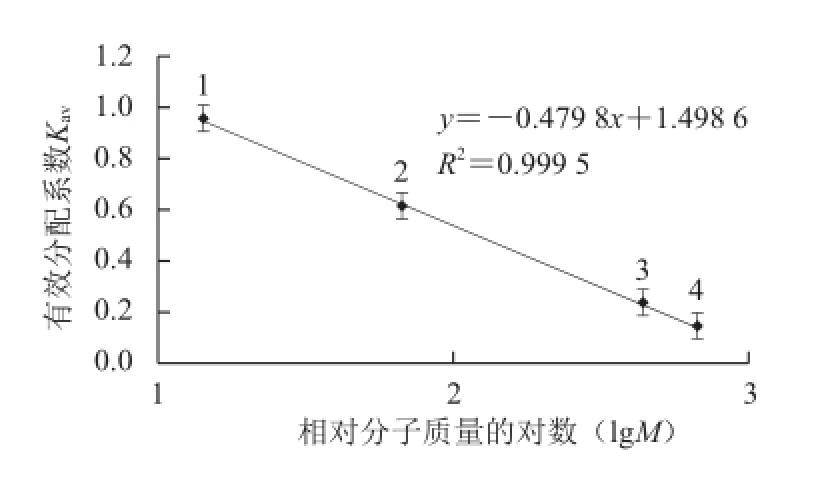
图4 Superdex-200凝胶过滤层析测大豆CAT的分子质量
Fig.4 Molecular weight estimation of catalase by Superdex-200 gel fi ltration chromatography
1.溶菌酶14.30 kD;2.牛血清白蛋白67 kD;3.铁蛋白440.0 kD;4.甲状腺球蛋白669.0 kD。
2.3 大豆CAT的最适温度与热稳定性
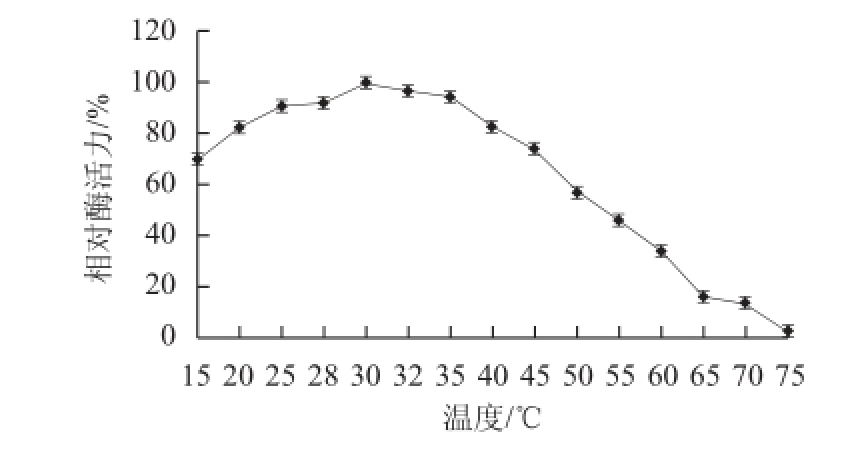
图5 温度对大豆CAT酶活力的影响
Fig.5 Effect of temperature on CAT activity
由图5可知,大豆CAT的最适温度为30 ℃。该酶在25~35 ℃范围内有相当好的热稳定性,保温5 h相对酶活力在86%以上,45 ℃时保温5 h相对酶活 力仍在50%以上,超过此温度相对酶活力迅速下降,65 ℃时保温1 h,酶活力几乎完全丧失(图6)。可能是因为高温破坏了酶分子的天然三维空间结构使酶的催化功能发生改变。
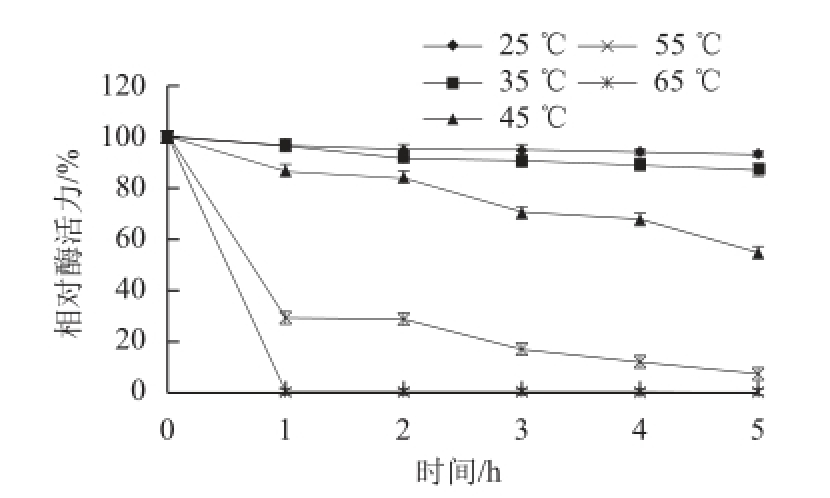
图6 大豆CAT的热稳定性
Fig.6 Thermal stability of CAT
2.4 大豆CAT的最适pH值与pH值稳定性
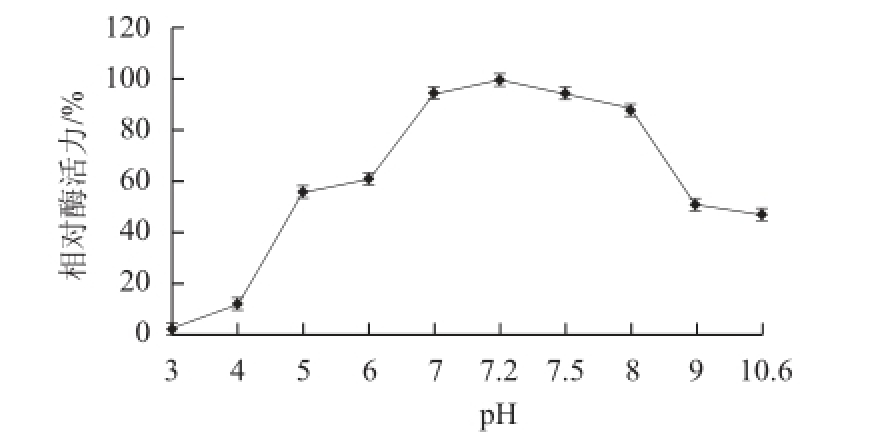
图7 pH值对大豆CAT酶活力的影响
Fig.7 Effect of pH on catalase activity
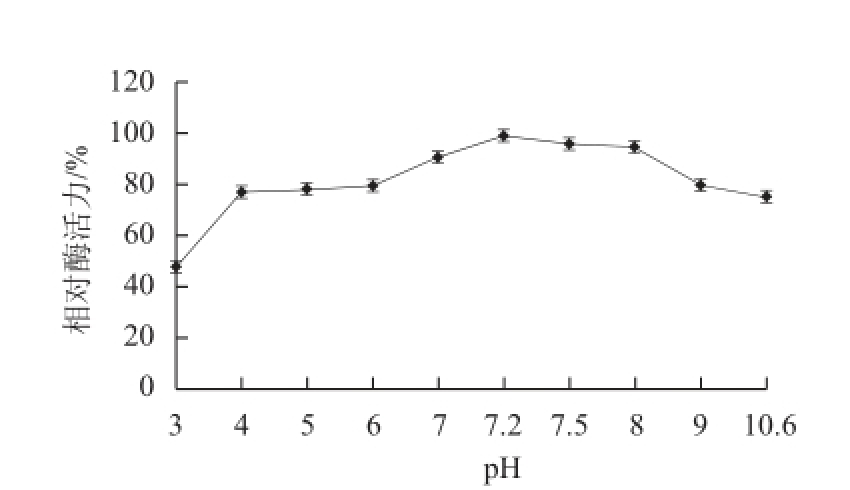
图8 大豆CAT的pH值稳定性
Fig.8 pH stability of catalase activity
由图7可知,大豆CAT的最适pH值为7.2。由图8可知,该酶在pH 4.0~10.6范围内稳定性较好,室温放置90 min,相对酶活力均保持在75%以上,说明该酶对酸碱的耐受范围较广,有非常好的应用价值。
2.5 米氏常数(K m)的测定结果
由实验结果可知,在30 ℃,pH 7.2条件下分别测定以不同浓度(5、10、20、30、40、50 mmol/L)为底物时该酶的反应速率,按Lineweaver-Burk作图法,计算出大豆CAT的K m值为31.82 μmol/L(图9)。该酶K m值为31.82 μmol/L,与芦荟 [13](34 mmol/L)、蒜苗 [16](38.2 mmol/L)、鸭肝 [17](37.29 mmol/L)的K m值相接近,而远高于苹果 [18](2.27 mmol/L)、重组大肠杆菌 [19](7.75 mmol/L)、发芽的黑绿豆(16.2 mmol/L) [20]的K m值,也远低于韭菜 [20](46.93 mmol/L)、大鼠肝脏 [21](56 mmol/L)、氧化葡糖杆菌 [22](61 mmol/L)的K m值,说明不同来源的CAT对底物的亲和力有差异。
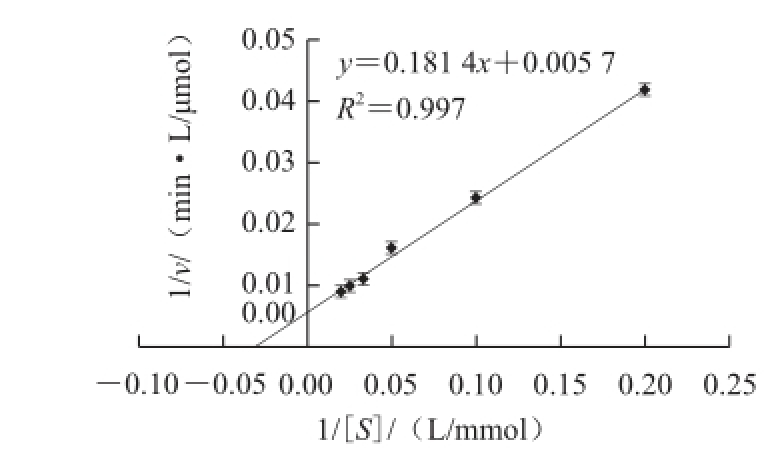
图9 双倒数法测得大豆CAT的米氏常数曲线
Fig.9 Lineweaver-Burk plot for K
mdetermination of CAT
2.6 不同有机溶剂对大豆CAT活性的影响

图10 甲醇、乙醇、异丙醇对大豆CAT酶活力的影响
Fig.10 Effect of methanol. ethanol and isopropyl alcohol on CAT activity
由图10可知,3种有机溶剂对大豆CAT都有抑制作用,当有机溶剂体积分数在10%~30%范围时,该酶的相对酶活性变化趋势不大,超出此范围,有机溶剂体积分数越大,抑制作用就越大,可能是因为有机溶剂的加入使酶周围的水化层被破坏,导致由水分子直接或间接参与形成的氢键、疏水键及范德华力已被破坏,从而引起酶构象发生改变,使酶活性下降 [23]。
2.7 不同化合物对大豆CAT活性的影响
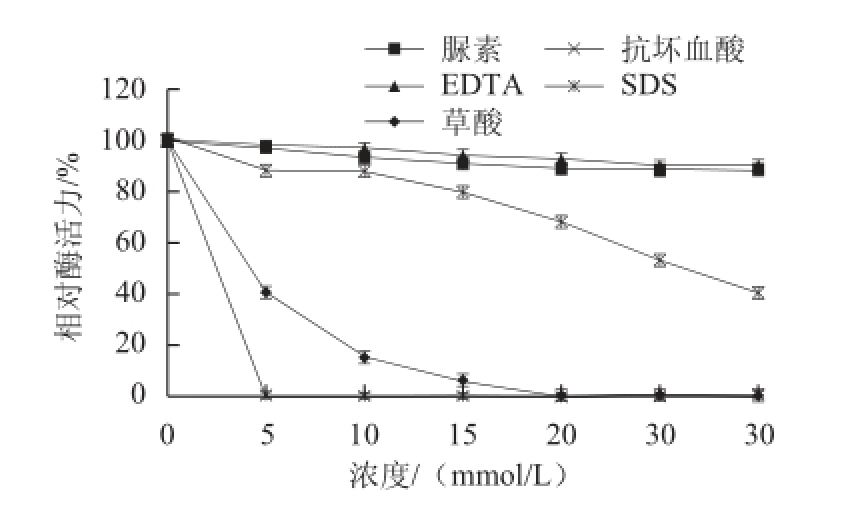
图11 不同化合物对大豆CAT的酶活力的影响
Fig.11 Effect of various compounds on CAT activity
由图11可知,SDS对该酶活性的抑制作用最强,当浓度达到5 mmol/L时,酶活性完全丧失,可能是因为SDS是一种阴离子去污剂能够破坏酶蛋白分子中的氢键和疏水键,改变酶的空间构象,使酶活性降低 [23]。草酸对该酶活性也有较强的抑制作用,当浓度达到20 mmol/L时,酶几乎完全失活。而脲素、EDTA对该酶活性影响不大,当浓度达到30 mmol/L时,相对酶活力均在85%以上。
2.8 金属离子对大豆CAT活性的影响
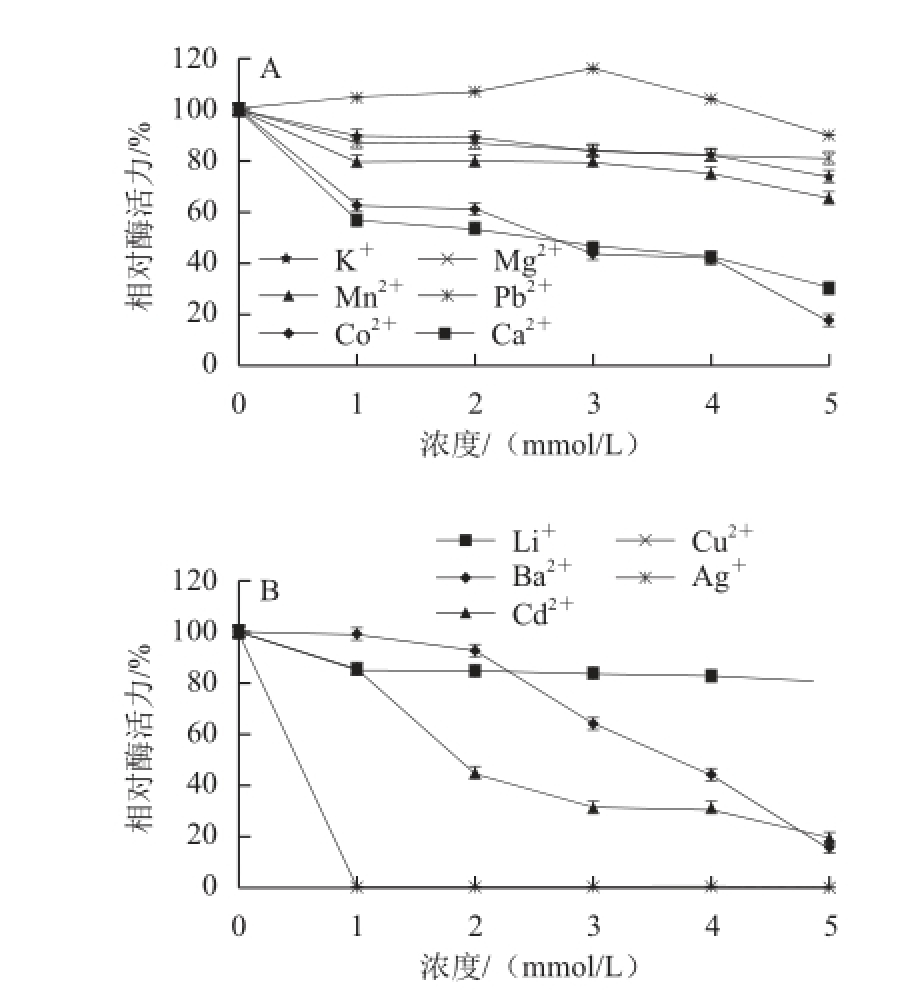
图12 不同金属离子对大豆CAT酶活力的影响
Fig.12 Effect of metal ions on CAT activity
由图12可知,Cu 2+、Ag +对大豆CAT的抑制作用最强,当浓度在1 mmol/L时,该酶的相对酶活力为0。Li +、Mn 2+、Mg 2+、K +对该酶活性的抑制作用相对较弱,而Ba 2+、Cd 2+、Co 2+、Ca 2+对该酶的抑制作用较明显。Pb 2+在低浓度(≤3 mmol/L)时对该酶活性有激活作用,高浓度(>3 mmol/L)时对该酶活性有抑制作用。
本实验以来源广泛、成本低廉、四季均可取材的大豆子叶为实验材料,经匀浆、磷酸缓冲液抽提、硫酸铵分级沉淀、DEAE-Sepharose离子交换层析及Superdex-200凝胶过滤层析,从大豆子叶中分离纯化出了CAT的均一组分。用pH 7.2磷酸盐缓冲液平衡DEAE-Sepharose离子交换柱时,目的蛋白没有被该离子柱所吸附,通过实验发现,用pH 8.0的磷酸盐缓冲液平衡柱子,目的蛋白能有效地吸附在离子柱上,与杂蛋白分离效果较好,且收集到的样品酶活较高,无需浓缩可直接上Superdex-200凝胶过滤层析柱,减少实验步骤的同时减少了酶活损失,同时得到了电泳纯的大豆CAT;虽然酶活回收率低于蒜苗CAT [17](蒜苗CAT的回收率40.05%),但比活力和纯化倍数高于蒜苗CAT [17](蒜苗CAT的比活力为25 975.36 U/mg,纯化倍数为125.97)。
该酶最适反应温度为30 ℃,与火龙果 [27](30 ℃)的最适温度一致,而低于其他来源的CAT的最适温度,该酶在25~35 ℃范围内有相当好的热稳定性,保温5 h相对酶活力在86%以上,45 ℃时保温5 h相对酶活仍在50%以上;该酶在pH 4.0~10.6范围内稳定性较好,室温放置90 min,相对酶活力均保持在75%以上,说明该酶对酸碱的耐受范围较广,有非常好的应用价值,最适pH值为7.2,与韭菜 [21](7.2)、蒜苗 [16](7.2)的最适pH值相一致,而与鸭肝 [17](7.0)、贻贝 [26](7.0)、大鼠 [22](7.5)、火龙果 [27](7.0)、芦荟 [13](7.5)的最适pH值近似,说明不同来源的CAT对环境中的pH值有相似的适应性。
该酶亚基分子质量为5 7.4 2 k D,与鸭肝 [1 7](6 2.5 k D)、蒜苗 [1 6](5 9.1 6 k D)、韭菜 [2 1](62.34 kD)、芦荟 [13](60.60 kD)的亚基分子质量相接近,而与贻贝 [26](76 kD)的CAT的亚基分子质量有差异,说明不同来源的CAT在分子结构上具有物种特异性。
通过实验表明:Cu 2+、Ag +对该酶有强烈的抑制作用,浓度为1 mmol/L时酶活完全丧失,与蒜苗 [16]中Cu 2+、Ag +对CAT的强烈抑制作用相似,可能是因为金属离子直接作用于酶的活性部位,减弱了酶的催化功能 [24],而在鸭肝 [17]、贻贝 [25]及火龙果 [26]中Cu 2+对酶有激活作用,可能是因为该金属离子的加入促进反应时形成酶蛋白、金属离子、底物三元配合物的稳定过渡态,从而降低反应的活化能,使酶促反应速度加快 [29]。Pb 2+对该酶活性有双重作用,低浓度时对酶有激活作用高浓度时抑制酶活,可能是因为二价的 Pb 2+的浓度会影响该酶本身的带电情况,在低浓度时,可能对CAT的带电量影响较弱,酶分子空间结构没有发生明显变化,并可以促进底物与酶活性中心相互结合,形成底物-酶-金属离子复合物 [23],因而对酶有激活作用;但当Pb 2+浓度增大时,大量Pb 2+的聚集改变了酶蛋白本身的带电情况,影响了酶分子的空间构型,从而逐渐抑制酶活性。Li +、Mn 2+、Mg 2+、K +、Ba 2+、Ca 2+对该酶都有一定的抑制作用,而在鸭肝 [17]和贻贝 [25]中Mg 2+对酶有激活作用,在蒜苗 [16]中Li +对酶有激活作用,K +对酶有双重作用,在嗜热链霉菌 [27]中Ca 2+对酶有激活作用,在芦荟 [13]中K +、Ba 2+对酶有激活作用,以上对比结果说明了同种金属离子对不同来源的CAT有不同的作用,可能是因为不同物种对环境的适应能力有差异和在进化过程中基因选择性表达的结果 [25]。
参考文献:
[1] MCCLUNG C R. Regulation of catalases in Arabidopsis[J]. Free Radical Biology & Medicine, 1977, 23(3): 489-496.
[2] 张坤生, 田荟琳. 过氧化氢酶的功能及研究[J]. 食品科技, 2007, 32(1): 8-10.
[3] ALPTEKIN O, TUKEL S S, YILDIRIM D, et al. Characterization and properties of catalase immobilized onto controlled poreglass and its application in batch and plug flow type reactors[J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 58(1): 124-131.
[4] 刘灵芝, 钟广蓉, 熊莲, 等. 过氧化氢酶的研究与应用新进展[J]. 化学与生物工程, 2009, 26(3): 15-18.
[5] TARHAN L. Use of immobilized catalase to remove H 2O 2used in thesterilization of milk[J]. Progress Biochemistry, 1995, 30(7): 623-628.
[6] ALACAM A, TULUNOGLU O, OYGUR T, et al. Effects of topical catalase application on dental pulp tissue: a histo-pathological evalution[J]. Journal of Dentistry, 2000, 28(5): 333-339.
[7] 张瑞萍. 过氧化氢酶在棉织物漂染工艺中的应用研究[J]. 印染, 2000, 26(8): 12-14.
[8] CHU H D, LEEDER J G, GILBERT S G. Immobilized catalase reactor for use in peroxide sterilization of dairy products[J]. Journal of Food Science, 2006, 40(3): 641-643.
[9] 曹翔宇, 华兆哲, 燕国梁, 等. 过氧化氢酶发酵生产条件优化及在染整清洁生产中的应用研究[J]. 工业微生物, 2007, 36(4): 7-12.
[10] MAURIZIO P, MASSIMILIANO F, PAOLA P, et al. Effect of stirrer speed and buffering agents on the production of glucose oxidase and catalase by Penicillium variabile (P16) in benchtop bioreactor[J]. Enzyme and Microbial Technology, 1995, 17(4): 336-339.
[11] 解义勇. 黄豆营养价值的新发现[J]. 中国保健营养, 2002(8): 33.
[12] 戈儒乾. 合理膳食话黄豆[J]. 心血管病防治知识, 2005(4): 11.
[13] 朱鸿, 李想韵, 邓玉. 等. 芦荟过氧化氢酶的分离纯化和性质研究[J].食品科学, 2010, 31(5): 206-210.
[14] 李建武, 余瑞元. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994.
[15] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社, 2002: 378-380.
[16] 胡瑞斌, 孙芳, 任美凤, 等. 蒜苗过氧化氢酶的分离纯化及部分性质研究[J]. 食品科学, 2013, 34(9): 250-255.
[17] 邱慧, 郭小路, 易燚波, 等. 鸭肝过氧化氢酶的分离纯化及部分性质研究[J]. 西南大学学报: 自然科学版, 2008, 30(4): 163-168.
[18] 邓向军, 余筱洁. 苹果过氧化氢酶的纯化及性质研究[J]. 食品科技, 2006, 31(11): 66-68.
[19] 王凡强, 王正祥, 邵蔚蓝, 等. 重组大肠杆菌热稳定性过氧化氢酶的纯化及性质研究[J]. 微生物学报, 2002, 42(3): 348-353.
[20] KANDUKRI S S, NOOR A, RANJINI S S, et al. Purification and characterization of catalase from sprouted black gram (Vigna mungo) seeds[J]. Journal of Chromatography B, 2012, 889: 50-54.
[21] 邓玉, 敬海明, 成丽丽, 等. 韭菜过氧化氢酶的分离纯化及其部分酶学特性[J]. 食品科学, 2011, 32(9): 217-221.
[22] 周娜磊, 李玥, 高媛, 等. 大鼠肝脏过氧化氢酶的分离纯化及性质[J].氨基酸和生物资源, 2009, 31(2): 56-58.
[23] YAMAGUCHI H, SUGIYAMA K, HOSOYA M, et al. Gene cloning and biochemical characterization of a catalase from gluconobacteroxydans[J]. Journal of Bioscience and Bioengineer, 2011, 111(5): 522-527.
[24] 孙芳, 胡瑞斌, 任美凤, 等. 鸭心苹果酸脱氢酶的分离纯化及酶学性质研究[J]. 食品科学, 2013, 34(23): 239-244.
[25] 孙芳, 任美凤, 胡瑞斌, 等. 韭菜酸性磷酸酶的分离纯化和部分性质研究[J]. 食品科学, 2013, 34(17): 187-191.
[26] 林少琴, 兰瑞芳, 余萍, 等. 贻贝过氧化氢酶的纯化及部分性质[J].食品科学, 2000, 21(11): 22-24.
[27] 张福平, 刘燕菁. 火龙果过氧化氢酶活性的研究[J]. 食品工业科技, 2008, 29(11): 128-132.
[28] 周一, 严自正, 张树政, 等. 嗜热链霉菌过氧化氢酶的纯化及性质研究[J]. 微生物学报, 1990, 30(5): 336-343.
[29] 王健. 金属离子对酶功能所起的作用[J]. 宜宾师专学报, 1993(2): 65-77.
Isolation, Purifi cation and Partial Characterization of Catalase from Soybean (Glycine max)
FANG Ling, SUN Caiyun, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweet Potato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
Abstract:Electrophoresis-purity catalase (CAT) was obtained from freshly sprouted soybean (Glycine max) by the sequential steps of homogenization, buffer solution extraction, ammonium sulfate precipitation, DEAE-Sepharose ion exchange chromatography and Superdex-200 gel filtration chromatography. The purifi ed enzyme had a specifi c activity of 26 322.43 U/mg, with a 30.92% activity recovery and a 293.09-fold purifi cation. The molecular mass of the CAT enzyme comprising a 57.42 kD subunit was 234.9 kD. Its optimum pH and temperature were 7.2 and 30 ℃, respectively. This enzyme was stable at pH 4.0–10.6 and at 25–35 ℃. Its K mtowards H 2O 2was 31.82 mmol/L. The enzyme activity was strongly inhibited by sodium dodecyl sulfate (SDS), oxalic, Ag +and Cu 2+, but was activated by low concentration of Pb 2+.
Key words:soybean; catalase; isolation and purification; characterization
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2015)01-0140-06
doi:10.7506/spkx1002-6630-201501027
收稿日期:2014-02-09
基金项目:重庆市科委科技攻关重点项目(CSTC2011AB1027)
作者简介:方玲(1988—),女,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:xuemeifl @163.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn