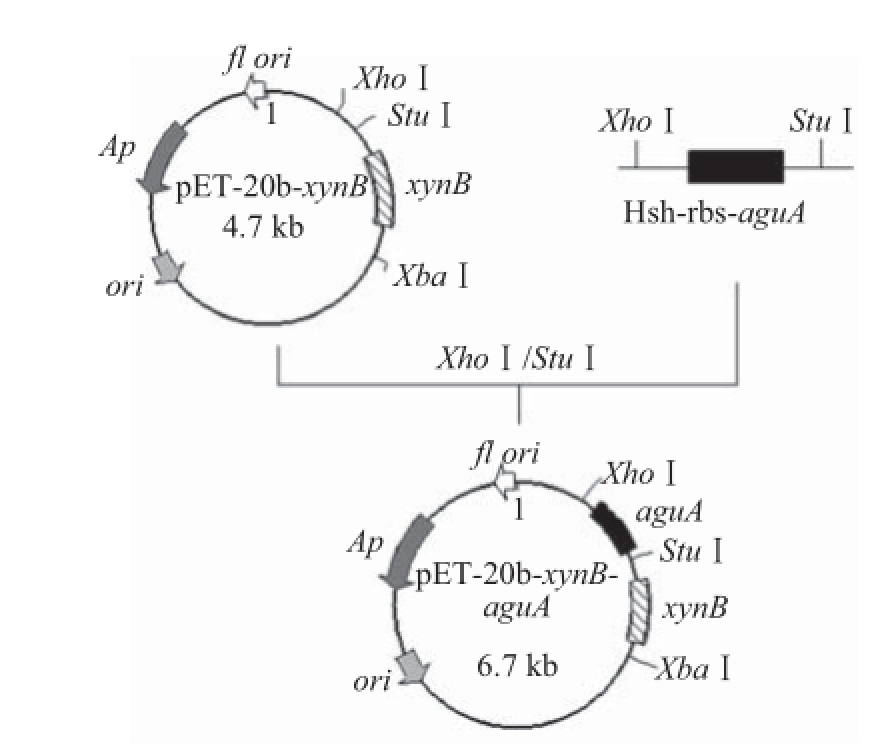
图1 共表达载体pET-20b-xynB aguA的构建
Fig.1 Construction of coexpression vector pET-20b-xynB-aguA
沈艺红 1,薛业敏 1,*,侯静静 1,许家兴 2,李相前 3
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.淮阴师范学院 江苏省生物质能与酶技术重点实验室,江苏 淮安 223000;3.淮阴工学院 江苏省生物质转化与过程集成工程实验室,江苏 淮安 223003)
摘 要:目的:提高海栖热袍菌(Thermotoga maritima MSB8)来源的木聚糖酶XynB和α-葡萄糖醛酸苷酶AguA生产效率并降低生产成本。方法:利用基因重组技术将海栖热袍菌的XynB和AguA基因置于不同表达盒下构建共表达载体pET-20b-xynB-aguA和pET-28a-xynB-aguA,分别转化大肠杆菌Escherichia coli JM109(DE3)进行诱导表达,获得双酶混合物进而水解桦木木聚糖及玉米芯。结果:重组菌E. coli JM109(DE3)/pET-28a-xynB-aguA比E. coli JM109(DE3)/pET-20b-xynB-aguA产酶更具优势,在LB培养基中诱导培养8 h,XynB和AguA的产量分别达到7.6 U/mL和0.5 U/mL,在TB培养基中培养,XynB可达到10.27 U/mL,AguA为1.5 U/mL。在80 ℃水解条件下,双酶比单一木聚糖酶能够更彻底降解桦木木聚糖,所得酶解液中木二糖的含量和纯度更高;从还原糖释放量及电子显微镜观察可以看出双酶液对农副产品玉米芯具有良好的降解作用。结论:XynB和AguA基因(T. maritima)的克隆共表达具有可行性,并且在生物转化、食品工业和饲料生产等领域具有潜在应用前景。
关键词:木聚糖酶;葡萄糖醛酸苷酶;共表达;水解
我国是一个农业大国,每年可产各种农作物秸杆约5.7亿 t,玉米芯0.4亿 t [1]。这些农业废弃物绝大部分被燃烧掉,既浪费资源又造成环境污染。若将其降解为低聚木糖,可作为功能因子,具有显著的双歧杆菌增殖能力、抗消化性、无龋齿性及促进人体对钙的吸收等生理活性 [2-4]。因此开发利用这一类半纤维素可再生资源,既可以相对减缓资源匮乏,又能达到清洁环境的效果,具有良好的经济效益和社会效益。
到目前为止,已有大量微生物及其所产木聚糖酶用于制备低聚木糖 [5-6]。但已有研究表明,玉米芯、甘蔗渣和秸秆等农林废弃 物中约94%的半纤维素是阿拉伯糖葡萄糖醛酸木聚糖 [12],其结构是以β-1,4糖苷键连接的多聚木糖链 [7],在D-木糖的第二位氧上连接有D-葡萄糖醛酸并在第3位氧上连接有L-阿拉伯呋喃糖。当木聚糖酶作用木聚糖底物时,这些侧链的存在妨碍了木聚糖 酶对木聚糖底物糖苷键的水解 [8-9]。α-葡萄糖醛酸苷酶水解葡萄糖醛酸与木聚糖主干上木糖残基间的α-1,2糖苷键,能协同木聚糖酶的水解作用,加速低聚糖的产生 [10-11]。研究表明:α-葡萄糖醛酸苷酶、阿拉伯糖苷酶和木聚糖酶的联合作,不仅加速木聚糖产生木寡糖的反应速度,而且使酶解产物中带有葡萄糖醛酸或阿拉伯糖侧枝的大片段得到有效水解,从而提高低聚木糖的产量和纯度 [12-14]。Fan Zhanmin等 [15]通过连接肽将木聚糖酶、阿拉伯糖苷酶以及木糖苷酶3 种基因进行共表达,结果表明该融合蛋白仍保留有原先各自酶的特性,且对于木聚糖的水解具有协同作用。因此,构建既产α-葡萄糖醛酸苷酶又产木聚糖酶活性的基因工程菌成为获得更高效降解秸秆木聚糖和价格低廉的生物催化剂的途径。
海栖热袍菌(Thermotoga maritima MSB8)生长在55~90 ℃的海底火山口附近 [16-17],是一种严格厌氧,杆状、无孢子的发酵型真细菌,该菌所产木聚糖酶B(XynB)和α-葡萄糖醛酸苷酶(AguA)的热稳定性好,在生物处理过程中具有减少污染危险、加快反应速度、提高酶作用底物溶解度和较高的抗化学变性等优点,可以弥补现有酶法水解木聚糖存在的底物作用浓度低、易污染带来的效率低和成本高的不足。利用基因重组技术将T. maritima的XynB和AguA基因置于不同表达盒下,构建双启动子共表达载体pET-20b-xynB-aguA和pET-28axynB-aguA,分别转化大肠杆菌Escherichia coli JM109(DE3)构建出既产α-葡萄糖醛酸苷酶又产木聚糖酶的基因工程菌E.coli JM109(DE3)/pET-20b-xynB-aguA和E. coli JM109(DE3)/pET-28a-xynB-aguA,并用诱导表达所获得木聚糖酶和葡萄糖醛酸苷酶的双酶混合物来水解桦木木聚糖及玉米芯,进一步检测还原糖释放量并通过TLC分析酶解产物中各组分的变化,比较分析单一木聚糖酶和双酶的水解效率,并对水解前后玉米芯进行扫描电镜分析。
1.1 菌株与质粒
质粒pET-28a购自美国Novagen公司,含有海栖热袍菌(Thermotoga maritima)木聚糖酶B(XynB)或葡萄糖醛酸苷酶(AguA)的质粒pHsh-aguA(构建方法见文献[13])、pET-20b-xynB (构建方法见文献[18])。大肠杆菌Escherichia coli JM109(DE3)与Escherichia coli TOP10(Promega)分别作为目的基因的表达宿主和克隆宿主。
1.2 试剂与仪器
限制性内切酶XhoⅠ、XbaⅠ、T4 DNA连接酶和Pyrobest DNA聚合酶 华美生物工程公司和宝生物工程公司;异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG) 美国Promega公司;QIAprep Spin Plasmid Miniprep Kit、QIAquick Gel Extraction Kit 美国Qiagen公司;低聚木糖标样95%纯度(木二糖) 山东龙力生物科技股份有限公司。
GF254硅胶板 山东江友硅胶开发有限公司;PCRMastercycler Personal PCR仪 德国Eppendorf公司;核酸凝胶电泳仪、蛋白电泳仪和凝胶成像仪 美国Bio-Rad公司;JY92-II超声波细胞破碎仪 上海新芝生物技术研究所。
1.3 培养基和培养条件
大肠杆菌培养在LB或TB培养基,转化用SOC培养基,转化子的选择用含有氨苄青霉素(100 μg/mL)或卡那霉素(30 μg/mL)的培养基。
1.4 方法
1.4.1 共表达质粒的构建
以质粒pHsh-aguA为模板,利用相应的上下游引物1和2(引物1:5′-AAAAGGCCTTGACCCCCTTG AATGTGGGGGGAAACA-3′内有StuⅠ酶切位点;引物2:5′-CGGCTCGAGCGGATATATATATCTTT CTTCCC-3′内有XhoⅠ酶切位点)聚合酶链式反应(polymerase chain reaction,PCR)扩增基因片段-Hshrbs-aguA-(Hsh启动子调控的AguA基因)。扩增条件为:95 ℃预变性5 min;94 ℃ 40 s、53 ℃ 40 s、72 ℃ 3 min,30个循环;72 ℃延伸10 min。取5 μL PCR产物用1%琼脂糖凝胶电泳检测,剩下产物割胶回收纯化。用限制性内切酶StuⅠ和XhoⅠ分别对纯化后PCR产物和pET-20b-xynB载体进行双酶切,胶回收pET-20b-xynB线性载体和目标基因,用T4 DNA 连接酶在16 ℃条件下连接载体和目标基因过夜。连接产物转化E. coli TOP10感受态细胞,涂布Amp抗性平板,通过对转化子酶切验证和测序,确认获得阳性质粒pET-20b-xynB-aguA。基因测序由生工生物工程(上海)股份有限公司完成,共表达质粒pET-20b-xynB-aguA构建方案见图1。

图1 共表达载体pET-20b-xynB aguA的构建
Fig.1 Construction of coexpression vector pET-20b-xynB-aguA
以质粒pET-20b-xynB-aguA为模板,利用上下游引物3、4(引物3:5′- TGCTCTAGAAATAATTTTGTTTAAC TTTAAGA-3′内有XbaⅠ酶切位点;引物4:5′-CGGCTC GAGCGGATATATATATCTTTCTTCCC-3′内有XhoⅠ酶切位点)PCR扩增片段-xynB-aguA-(分别由T 7和Hsh启动子调控的共表达基因XynB-AguA)。扩增条件为:95 ℃预变性5 min;94 ℃ 40 s、56℃ 40 s、72 ℃ 3 min,30 个循环;72 ℃延伸10 min。PCR产物验证正确后过柱纯化,限制性内切酶XbaⅠ和XhoⅠ分别对PCR产物和pET-28a载体双酶切。割胶回收、连接、转化及验证步骤同上,阳性质粒命名为pET-28a-xynB-aguA,重组质粒构建方案见图2。

图2 共表达载体pET-28a-xynB aguA的构建
Fig.2 Construction of coexpression vector pET-28a-xynB-aguA
1.4.2 目的基因的诱导表达
将质粒pET-28a-xynB-aguA和pET-20b-xynB-aguA分别转入E. coli JM109(DE3),分别挑取单菌落接入含有卡那霉素(kana 30 μg/mL)和氨苄青霉素钠(Amp 100 μg/mL)的4 mL LB液体培养基中,37 ℃、220 r/min振荡培养过夜;种子液转接至100 mL LB液体培养基(相应抗性)中,30 ℃、220 r/min振荡培养至OD 600 nm达0.6~0.8后加入IPTG至终浓度0.8 mmol/L,于42 ℃诱导8 h。取菌液1 mL 以5 000×g离心10 min离心收集菌体,400 μL 50 mmol/L 邻苯咪唑缓冲液 (pH 6.2)重悬,超声破碎,离心取上清( 即粗酶液)检测胞内木聚糖酶活性性和葡萄糖醛酸苷酶活性性。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)(浓缩胶5%,分离胶10%)检测XynB和AguA基因在原核表达载体中的表达情况。
1.4.3 重组菌E.coli JM109(DE3)/ pET-28a-xynB-aguA产酶
以诱导温度42 ℃、IPTG 终浓度0.8 mmol/L为初始诱导条件,根据重组菌在TB培养基中的生长曲线变化诱导时机,诱导8 h,检测胞内酶活性,SDS-PAGE验证。
1.4.4 酶活性测定
XynB和AguA酶活性检测方法分别参考文献[19-20]。1.4.5 酶解应用
1.4.5.1 桦木木聚糖的酶解
称取桦木木聚糖80 mg溶于pH 6.6 100 mmol/L的邻苯咪唑缓冲液中,总体系为2 mL。以单一XynB酶解体系为对照组,实验组加入诱导8 h的双酶液,然后在80 ℃条件下反应1、2、4、6、8 h后,5 000×g离心10 min得上清,用DNS法测还原糖,酶添加量则以等木聚糖酶活力单位(10 U/g底物)为标准计算得到,实验重复3 次。同时取4 μL上清用于薄层层析技术(thin-layer chromatography,TLC)分析,具体方法参考文献[12]。
1.4.5.2 玉米芯的降解
称取粉碎后过40 目筛的玉米芯粉末0.1 g溶于pH 6.6 100 mmol/L的邻苯咪唑缓冲液中,反应总体系为2 mL。加入诱导8 h条件下的双酶液,然后在80 ℃条件下反应12 h后取样用DNS法测还原糖,并将反应后玉米芯残渣过滤,烘干备用,实验重复3 次。将酶解反应前后的玉米芯进行电子扫描显微镜观察其微观结构变化,水解率按下式计算。

2.1 共表达质粒的构建
将T. maritima的XynB和AguA基因置于不同表达盒下共表达,使XynB和AguA基因分别带有独立的启动子、核糖体结合位点和转录终止子,其中XynB基因置于T 7启动子下,AguA基因则置于热启动子Hsh [21]下(图3),两个基因表达相对独立,避免多顺反子表达系统存在的多基因表达不平衡性 [22],以达到调控XynB和AguA的表达比例。

图3 共表达质粒的构建
Fig.3 Construction of coexpression plasmids
以质粒pHsh-aguA为模板,利用PCR扩增获得基因片段Hsh-aguA,大小约为2 000 bp(图4a泳道2),纯化后的PCR产物与pET-20b-xynB连接,经StuⅠ和XhoⅠ双酶切得到大小近2 000 bp和4 700 bp的片段(图4b泳道2),分别为PCR片段和载体片段。测序结果证实质粒pET-20b-xynB-aguA构建成功。
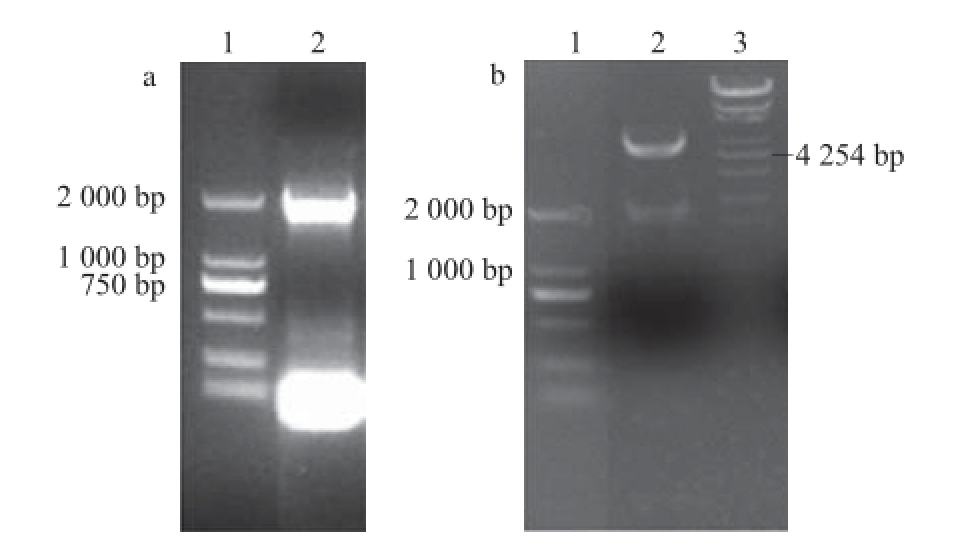
图4 重组质粒pET-20b-xynB-aguA的构建
Fig.4 Construction of expression vector pET-20b-xynB-aguA
a. 泳道1:DL2000核酸分子质量;泳道2:AguA的PCR片段;b. 泳道1:DL2000核酸分子质量;泳道2:pET-20b-xynB-aguA的双酶切/StuI和XhoI;泳道3:λ-EcoT14 I digest 核酸分子质量。
以pET-20b-xynB-aguA的DNA为模板,利用PCR扩增获得基因片段-xynB-aguA,大小约为3 000 bp(图5泳道2),纯化后的PCR产物与载体pET-28a连接,经XbaⅠ单酶切后得到约8 000 bp大小的片段(图5泳道4),比XbaⅠ单酶切后的pET-28a载体片段(图5泳道3)大3 000 bp左右,即目的基因片段大小。测序结果证实质粒pET-28a-xynB-aguA构建成功。
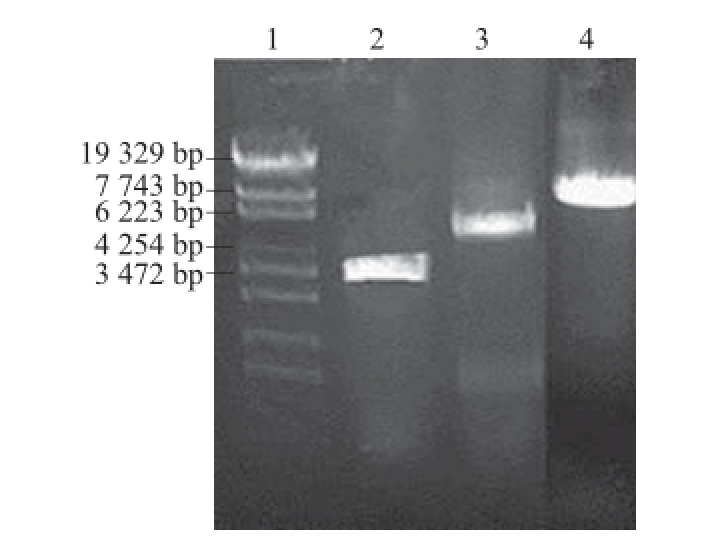
图5 DNA琼脂糖凝胶电泳图
Fig. 5 Agarose gel electrophoresis of DNA
泳道1. λ-EcoT14 I digest 核酸分子质量;泳道2. PCR片段;泳道3. pET-28a载体单酶切/XbaⅠ;泳道4. 重组质粒pET-28a-xynB-aguA单酶切/XbaⅠ。
2.2 XynB和AguA的共表达
为了评估XynB和AguA基因在两个不同载体pET-28a和pET-20b中的共表达效果,将构建成功的共表达质粒pET-28a-xynB-aguA和pET-20b-xynB-aguA转化大肠杆菌E. coli JM109(DE3)进行诱导表达,分析检测重组菌E. coli JM109(DE3)/pET-28a-xynB-aguA和E. coli JM109(DE3)/pET-20b-xynB-aguA在不同培养时间的生长和双酶产量(图6)。结果正如图6A所示,E.coli JM109(DE3)/pET-28a-xynB-aguA和E. coli JM109(DE3)/ pET-20b-xynB-aguA生长趋势一致,3 h之前菌体处于生长延滞期,3~4 h处于对数生长期,此时加入IPTG进行诱导,当诱导至6~12 h时菌体生长处于平缓期,且由图可见E. coli JM109(DE3)/pET-28a-xynB-aguA的菌体生长和最高OD 600 nm值(3.6),明显高于E. coli JM109(DE3)/pET-20b-xynB-aguA最高OD 600 nm值(2.5);进一步检测XynB和AguA的产量发现,重组菌E. coli JM109(DE3)/pET-28a-xynB-aguA更具优势,其结果见图6B,重组菌E. coli JM109(DE3)/pET-28a-xynB-aguA和E. coli JM109(DE3)/pET-20b-xynB-aguA中XynB和AguA随着诱导时间的增加而增加,诱导培养8 h后双酶产量达到最高,分别为7.6 U/mL(XynB)、0.5 U/mL(AguA)以及1.7 U/mL(XynB)、0.06 U/mL(AguA),XynB和AguA基因在载体pET-28a比在pET-20b中表达的产酶水平分别提高3.5 倍和7.3 倍;这可能与pET-28载体存在一个额外表达阻遏蛋白lacI基因有关,相反,pET-20b载体不含有阻遏蛋白lacI基因,这样当外源基因高效表达时宿主本身表达的阻遏蛋白量远远不足于控制启动子的转录翻译而同时又无额外阻遏蛋白的补充,继而产生外源蛋白的渗漏表达造成对菌体生长的抑制而影响重组菌的产酶水平,这也被图6A重组菌的生长曲线结果所印证。取等体积粗酶液进行SDS-PAGE(12%分离胶),并以空载pET-20b为对照,考马斯亮蓝染色的结果见图6C,XynB(43 kD)和AguA(72 kD)基因在载体pET-28a中的表达量(图6C:泳道6、7、8)明显高于其在pET-20b中的表达量(图6C:泳道3、4、5),与图6B的产酶水平结果一致。
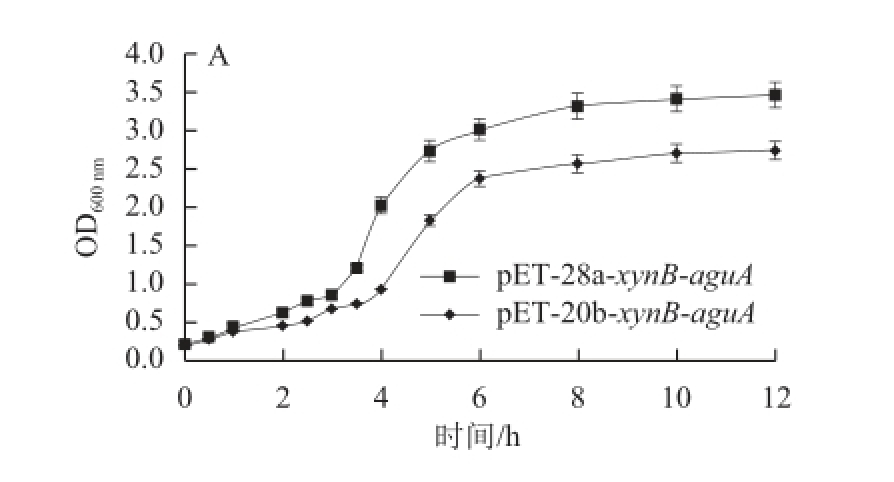
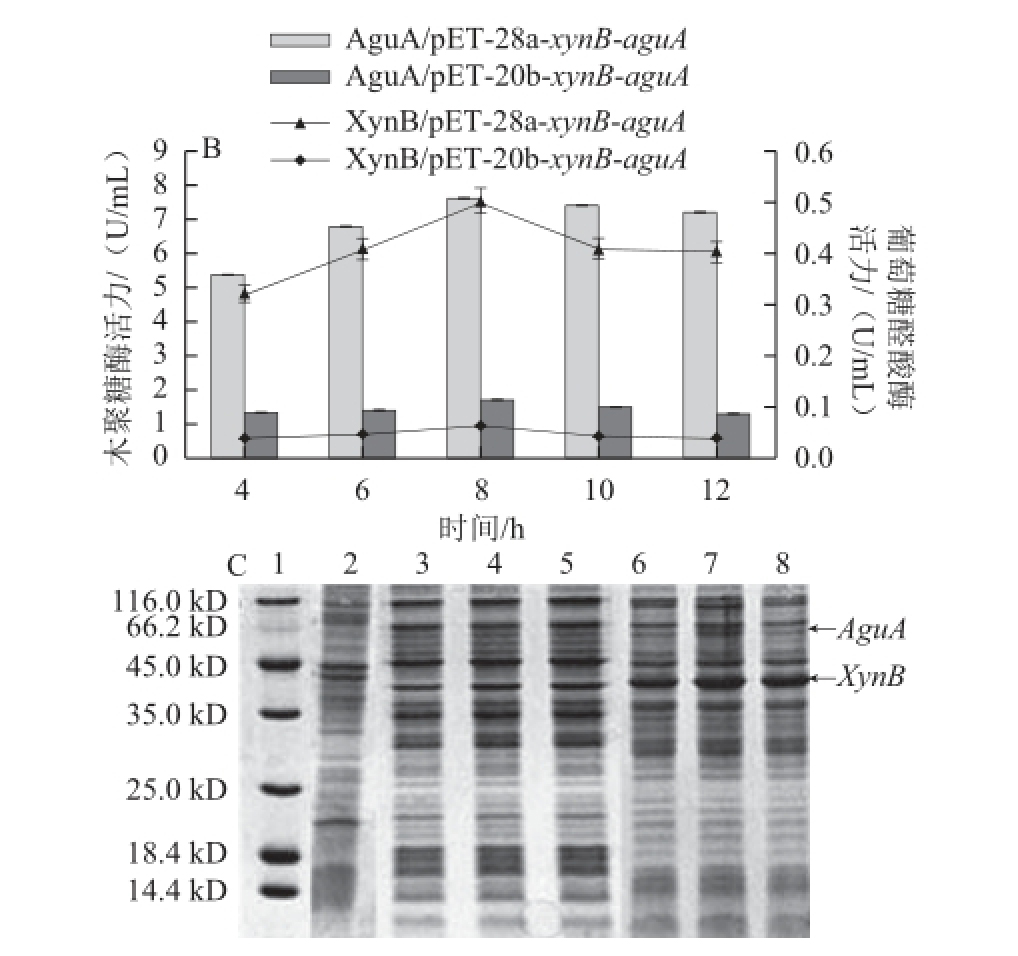
图6 两种重组菌中XynB和AguA的表达
Fig.6 Expression levels of XynB and AguA in two recombinant E. coli strains
A. 两种重组菌的生长曲线;B. 两种重组菌分别诱导4、6、8、10、12 h时双酶酶活性;C. 两种重组菌诱导不同时间时双酶表达SDS-PAGE图谱。1. 中分子质量蛋白Marker;2. E.coli JM109(DE3)/ pET-20b粗酶液; 3~5. E. coli JM109(DE3)/ pET-20b-xynB-aguA分别诱导 6、8、10 h的粗酶液;6~8. E. coli JM109(DE3)/pET-28a-xynB-aguA分别诱导6、8、10 h的粗酶液。
有研究表明TB培养基更有利于重组菌目的蛋白的表达 [23],本实验将重组菌E. coli JM109(DE3)/ pET-28a-xynB-aguA置于TB培养基中培养,观察其生长状况,结果见图7。可以看出,OD 600 nm在0.5~2.0、2.0~3.5和3.5~5.0时分别为菌体生长的延滞期、对数期和中后期,菌体生长至6 h时OD 600 nm可达4.5。
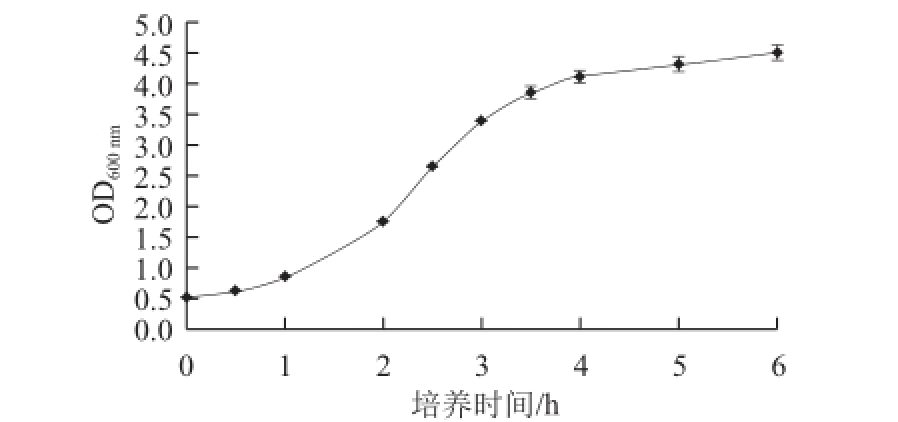
图7 重组菌在TB培养基中生长曲线
Fig.7 Growth curves of recombinant E. coli in TB medium
重组菌E. coli JM109(DE3)/pET-28a-xynB-aguA在不同时机即OD 600 nm为分别1.0、2.0和3.5时加入IPTG诱导8 h后,测得在对数期诱导产酶量最高,其中XynB为10.27 U/mL,AguA为1.5 U/mL(表1),表明诱导时机对基因表达效果影响很大 [24],加入过早或过迟,双酶的表达水平都不够理想。延滞期菌体生长密度低,因IPTG有一定毒性,过早加入诱导剂会抑制菌体生长,而菌体生长中后期时,大多菌体已趋于成熟,生长活力较低,且培养过程中积累了一定的代谢副产物不利于外源蛋白的合成。收集菌体并破细胞,离心得上清取等体积进行SDS-PAGE分析,考马斯亮蓝染色表明,在菌体生长的对数期时添加诱导剂所产生的XynB和AguA条带最粗(图8,泳道3),这与其产酶水平的分析结果(表1)一致。
表1 重组菌E. coli JM109(DE3)/ pET-28a-xynB-aguA不同诱导时机产酶量(酶活性)
Table 1 Expression levels of recombinantE. coli JM109 (DE3)/ pET-28a-xynB-aguA with different induction time points

诱导时机(OD 600 nm) XynB酶活力/(U/mL)AguA酶活力/(U/mL)1.04.190.54 2.010.271.55 3.51.300.16

图8 不同诱导时机XynB和AguA的表达
Fig.8 Expression levels of XynB and AguA with different induction time points
1. 中分子质量蛋白Marker;2~4. E. coli JM109(DE3)/ pET-28a-xynB-aguA分别在延滞期、对数期以及中后期诱导时粗酶液。
后续研究将进一步提高重组菌E. coli JM109(DE3)/ pET-28a-xynB-aguA的产酶水平,优化XynB和AguA活力比例使其达到最佳酶解效率。
2.3 桦木木聚糖的酶解
桦木木聚糖是典型的4-O-甲基葡萄糖醛酸木聚糖,为了评估木聚糖酶和葡萄糖醛酸苷酶共同降解纯化木聚糖的效果,本实验选择桦木木聚糖为底物,以4 g/100 mL的底物,加入重组菌E. coli JM109(DE3)/pET-28axynB-aguA所产的双酶液(其中XynB为10 U/g和AguA为1 U/g),在80 ℃条件下水解不同时间,以单一木聚糖酶(重组菌E. coli JM109(DE3)/pET-20b-xynB所产的XynB,10 U/g)水解为对照,通过DNS测定还原糖释放量以及TLC分析酶解产物组分(图9),比较双酶与单酶水解木聚糖底物的效率。
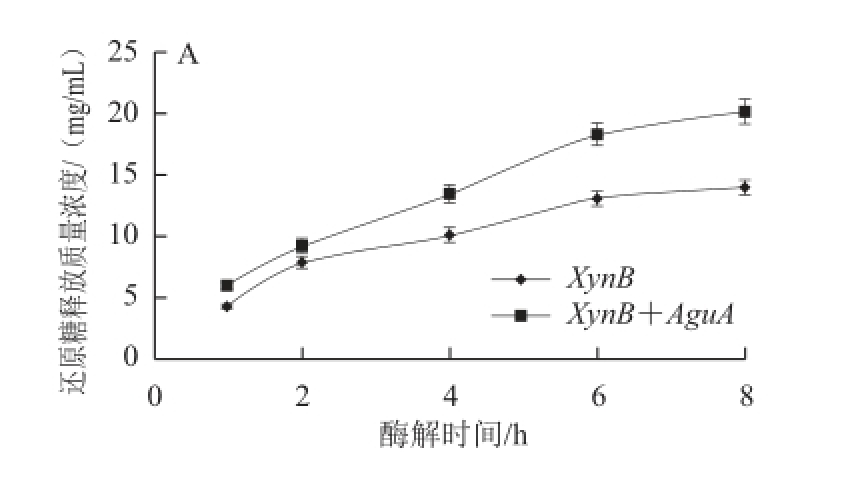

图9 单一木聚糖酶和双酶对桦木木聚糖水解的还原糖释放量(A)和TLC图谱(BB)
Fig.9 Sugar release (A) and TLC spectrum(B) on single and dual enzymatic hydrolysis of birch xylan
1.木二糖;2、11.木糖;3~6.单一木聚糖酶水解桦木木聚糖 1、2、4、8 h的酶解液;7~10.双功能酶水解桦木木聚糖1、2、4、8 h的酶解液。
由图9A可知,双酶与单一木聚糖酶水解释放还原糖量均随着酶解时间的延长而增加,且双酶水解时,还原糖释放变化率较单酶快,随着时间的延长,还原糖释放质量浓度持续增加,水解8 h后还原糖释放质量浓度达到20 mg/mL,高于单酶水解还原糖释放质量浓度的14 mg/mL,表明双酶具有更高的水解效率。由图9B可知,当水解1 h时,双酶水解产物中木二糖及以上聚合度寡糖完全降解(图9B中泳道7),而单酶水解产物中直至8 h仍有更高聚合度木寡糖残留(图9B中泳道6),这表明双酶具有更高的催化效率,其含有的葡萄糖醛酸苷酶比例足以保证桦木木聚糖的彻底降解;同时,与单酶水解产物相比,双酶水解液中木二糖含量和和纯度更高(图9B中泳道7~10,产物主要为木二糖),这些结果表明,木聚糖酶和葡萄糖醛酸苷酶间存在着协同水解作用,当葡萄糖醛酸苷酶水解去除掉葡萄糖醛酸侧枝后减少了木聚糖酶作用底物的空间位阻,而提高水解木聚糖底物的效率。与Sunna等 [10]的研究结果一致。且已有研究表明,低聚木糖,尤其是木二糖对于双歧杆菌增殖具有促进作用 [25-26],被称为“超强双歧因子”,它可以抑制肠道内腐败菌的生长,改善肠道微生态环境,有调节机体生理功能,增强人体免疫力,预防疾病发生的效果 [27]。本实验双酶制得的低聚木糖不仅木二糖含量更高且纯度更好,具有潜在的应用前景。
2.4 玉米芯的降解
玉米芯是重要的农业废弃物,广泛用于饲料加工业 [28-29],为提高其可消化率,本实验选择玉米芯为底物,尝试木聚糖酶和葡萄糖醛酸苷酶共同降解玉米芯的效果,并用DNS法测定还原糖释放率,结果显示玉米芯经双酶液水解后水解率可达到24%。用扫描电镜观察玉米芯酶处理前后表面形态的变化的结果见图10。从300 倍电镜扫描(图10A、10C)可以看出,未处理玉米芯表面结构致密,呈现有序、有规律的排列,纤维表面比较完整,无损伤,存在着细小的褶皱硅质;酶处理后的玉米芯表面出现许多致密的孔洞,且表面“沟壑状”结构清晰可见。从1 000 倍电镜扫描(图10B、10D)可以看出,未处理玉米芯表面被许多被突起、硅细胞、栓细胞所覆盖,整体排列紧密;而酶处理后玉米芯表面明显有破洞,表明其半纤维结构被酶水解破坏,且酶法处理比Kahar等 [30]报道的硫酸处理法更温和且环保,因此表明该双酶液降解效果显著。玉米芯含粗蛋白、粗脂肪、粗纤维,还含有丰富的矿物质、维生素和微量元素 [31],不仅可作为制取益生因子低聚木糖的理想来源,还可以将玉米芯粉经过酶预处理后促进有效物质的释放,以及降低饲料用粮中的非淀粉多糖,促进营养物质的吸收利用,增强牲畜适口性,因此具有一定的工业应用价值。
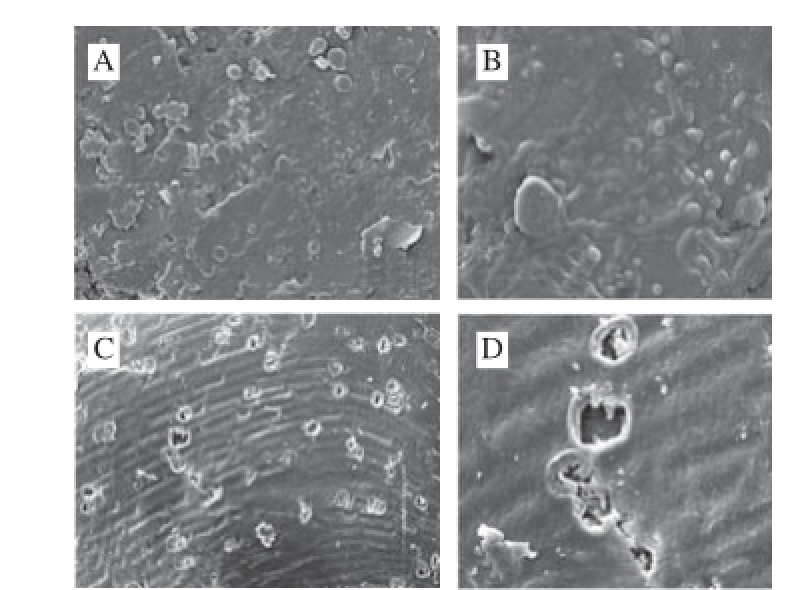
图10 玉米芯酶解前后电子显微镜图
Fig.10 Electron microscope pictures of corncob before and after enzymatic hydrolysis
A、B分别为×300和×1 000酶解前玉米芯;C、D分别为×300和×1 000双酶酶解后玉米芯。
海栖热袍菌是极耐热性酶的重要来源,但该菌生长条件要求苛刻,细胞密度较低,不适合工业化生产。因此,构建合适的极端菌的外源基因表达系统来高效表达耐热耐碱酶蛋白,一直是人们研究的热点,且分别生产多个木聚糖降解酶既耗费时间又浪费资金。本研究选用大肠杆菌Escherichia coli JM109(DE3)为表达宿主,采用基因工程技术构建共表达载体pET-20b-xynB-aguA和pET-28a-xynB-aguA在大肠杆菌中同时生产XynB和AguA从而获得双酶混合物,结果表明重组菌E.coli JM109(DE3)/pET-28a-xynB-aguA在LB培养基中诱导培养8 h,XynB和AguA的产量分别达到7.6 U/mL和0.5 U/mL,比重组菌E. coli JM109(DE3)/pET-20b-xynB-aguA产酶提高近一倍,进一步在TB培养基中培养,XynB可达到10.27 U/mL,AguA为1.5 U/mL;在低聚木糖的制备中,双酶在相同的条件下相比单酶能够彻底快速地水解桦木木聚糖产生木寡糖,酶解产物中木二糖含量及纯度更高,且对农副产品玉米芯具有良好的降解效果。有报道 [32]表明,动物食用含低聚木糖的饲料后,能提高动物对营养物质的吸收,增强免疫力。为能够将该嗜热木聚糖酶系应用于食品酿造或其他加工行业,还需进行进一步的探索,如选择食品安全级的表达宿主:枯草芽孢杆菌、酿酒酵母等。
参考文献:
[1] 李相安. 玉米芯特殊用途的介绍[J]. 淀粉与淀粉糖, 1995, 32(3): 17.
[2] CHAPLA D, PANDIT P, SHAH A. Production of xylooligosaccharides from corncob xylan by fungal xylanase and their utilization by probiotics[J]. Bioresource Technology, 2012, 115: 215-221.
[3] APINAR O, ERDOGAN K, BOSTANCI S. Enzymatic production of xylooligosaccharide from selected agricultural wastes[J]. Food and Bioproducts Processing, 2009, 87(2): 145-151.
[4] SAMANTA A K, SENANI S, KOLTE A P, et al. Production and in vitro evaluation of xylooligosaccharides generated from corn cobs[J]. Food and Bioproducts Processing, 2012, 90(3): 466-474.
[5] 王海, 李里特, 石波. 用玉米芯酶法制备低聚木糖[J]. 食品科学, 2002, 23(5): 81-83.
[6] 张帆, 李敏康, 宋宏新. 两种酶法制备麦麸低聚木糖的比较[J]. 陕西科技大学学报, 2013, 31(4) : 106-109.
[7] TUNCER M, BALL A S. Co-operative actions and degradation analysis of purifi ed xylan-degrading enzymes from Thermomonospora fusca BD25 on oat-spelt xylan[J]. Journal of Applied Microbiology, 2003, 94(6): 1030-1035.
[8] BULOW L. Characterization of an artificial bifunctional enzyme, β-galactosidase/galactokinase, prepared by gene fusion[J]. Europe Journal of Biochemistry, 1987, 163(3): 443-448.
[9] BIAN J, PENG F, PENG X, et al. Structural features and antioxidant activity of xylooligosaccharides enzymatically produced from sugarcane bagasse[J]. Bioresource Technology, 2013, 127: 236-241.
[10] SUNNA A, AUTRANIKIAN G. Xylanolytic enzymes from fungi and bacteria[J]. Critical Reviews in Biotechology, 1997, 17(1): 39-67.
[11] 薛业敏, 毛忠贵. α-葡萄糖醛酸酶的研究进展[J]. 林产化学与工业, 2002, 22(4): 75-79.
[12] 薛业敏, 于瑾瑾, 戴军, 等. 极耐热性阿拉伯糖苷酶在木糖制备中的应用[J]. 食品与发酵工业, 2007, 33(9): 14-19.
[13] XUE Yemin, YU Jinjin, SONG Xiangfei, et al. Over-expression of xylanolytic α-glucuronidase from Thermotoga maritima in the pHsh system of Escherichia coli for the production of xylobiose from xylan[J]. African Journal of Biotechnology, 2008, 7(14): 2454-2461.
[14] 薛业敏, 毛忠贵, 邵蔚蓝. 极端嗜热菌海栖热袍菌α-葡萄糖醛酸酶的高效表达和重组酶的纯化[J]. 生物工程学报, 2004, 20(4): 555-560.
[15] FAN Zhanmin, WAGSCHAL K, CHEN Wei, et al. Multimeric hemicellulases facilitate biomass conversion[J]. Applied Environment Microbionology, 2009, 75(6): 1754-1757.
[16] JIANG Z Q, DENG W, ZHU Y P, et al. The recombinant xylanase B of Thermotoga maritima is highly xylan specific and produces exclusively xylobiose from xylans, a unique character for industrial applications[J]. Journal of Molecular Catalysis B: Enzymatic, 2004, 27(4): 207-213.
[17] WU Huawei, PEI Jianjun, WU Guogan, et al. Overexpression of GH10 endoxylanase XynB from Thermotoga maritima in Escherichia coli by a novel vector with potential for industrial application[J]. Enzyme and Microbial Technology, 2008, 42(3): 230-234.
[18] 薛业敏, 毛忠贵, 邵蔚蓝. 极端耐热木聚糖酶基因在大肠杆菌中的高效表达[J]. 食品与发酵工业, 2003, 29(11): 20-25.
[19] LEVER M. A new reaction for colorimetric determination of carbohydrates[J]. Analytical Biochemistry, 1972, 47(1): 273-279.
[20] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning: a laboratory manual[M]. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989.
[21] LE Yilin, PENG Jingjing, WU Huawei, et al. An approach to the production of soluble protein from a fungal gene encoding an aggregation-prone xylanase in Escherichia coli[J]. PLoS One, 2011, 6(4): 1-8.
[22] 何彰华, 王洋, 赵珺, 等. 一种多基因串联共表达载体的构建[J]. 中国生物工程杂志, 2011, 31(1): 40-45.
[23] 谢琦, 林军, 白玲, 等. 乳糖诱导重组多价人精子表位肽在大肠杆菌中的表达[J]. 生物技术通报, 2011(7): 172-175.
[24] 陈卫, 葛佳佳, 张灏, 等. 半乳糖苷酶基因在大肠杆菌中过量表达及IPTG 诱导条件[J]. 无锡轻工大学学报, 2002, 21(5): 492-495.
[25] SUNG B H, LEE C H, YU B J, et al. Development of a biofilm production-deficient Escherichia coli strain as a host for biotechnological applications[J]. Applied and Environmental Microbiology, 2006, 72(5): 3336-3342.
[26] CHEN C, CHEN J L, LIN T Y. Purifi cation and characterization of a xylanase from Trichoderma longibrachiatum for xylooligosaccharide production[J]. Enzyme and Microbial Technology, 1997, 21(2): 91-96.
[27] 杨瑞金, 许时婴, 王璋. 低聚木糖的功能性质与酶法生产[J]. 中国食品添加剂, 2000(2): 89-93.
[28] 纤儿. 玉米芯酶解饲料[J]. 农产品加工, 2006(8): 34.
[29] 周到. 农家废弃物可作饲料[J]. 科技园地, 2004(6): 32.
[30] KAHAR P, TAKU K, TANAKA S. Enzymatic digestion of corncobs pretreated with low strength of sulfuric acid for bioethanol production[J]. Journal of Bioscience and Bioengineering, 2010, 110(4): 453-458.
[31] 刘东波, 陈珊, 史晓昆, 等. 利用混合微生物酶制剂提高玉米芯饲用价值的研究[J]. 东北师范大学学报: 自然科学版, 2003, 35(2): 65-68.
[32] 张洪宾, 丁长河, 周迎春, 等. 低聚木糖生产现状及其应用[J]. 粮食与油脂, 2012(11): 46-48.
Coexpression and Application of Thermostable Xylanase and Glucuronidase
SHEN Yihong
1, XUE Yemin
1,*, HOU Jingjing
1, XU Jiaxing
2, LI Xiangqian
3
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. Jiangsu Key Laboratory for Biomass-based Energy and Enzyme Technology, Huaiyin Normal University, Huaian 223000, China; 3. Jiangsu Provincial Engineering Laboratory for Biomass Conversion and Process Integration, Huaiyin Institute of Technology, Huaian 223003, China)
Abstract:Objective: To improve the productivity and reduce production costs of xylanase (XynB) and α-glucuronidase (AguA) from Thermotoga maritima MSB8. Methods: Gene recombination technology was used to clone the XynB and AguA genes into different BioBrick base vectors, thus constructing pET-20b-xynB-aguA and pET-28a-xynB-aguA. These plasmids were then transformed into Escherichia coli JM109 (DE3), respectively, to induce the coexpression of the two enzymes for hydrolysis of birch xylan and corncob. Results: After 8 hours of induction, the recombinant E. coli JM109 (DE3)/pET-28a-xynB-aguA produced XynB and AguA with the yields reaching 7.6 and 0.5 U/mL in LB medium, respectively, which were higher than those of E. coli JM109 (DE3)/pET-20b-xynB-aguA. In TB medium, XynB activity reached 10.27 U/mL and AguA activity reached 1.5 U/mL. At 80 ℃, combination of both enzymes degraded birch xylan more thoroughly than single xylanase, resulting in a higher content and purity of xylobiose in hydrolyzate. The amount of reducing sugar released and electron microscopy observation revealed good degradation of corncob. Conclusions: Cloning and co-expression of XynB and AguA from T. maritima are practicable and the recombinmant XynB and AguA have potential applications in biotransformation, food industry, feed production and other areas.
Key words:xylanase; glucuronidase; coexpression; hydrolysis
中图分类号:Q814.9
文献标志码:A
文章编号:1002-6630(2015)01-0146-07
doi:10.7506/spkx1002-6630-201501028
收稿日期:2014-01-14
基金项目:江苏省生物质能与酶技术重点实验室开放课题(JSBEET1301);
江苏省生物质转化与过程集成工程实验室开放课题(JPELBCPL2012002)
作者简介:沈艺红(1989—),女,硕士,研究方向为营养与食品功能因子。E-mail:shenyihong1989@foxmail.com
*通信作者:薛业敏(1963—),女,教授,博士,研究方向为分子生物学与可再生资源。E-mail:xueyemin@njnu.edu.cn