图1 热处理对GABA转化效率的影响
Fig.1 Effect of heat treatment on the productivity of GABA
陈 琳,张 充,吕凤霞,别小妹,赵海珍,陆兆新 *
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:研究重组谷氨酸脱羧酶大肠杆菌合成γ-氨基丁酸(γ-aminobutyric acid,GABA)的适宜条件。检测温度、pH值、表面活性剂、金属离子、底物与菌体质量比以及反应体系体积对GABA转化效率的影响。结果表明:最优转化条件为:转化体系5 mL、底物L-谷氨酸钠浓度0.1 mol/L、重组大肠杆菌细胞6.4 mg(干质量)、Triton-100体积分数0.06%、Ca 2+浓度0.6 mmol/L,转化温度45 ℃、反应体系pH 4.5。在该体系下反应7 h,GABA合成量达到26.1 g/L,GABA转化效率在1 h时达到最高,为13.8 g/(g•h),较优化前提高1.5 倍。
关键词:γ-氨基丁酸;谷氨酸脱羧酶;转化条件;优化
γ-氨基丁酸(γ-aminobutyric acid,GABA)是哺乳动物中枢神经系统一种主要的抑制性神经递质。GABA具有许多重要的生理功能,如降血压 [1]、预防癫痫 [2]、抗抑郁 [3]、抗疲劳 [4]、控制哮喘 [5]和促进激素分泌等。由于GABA具有诸多重要的生理功能,已经发展成为一种新型的功能性因子,正逐渐被广泛应用于食品保健、医药、化工及饲料 [6]等领域。目前,国内外都在积极研发富含GABA的食品,己成功研发的有茶饮料、米胚芽、功能性饮料、乳制品和大豆发酵制品 [7-9]。
微生物法制备GABA的优点很多,如安全性较高、反应条件温和、生产成本较低以及较好的商业化开发应用前景等,因此,近年来微生物法制备GABA受到国内外学者广泛的关注,其中大肠杆菌、红曲霉、酿酒酵母、乳酸菌等GABA生产菌种研究较为深入。已有很多研究证明乳酸菌具有合成GABA的能力 [10-13],乳酸菌作为一种有保健作用的益生菌,用其合成GABA越来越受到人们的青睐,目前用乳酸菌合成 GABA的研究主要集中在菌株的筛选、传统诱变方法以及发酵条件优化上,但是,由于乳酸菌具有发酵周期较长以及培养条件较难控制等缺点,在生产强度上处于劣势,而借助基因工程手段构建高拷贝重组质粒,导入宿主菌,可以使谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)表达量提高,获得高GAD活性的基因工程菌,从而缩短生产周期,提高生产强度。
GABA对紫外、可见光及电化学都不灵敏,直接检测GABA很困难。目前报道的有纸层析法 [14]、薄层扫描法 [15]、氨基酸分析仪法 [16]、毛细管电泳法 [17]、高效液相色谱 [18]及气相色谱-质谱法 [19]等,其中高效液相色谱法可定量检测GABA,相较氨基酸分析仪法成本低、分离时间短,是一种较为常用的方法。
谷氨酸脱羧酶基因gadB来源于菌株Streptococcus thermophilus Y2,将其与E. coli表达载体pET-23a连接构建重组表达载体,转入E. coli,获得gadB基因工程菌E. coli BL21(DE3)-[pET-23a-gadB] [20]。利用该基因工程菌催化L-谷氨酸钠生成GABA,通过研究温度、pH值、表面活性剂、金属离子、底物与菌体质量比以及反应体系体积对GABA转化效率的影响,确定该菌株转化合成GABA的最佳转化条件,通过在此最佳转化条件下合成GABA,以期提高GABA转化效率,达到全细胞转化法高效制备GABA的目的。
1.1 菌种、培养基与试剂
Escherichia coli BL21(DE3)-[pET-23a-gadB]由南京农业大学酶工程研究室保藏。
种子培养基和发酵培养基(LB培养基):胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g,加水溶解后,加去离子水定容到1 000 mL。使用时向其中添加经过滤除菌的氨苄青霉素,抗生素终质量浓度为100 μg/mL。
GABA(纯度≥99%)、丹磺酰氯 美国Sigma公司;曲拉通X-100 广东光华科技股份有限公司;四氢呋喃(色谱纯)、丙酮 上海凌峰化学试剂有限公司;冰乙酸(色谱纯) 天津市科密欧化学试剂有限公司;甲醇(色谱纯) 国药集团化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
HYG-A全温摇瓶柜 太仓实验设备厂;AY120电子精密天平 日本Shimadzu公司;隔水式电热恒温培养箱上海跃进医疗器械厂;手提式蒸汽压力灭菌器 上海医用核子仪器厂;5804R高速冷冻离心机 德国Eppendorf基因公司;SW-CJ-IBU超净工作台 苏净集团安泰公司;Agilent 1100 series高效液相色谱系统 美国安捷伦公司。
1.3 方法
1.3.1 重组大肠杆菌细胞的制备
1.3.1.1 培养条件
转接甘油冻存菌E. coli BL21(DE3)-[pET-23a-gadB]于LB液体培养基中,37 ℃、180 r/min振荡培养12~14 h至对数期备用,将种子液按3%的接种量接入300 mL的新鲜液体LB培养基中,37℃、180 r/min振荡培养至OD 600 nm= 0.6~0.8,加入诱导剂异丙基硫代半乳糖苷至其终质量浓度为0.1 μg/mL,16 ℃、180 r/min诱导16 h以上。
1.3.1.2 菌悬液的制备
将发酵液在4 ℃于8 000×g离心10 min,弃上清液,得到菌体沉淀。用9 g/L的生理盐水重悬菌体2 次,按照10 倍浓缩发酵液的比例加入已灭菌的生理盐水,反复吹打制得菌悬液,加入甘油置于-20 ℃冰箱中保存。
1.3.2 重组大肠杆菌细胞合成GABA转化条件优化
分别对转化温度、转化pH值、表面活性剂处理、金属离子处理、底物与菌体质量比、反应体系体积进行单因素优化试验,然后在最优条件下测定转化时间对GABA转化效率的影响。
以26.55 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以3 mL菌液为酶源,乙酸-乙酸钠缓冲液调pH值为4.5作为标准反应体系,于37 ℃、180 r/min的恒温摇床反应1 h,取上清液冻存待测。
1.3.3 GABA含量的测定
1.3.3.1 色谱条件 [21-25]
GABA的高效液相色谱检测条件:Agilent HC-C 18柱(4.6 mm×250 mm,0.5 μm);进样量:20 μL;柱温:35 ℃;紫外检测波长:254 nm;流速:0.6 mL/min;检测时间:45 min;流动相:A相为甲醇,B相为四氢呋喃-甲醇-0.05 mol/L乙酸钠(pH 6.2,体积比5∶75∶420)。
1.3.3.2 样品处理及衍生化
取冰箱中保存的待测样品20 μL,用0.1 mol/L(pH 9.8)的碳酸氢钠缓冲液稀释10 倍,然后加入0.2 mL等量的(4 g/L)丹磺酰氯(1-二甲氨基-萘-5-磺酰氯,DNS-Cl)丙酮溶液,置于37 ℃条件下避光衍生化反应1 h,DNS-Cl能与氨基酸的一级胺、二级胺、巯基、咪唑基和酚羟基缩合,生成DNS-GABA衍生物,衍生结束后过0.22 μm滤膜待测。
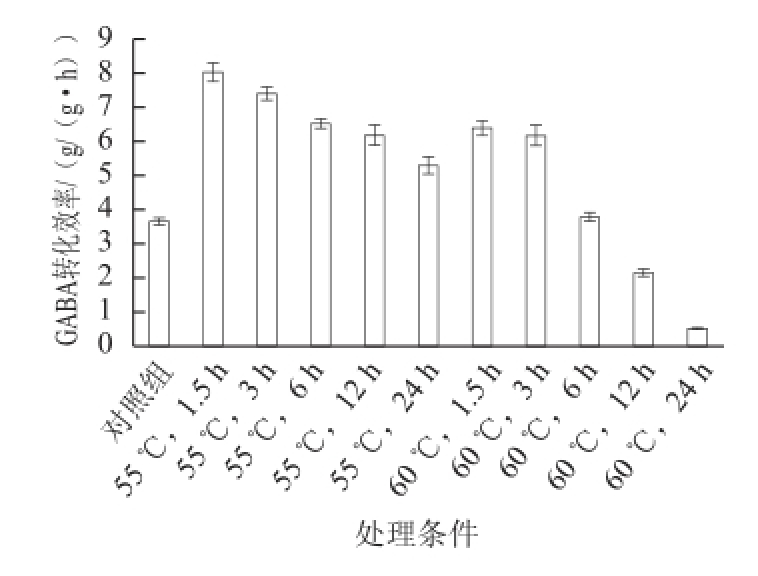
2.1 最适预处理温度与时间
在转化之前,把菌体在55、60 ℃分别处理1.5、3、6、12、24 h,并设置未加热处理对照组。在29.55 mL反应体系中,以26.55 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以3 mL菌液为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在37 ℃条件下反应2 h,测定在不同温度与不同时间热处理条件下GABA转化效率。如图1所示,菌体经过热处理后,GABA转化效率明显提高,其中效果最好为55 ℃处理1.5 h,GABA转化效率由3.6 g/(g•h)提高到8.0 g/(g•h),提高了1.2 倍。55 ℃处理1.5~24 h时GABA转化效率均高于对照组,说明热处理对GABA转化效率的提高具有促进作用,原因可能是热处理使得菌体细胞结构更加疏松,有利于与底物充分进行反应,使得GABA转化效率提高。以55、60 ℃条件对菌体进行热处理,GABA转化效率均随处理时间的增加而降低,这是由于热处理时间的增加会导致工程菌中GAD酶活性的下降,从而降低GABA转化效率。

图1 热处理对GABA转化效率的影响
Fig.1 Effect of heat treatment on the productivity of GABA
2.2 最适转化温度

图2 转化温度对GABA转化效率的影响
Fig.2 Effect of temperature on the productivity of GABA
实验选取28~55 ℃进行研究,在29.55 mL反应体系中,以26.55 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以3 mL菌液为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在不同温度下反应1 h,测定在不同温度下GABA转化效率。如图2所示,GABA转化效率随着转化温度的升高而升高,在45 ℃达到最高,GABA转化效率为6.1 g/(g•h),45 ℃以后GABA转化效率随着转化温度的升高而降低,可能是因为温度过高使得GAD酶活性下降,可见GAD催化合成GABA的最适转化温度为45 ℃。
2.3 最适转化pH值
研究认为GAD赋予微生物细胞对酸性环境的抵抗能力,微生物在缺氧、酸性等不利条件下,GAD催化酸性谷氨酸变成中性GABA,进而维持细胞处于pH值较稳定的环境中 [26]。实验选取pH 3.0~5.0进行研究,在29.55 mL反应体系中,以26.55 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以3 mL菌液为酶源,乙酸-乙酸钠缓冲液调节不同pH值,在37 ℃条件下反应1 h,测定在不同pH值条件下GABA转化效率。

图3 转化pH值对GABA转化效率的影响
Fig.3 Effect of pH on the productivity of GABA
如图3所示,GABA转化效率随着pH值的增加呈现先增加后减小的趋势,pH值为4.5时GABA转化效率达到最大,为6.25 g/(g•h),可见pH 4.5时GAD酶活性最高,与已报道的微生物来源的GAD反应最适pH 3.8~5.0之间 [27]基本一致。pH值在3.0、3.5时,GABA转化效率很小,可能是pH值过低抑制了GAD酶活性及细胞的通透性,继而影响GABA的转化效率。
2.4 不同表面活性剂对GABA转化效率的影响
表面活性剂可以增加细胞的通透性,同时表面活性剂也可能是酶的促进剂或抑制剂。实验选取了表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、吐温-80和Triton-100进行处理。

图4 不同表面活性剂对GABA转化效率的影响
Fig.4 Effect of surfactants on the productivity of GABA
在29.55 mL反应体系中,以26.55 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以3 mL菌液为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在37 ℃条件下反应30 min,测定在不同表面活性剂处理下GABA转化效率。如图4所示,吐温-80对 GABA的合成具有抑制作用,SDS严重抑制了GABA的合成。Triton-100对GABA的合成具有促进作用,因此选取Triton-100作为GABA合成促进因子,并对其添加量进行优化。
测定添加不同Triton-100添加量处理下GABA转化效率,如图5所示,在Triton-100体积分数小于0.02%时,GABA转化效率随着Triton-100添加量的增加而升高,在Triton-100体积分数大于0.02%时GABA转化效率增加较为缓慢并趋于稳定,在Triton-100体积分数为0.06%时,GABA转化效率达到最高,为12.6 g/(g•h),提高了1.3 倍,效果显著,因此Triton-100添加的最适体积分数为0.06%。
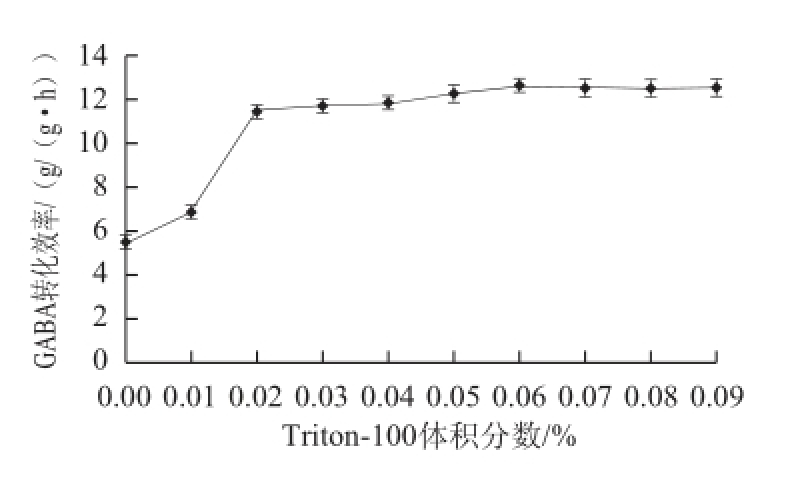
图5 Triton-100添加量对GABA转化效率的影响
Fig.5 Effect of Triton-100 concentration on the productivity of GABA
2.5 不同金属离子对GABA转化效率的影响
金属离子可能是酶活性中心的组成部分,可以与酶螯合成络合物以维持酶三级、四级结构及蛋白质分子构象稳定,也可能是和底物结合催化反应有关 [28]。为了考察金属离子对GABA转化效率的影响,本实验探讨Mg 2+、Ca 2+、Ba 2+、Mn 2+、Ni 2+、Cu 2+、Fe 2+、Co 2+、Zn 2+、Fe 3+10 种金属离子对GABA转化率的影响,这些金属离子分别来自于MgCl 2、CaCl 2、BaCl 2、MnCl 2、NiCl 2、CuCl 2、FeCl 2、CoCl 2、ZnCl 2、FeCl 3,浓度分别选取5、50 mmol/L。
在29.55 mL反应体系中,以26.55 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以3 mL菌液为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在37 ℃条件下反应1 h,测定在不同金属离子处理下GABA转化效率。

图6 不同金属离子对GABA转化效率的影响
Fig.6 Effect of metal ions on the productivity of GABA
如图6所示,10 种金属离子添加量为50 mmol/L时均对GABA的合成具有抑制作用,说明高浓度的金属离子可能对微生物细胞具有损伤作用。金属离子添加量为5 mmol/L时,Mg 2+、Co 2+、Fe 2+、Fe 3+、Ca 2+对GABA的合成具有抑制作用,Ba 2+、Mn 2+、Zn 2+、Cu 2+、Ni 2+对GABA的合成有促进作用,其中Cu 2+、Ni 2+效果明显。在植物中,GAD被认为是感受Ca 2+信号的压力调节伴侣蛋白,敲除CaM结合区域将会导致GAD活性的下降,并会严重影响植物的发育 [26],细菌GAD结构特征类似于植物 [29],为了研究细菌GAD受Ca 2+激活是否类似于植物GAD,测定Ca 2+、Cu 2+、Ni 2+3 种离子添加量为低浓度时对GABA转化效率的影响。

图7 Cu
2+、Ni
2+浓度对GABA转化效率的影响
Fig.7 Effects of Cu
2+2+and Ni
2+2+concentrations on the productivity of GABA

图8 Ca 8 Ca
2+2+浓度对GABA转化效率的影响
Fig.8 Effect of Ca
2+2+concentration on the productivity of GABA
测定Ca 2+、Cu 2+、Ni 2+3 种金属离子在不同浓度添加量下GABA转化效率。如图7、8所示,GABA转化效率随着3 种金属离子浓度的增加均呈先增加后减小趋势,但最适浓度不一致,其中促进效果最好的为Ca 2+,最适浓度为0.6 mmol/L,GABA转化效率从6.0 g/(g•h)增加到9.2 g/(g•h),提高了53.3%;其次为Ni 2+,最适浓度为6 mmol/L,GABA转化效率提高了28.0%;再次为Cu 2+,最适浓度为10 mmol/L,GABA转化效率提高了21.8%。
2.6 最适底物与菌体质量比
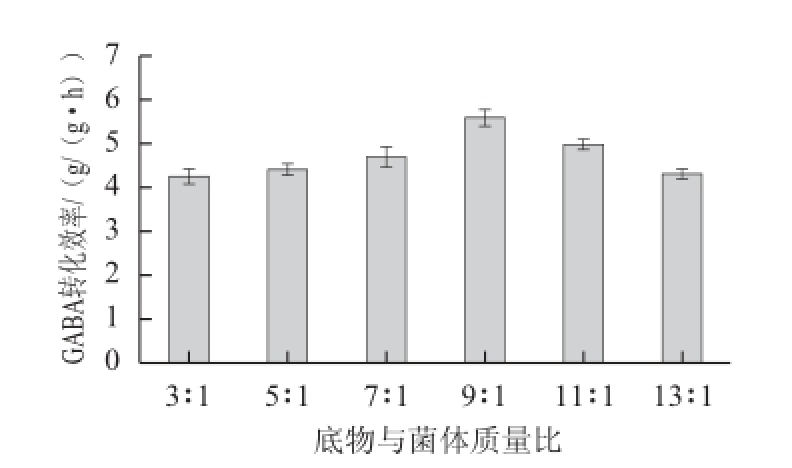
图9 底物与菌体质量比对GABA转化效率的影响
Fig.9 Effect of mass ratio between substrate and bacterial cells on the productivity of GABA
在29.55 mL反应体系中,以26.55 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以不同体积菌液为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在37 ℃反应1 h,测定底物与菌体不同质量比条件下GABA转化效率。如图9所示,GABA转化效率随着底物与菌体质量比增加呈先增加后减小的趋势,在底物与菌体质量比为9∶1时GABA转化效率最大,达到5.6 g/(g•h),因此选取9∶1为最适底物与菌体质量比。
2.7 最适反应体系体积
保持底物质量与菌体质量比为9∶1,设置反应转化液不同体积:5、10、15、20、25、30、35 mL,以浓度为0.1 mol/L的L-谷氨酸钠为底物,以不同体积菌液为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在37 ℃条件下反应1 h,测定在不同反应体系体积下GABA转化效率。如图10所示,GABA转化效率随着反应体系体积的增加而降低,原因可能是反应体系体积小时,菌体与底物的接触机会较多,转化效率高。当反应体系体积大于25 mL时,GABA转化效率下降较为缓慢,趋势趋于平稳。因此,选取5 mL为最适反应体系。

图10 反应体系体积对GABA转化效率的影响
Fig.10 Effect of reaction system volume on the productivity of GABA
2.8 最优条件下反应时间对GABA转化效率的影响
为了探索转化时间对GABA产量和转化效率的影响,研究1~10 h不同转化时间下GABA转化效率和合成量的变化。

图11 转化时间对GABA转化效率和合成量的影响
Fig.11 Effect of reaction time on the productivity and yield of GABA
由上述单因素优化试验得出最佳反应条件组合:以5 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以6.4 mg菌体为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在反应体系中加入体积分数为0.06%的Triton-100,并加入浓度为0.6 mmol/L的Ca 2+,在45 ℃条件下反应10 h。由图11可知,GABA转化效率随着转化时间的增加而减小,1~4 h,GABA转化效率下降较为明显,4~10 h,GABA转化效率下降较为缓慢,1 h时GABA转化效率最高,达到13.8 g/(g•h),优化前GABA转化效率为5.6 g/(g•h),优化后使得GABA转化效率提高1.5 倍,优化效果较好。
GABA合成量随着反应时间的增加呈先增加后减小趋势,GABA合成量在1 h时增加最多,达到16.0 g/L,1~7 h GABA合成量缓慢增加,反应时间为7 h时GABA合成量最高,为26.1 g/L,7 h以后GABA合成量缓慢减小,可能是由于随着反应时间的增加,底物和菌体均会减少,而产物GABA逐渐积累,反应一定时间后,底物被消耗完全,且产物 GABA被反应体系中某些物质消耗,从而导致GABA合成量的减小。
本研究利用实验室保藏的菌株E. coli BL21(DE3)-[pET-23a-gadB]进行全细胞转化,该菌株是高效表达GAD的基因工程菌,本菌株打破了乳酸菌野生菌株GAD本底表达量不高所导致的全细胞转化效率不高的限制,借助大肠杆菌GAD表达具有可人工调控、生长迅速以及易于高密度培养等颇多优点,达到高效率生产GABA的目的。
本实验对重组谷氨酸脱羧酶细胞生物合成GABA转化条件进行了优化,最终得到最佳转化条件为:以5 mL浓度为0.1 mol/L的L-谷氨酸钠为底物,以6.4 mg菌体为酶源,乙酸-乙酸钠缓冲液调pH值为4.5,在反应体系中加入体积分数为0.06%的Triton-100,并加入浓度为0.6 mmol/L的Ca 2+,在45 ℃条件下反应7 h,GABA合成量达到26.1 g/L。王期等 [30]利用工程菌粗酶液以L-谷氨酸钠为底物催化合成GABA,GABA生成量达到19.57 g/L,本实验所得到的GABA生成量略高于此研究。
GABA转化效率在1 h时达到最高,为13.8 g/(g•h),优化前GABA转化效率为5.6 g/(g•h),优化后使得GABA转化效率提高1.5 倍,优化条件中pH值对GABA转化效率影响较大,因此控制底物转化液pH值较为关键,pH值过高或过低均不利于GABA的生成,因pH值过高或过低均会影响酶活性。此外,添加低浓度的表面活性剂Triton-100对GABA转化效率的提高效果显著,最佳添加量为0.06%,GABA转化效率较对照组提高1.3 倍,这可能是因为Triton-100增加了细胞膜的通透性,使得底物更易进入细胞内进行反应,而产物GABA更易透过细胞膜进入细胞外。本实验主要考察了单因素对GABA转化效率的影响,未对因素间的交互作用做出研究,还有待进一步探索。
田灵芝等 [31]利用重组谷氨酸脱羧酶大肠杆菌合成GABA,在最优条件下,批次添加底物L-谷氨酸共600 g,5 L发酵罐转化24 h,GABA累计质量浓度高达204.5 g/L,以物质的量计,转化率为 97.92%,说明用发酵罐生产GABA的产量很高,因此本课题组下一步研究将在发酵罐的水平上进行。
参考文献:
[1] SHIMADA M, HASEGAWA T, NISHIMURA C, et al. Antihypertensive effect of γ-aminobutyric acid (GABA)-rich chlorella on high-normal blood pressure and borderline hypertension in placebo-controlled double blind study[J]. Clinical and Experimental Hypertension, 2009, 31(4): 342-354.
[2] COSSART R, BERNARD C, BEN-ARI Y. Multiple facets of GABAergic neurons and synapses: multiple fates of GABA signalling in epilepsies[J]. Trends in Neurosciences, 2005, 28(2): 108-115.
[3] OKADA T, SUGISHITA T, MURAKAMI T, et al. Effect of the defatted rice germ enriched with GABA for sleeplessness, depression, autonomic disorder by oral administration[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2000, 47(8): 596-603.
[4] 杨帆, 金迪, 蔡东联, 等. γ-氨基丁酸茶对小鼠抗疲劳作用的研究[J].氨基酸和生物资源, 2011, 33(2): 60-63.
[5] 孙日雯, 祝晋芳, 冯源. γ-氨基丁酸与哮喘的关系[J]. 中国医药指南, 2010(3): 40-42.
[6] 胡家澄, 邹晓庭. 新型绿色饲料添加剂: γ-氨基丁酸[J]. 畜牧与兽医, 2009, 41(8): 98-100.
[7] 周小理, 赵琳. γ-氨基丁酸的生理功能及在食品中应用的研究进展[J].食品工业, 2011, 32(10): 58-61.
[8] 王辉, 项丽丽, 张锋华. γ-氨基丁酸(GABA)的功能性及在食品中的应用[J]. 食品工业, 2013, 34(6): 186-189.
[9] HAYAKAWA K, KINURA M, KASAHA K, et al. Effect of γ-aminobutyric acid enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J]. British Journal of Nutrition, 2004, 92(3): 411-417.
[10] LEE B J, KIM J S, KANG Y M, et al. Antioxidant activity and γ-aminobutyric acid (GABA) content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J]. Food Chemistry, 2010, 122(1): 271-276.
[11] LI Haixing, GAO Dandan, CAO Yusheng, et al. A high γ-aminobutyric acid-producing Lactobacillus brevis isolated from Chinese traditionalpaocai[J]. Annals of Microbiology, 2008, 58(4): 649-653.
[12] 刘婷婷. 高产γ-氨基丁酸乳酸菌菌株选育及其转化条件优化[D]. 无锡: 江南大学, 2010: 19-20.
[13] 仇婷. 短乳杆菌NCL912连续培养生产γ-氨基丁酸研究[D]. 南昌: 南昌大学, 2011: 12.
[14] 曾小群, 盛姣铃, 潘道东, 等. 新疆酸马奶中产γ-氨基丁酸乳酸菌的筛选与鉴定[J]. 中国食品学报, 2013, 13(10): 191-196.
[15] 黄美娥, 彭胜, 陈阳波. 南瓜叶中γ-氨基丁酸的提取及薄层扫描测定[J].天然产物研究与开发, 2012, 24(9):1284-1287.
[16] 夏虹, 彭茂民, 周有祥. 发芽米中γ-氨基丁酸含量的测定[J]. 食品与机械, 2009, 25(4): 100-102.
[17] 张庆庆, 刘辉, 汤斌, 等. 柱前衍生化毛细管电泳法测定红曲酒中γ-氨基丁酸含量[J]. 食品与发酵工业, 2009, 35(12): 119-122.
[18] 李遂勤, 王立忠, 彭海成. 反相高效液相色谱法测定食品中γ-氨基丁酸的研究[J]. 中国卫生检验杂志, 2011, 21(9): 2179-2180.
[19] BUCK K, VOEHRINGER P, FERGER B. Rapid analysis of GABA and glutamate in microdialysis samples using high performance liquid chromatography and tandem mass spectrometry[J]. Journal of Neuroscience Methods, 2009, 182(1): 78-84.
[20] LIN Q, YANG S Y, LÜ F X, et al. Cloning and expression of glutamate decarboxylase gene from Streptococcus thermophilus Y2[J]. Journal of General and Applied Microbiology, 2009, 55(4): 305-310.
[21] 黄俊. 利用短乳杆菌制备γ-氨基丁酸相关过程研究[D]. 杭州: 浙江大学, 2006: 29-32.
[22] 陈希贤, 李东, 吕建新, 等. 高效液相色谱法测定人脑脊液中γ-氨基丁酸和谷氨酸[J]. 色谱, 1997, 15(3): 59-61.
[23] 闫淑莲, 赵光, 刘永利. 反相高效液相色谱-丹酰氯柱前衍生法的氨基酸分析测定[J]. 首都医科大学学报, 2003, 24(3): 338-339.
[24] 夏江, 梅乐和, 黄俊, 等. 产γ-氨基丁酸的乳酸菌株筛选及诱变[J].核农学报, 2006, 20(5): 379-382.
[25] 黄俊, 梅乐和, 盛清, 等. γ-氨基丁酸液体发酵过程的条件优化及补料研究[J]. 高校化学工程学报, 2008, 22(4): 618-623.
[26] BAUM G, LEV-YADUN S, FRIDMANN Y, et al. Calmodulin binding to glutamate decarboxylase is required for regulation of glutamate and GABA metabolism and normal development in plants[J]. The EMBO Journal, 1996, 15(12): 2988-2996.
[27] YANG Shengyuan, LIN Qian, LU Zhaoxin, et al. Characterization of a novel glutamate decarboxylase from Streptococcus salivarius ssp. thermophilus Y2[J]. Journal of Chemical Technology and Biotechnology, 2008, 83(6): 855-861.
[28] 居乃琥. 酶工程手册[M]. 北京: 中国轻工业出版社, 2011: 162-163.
[29] SUKHAREVA B S, TIKHONENKO A S, DARIĬ E L. Study of the quaternary structure of glutamate carboxylase from Escherichia coli[J]. Molekuliarnaia Biologiia, 1993, 28(6): 1407-1411.
[30] 王期, 抗晶晶, 忻寅强, 等. 生物转化法重组谷氨酸脱羧酶合成γ-氨基丁酸[J]. 南京师范大学学报: 自然科学版, 2010, 33(3): 85-90.
[31] 田灵芝, 徐美娟, 饶志明. 一株重组大肠杆菌/pET-28a-lpgad的构建及其高效生产γ-氨基丁酸转化条件的优化[J]. 生物工程学报, 2012, 28(1): 65-75.
Optimization of Conversion Conditions for Biosynthesizing γ-Aminobutyric Acid by Recombinant Glutamate Decarboxylase from Escherichia coli
CHEN Lin, ZHANG Chong, LÜ Fengxia, BIE Xiaomei, ZHAO Haizhen, LU Zhaoxin*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:The conditions for the synthesis of γ-aminob utyric acid (GABA) using glutamate decarboxylase from recombinant E. coli cells were optimized in this work. The effects of temperature, pH, surfactants, metal ions, the ratio of substrate and cells and the transformation system volume on the productivity of GABA were studied. Results indicated that the optimal reaction system volume was 5 mL containing 0.1 mol/L sodium glutamate as the substrate, 6.4 mg of E. coli cells (dry weight), 0.06% Triton-100 (volume fraction) and 0.6 mmol/L Ca 2+at pH 4.5. The reaction was allowed to proceed for 7 h at 45 ℃. Under these optimal conditions, the yield of GABA was 26.1 g/L. The transformation effi ciency of GABA reached the highest level of 13.8 g/(g·h) after 1 h reaction, which is 2.5 times higher than that observed before optimization.
Key words:γ-aminobutyric acid (GABA); glutamate decarboxylase; conversion conditions; optimization
中图分类号:Q939.9
文献标志码:A
文章编号:1002-6630(2015)01-0158-06
doi:10.7506/spkx1002-6630-201501030
收稿日期:2014-03-03
作者简介:陈琳(1991—),女,硕士,研究方向为食品生物技术。E-mail:2013108025@njau.edu.cn
*通信作者:陆兆新(1957—),男,教授,博士,研究方向为食品微生物及生物技术。E-mail:fmb@njau.edu.cn