李伟丽 1,2,赵 超 1,2,车建途 1,2,李东乐 1,2,易武华 2,赵丽娟 2
(1.北京威力格生物科技有限公司,北京 102200;2.山西水塔醋业股份有限公司,山西 清徐 030400)
摘 要:从腐败醋中分离出84 株不同微生物菌株,通过对其形态学观察、革兰氏染色、16S rDNA测序,并与GenBank中已知序列进行比对,以及进一步测定16S~23S ITS,发现其由20 株解淀粉芽孢杆菌、12 株地衣芽孢杆菌、6 株芽孢杆菌属1NLA3E、12 株蜡样芽孢杆菌、4 株巨大芽孢杆菌、3 株短短芽孢杆菌、2 株短小芽孢杆菌、11 株凝结芽孢杆菌、12 株类芽孢杆菌、1 株耐酸乳酸菌、1 株产气荚膜梭菌组成。除耐酸乳酸菌外,均为革兰氏阳性芽孢杆菌。通过管碟法和比浊法测定了乳酸链球菌素(Nisin)对以上菌株的抑菌效价,显示Nisin对腐败醋中分离得到的微生物菌株均具有明显的抑菌或杀菌活性。
关键词:腐败醋;16S rDNA;16S~23S ITS;分离鉴定;乳酸链球菌素
在食用醋的生产、陈酿、贮存过程中,经常会出现食醋风味变差甚至腐败产生臭味的现象。在食用醋生产企业,夏季这种情况的产生尤为突出,其原因可能与夏季温度较高,适宜微生物生长繁殖有关 [1-4]。尽 管在食醋的生产过程中添加了对大部分细菌和真菌有较强抑制作用的苯甲酸钠等作为化学防腐剂,但本研究通过对腐败醋离心收集菌体、多次洗涤去除杂质沉淀,镜检等操作后发现腐败醋中依然存在大量可能导致食醋腐败的杆状细菌。
乳酸链球菌素(Nisin),又称乳酸链球菌肽或乳链菌肽,是由乳酸链球菌经特定发酵所产生的多肽类抗菌物质,能有效地抑制容易引起食品腐败变质的大多数革兰氏阳性菌(G +) [5-12]。Nisin的抑菌作用取决于其由34 个氨基酸组成小肽所具有的两亲性和所携带的正电荷,它们作用在细菌细胞壁所带负电荷的阴离子成分上,形成孔状结构,引起细胞膜渗漏,导致小分子质量的细胞成分如钾离子、氢离子、氨基酸、核苷酸等物质从胞内流出,引起细胞死亡。研究发现在金黄色葡萄球菌菌液中加入Nisin,会导致菌体变形,质壁分离,进而菌体细胞破裂为残片 [10]。Nisin是一种纯天然食品防腐剂。目前,我国已批准Nisin作为一种纯天然食品防腐剂广泛用于乳制品、发酵饮品、罐藏食品、肉类及肉制品的防腐保鲜 [5-12]。Nisin有望在食醋生产中Nisin取代广泛应用的化学防腐剂,从而减少化学防腐剂对人体的损害。
为考察导致腐败醋产生的微生物种类及Nisin对这些微生物的抑制作用,本研究按照国标中规定的分离细菌的方法,从腐败醋中分离、培养微生物菌株,并对其进行形态学观察,革兰氏染色等实验,进而测定其16S rDNA和16S~23S ITS序列,从分子水平上对这些菌株进行分类学鉴定。同时测定了Nisin对分离得到的腐败醋污染菌株的抑菌活性,旨在为利用有效无毒的抑菌剂防治食醋腐败提供实验依据。
1.1 材料、培养基与试剂
腐败醋由山西水塔醋业股份有限公司提供。
PCA培养基、NB培养基、MC培养基、MRS培养基、效价检测培养基 北京博奥星生物技术有限责任公司;Taq DNA聚合酶、dNTP、DL2000 Marker 北京康为世纪生物科技有限公司;溶菌酶溶液、细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;乳酸链球菌素 浙江新银象公司;其他试剂均购自北京化工厂。
1.2 仪器与设备
生化培养箱、摇床、分光光度计、荧光显微镜 重庆奥特光学公司;GeneAmp PCR System 2720(ABI)、厌氧培养袋、厌氧产气袋、氧气指示剂 北京陆桥技术有限责任公司;ChampGel凝胶成像分析系统 北京赛智公司。
1.3 方法
1.3.1 培养基和试剂配制
效价检测培养基:蛋白胨8 g、酵母浸粉3 g、葡萄糖5 g、Na 2HPO 4·12H 2O 2 g、氯化钠5 g、吐温-20 5 mL,调节pH 6.8,琼脂粉15 g,115 ℃灭菌15 min备用。
用0.02 mol/L无菌稀盐酸配制Nisin浓度为10 3U/mL的标准液,室温放置1 h,4 ℃冰箱保存备用(不超过7 d),需要时用0.02 mol/L无菌盐酸溶液配制1 000、100、50、25、10、0 U/mL 6 种效价的溶液,分别标记为5、4、3、2、1、0。
1.3.2 腐败醋中微生物的镜检
取腐败醋60 mL到100 mL无菌离心管中,8 000 r/min离心5 min,弃去上清收集沉淀;然后用60 mL无菌生理盐水重新悬浮沉淀,8 000 r/min离心5 min,弃去上清收集沉淀;重复用无菌生理盐水洗涤沉淀4~5 次,最后沉淀用2 mL无菌生理盐水悬浮。取20 μL菌液,按照GB/T 4789.28—2003《食品卫生微生物学检验 染色法、培养基和试剂》的方法用结晶紫染液进行染色和镜检。
1.3.3 腐败醋中微生物的分离和鉴定
分离方法:以下操作在超净工作台中进行。依据GB/T 4789.22—2003用25%灭菌碳酸钠溶液调节腐败醋pH值至中性(pH 7.0),分别取100 μL,涂PCA平板、MC平板、MRS平板,各涂10 个平板。PCA平板和MC平板倒置平放于37 ℃生化培养箱,过夜培养,观察菌落情况。MRS平板于37 ℃厌氧培养48~72 h,观察菌落情况。
挑取、转接单菌落:PCA平板上的单菌落转接到NB液体培养基,MC平板上的单菌落转接到MC液体培养基后过夜培养(37 ℃,200 r/min,16~18 h),按照GB/T 4789.28—2003对菌液进行革兰氏染色和镜检。MRS平板上的单菌落转接到MRS液体培养基,放置到圆底立式培养袋,袋中加入厌氧产气袋、氧气指示剂,37 ℃厌氧培养48~72 h。按照GB/T 4789.28—2003对菌液进行革兰氏染色和镜检。
1.3.4 腐败醋中菌株基因组DNA的提取
取菌液2 mL,12 000 r/min离心2 min,弃上清收集菌体,按试剂盒的方法提取基因组DNA。提取后的基因组DNA作为扩增16S rDNA和16S~23S ITS的模板。
1.3.5 16S rDNA序列扩增
利用通用引物27F和1492R以菌株总DNA为模版进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。在50 μL PCR反应体系中加入38 μL水、5 μL Buffer、4 μL dNTP、引物27F和1492R各l μL、0.5 μL模版、0.5 μL Taq DNA聚合酶。扩增程序:95 ℃变性5 min后,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,共35 个循环,72 ℃延伸10 min。扩增产物经纯化后作为序列测定的模板,送北京市理化分析测试中心进行测序。
1.3.6 16S~23S ITS序列扩增
利用通用引物L16S1349F和L523SR,以菌株总DNA为模版进行PCR [13-14]。在50 μL PCR反应体系中加入38 μL水、5 μL Buffer、4 μL dNTP、正向引物L16S1349F和反向引物L523SR各1 μL、0.5 μL 模版、0.5 μL Taq DNA聚合酶。扩增程序:95 ℃变性5 min后,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸90 s,共35 个循环,72 ℃延伸10 min。扩增产物经纯化后作为序列测定的模板,送北京市理化分析测试中心进行测序。
1.3.7 数据处理
将测序结果输入数据库http://blast.ncbi.nlm.nih.gov/,使用BLAST程序与数据库中的序列进行比对分析。根据比对结果,找出与数据库同源性最高的已知菌种,推测待定菌株可能的属或种。
1.3.8 管碟法检测Nisin抑菌活性
Nisin对从PCA平板和MC平板分离得到的好氧和兼性厌氧微生物菌株进行抑菌活性测定:将效价检测固体培养基冷却至50 ℃左右,加入适量菌悬液使培养基中菌液浓度达到5×10 5~5×10 6CFU/mL,混匀后倒入平板;平板放置水平台面冷却后,在平皿中均匀放入牛津杯(直径8.00 mm),静置10 min使其自然下沉;取200 μL已制备好的Nisin溶液加入牛津杯中,平稳移至恒温箱,37 ℃培养16 h左右,移去牛津杯观察抑菌圈大小,利用游标卡尺测量抑菌圈直径d(mm),抑菌效果(X)计算公式为:
抑菌活性实验重复3 次,抑菌效果表示为
 。
。
1.3.9 浊度法检测Nisin抑菌活性
Nisin对经MRS平板分离得到的兼性厌氧菌和厌氧菌的抑菌活性测定:将2.25 mL Nisin标准品溶液与1 mL菌悬液(OD 600 nm为1.0左右的指示菌溶液)加入含有15 mL MRS液体培养基的厌氧管中混匀;同时取2 个厌氧管分别加2.25 mL无菌稀盐酸、1 mL指示菌混合液,再分别加入15 mL MRS液体培养基混匀,其中1 管作为同步培养时的阳性对照,另1 管用于测定初始培养时的OD 600 nm;用MRS液体培养基进行调零,37 ℃培养24~120 h、取样,读取OD 600 nm值并作相应记录。根据所得到的OD 600 nm值进行抑菌率(I)分析,计算公式如下:
式中:OD
1、OD
2、OD
0分别代表阳性对照、待测样品和初始培养的OD
600
nm值。抑菌活性实验重复3 次,结果为
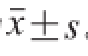 。
。
2.1 腐败醋中微生物镜检
镜检发现,腐败醋中含有包括长杆菌和短杆菌等形态结构有明显差异的多种杆状细菌(图1)。

图1 腐败醋中的微生物
Fig.1 Microorganisms observed in spoiled vinegar
2.2 腐败醋中分离获得菌株的形态观察和革兰氏染色
对分离得到的菌株编号,进行菌落形态学观察、革兰氏染色和镜检,结果发现分离得到的菌株均呈杆状形态的G +。
2.3 16S rDNA和16S~23S ITS测序
由表1、2可知,从腐败醋中分离获得84 株菌,其组成为20 株解淀粉芽孢杆菌、12 株地衣芽孢杆菌、6 株芽孢杆菌属1NLA3E、12 株蜡样芽孢杆菌、4 株巨大芽孢杆菌、3 株短短芽孢杆菌、2 株短小芽孢杆菌、11 株凝结芽孢杆菌、12 株类芽孢杆菌、1 株耐酸乳酸菌、1 株产气荚膜梭菌。分离得到的菌株除一株耐酸乳酸菌外其余均为芽孢杆菌,均属于G +。
表1 PCA培养基平板分离获得的菌株
Table 1 Bacterial strains separated from spoiled vinegar in PCA medium
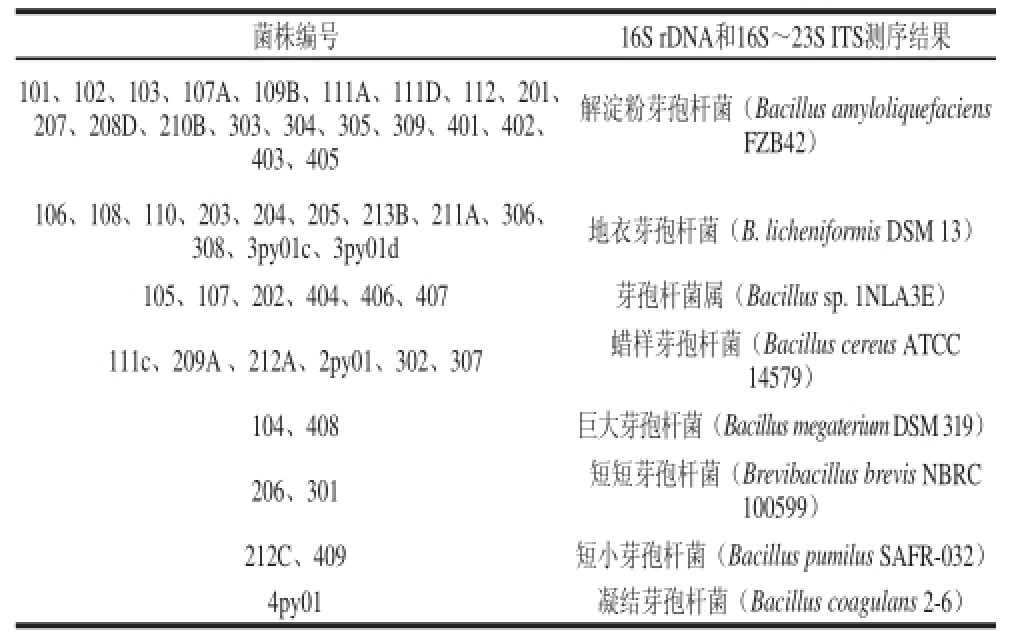
菌株编号16S rDNA和16S~23S ITS测序结果101、102、103、107A、109B、111A、111D、112、201、207、208D、210B、303、304、305、309、401、402、403、405解淀粉芽孢杆菌(Bacillus amyloliquefaciens FZB42)106、108、110、203、204、205、213B、211A、306、308、3py01c、3py01d地衣芽孢杆菌(B. licheniformis DSM 13)105、107、202、404、406、407芽孢杆菌属(Bacillus sp. 1NLA3E)111c、209A 、212A、2py01、302、307蜡样芽孢杆菌(Bacillus cereus ATCC 14579)104、408巨大芽孢杆菌(Bacillus megaterium DSM 319)206、301短短芽孢杆菌(Brevibacillus brevis NBRC 100599)212C、409短小芽孢杆菌(Bacillus pumilus SAFR-032)4py01凝结芽孢杆菌(Bacillus coagulans 2-6)
表2 乳酸菌培养基平板分离获得的菌株
Table 2 Bacterial strains separated from spoiled vinegar in MC
Table 2 Bact medium and MRS medium
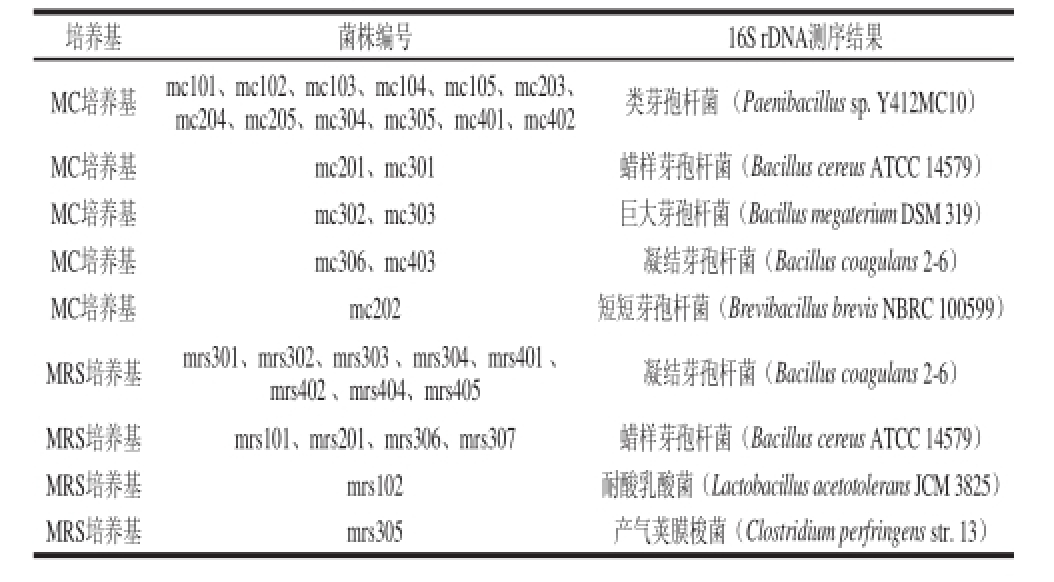
培养基菌株编号 16S rDNA测序结果MC培养基mc101、mc102、mc103、mc104、mc105、mc203、mc204、mc205、mc304、mc305、mc401、mc402类芽孢杆菌 (Paenibacillus sp. Y412MC10)MC培养基mc201、mc301蜡样芽孢杆菌(Bacillus cereus ATCC 14579)MC培养基mc302、mc303巨大芽孢杆菌(Bacillus megaterium DSM 319)MC培养基mc306、mc403凝结芽孢杆菌(Bacillus coagulans 2-6)MC培养基mc202短短芽孢杆菌(Brevibacillus brevis NBRC 100599)MRS培养基mrs301、mrs302、mrs303 、mrs304、mrs401 、mrs402 、mrs404、mrs405凝结芽孢杆菌(Bacillus coagulans 2-6)MRS培养基mrs101、mrs201、mrs306、mrs307蜡样芽孢杆菌(Bacillus cereus ATCC 14579)MRS培养基mrs102耐酸乳酸菌(Lactobacillus acetotolerans JCM 3825)MRS培养基mrs305产气荚膜梭菌(Clostridium perfringens str. 13)
2.4 指示菌的选取
根据测序比对结果,从PCA平板和MC平板分离获得的菌株中选取112、204、105、2py01、104、301、212c、4py01、mc401分别作为解淀粉芽孢杆菌、地衣芽孢杆菌、芽孢杆菌属1NLA3E、蜡样芽孢杆菌、巨大芽孢杆菌、短短芽孢杆菌、短小芽孢杆菌、凝结芽孢杆菌、类芽孢杆菌的指示菌。同样在MRS平板分离得到的厌氧菌株中选取 mrs101、mrs102、mrs301、mrs305分别作为蜡样芽孢杆菌、耐酸乳酸菌、凝结芽孢杆菌、产气荚膜梭菌的指示菌。
2.5 管碟法检测Nisin对指示菌的抑菌活性
由表3可知,Nisin对不同指示菌株均具有抑菌活性,其抑菌作用数值越大表示其抑菌效价越高。Nisin浓度为0时,有抑菌圈产生,说明稀盐酸对菌株105、2py01、104也有抑制作用,添加Nisin后,抑菌作用增强。
表3 管碟法测定Nisin对指示菌的抑菌作用
Table 3 Bactericidal effect of Nisin on indicator strains using Oxford plate assssaayy
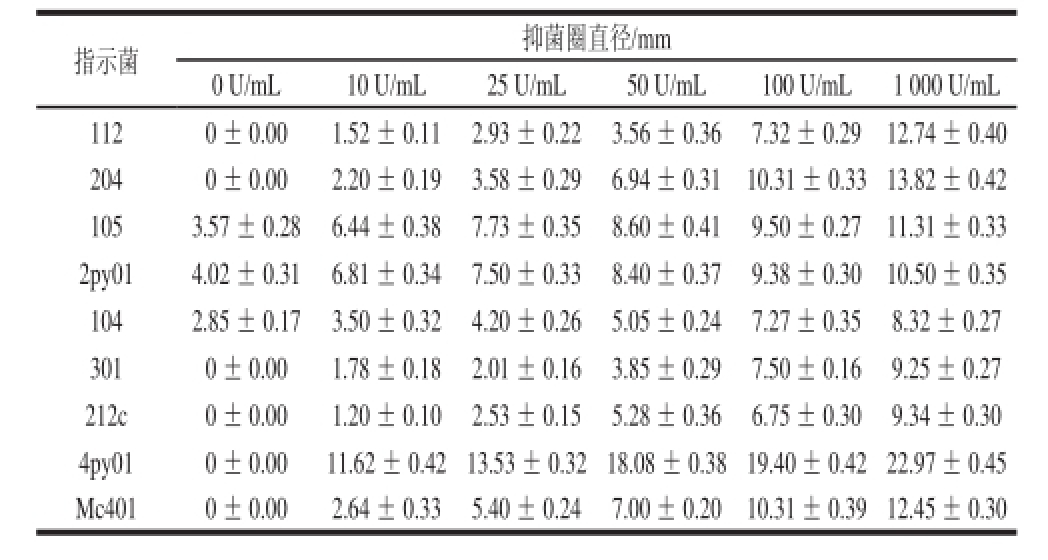
指示菌抑菌圈直径/mm 0 U/mL10 U/mL25 U/mL50 U/mL100 U/mL1 000 U/mL 1120 ± 0.001.52 ± 0.112.93 ± 0.223.56 ± 0.367.32 ± 0.2912.74 ± 0.40 2040 ± 0.002.20 ± 0.193.58 ± 0.296.94 ± 0.3110.31 ± 0.33 13.82 ± 0.42 1053.57 ± 0.286.44 ± 0.387.73 ± 0.358.60 ± 0.419.50 ± 0.2711.31 ± 0.33 2py014.02 ± 0.316.81 ± 0.347.50 ± 0.338.40 ± 0.379.38 ± 0.3010.50 ± 0.35 1042.85 ± 0.173.50 ± 0.324.20 ± 0.265.05 ± 0.247.27 ± 0.358.32 ± 0.27 3010 ± 0.001.78 ± 0.182.01 ± 0.163.85 ± 0.297.50 ± 0.169.25 ± 0.27 212c0 ± 0.001.20 ± 0.102.53 ± 0.155.28 ± 0.366.75 ± 0.309.34 ± 0.30 4py010 ± 0.0011.62 ± 0.42 13.53 ± 0.32 18.08 ± 0.38 19.40 ± 0.42 22.97 ± 0.45 Mc4010 ± 0.002.64 ± 0.335.40 ± 0.247.00 ± 0.2010.31 ± 0.39 12.45 ± 0.30
2.6 浊度法检测Nisin对指示菌的抑菌活性
根据测序比对结果从MRS平板分离获得的厌氧菌株或兼性厌氧菌株中选取mrs101、mrs102、mrs103、mrs305作为蜡样芽孢杆菌、耐酸乳酸菌、凝结芽孢杆菌、产气荚膜梭菌的指示菌。通过浊度法检测Nisin对其抑菌效价。
表4 浊度法测定乳酸链球菌素对指示菌的抑菌作用
Table 4 Bactericidal effect of Nisin on indicator strains using
Table 4 Bacte turbidity method

菌株OD 600 nm对照菌株添加Nisin菌株初始培养菌株mrs1011.400±0.0210.031±0.0020.095±0.007 mrs1021.331±0.0500.034±0.0080.096±0.006 mrs3011.367±0.0740.030±0.0050.087±0.009 mrs3051.441±0.0480.024±0.0070.135±0.004
由表4和公式(2)计算可知,菌液中添加Nisin后,其对MRS培养基分离得到的mrs101、mrs102、mrs301、mrs305这4株菌的抑菌率分别为105.0%、105.0%、104.5%、108.5%,表明Nisin对它们均有很强的杀菌效果。由于Nisin的杀菌作用导致指示菌死亡溶解,从而造成添加Nisin后培养一定时间的菌液OD 600 nm值小于初始培养菌液OD 600 nm值,故抑菌率大于100%。
本研究从腐败醋中分离得到的菌株除一株耐酸乳酸菌外均为芽孢杆菌。其中解淀粉芽孢杆菌菌株最多,其16S rDNA序列与解淀粉芽孢杆菌、枯草芽孢杆菌、萎缩芽胞杆菌的相同序列同源性均为99%,为了进一步具体确定它们的归属,使用了正向引物L16S1349F和反向引物L523SR扩增其16S~23S ITS [14-19]。
解淀粉芽孢杆菌基因组(G e n B a n k 登录号NC_009725.1)中的16S~23S ITS序列存在10 条等位基因片段,利用正向引物L16S1349F和反向引物L523SR可以扩增出2 条628 bp基因片段(仅有一个碱基不同),2 条512 bp基因片段(2 个碱基不同),6 条454 bp基因片段(5 条碱基序列一致,1 条有3 个碱基不同 )。枯草芽孢杆菌基因组(GenBank 登录号NC_000964.3)中的16S~23S ITS序列存在10 条等位基因片段,利用正向引物L16S1349F和反向引物L523SR可以扩增出2 条序列完全一致的626 bp基因片段,8 条序列不完全一致的446 bp基因片段。萎缩芽孢杆菌基因组(GenBank登录号NC_014639.1)中的16S~23S ITS序列存在7 条等位基因片段,利用正向引物L16S1349F和反向引物L523SR可以扩增出2条序列完全一致的632 bp的基因片段,5 条459 bp基因片段(4 条片段序列完全一致,另1 条多1 个碱基)。本实验中利用正向引物L16S1349F和反向引物L523SR扩增出了3条基因片段,长度分别为628、512、454 bp,取长度为628 bp的片段测序后发现其序列与解淀粉芽孢杆菌的基因匹配。
王俊等 [2]向固态发酵食用醋的无菌成品中直接添加分离得到的芽孢杆菌属杂菌和葡糖杆菌属杂菌,均引起了食用醋返混并产生酸臭味,均破坏了固态发酵食用醋成品的风味。本实验则从腐败醋中分离得到了一株产气荚膜梭菌,该菌适宜的生长温度为37~47 ℃,在此温度范围内其生长和繁殖速率极快,世代间隔时间仅为8 min,此外其能够利用多种糖,代谢过程会产生H 2S。推测此产气荚膜梭菌污染食醋后可能会导致食醋风味发生变化,使其腐败变臭。
Nisin对G +的抑菌效果明显优于对革兰氏阴性细菌(G -)。G +和G -在结构上的差异主要表现在细胞壁上。G +细胞壁肽聚糖含量丰富,交联度高;而G -的细胞壁肽聚糖含量少,但组成复杂,主要包括磷脂、蛋白质和脂多糖等,十分致密,仅允许分子质量小于600 D的分子通过。Nisin的分子质量约为3 500 D,无法正常通过G -细胞壁到达细胞膜。而Nisin对G +抑菌效果优于对G -这一现象,从另一个侧面证明了对细胞膜的吸附是Nisin发挥作用的必要条件 [10]。
本实验通过分离获得的细菌均为G +,提示食醋的细菌污染主要来源于G +。抑菌实验表明Nisin对从腐败醋中分离得到的腐败菌株均有明显的抑菌或杀菌作用,与报道Nisin对G +具有抑菌或/和杀菌作用及机理的结果一致 [5-11]。本研究发现,管碟法检测过程操作简单,实验结果直观,培养过程中不需要添加厌氧袋,适用于好氧菌及兼性厌氧菌的培养,但对厌氧菌或兼性厌氧菌不适用。浊度法检测过程中使用了厌氧管培养厌氧菌或兼性厌氧菌,方法对好氧菌或兼性好氧菌不适用。
杨荣杰 [4]研究了苯甲酸钠对芽孢杆菌的最小抑菌浓度,结果表明苯甲酸钠的最低抑菌浓度已经超出了其在食品中允许的最大添加量。由此可见,在食品安全允许范围内,苯甲酸钠对芽孢杆菌的抑制作用有限。该报道同时也研究了Nisin对芽孢杆菌的最小抑菌浓度,发现其对芽孢杆菌的最小抑菌浓度远小于其允许的最大添加量。本研究中,Nisin的抑菌浓度亦明显低于食品中允许的最大添加量,提示在食品安全允许的范围内,添加Nisin能够有效抑制芽孢杆菌的增殖生长 [10]。由于食醋腐败在食醋酿造行业几乎每年夏天都会发生,对食醋酿造生产企业造成了很大经济损失。本研究为食醋生产过程中利用Nisin取代化学防腐剂预防腐败醋的发生提供了一定的实验依据。
本研究中分离到的微生物菌株并不一定都能够引起食醋的腐败,有关食醋腐败的原因、条件、腐败菌的组成等研究还有待进一步开展。构建腐败食醋中非培养微生物的克隆文库 [20-25]并开展食醋变质过程中微生物菌群多态性分析,将会进一步为腐败醋的防治工作提供有价值的指导。
参考文献:
[1] 王玉美, 卢红梅, 王伟, 等. 食醋生物性返浑的防治[J]. 中国调味品, 2010, 35(2): 75-76.
[2] 王俊, 卢红梅, 崔云. 杂菌污染对固态发酵食醋返混的影响[J]. 食品科学, 2013, 34(5): 172-176.
[3] 崔云. 食醋返浑机理的研究[D]. 贵阳: 贵州大学, 2009.
[4] 杨荣杰. 食醋中产膜菌株的分离鉴定及其特性研究[D]. 呼和浩特:内蒙古农业大学, 2012: 2.
[5] 杨晓韬, 李春, 周晓宏. 7 种食品防腐剂对肉制品污染微生物的抑菌效果比较研究[J]. 食品科学, 2012, 33(11): 12-16.
[6] 陈南南, 徐歆, 商丰才, 等. 不同防腐剂对3种模式腐败菌抑菌效果的比较[J]. 食品科学, 2011, 32(1): 14-18.
[7] 吴琼, 李晶, 黄海燕. 乳酸链球菌素与化学防腐剂抑菌效果比较[J].食品研究与开发, 1999, 20(2): 44-46.
[8] 杜琨. 乳酸链球菌素的稳定性及抑菌特性研究[J]. 食品工业, 2012, 33(1): 99-101.
[9] 张国只, 陈林海, 杨天佑, 等. 琼脂扩散法测定乳链菌肽效价的优化[J].食品科学, 2007, 28(3): 175-178.
[10] 吕淑霞, 白泽朴, 代义, 等. 乳酸链球菌素(Nisin)抑菌作用及其抑茵机理的研究[J]. 中国酿造, 2008, 27(9): 87-91.
[11] 庞瑞霞, 宗楠. Nisin及其在食品工业中的应用[J]. 食品研究与开发, 2011, 32(9): 218-220.
[12] GB 2760—2007 食品添加剂使用标准[S].
[13] 萨姆布鲁克, 拉塞尔. 分子克隆实验指南[M]. 黄培堂, 译. 3版. 北京:科学出版社, 2002: 614-616.
[14] 郑雪松, 杨虹, 李道棠, 等. 基因间隔序列(ITS)在细菌分类鉴定和种群分析中的应用[J]. 应用与环境生物学报, 2003, 9(6): 678-684.
[15] XU Dong, COTE J C. Phylogenetic relationships between Bacillus species and related genera inferred from comparison of 3’ end 16S rDNA and 5’ end 16S-23S ITS nucleotide sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53: 695-704.
[16] 刘国红, 林营志, 刘波, 等. 芽孢杆菌种类脂肪酸鉴定与分子鉴定方法的比较[J]. 福建农业学报, 2012, 27(2): 173-180.
[17] PRIEST F G, GOODFELLOW M, SHUTE L A, et al. Bacillus amyloliquefaciens sp. nov. nom. Rev[J]. International Journal of Systematic Bacteriology, 1987, 37: 66-71.
[18] 杨胜远, 韦锦, 李云, 等. 一株产抗菌活性物质解淀粉芽孢杆菌的筛选及鉴定[J]. 食品科学, 2010, 31(21): 208-212.
[19] ROONEY A, PRICE N, EHRHARDT C, et al. Phylogeny and molecular taxonomy of the Bacillus subtilis species complex and description of Bacillus subtilis subsp. inaquosorum subsp. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 2429-2436.
[20] 聂志强, 韩玥, 郑宇, 等. 宏基因组学技术分析传统食醋发酵过程微生物多样性[J]. 食品科学, 2013, 34(15): 198-203.
[21] 田小群, 鲁欣, 周世宁. 啤酒腐败菌的分离鉴定及对啤酒的危害[J].酿酒科技, 2005(7): 32-35.
[22] SCHEU P M, BERGHOF K, STSHL U. Detection of pathogenic and spoilage microorganisms in food with the polymerase chain reaction[J]. Food Microbiology, 1998, 15: 13-31.
[23] ERCOLINI D. PCR-DGGE fingerprinting: novel strategies for detection of microbes in food[J]. Journal of Microbiological Methods, 2004, 56: 297-314.
[24] MAMLOUK D, HIDALGO C, TORIJA M J, et al. Evaluation and optimisation of bacterial genomic DNA extraction for no-culture techniques applied to vinegars[J]. Food Microbiology, 2011, 28(7): 1397-1379.
[25] CHUN J, RAINEY F. Integrating genomics into the taxonomy and systematics of the Bacteria and Archaea[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64: 316-324.
Inhibitory Effect of Nisin on Microorganisms Isolated and Identifi ed from Spoiled Vinegar
LI Weili
1,2, ZHAO Chao
1,2, CHE Jiantu
1,2, LI Dongle
1,2, YI Wuhua
2, ZHAO Lijuan
2
(1. Beijing S&V Science and Technology Co. Ltd., Beijing 102200, China; 2. Shanxi Shuita Vinegar Industry Co. Ltd., Qingxu 030400, China)
Abstract:In the present study, 84 different bacterial strains were isolated from spoiled vinegar, which were identifi ed as 20 Bacillus amyloliquefaciens, 12 B. licheniformis, 6 Bacillus 1NLA3E, 12 Paenibacillus, 4 B. megaterium, 3 Brevibacillus brevis, 2 B. pumilus, 11 B. coagulans, 1 Lactobacillus acetotolerans and 1 Clostridium perfringens strains by morphological observation, 16S rDNA sequencing, and sequence alignment with GenBank database, as well as 16S-23S ITS sequencing. The inhibitory potency of nisin on these 84 bacterial strains was determined by assaying the diameter of inhibition zone using cup-plate method and turbidity using nephelometry, indicating that nisin had a signifi cant inhibitory activity on all the microbes isolated from the spoiled vinegar.
Key words:spoiled vinegar; 16S rDNA; 16S–23S ITS; isolation and identifi cation; Nisin
中图分类号:Q93
文献标志码:A
文章编号:1002-6630(2015)01-0174-05
doi:10.7506/spkx1002-6630-201501033
收稿日期:2014-03-11
作者简介:李伟丽(1981—),女,中级工程师,硕士,研究方向为微生物学、分子生物学。E-mail:liweili524@sina.com