
图1 细胞内中心代谢途径网络简化图
Fig.1 Central metabolic pathways for man
Glu. 葡萄糖;G6P. 6-磷酸-葡萄糖;Ru5P. 5-磷酸核酮糖;F6P. 6-磷酸果糖;GAP. 3-磷酸甘油醛;PEP. 磷酸烯醇式丙酮酸;PYR. 丙酮酸;Lac. 乳酸;AcCoA. 乙酰辅酶A。
李 阳,王兴亚,王茜茜,庞广昌 *
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
摘 要:目的:食品对机体的影响主要表现为对代谢和代谢网络的影响,本实验旨在研究食品对机体代谢作用的定量化评价方法。方法:通过对志愿者外周血采样,首先研究4 种生理状态(基础状态、学习状态、运动状态和发烧状态)下,乳酸盐代谢通量的变化,同时研究中心代谢途径中的15 种酶对乳酸盐代谢通量的控制作用;采用相关分析和主成分分析相结合的方法,研究酶的表达(或合成)量对乳酸盐代谢通量的作用,确定主成分及各种酶的控制系数。另招募健康志愿者,采集其食用大米变性淀粉前后的外周血样,运用已建立的代谢通量模型及控制分析方法对变性淀粉的功能性进行评价。结果:4 种状态下乳酸盐代谢通量各不相同,由小到大依次为:基础状态、学习状态、运动状态和发烧状态,4 种生理状态下机体内的分解代谢依次增强,可见乳酸盐代谢通量实质上反映了机体分解代谢(氧化磷酸化供能)的强弱。丙酮酸激酶(pyruvate kinase,PK,C pPK=0.221 6),丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDHC,C pPDHC=0.206 4),乳酸脱氢酶(lactate dehydrogenase,LDH,C pLDH=0.162 6),转酮酶(transketolase,TKL,C pTKL=0.206 0)对乳酸盐代谢通量起到主要作用,其中,PK的控制作用最强。志愿者食用变性淀粉后,乳酸盐通量增强,分解代谢增强而合成代谢减弱;PK的基因表达(合成)量显著增加(P=0.01<0.05),PDHC的基因表达(合成)量极显著降低(P=0.003<0.01),说明所测酶的表达量与所预测的乳酸盐通量之间的拟合程度较好。结论:本实验建立的评价方法可以通过采集适量的外周血对食用食品后的人体代谢作用进行定量化评价。
关键词:功能性食品;评价方法;生理状态;乳酸盐代谢通量;代谢控制分析
20世纪80年代以来,人们的饮食消费 结构慢慢从“温饱型”过渡为“小康型”,实现了从“食饱”、“食味”到“食疗”方面的转换,对食品有了越来越高的质量追求,以满足机体需要。人们致力于追求高营养,但也正是由于吃精、吃细、营养过剩以及营养失调,致使机体代谢紊乱,肥胖症、心脑血管疾病、糖尿病等“现代文明病”也因此发生,人们的健康受到了严重的威胁。为了调节人体生理活动、增强体质,防止疾病的发生,人们开始研究更具营养价值的食品——功能性食品。早在20世纪80年代,日本厚生劳动省出台的一项管理法规中就定义了功能性食品的概念 [1]。在我国,功能性食品也被称为保健食品 [2]。
目前,市场上大量的功能性食品不断涌现,从遗传学、分子生物学、生理学以及细胞学等不同角度对功能性食品和其功能因子的生物学研究在国外比较普遍。如日本的XYZ评价系统、DNA芯片分析技术和建立应用数据库 [3]。在我国,对功能性食品的生理作用评价主要是依靠动物学实验和人体试吃实验,但这些实验很难对功能性食品的作用机理进行科学的、令人信服的解释。寻找更好的、适用于人体的无损伤(或接近无损伤) 定量化评价方法已经成为解决这些难题的关键所在。
乳酸盐和乳酸这两个名词如今仍然被大多数人混淆,但二者实质上是不同的,在生理pH值的条 件下,机体代谢产生的乳酸几乎全部进一步解离成为乳酸盐和氢离子,以发挥生理作用 [4-5]。乳酸并不只是一种简单的厌氧发酵产物,也不是造成机体“酸中毒”的罪魁祸首。相反,乳酸作为一种调节分子,具有整合和调节多条生理代谢途径的作用 [6]。乳酸在信号调节方面的作用体现在调节中心代谢途径中酶的活性、调节炎症和抗炎性细胞因子 [7-8]等方面。尽管乳酸本身并没有氧化还原作用,但它作为一种重要的代谢中间产物参与了糖酵解、生物合成和生物氧化等过程。研究表明,新陈代谢中的乳酸盐代谢途径对于运动后机体的生理反应以及普遍疾病(如糖尿病和 癌症)的发病机制具有重要作用 [9-11]。肥胖和糖尿病与乳酸盐代谢通量的改变有密切关系 [12]。乳酸盐通量的调控作用是通过中心代谢途径中乳酸盐合成途径来实现的,维生素、微量元素,特别是许多微量元素实际上是酶的辅因子、辅酶、辅基等,这些微量元素都通过代谢网络的整体调控发挥作用;另外,蛋白质、脂肪以及各种功能性糖类的代谢都必须与中心代谢途径相结合发挥整体的代谢网络作用。在正常细胞中,乳酸盐通量可以作为衡量分解代谢的重要指标,即乳酸盐通量增加,分解代谢作用增强 [13]。生物体处于不同的生理状态下具有不同的体温水平,体温对生物体的代谢又具有全面和协调的作用。在不同的生理状态下,乳酸盐通量明显不同,受其代谢网络中多种酶的调控,因此有必要探讨哪些酶的合成量和活性对乳酸盐通量的调节起到了关键作用。
关于食物对人体代谢作用的机理,已经有学者进行了探讨和研究 [14-17],食物中的营养成分通过激活细胞内的信号级联反应来调节机体的生理代谢 [18]。但是通过代谢控制分析方法来研究食物对人体代谢的作用方面却鲜有报道。本实验从代谢角度出发,检测人外周血清中心代谢网络中15 种酶的基因表达(合成)量的变化,运用代谢通量及其控制分析方法来评价代谢网络中酶对乳酸盐代谢通量的控制作用。
近年来,抗性淀粉作为功能性食品或功能性成分添加到食品中,在控制血糖升高和缓解肥胖症方面起到了保健作用。由于抗性淀粉在小肠内不被吸收,因此不能为机体提供能源物质,抗性淀粉主要在大肠内菌群的作用下生成短链脂肪酸如乙酸、丁酸等,减缓结肠上皮萎缩或增加结肠中隐窝细胞的产率,提高结肠的健康程度,排除胆固醇酯,减少脂质的吸收和脂肪的合成 [19]。联合国粮食及农业组织的报告中将RS 3看成是膳食纤维的一部分,能够影响胰岛素水平和血糖生成指数 [20]。这是因为RS 3在结肠中难以消化,可被用作为缓释葡萄糖的载体,以控制体内葡萄糖的释放。目前,对于抗性淀粉的保健功能的评价,已有很多学者进行研究,如分别对仓鼠或大鼠进行动物实验 [21-24],但是对于功能性食品来说,最终的食用群体是人类,因此,研究抗性淀粉在人体内如何发挥保健作用,只需要采集志愿者少量外周血,便可从代谢角度对抗性淀粉的功能性进行评价。本实验选取变性淀粉中的RS 3抗性淀粉为实验对象,招募健康的青年志愿者,检测其食用变性淀粉前后外周血清中各项指标,建立代谢通量模型及控制分析方法,对变性淀粉的功能性进行评价。
1.1 材料与试剂
大米变性淀粉 实验室自制。
丙酮酸、乳酸脱氢酶、烯醇化酶、丙酮酸激酶、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide hydrogen,NADH)、磷酸烯醇丙酮酸、3-磷酸甘油酸、3-磷酸甘油醛、醛缩酶、6-磷酸果糖、1,6-二磷酸果糖、6-磷酸葡萄糖脱氢酶、磷酸丙糖异构酶、磷酸甘油酸激酶、腺苷三磷酸、腺苷二磷酸、腺苷一磷酸、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)、还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH) 美国Sigma公司;Tris、羟乙基哌嗪乙硫磺酸、乙二胺四乙酸 美国Amresco公司。
1.2 仪器与设备
3K15高速冷冻离心机 美国Sigma公司;HVE-50哈雅玛高压灭菌器 日本Hirayama Manufacturing公司;Fluoroskan Ascent FL荧光-化学发光检测仪 美国Thermo公司;PB-10 pH计 赛多利斯科学仪器(北京)有限公司;SBA-40C生物传感分析仪 山东省科学院生物研究所;VIS-7220可见光分光光度计 北京瑞利分析仪器公司;MINITEMP手掌型体温测量计 美国Raytek公司。
1.3 方法
1.3.1 不同生理状态下生理模型的建立
4 种生理状态分别是:基础代谢(睡眠)状态、学习状态、运动状态、发烧状态。招募健康的青年志愿者(共8 人,其中每种生理状态2 人,男女各半,女性志愿者未处于生理周期)。基础代谢(睡眠)状态模型的建立:安排志愿者入住校医院,室温适宜(20~25 ℃),第2天早晨将志愿者从睡眠中叫醒,不做任何活动,排除一切肌肉活动对测试的影响,每隔30 min测量一次体温,采集一次血样,共采集4 次;运动状态模型的建立:充分休息后,志愿者在跑步机上进行速率为8 km/h的被动运动,每隔30 min测量一次体温,采集一次血样,共采集4 次;学习状态模型的建立:充分休息后,志愿者按照要求的记忆任务,背诵一些资料,快速准确并默写出来,每隔30 min测量一次体温,采集一次血样,共采集4 次;发烧状态模型的建立:招募发烧病人作为志愿者,每隔30 min测量一次体温,采集一次血样,共采集4 次。
选取变性淀粉中的RS 3抗性淀粉为实验材料,招募健康的青年志愿者(共16 人,男女各半,女性志愿者均未处于生理周期)进行2 d的实验。所有志愿者第1天食用无偏性基础配餐作为空白对照,在食用后的2.5、3、3.5 h分别采集外周血;第2天在无偏性配餐的基础上食用变性淀粉40 g,采血方法同第1天。运用本实验建立的代谢通量模型及控制分析的方法,从代谢的角度对变性淀粉的功能性进行评价。
将采集到的血液样品,4 ℃、2 000 r/min离心10 min分离得到血清,将血清分装并用液氮速冻,置于-80 ℃保存待测。
1.3.2 人代谢通量图谱的建立

图1 细胞内中心代谢途径网络简化图
Fig.1 Central metabolic pathways for man
Glu. 葡萄糖;G6P. 6-磷酸-葡萄糖;Ru5P. 5-磷酸核酮糖;F6P. 6-磷酸果糖;GAP. 3-磷酸甘油醛;PEP. 磷酸烯醇式丙酮酸;PYR. 丙酮酸;Lac. 乳酸;AcCoA. 乙酰辅酶A。
如图1所示,根据生物化学 [25]和代谢网络的构建原则,构建出人代谢网络图谱。该代谢网络分布图呈现了中心代谢途径,将整个细胞代谢系统分为3 个子网络:糖酵解途径、三羧酸循环(tricarboxylic acid cycle,TCA)、磷酸戊糖途径。
1.3.3 代谢通量的计算
根据各节点处的代谢物的通量平衡关系,得到下式。
式中:G为m×n的化学计量系数矩阵;V为m维代谢反应速率向量;dx/dt包含3 层含义:一是由实验测得底物消耗或产物合成的速率;二是生物合成前体物质的合成速率;三是胞内中间物质,处于拟稳态,累积速率为0 [26]。
1.3.4 代谢物浓度及酶活性的测定
血清中葡萄糖、乳酸的含量,通过SBA-40C型生物传感分析仪测定。NADH、NADPH的含量以及代谢网络中的酶的合成量采用酶偶联法,参考Pierce [27]和Teusink [28]等的方法,通过荧光化学发光检测仪进行测定。测得葡萄糖、乳酸及NADH含量变化后对时间微分,计算得出代谢速率。
1.3.5 不同生理状态下体温的测定
采用手掌型体温测量计测量志愿者的体温。
2.1 不同生理状态下体温测定结果
温度的变化可以促进某些植物更好地生长,调节果实的代谢过程、品质及贮藏寿命;温度还会影响动物的新陈代谢活动、生殖能力等。不论是恒温动物还是变温动物,都有特定的调节体温方式。动物大多通过调节体温来适应环境的变化以求生存。机体处于不同的生理状态时,会自发地通过调节体温来调节机体内酶的合成量,进而调控自身代谢。如表1所示,人体处于不同的生理状态下,体温也会有所差异,与基础状态相比,学习、运动和发烧状态均导致体温升高,且呈递增趋势,说明机体进行体力和脑力活动引起体温升高,进而导致分解代谢增强。
表1 不同生理状态下的体温测量结果
Table 1 Temperatures measured under different physiological states
生理状态基础状态学习状态运动状态发烧状态体温/℃36.21±0.0536.62±0.0836.93±0.0738.09±0.05
2.2 乳酸盐代谢通量测定结果
测定4 种生理状态下采血样品的血清中葡萄糖、乳酸及NADH的含量,用时间进行微分得出代谢速率。根据1.3.3节所述方法,应用Excel程序,计算得出4 种生理状态下乳酸盐代谢通量。
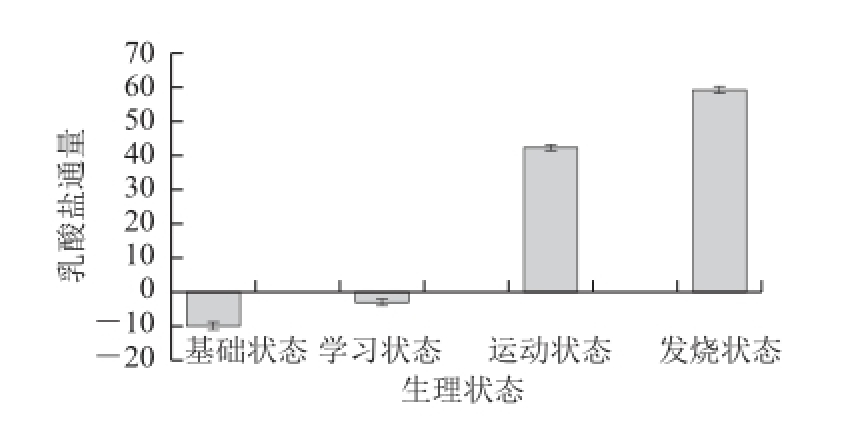
图2 不同生理状态的乳酸盐通量
Fig.2 Lactate fl ux under different physiological states
由图2可知, 不同生理状态下,乳酸盐通量具有不同水平,起到了不同的生理作用。基础状态、学习状态、运动状态和发烧状态的乳酸盐通量分别为-10.00±0.08、-3.07±0.14、42.11±0.04、58.97±0.12。说明4 种生理状态的乳酸盐通量依次增加,4 种生理状态下机体分解代谢依次增强。从基础状态到发烧状态,机体通过增强分解代谢以产生更多的能量供应来满足机体需要。氧气充足时,机体通过有氧呼吸进行氧化磷酸化来实现能量供应;当呼吸链和氧化磷酸化受限或处于低氧、缺氧等状态时,丙酮酸则在乳酸脱氢酶的催化下生成乳酸,乳酸在这种情况下充当还原力(NADH)库或起到载体的作用,通过体液循环系统运输到其他有氧的地方进行氧化分解或参与糖异生作用,以满足机体对于能量的需求。
2.3 15 种酶的合成量及其与乳酸盐代谢通量的相关性分析
对4 种生理状态下血清中15 种酶的合成量分别进行检测,结果如表2所示,并用SPSS 17.0软件对15 种酶合成量与乳酸盐代谢通量进行相关分析,结果如表3所示。由表3可知,4 种生理状态下的15 种酶与代谢通量之间存在着不同程度的相关性,15 种酶之间也存在着相关关系,每一种酶都影响着乳酸盐代谢通量,因为它们在乳酸的合成代谢途径中的作用存在着重叠性,这正是代谢网络的调控特点。由于各种酶与代谢通量的关系十分复杂,所以更加深入地分析酶对乳酸盐通量的控制作用,还需进一步研究。
表2 4种生理状态下的15 种酶的合成量
Table 2 Expression levels of enzymes measured under different physiological conditions mol/(min·mg pro)
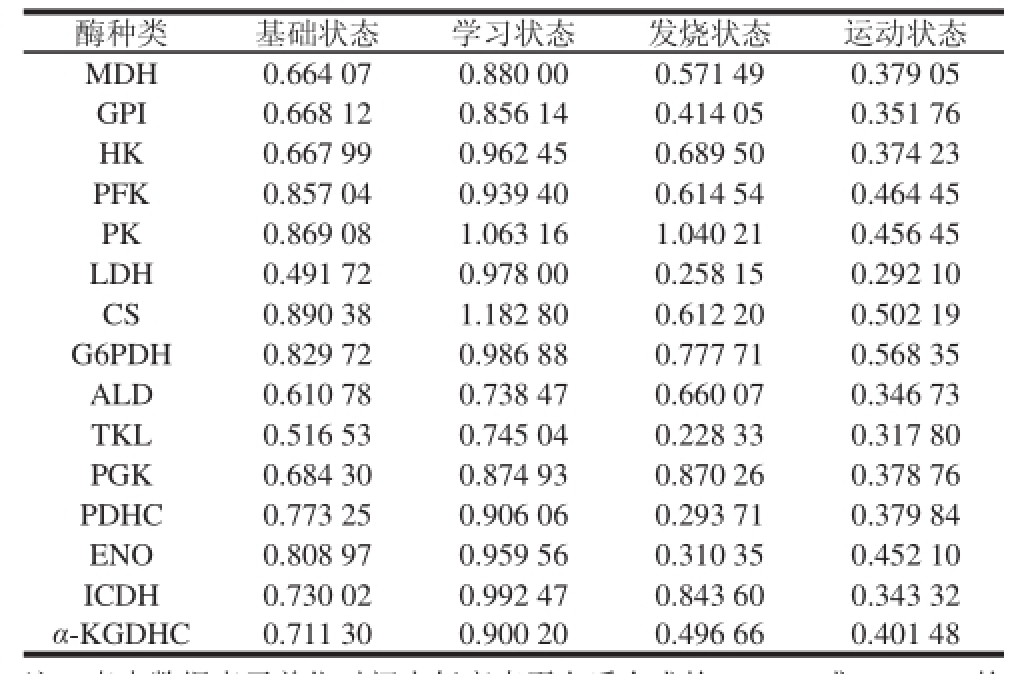
注:表中数据表示单位时间内每毫克蛋白质合成的NADH或NADPH的物质的量变化量。
酶种类基础状态学习状态发烧状态运动状态MDH0.664 070.880 000.571 490.379 05 GPI0.668 120.856 140.414 050.351 76 HK0.667 990.962 450.689 500.374 23 PFK0.857 040.939 400.614 540.464 45 PK0.869 081.063 161.040 210.456 45 LDH0.491 720.978 000.258 150.292 10 CS0.890 381.182 800.612 200.502 19 G6PDH0.829 720.986 880.777 710.568 35 ALD0.610 780.738 470.660 070.346 73 TKL0.516 530.745 040.228 330.317 80 PGK0.684 300.874 930.870 260.378 76 PDHC0.773 250.906 060.293 710.379 84 ENO0.808 970.959 560.310 350.452 10 ICDH0.730 020.992 470.843 600.343 32 α-KGDHC0.711 300.900 200.496 660.401 48
表3 各种酶合成量与乳酸盐通量之间的相关系数
Table 3 Person correlation coeffi cients between enzymes and lactate Table 3 Person correlation coeffi cients between enzymes and lactate metabolic fl ux l ux

注:MDH. 苹果酸脱氢酶(malate dehydrogenase);GPI. 磷酸己糖异构酶(glucose phosphate isomerase);HK.己糖激酶(hexokinase);PFK. 磷酸果糖激酶(phosphofructokinase);PK.丙酮酸激酶(pyruvate kinase);LDH. 乳酸脱氢酶(lactate dehydrogenase);CS. 柠檬酸合酶(citrate synthase);G6PDH. 6-磷酸葡萄糖脱氢酶(6-phosphogluconate dehydrogenase);ALD. 醛缩酶(aldolase);TKL. 转酮酶(transketolase);PGK. 磷酸甘油酸激酶(phosphoglyceratekinase);PDHC. 丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex);ENO. 烯醇化酶(enolase);ICDH. 异柠檬酸脱氢酶(isocitrate dehydrogenase);α-KGDHC. α-酮戊二酸脱氢酶系复合物(α-ketoglutarate dehydrogenase complex);J.乳酸盐代谢通量;*. 0.05水平显著相关;**. 0.01水平极显著相关。下同。
酶种类MDHGPIHKPFKPKLDHCSG6PDHALDTKLPGKPDHCENOICDHα-KGDHCJ MDH1.000 0******* GPI0.952 91.000 0******** HK0.974 40.861 21.000 0*** PFK0.951 20.970 00.871 91.000 0 * PK0.808 50.605 20.900 10.705 41.000 0**** LDH0.896 50.942 80.821 40.838 40.491 61.000 0* CS0.969 40.996 80.892 90.962 10.642 20.954 91.000 0*** G6PDH0.991 10.913 20.98530.940 40.876 20.830 30.932 11.000 0 ALD0.893 50.728 90.952 80.809 70.986 10.617 80.759 80.943 71.000 0*** TKL0.852 90.960 30.730 30.870 40.382 40.969 70.952 80.779 20.528 51.000 0** PGK0.782 80.564 00.889 30.656 70.996 60.471 20.60660.851 60.974 30.344 31.000 0* PDHC0.836 30.962 70.692 20.919 80.388 10.895 00.940 50.776 30.535 00.971 10.334 21.000 0**** ENO0.804 50.946 80.652 70.887 40.32480.897 90.923 50.735 50.477 10.977 00.272 10.997 01.000 0* ICDH0.899 60.729 30.965 80.793 10.982 30.645 70.765 30.944 60.996 40.540 70.975 90.526 90.472 31.000 0 α-KGDHC 0.971 30.997 60.893 50.975 70.657 90.937 20.998 50.939 00.773 70.942 40.619 40.942 50.922 40.774 71.000 0 J-0.830 6-0.955 1-0.684 6-0.934 5-0.408 8-0.855 9-0.928 7-0.779 5-0.551 6-0.944 6-0.350 0-0.995 4-0.987 1-0.535 6-0.936 1 1.000 0
2.4 基于主成分分析的代谢控制分析
表4 主成分载荷矩阵
Table 4 Principal component matrix

酶种类主成分1主成分2 MDH0.958 60.253 3 GPI0.967 9-0.102 7 HK0.782 20.620 8 PFK0.901 6-0.319 2 PK0.979 9-0.197 6 LDH0.985 60.168 2 CS0.874 30.482 1 G6PDH0.873 5-0.475 7 ALD0.751 70.659 4 TKL0.867 2-0.479 0 PGK0.836 6-0.539 1 PDHC0.877 00.479 8 ENO0.983 2-0.181 0 ICDH0.968 3-0.247 8 α-KGDHC0.997 90.048 6
如表4所示,通过主成分分析,得到方差分解主成分提取分析表,前2 个主成分解释了全部方差的98.632%。说明这些数据代表15 种酶对乳酸盐代谢通量的调节作用,没有明显的信息损失。因此提2 个主成分,主成分1的贡献率达到了82.835%,主成分2的贡献率为15.797%。其中主成分1主要反映了丙酮酸激酶(PK)、乳酸脱氢酶(LDH)、磷酸己糖异构酶(GPI)、烯醇化酶(ENO)、α-酮戊二酸脱氢酶复合物(α-KGDHC)对乳酸盐通量的控制作用,这几种酶主要集中在代谢网络中的重要节点——丙酮酸(pyruvic acid,PYR)节点处,糖酵解过程中,PK催化磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)生成丙酮酸,丙酮酸再由LDH催化,生成乳酸,因此该节点处的流量分配直接影响乳酸盐通量。主成分2主要反映了己糖激酶(HK)、醛缩酶(ALD)、磷酸甘油酸激酶(PGK)对乳酸盐通量的控制作用,这几种酶多为糖酵解途径中的酶,间接影响乳酸盐通量。
用表4中的数据计算2 个主成分中每个指标所对应的系数,再以每个主成分所对应的特征值占所提取主成分总的特征值之和的比例作为权重计算综合主成分中每个 指标所对应的系数。这组系数综合反应每种酶对代谢通量的控制作用的大小,将归一化后的数值记为C p。由表5可知,丙酮酸激酶(PK,C pPK=0.221 6),乳酸脱氢酶(LDH,C pLDH=0.162 6),转酮酶(TKL,C pTKL=0.206 0),丙酮酸脱氢酶复合物(PDHC,C pPDHC=0.206 4)对乳酸盐代谢通量起到了主要控制作用,其中,丙酮酸激酶(PK)的控制作用最强;而磷酸甘油酸激酶(PGK,C pPGK=-0.134 1)和磷酸己糖异构酶(GPI,C pGPI=0.146 9)对乳酸盐代谢通量也具有重要的控制作用。已有研究表明,基于相关分析和主成分分析所建立的代谢控制系数与基于通径分析所建立的代谢控制系数具有较高的一致性 [29]。
表5 主成分表达式矩阵系数和基于主成分分析的控制系数
Table 5 Principal component expression coeffi cient matrix and control coeffi cients based on principal component analysis

酶种类主成分表达式矩阵系数主成分综合表达系数控制系数C pAP1AP2 HK0.271 90.164 60.000 40.000 2 PFK0.274 6-0.066 70.263 00.104 6 PK0.237 3-0.350 20.557 30.221 6 LDH0.255 8-0.207 40.408 80.162 6 CS0.278 0-0.128 40.334 90.133 2 G6PDH0.279 60.109 30.068 00.027 0 ALD0.248 00.313 2-0.183 6-0.073 0 TKL0.247 8-0.309 00.518 00.206 0 PGK0.213 30.428 4-0.337 3-0.134 1 PDHC0.246 0-0.311 20.519 20.206 4 ENO0.221 90.403 3-0.303 1-0.120 5 ICDH0.248 80.311 7-0.181 4-0.072 1 α-KGDHC0.278 9-0.117 60.323 30.128 6 GPI0.274 7-0.161 00.369 40.146 9 MDH0.283 10.031 60.158 00.062 8
2.5 变性淀粉对于代谢控制的功能性评价
将所测葡萄糖、乳酸、NADH的含量以及中心代谢途径中的主要酶的表达量运用上述方法进行分析,结果从两个方面进行评价。一是乳酸盐通量的变化:与空白对照相比,食用变性淀粉后,乳酸盐通量从-238.84增加到37.00,说明食用变性淀粉后体内的分解代谢增强而合成代谢减弱;二是中心代谢途径中酶的基因表达量的变化:食用变性淀粉后,3-磷酸甘油醛脱氢酶(glyceraldehyde-3-pho-sphate dehydrogenase,GAPDH)和丙酮酸脱氢酶复合物(PDHC)基因表达量显著降低,6-磷酸葡萄糖脱氢酶(G6PDH)、丙酮酸激酶(PK)的基因表达量则显著升高。
对乳酸盐通量起主要控制作用的丙酮酸激酶(PK,C pPK=0.221 6),丙酮酸脱氢酶复合物(PDHC,C pPDHC=0.206 4),乳酸脱氢酶(LDH,C pLDH= 0.162 6)和转酮酶(TKL,C pTKL=0.206 0),都是丙酮酸节点处的相关酶,它们的变化会改变乳酸盐通量。在对变性淀粉功能性评价的实验中,丙酮酸激酶(PK)的基因表达(合成)量显著增加(P=0.01<0.05),表明糖酵解途径中由磷酸烯醇式丙酮酸生成丙酮酸的反应增强,而丙酮酸脱氢酶复合物(PDHC)的基因表达(合成)量极显著降低(P=0.003<0.01)表明由丙酮酸生成乙酰辅酶A的反应反而减弱,这也解释了乳酸盐通量增强的原因。这些变化共同说明了所测酶的表达量与所预测的乳酸盐通量之间的拟合程度较好。
为了能够实现食品对机体代谢作用的定量化评价,本实验通过对志愿者外周血采样,首先研究了基础状态、学习状态、运动状态和发烧状态下,乳酸盐代谢通量的变化,同时研究了中心代谢途径中的15 种酶对乳酸盐代谢通量的控制作用。结果表明,基础状态、学习状态、运动状态和发烧状态下的乳酸盐代谢通量各不相同,乳酸盐代谢通量由小到大依次为:基础状态、学习状态、运动状态和发烧状态,4 种生理状态下机体内的分解代谢依次增强。为防止多维变量之间相互作用所造成的影响,继续运用相关分析和主成分分析相结合的方法,提取2 个主成分,计算出各种酶对乳酸盐代谢通量的控制系数分别为:丙酮酸激酶(PK,C pPK=0.221 6),乳酸脱氢酶(LDH,C pLDH=0.162 6),转酮酶(TKL,C pTKL=0.206 0),丙酮酸脱氢酶复合物(PDHC,C pPDHC=0.206 4),其中,PK的控制作用最强;而磷酸甘油酸激酶(PGK,C pPGK=-0.134 1)和磷酸己糖异构酶(GPI,C pGPI=0.146 9)对乳酸盐代谢通量也具有较大的控制作用,由此确定了对乳酸盐代谢通量起主要调控作用的几种关键酶,这几种酶基因表达量的变化即反映了分解代谢强度的变化。
志愿者食用大米抗性淀粉前后的检测结果表明:食用抗性淀粉后,乳酸盐通量增强,分解代谢增强,合成代谢减弱。PK的基因表达(合成)量显著增加(P=0.01<0.05),表明糖酵解途径中由 磷酸烯醇式丙酮酸生成丙酮酸的反应增强,而PDHC的基因表达(合成)量极显著降低(P=0.003<0.01)则表明由丙酮酸生成乙酰辅酶A的反应反而减弱,比较完美地解释了乳酸盐通量增强的原因。这些变化也共同说明了所测酶的表达量的变化与所预测的乳酸盐通量的变化之间具有较好的相关性,能够较好地定量化评价食品对机体代谢作用。
乳酸盐通量定量化地反映了机体内分解供能(氧化磷酸化)的强度,利用乳酸盐代谢通量分析和控制分析的方法,通过采集少量外周血检测相关指标,计算出乳酸盐通量的变化和中心代谢途径中起主要控制作用的酶的表达量,若乳酸盐代谢通量增加,说明该食品对于分解代谢发挥促进作用,反之亦然。这种方法的建立,可用于定量化评价功能性食品对机体的代谢作用,对于科学膳食、控制体质量和个性化营养与健康的保持具有重要的指导意义。
参考文献:
[1] VERSCHUREN P M. Functional foods: scientific and global perspectives[J]. British Journal of Nutrition, 2002, 88(Suppl 2): 126-130.
[2] 叶永茂. 中国食品保健品及其安全问题[J]. 上海医药情报研究, 2005(1): 43-49.
[3] 黄丽芸, 刘垚, 杨景峰. 功能性食品科技创新体系现状及对策[J]. 广东农业科学, 2009(3): 168-171.
[4] PHILP A, MACDONALD A L, WATT P W. Lactate: a signal coordinating cell and systemic function[J]. The Journal of Experimental Biology, 2005, 208(24): 4561-4575.
[5] CASTAGNETTI C, PIRRONE A, MARIELLA J, et al. Venous blood lactate evaluation in equine neonatal intensive care[J]. Theriogenology, 2010, 73(3): 343-357.
[6] BROOKS G A. Lactate shuttles in nature[J]. Biochemical Society Transactions, 2002, 30(2): 258-264.
[7] LEITE T C, COELHO R G, SILVA D D, et al. Lactate downregulates the glycolytic enzymes hexokinase and phosphofructokinase in diverse tissues from mice[J]. FEBS Letters, 2011, 585(1): 92-98.
[8] TRABOLD O, WAGNER S, WICKE C, et al. Lactate and oxygen constitute a fundamental regulatory mechanism in wound healing[J]. Wound Repair and Regeneration, 2003, 11(6): 504-509.
[9] LAZZERI C, VALENTE S, CHIOSTRI M, et al. Correlates of acute insulin resistance in the early phase of non-diabetic ST-elevation myocardial infarction[J]. Diabetes and Vascular Disease Research, 2011, 8(1): 35-42.
[10] BIER D M, GERICH J E. Contribution of liver and skeletal muscle to alanine and lactate metabolism in humans[J]. American Journal of Physiology, 1990, 259: E677-E684.
[11] GOODWIN M L, HARRIS J E, HERNÁNDEZ A, et al. Blood lactate measurements and analysis during exercise: a guide for clinicians[J]. Journal of Diabetes Science and Technology, 2007, 1(4): 558-569.
[12] ADEVA-ANDANY M, LÓPEZ-OJÉN M, FUNCASTA-CALDERÓN R, et al. Comprehensive review on lactate metabolism in human health[J]. Mitochondrion, 2014, 17: 76-100.
[13] 庞广昌, 陈庆森, 胡志和. 乳酸盐代谢及其在健康中的关键作用[J].食品科学, 2012, 33(1): 1-15.
[14] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅰ)[J]. 食品科学, 2006, 27(5): 258-264.
[15] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅱ)[J]. 食品科学, 2006, 27(6): 260-270.
[16] 于立芹, 庞广昌, 李珍珍. 普洱茶对主要发炎和抗炎细胞因子的影响[J]. 食品科学, 2008, 29(7): 428-431.
[17] 肖笑洁, 庞广昌. 应该把细胞因子纳入功能性食品评价新标准[J].食品科学, 2012, 33(19): 331-337.
[18] RYAN K K, SEELEY R J. Food as a hormone[J]. Science, 2013, 339: 918-919.
[19] 陈光, 高俊鹏, 王刚, 等. 抗性淀粉的功能特性及应用研究现状[J].吉林农业大学学报, 2006, 27(5): 578-581.
[20] 蹇华丽, 高群玉, 梁世中. 抗性淀粉结晶性质的研究[J]. 食品科学, 2003, 24(7): 44-47.
[21] MITRA A, BHATTACHARYA D, ROY S. Role of resistant starches particularly rice containing resistant starches in type 2 diabetes[J]. Journal of Human Ecology, 2007, 21(1): 47-51.
[22] SHIH C K, CHEN Shihong, HOU Wenchi, et al. A high-resistancestarch rice diet reduces glycosylated hemoglobin levels and improves the antioxidant status in diabetic rats[J]. Food Research International, 2007, 40(7): 842-847.
[23] BRITES C M, TRIGO M J, CARRAPIÇO B, et al. Maize and resistant starch enriched breads reduce postprandial glycemic responses in rats[J]. Nutrition Research, 2011, 31(4): 302-308.
[24] RANHOTRA G S, GELROTH J A, GLASER B K. Effect of resistant starch on blood and liver lipids in hamsters[J]. Cereal Chemistry, 1996, 73(2): 176-178.
[25] 沈同, 王镜岩. 生物化学[M]. 北京: 高等教育出版社, 2002: 63-175.
[26] 白冬梅, 付卫明, 赵学明, 等. 代谢通量分析优化米根霉R1021发酵生产L(+)-乳酸过程[J]. 无锡轻工大学学报, 2002, 21(6): 554-558.
[27] PIERCE V A, CRAWFORD D L. Phylogenetic analysis of glycolytic enzyme expression[J]. Science, 1997, 276: 256-259.
[28] TEUSINK B, PASSARGE J, REIJENGA C A, et al. Can yeast glycolysis be understood in terms of in vitro kinetics of the constituent enzymes? Testing biochemistry[J]. European Journal of Biochemistry, 2000, 267(17): 5313-5329.
[29] 王芳, 庞广昌, 王景川. 螺旋藻β-胡萝卜素代谢控制分析及其新方法的研究[J]. 食品科学, 2011, 32(7): 237-243.
Lactate Metabolic Flux Analysis and Metabolic Control Analysis: Quantitative Evaluation Method of Functional Foods
LI Yang, WANG Xingya, WANG Xixi, PANG Guangchang*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:The effects of food on the body are mediated mainly through its influence on the metabolic and metabolic networks after being ingested and absorbed. This study aimed to develop a new experimental method to quantitatively evaluate the effects of food on metabolic and metabolic networks. Peripheral blood samples were collected from volunteers with four kinds of physiological states including basic state (or sleeping state), learning state, motion state and fever state, and their changes in lactate metabolic fl ux were studied as well as the role of 15 enzymes involved in the central metabolic pathways in controlling lactate metabolic fl ux. The results indicated that lactate metabolic fl ux in the four states were quite different, following the increasing order: basic, learning, motion and fever, which was consistent with that observed for the catabolism. A combination of correlation analysis and principal component analysis was used to determine the control coeffi cient of lactate metabolic fl ux. The results showed that pyruvate kinase (PK, C pPK= 0.221 6), pyruvate dehydrogenase complex (PDHC, C pPDHC= 0.206 4), lactate dehydrogenase (LDH, C pLDH= 0.162 6), transketolase (TKL, C pTKL= 0.206 0) played major roles in controlling lactate metabolic flux, among which, PK played the most important role. Peripheral blood samples collected from healthy volunteers before and after eating modified rice starch were then analyzed by applying the experimental methods mentioned above and the results indicated that lactate flux was obviously enhanced after eating modifi ed starch as compared with that before eating and as the same effect was observed on the catabolism.On the contrary, the anabolism decreased. PK gene expression was signifi cantly increased (P = 0.01) whereas PDHC gene expression (synthetic) was signifi cantly reduced (P = 0.003). The present study showed that the gene expression profi les of enzymes were fi tted with the predicted lactate fl ux well. These results have demonstrated that this method could be used to quantitatively evaluate the effects of food on metabolism by collecting appropriate peripheral blood samples after eating it.
Key words:functional foods; evaluation methodology; physiological states; lactate metabolic fl ux; metabolic control analysis
中图分类号:TS207.7
文献标志码:A
文章编号:1002-6630(2015)01-0185-06
doi:10.7506/spkx1002-6630-201501035
收稿日期:2014-06-30
基金项目:国家自然科学基金面上项目(31371773);“十二五”国家科技支撑计划项目(2012BAD29B07)
作者简介:李阳(1988—),女,硕士研究生,研究方向为代谢工程。E-mail:liyang1980ss@126.com
*通信作者:庞广昌(1956—),男,教授,博士,研究方向为食品免疫与生物传感器。E-mail:pgc@tjcu.edu.cn