任 婧 1,2,邓秀娟 1,2,王燕燕 1,2,张莉珂 1,2,牙甫礼 1,2,卢敏琪 1,张 擎 3,杨 燕 1,2,*
(1.中山大学公共卫生学院,广东 广州 510080;2.广东省营养膳食与健康重点实验室,广东 广州 510080;3.中山大学生命科学学院,广东 广州 510275)
摘 要:目的:研究植物花色苷单体矢车菊素-3-葡萄糖苷(cyanidin-3-O-β-glucoside,Cy-3-g)对人巨核细胞株Dami的增殖、分化作用。方法:不同浓度的花色苷Cy-3-g(0.05、0.50、5.00、50.00、100.00 μmol/L)与人巨核细胞株Dami细胞共同培养,并将用完全培养基培养的细胞设为对照组。培养结束后,用台盼蓝染色法检测巨核细胞活性、噻唑蓝(methyl thiazo lyl tetrazolium,MTT)染色法检测细胞增殖能力,软琼脂细胞集落培养法观察巨核细胞集落生成情况。采用Giemsa染色法观察细胞形态、流式细胞术检测巨核细胞DNA多倍体的生成及细胞表面CD41阳性表达率。结果:与对照组相比,50.00、100.00 μmol/L的Cy-3-g可增强Dami细胞活性,差异具有统计学意义(P<0.05);各Cy-3-g剂量组与对照组相比,均可明显增强Dami细胞增殖能力(P<0.01);Dami细胞集落数目、DNA多倍体数目以及CD41的阳性表达率在50.00、100.00 μmol/L Cy-3-g作用下明显升高,且与对照组相比均具有统计学差异(P<0.01)。结论:Cy-3-g能够明显促进人巨核细胞株Dami的增殖、分化,这可以为花色苷促进血小板生成提供可能的理论依据。
关键词:矢车菊素-3-葡萄糖苷;巨核细胞;增殖;分化
心血管疾病(cardiovascular diseases,CVDs)严重威胁着人类健康与生命,动脉粥样硬化(atherosclerosis,AS)作为心血管疾病中一种常见的血管病变已成为CVD疾病死亡的主要原因。有研究发现,血小板参与AS的发生、发展和斑块形成等过程,尤其在动脉粥样硬化灶破损后,会引发大量的血小板黏附与聚集,进而导致血管闭塞和血栓性疾病,如心肌梗塞和脑梗塞,已经成为人类健康的第一杀手 [1]。因此,对血小板黏附与聚集的深入研究不仅有利于出血性疾病的诊断治疗,对血栓性疾病的诊治也起着重要的促进作用。大量研究表明,植物性食物具有广泛的促进健康和预防心血管疾病的作用 [2]。花色苷是植物化学物中一类重要的黄酮类化合物,常以糖苷的形式存在,是自然界中广泛存在于植物中的水溶性天然色素。花色苷不同程度地存在于大部分植物花瓣和果实种皮中,其中以深色浆果如葡萄、越橘、蓝莓、桑葚,有色薯类如紫番薯,谷物如高梁、紫玉米和黑米中含量尤为丰富 [3]。
近年来大量的研究以及本课题组的研究结果均发现膳食花色苷的摄入可以抑制AS发展以及抑制血小板的激活和血栓形成 [4-6]。近期本课题组的研究结果还发现,花色苷单体可以促进活化血小板凋亡,且其能够通过调控Bcl-2家族中凋亡/抗凋亡蛋白水平来促进活化血小板凋亡 [7-8]。血小板凋亡后必然会引起血小板数目的减少,继而延长机体凝血时间。但是前期的研究结果显示,花色苷并未引起小鼠出血时间的延长 [6]。而血小板主要来源于巨核细胞,那么花色苷是否可以通过促进机体巨核细胞增殖分化而增加血小板生成来维持血小板数目稳定呢?因此,本实验拟通过体外研究花色苷单体矢车菊素-3-葡萄糖苷(cyanidin-3-O-β-glucoside,Cy-3-g)对人巨核细胞株Dami的增殖分化作用,从而为花色苷调控巨核细胞的功能以及血小板的生成提供一定的理论依据。
1.1 材料与试剂
Dami细胞由中山大学生命科学学院张擎教授实验室惠赠。
Cy-3-g(纯度为99.9%) 挪威Polyphenol AS公司;RPMI-1640培养基、胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;双抗(青霉素、链霉素)美国Thermo公司;台盼蓝 加拿大BioBasic有限责任公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT) 广州艾斯金生物科技有限公司;β-巯基乙醇 美国Amresco公司;姬姆萨(Giemsa)色素 国药集团化学试剂有限公司;琼脂粉 日本广野公司;人血小板生成素(human thrombopoietin,TPO) 美国PeproTech公司;CD41-FITC 美国BioLegend公司;碘化丙啶(propidium iodide,PI)染料、RNA酶 美国Sigma公司。
1.2 仪器与设备
酶标仪 瑞士Tecan公司;倒置荧光显微镜 日本Nikon公司;FACS Calibar流式细胞仪(配有Cell Quest软件) 美国BD公司。
1.3 方法
1.3.1 细胞培养及分组
RPMI-1640培养基中添加体积分数10%胎牛血清和1%双抗配成完全培养基,于37 ℃、5% CO 2、95%相对湿度条件下培养人巨核细胞株Dami,取对数生长期的细胞用于实验。Cy-3-g粉末溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)中,使储备液浓度为100 mmol/L,取100 μL分装后存放于-80 ℃冰箱中,使用时用完全培养基稀释至所需浓度。细胞分组:按Cy-3-g浓度分为0.05、0.50、5.00、50.00、100.00 μmol/L 5 组与Dami细胞共同培养,将完全培养基培养的细胞设为对照组。
1.3.2 台盼蓝染色实验检测细胞活性
将按照1.3.1节方法常规培养2 d的各组细胞悬液与质量分数0.4%的台盼蓝染液按体积比9∶1混合后,滴入计数板。静置 1 min,使悬浮细胞下沉,在显微镜下计数。未着色的为活细胞,呈蓝色的为死细胞。按照下式计算活细胞比例。
1.3.3 MTT细胞增殖实验
细胞达到对数生长期后按5×10 4个/mL的密度接种于96 孔板中,每孔体积200 μL,每组设6个复孔。放入培养箱中常规培养48 h后离心,弃去上清液,每孔加入20 μL质量分数0.5% MTT溶液,继续培养4 h后弃去上清液,每孔加入150 μL DMSO,在微量振荡仪上振荡5 min,于酶标仪上570 nm波长处测定吸光度。
1.3.4 细胞集落培养实验
取无菌离心管5 支,按体积分数依次加入60% RPMI-1640培养基、10% β-巯基乙醇(10 mmol/L)、10% FBS、10%各组细胞悬液(调整细胞密度为10 4个/mL)、50 ng/mL TPO,混匀后在37 ℃条件下预热。取预热的琼脂迅速按10%体积分数加入到各组细胞悬液中,混匀后接种于3.5 cm培养皿上。数十分钟后待其凝固,放入培养箱中常规培养 [9]。5 d后取出,在显微镜下观察细胞集落生长情况(细胞集落生成越多、越大,表明细胞增殖能力越强),每个培养皿底以“米”字等分为8 份,每份中选取两个视野,记录每组集落数目之和,大于或等于10 个细胞记为一个集落。
1.3.5 细胞Giemsa染色实验
细胞常规培养2 d后取各组细胞涂于载玻片上。待自然晾干后,于甲醇中固定5 min,然后在Giemsa染色液中浸染20 min,流水冲洗后晾干,中性树胶封固并在显微镜下观察,选取每张载玻片的4 个顶角及载玻片中间共5 个视野拍照。
1.3.6 流式细胞仪定量检测细胞DNA多倍体
收集常规培养2 d的各组细胞于洁净的EP管中,调整细胞密度为1×10 6个/mL。细胞固定15 min后用体积分数70%乙醇通透细胞1 h,洗涤细胞两次,取100 μL细胞悬液于流式细胞上样管中,加入RNA酶,37 ℃条件下孵育20 min,再加入PI染料(对照组不加),避光作用20 min后每管加入磷酸盐缓冲液(phosphate buffered saline,PBS)至500 μL,用流式细胞仪检测细胞DNA浓度分析其多倍体生成情况 [10]。
1.3.7 流式细胞术测定细胞表面CD41含量
流式细胞术细胞样本收集同1.3.6节,细胞洗涤两次后取100 μL细胞悬液于流式细胞上样管中,分别加入流式抗体CD41-FITC,每组设两个平行样并设IgG同型对照组。细胞与抗体避光孵育15 min后,每管加入400 μL PBS,在流式细胞仪上检测其表达情况。
1.4 数据分析
每项实验至少重复3 次,数值采用SPSS 16.0软件包进行统计分析,结果以
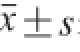 表示。多组均数的比较采用单因素方差分析(One-Way ANOVA),两组间的比较采用t检验分析。采用Graphpad Prism 5软件制作统计图。
表示。多组均数的比较采用单因素方差分析(One-Way ANOVA),两组间的比较采用t检验分析。采用Graphpad Prism 5软件制作统计图。
2.1 Cy-3-g对人巨核细胞株Dami活性的影响

图1 Cy-3-g对人巨核细胞株Dami细胞活性的影响
Fig. 1 Effect of Cy-3-g on viability of megakaryocytic cells
*. 与对照组比较,差异显著(P<0.05)。下同。
各组细胞在培养箱中培养2 d后,计算其活细胞比例。由图1可知,50.00、100.00 μmol/L花色苷Cy-3-g与细胞共同培养后,活细胞比例达到98.07%和99.25%,与对照组(88.10%)相比,细胞活性明显升高(P<0.05),但0.05、0.50、5.00 μmol/L花色苷Cy-3-g对细胞活性的影响与对照组相比没有统计学差异。
2.2 Cy-3-g对人巨核细胞株增殖能力的影响
MTT法检测Cy-3-g对Dami细胞增殖能力的影响,如图2所示,各浓度Cy-3-g均可明显增强Dami细胞的增殖能力,且与对照组相比,具有统计学差异(P<0.01)。

图2 MTT法检测Cy-3-g对Dami细胞的增殖作用
Fig.2 Proliferation effect of Cy-3-g on Dami cells tested by MTT
**. 与对照组比较,差异极显著(P<0.01)。下同。
2.3 Cy-3-g对Dami巨核细胞集落生成的影响
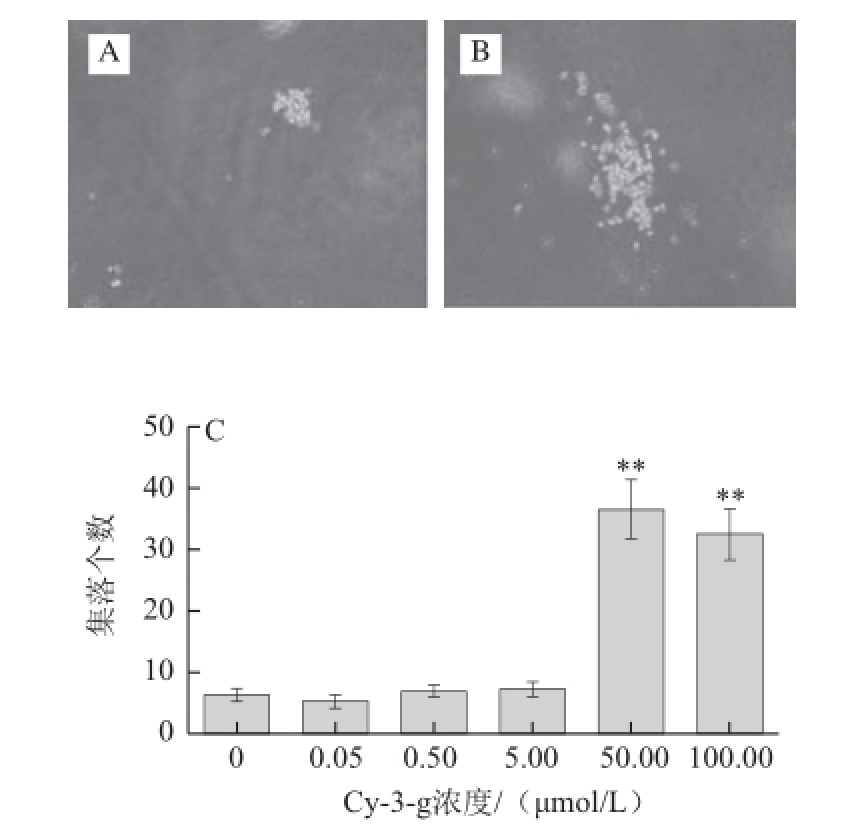
图3 Cy-3-g对Dami巨核细胞集落生成的影响
Fig.3 Effect of Cy-3-g on colony formation of Dami cells
A. 对照组细胞集落(×200);B. 50.00 μmol/L Cy-3-g组细胞集落(×200);C. 显微镜下计数各组细胞集落数目统计图。
Dami巨核细胞集落培养结果如图3所示,与对照组相比,50.00、100.00 μmol/L Cy-3-g共同培养的细胞集落生成数目≥30 个(图3B),明显高于对照组≤10 个(图3A)(其他剂量组图片未列出),且差异具有统计学意义(P<0.01),但0.05、0.50、5.00 μmol/L Cy-3-g剂量组的细胞集落生成数目与对照组相比没有统计学差异(图3C)。
2.4 Cy-3-g对Dami细胞DNA多倍体生成的影响

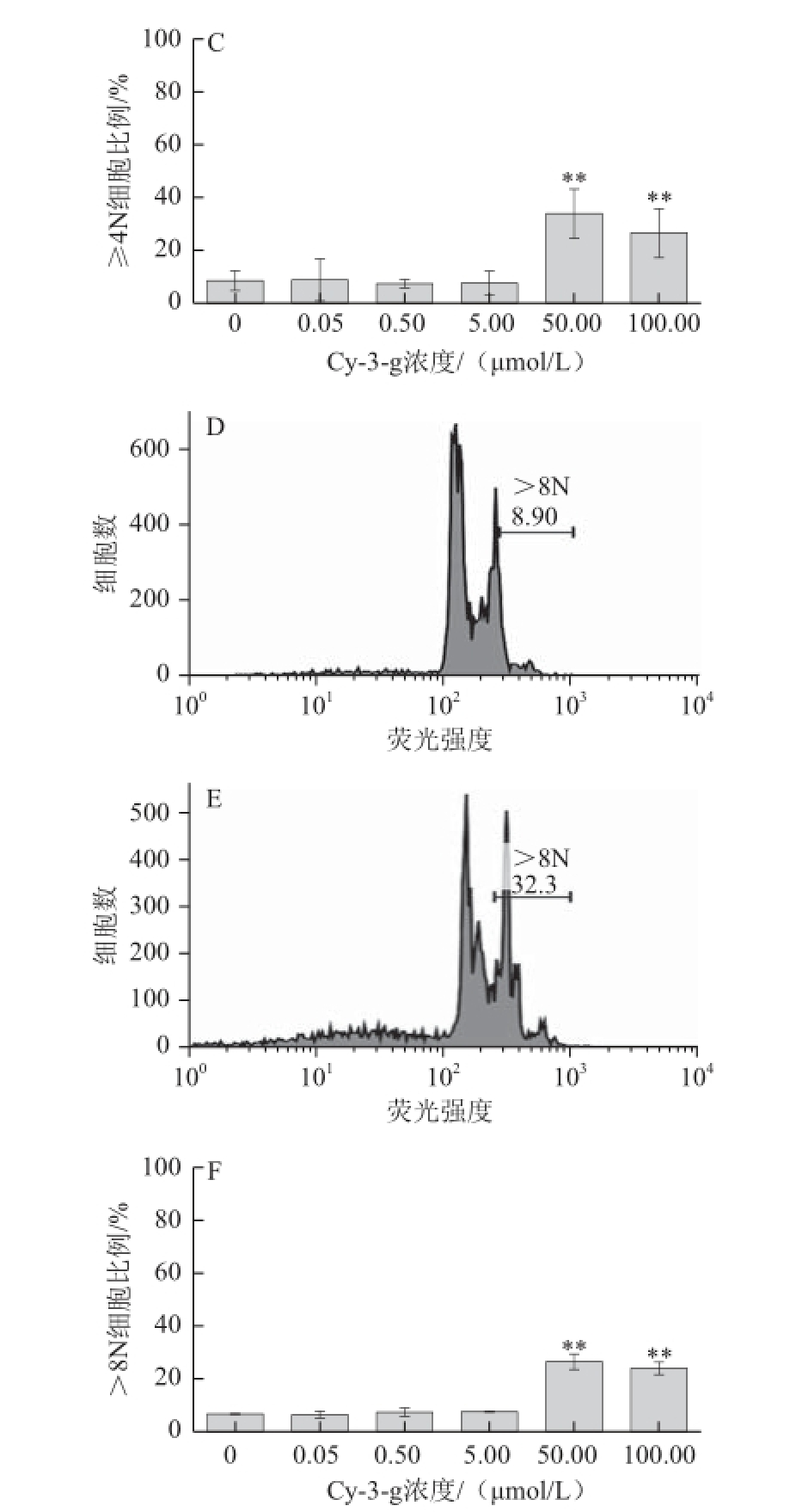
图4 Cy-3-g对Dami巨核细胞多倍体的影响
Fig.4 Effect of Cy-3-g on cell polyploidy of Dami cells
A. 对照组细胞Giemsa染色照片(×200);B. 50.00 μmol/L花色苷Cy-3-g共同培养组细胞Giemsa染色照片(×200),箭头所指为多核细胞;C. 各组细胞Giemsa染色后计数≥4N细胞比例的统计图;D. 对照组流式细胞仪检测细胞多倍体数目,>8N的细胞比例(8.90%);E. 50.00 μmol/L花色苷Cy-3-g共同培养组流式细胞仪检测多倍体数目,>8N的细胞比例(32.30%);F. 各组细胞多倍体检测>8N细胞比例的统计图。
如图4所示,对照组与0.05、0.50、5.00 μmol/L剂量花色苷共同孵育的细胞倍体多为2N,仅有少量呈多倍性(图4A,0.05、0.50、5.00 μmol/L剂量组图片未列出),计数后发现≥4N的细胞占细胞总数的8.38%,而50.00、100.00 μmol/L Cy-3-g与细胞共同培养后与对照相比,多核细胞明显增多(图4B)(P<0.01),分别约占细胞总数的33.88%和26.44%(图4C)。流式细胞仪检测细胞DNA多倍体数目结果显示,与对照组(8.90%)(图4D)相比,50.00 μmol/L Cy-3-g与细胞共同培养后>8N细胞比例(32.30%)(图4E)明显增加(P<0.01)。但0.05、 0.50、5.00 μmol/L剂量的花色苷对巨核细胞多倍体的影响与对照组相比没有统计学差异(图4F)。
2.5 Cy-3-g对Dami巨核细胞表面CD41表达量的影响
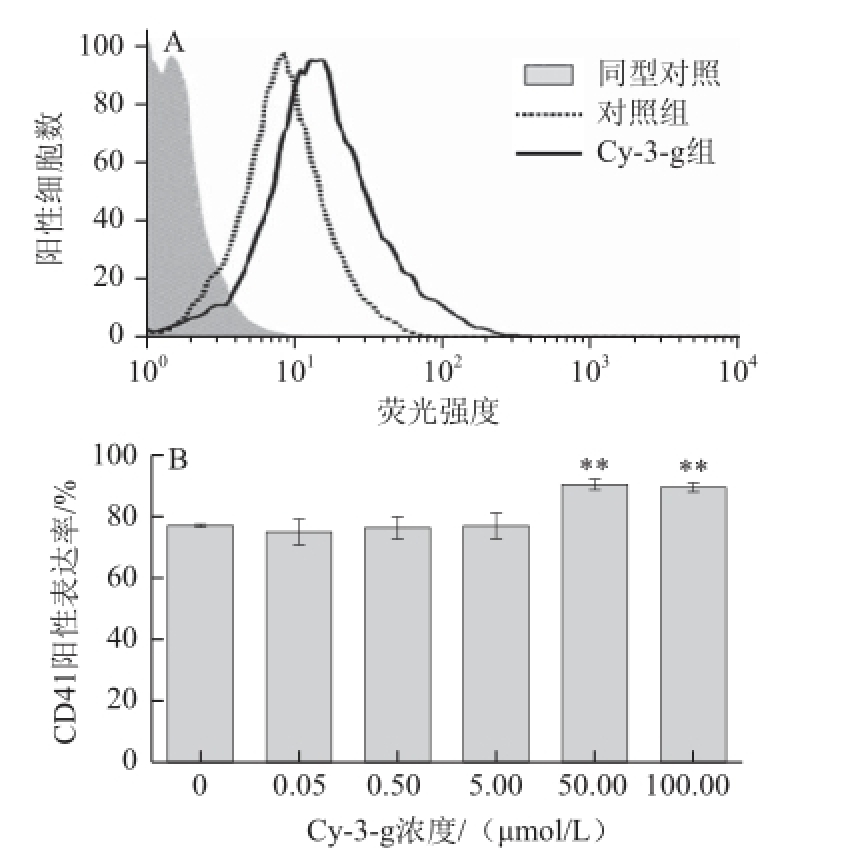
图5 Cy-3-g对Dami巨核细胞表面CD41表达率的影响
Fig.5 Effect of Cy-3-g on CD41 expression rate on the surface of Dami cells
A. 流式细胞仪测定细胞CD41表达率,其中Cy-3-g组浓度为50.00 μmol/L;B.不同浓度Cy-3-g与细胞共同培养后细胞CD41表达量的统计图。
流式细胞术检测细胞表面CD41阳性表达率。如图5所示,与对照组相比,高剂量花色苷(50.00、100.00 μmol/L)与细胞共同孵育后表面CD41表达率明显增加(P<0.01)。高剂量Cy-3-g可增加细胞成熟度,但0.05~5.00 μmol/L低剂量组与对照组相比没有统计学差异(图5B)。
巨核细胞增殖分化是血小板产生的前提,巨核细胞经过成熟、前血小板的产生、细胞内外环境作用等一系列过程后最终将血小板释放到血液中 [11]。促进巨核细胞增殖分化可以维持体内血小板活化凋亡后数目的稳定 [12]。巨核细胞大小不一,直径为12~120 μm,是体内唯一可以进行核内有丝分裂的细胞,其细胞核的数目可以从2N、4N、8N、16N到32N,最多可达到128N甚至更多,随着多倍体数目的增多,细胞的分化能力逐渐增强 [13]。伴随着细胞核的成熟,巨核细胞表面特异性的蛋白表达量可以反映巨核细胞的细胞质成熟度。
Dami细胞是人源巨核系细胞株,它具有巨核细胞的基本特性,其表面含有大量与血小板相同的糖蛋白如CD41、CD61、CD42b等,其中CD41表达量最多,是研究人巨核细胞生理生化、分化成熟机理及其与血小板关系的理想模型 [12,14]。本研究首次发现高浓度花色苷单体Cy-3-g(50.00、100.00 μmol/L)能明显增强Dami细胞活性(图1);MTT法与细胞集落培养法的结果均表明细胞增殖能力在Cy-3-g作用下也明显增强(图2、3);细胞Giemsa染色实验与细胞DNA多倍体检测结果分别定性、定量地说明了细胞在Cy-3-g作用下分化能力显著增强(图4),与此同时细胞的成熟度也相应增加(图5)。因此,花色苷单体Cy-3-g能够在体外有效促进人巨核细胞的增殖分化。
目前关于植物性食物对于巨核细胞增殖分化的研究主要集中在中草药中某些成分的作用方面,如地榆提取物总皂苷、肿节风总黄酮等分别对巨核祖细胞和小鼠巨核细胞有明显的增殖分化作用 [15-16]。莫姝等 [17]发现当归多糖能够有效刺激巨核细胞的增殖,可为血小板减少症的辅助治疗提供一定的理论依据。目前临床上对于血小板减少症主要采用促血小板生成素(TPO)进行治疗,虽然TPO能够有效刺激巨核细胞的增殖分化并产生具有生理功能的血小板 [18],但是在临床实验中也会对病人产生一定的不良反应,如诱发血栓以及不可逆骨髓网状纤维增生等多种并发症或后遗症 [19-20]。因而,探索并发现更多具有促血小板生成作用的功能性食物成分,如花色苷等植物化合物对疾病的预防与治疗具有重要意义。
参考文献:
[1] RUGGERI Z M. Platelets in atherothrombosis[J]. Nature Medicine, 2002, 8(11): 1227-1234.
[2] DALEN J E, DEVRIES S. Diets to prevent coronary heart disease 1957-2013: what have we learned?[J]. The American Journal of Medicine, 2014, 127(5): 364-369.
[3] LI Xinying, MA Hongyan, HUANG Huilian, et al. Natural anthocyanins from phytoresources and their chemical researches[J]. Natural Product Research, 2013, 27(4/5): 456-469.
[4] RECHNER A R, KRONER C. Anthocyanins and colonic metabolites of dietary polyphenols inhibit platelet function[J]. Thrombosis Research, 2005, 116(4): 327-334.
[5] ZHU Yanna, XIA Min, YANG Yan, et al. Purified anthocyanin supplementation improves endothelial function via NO-cGMP activation in hypercholesterolemic individuals[J]. Clinical Chemistry, 2011, 57(11): 1524-1533.
[6] YANG Yan, SHI Zhenyin, REHEMAN A, et al. Plant food delphinidin-3-glucoside significantly inhibits platelet activation and thrombosis: novel protective roles against cardiovascular diseases[J]. PLoS One, 2012, 7(5): e37323. doi: 10.1371/journal.pone.0037323.
[7] 田金举, 陈礼仪, 宋丰林, 等. 花色苷诱导健康人血小板线粒体凋亡通路的体外研究[J]. 营养学报, 2013, 35(6): 567-570.
[8] 陈礼仪, 田金举, 任婧, 等. 植物花色苷对血小板凋亡通路中BCL2家族影响[J]. 中国公共卫生, 2014, 30(1): 67-69.
[9] HSIEH D P H, HUXTABLE S, NG K F, et al. Determination of interactions between human thrombopoietin and its receptor MPL by yeast two-hybrid system and affi nity biosensor[J]. The International Journal of Biochemistry & Cell Biology, 2000, 32(5): 481-488.
[10] APOSTOLIDIS P A, WOULFE D S, CHAVEZ M, et al. Role of tumor suppressor p53 in megakaryopoiesis and platelet function[J]. Experimental Hematology, 2012, 40(2): 131-142.
[11] MACHLUS K R, ITALIANO J E. The incredible journey: from megakaryocyte development to platelet formation[J]. The Journal of Cell Biology, 2013, 201(6): 785-796.
[12] GREENBERG S M, ROSENTHAL D S, GREELEY T A, et al. Characterization of a new megakaryocytic cell line: the Dami cell[J]. Blood, 1988, 72(6): 1968-1977.
[13] DEUTSCH V R, TOMER A. Advances in megakaryocytopoiesis and thrombopoiesis: from bench to bedside[J]. British Journal of Haematology, 2013, 161(6): 778-793.
[14] MAJKA M, BAJ-KRZYWORZEKA M, KIJOWSKI J, et al. in vitro expansion of human megakaryocytes as a tool for studying megakaryocytic development and function[J]. Platelets, 2001, 12(6): 325-332.
[15] 代燕平, 高小平, 吴建明, 等. 地榆总皂苷对巨核祖细胞增殖分化及相关受体表达的影响[J]. 中国中药杂志, 2014, 39(9): 1685-1689.
[16] 汤喜兰, 黄立新, 曾治君, 等. 肿节风总黄酮对巨核系细胞体外扩增的作用研究[J]. 中国实验方剂学杂志, 2010, 16(1): 79-82.
[17] 莫姝, 于洁, 杨默, 等. 当归多糖与血小板源性生长因子, 血小板生成素对巨核细胞造血影响的比较研究[J]. 中华儿科杂志, 2008, 46(1): 45-48.
[18] KUTER D J. Milestones in understanding platelet production: a historical overview[J]. British Journal of Haematology, 2014, 165(2): 248-258.
[19] 赵永强. 第2代促血小板生成剂临床研究现状[J]. 内科理论与实践, 2008, 3(2): 85-87.
[20] 王崧, 许杨, 王军平, 等. TPO模拟肽类血小板生长因子研究进展[J].重庆医学, 2010, 39(4): 477-479.
Effect of Cyanidin-3-O-β-Glucoside on the Proliferation and Differentiation of Human Megakaryocytic Cell Line Dami
REN Jing
1,2, DENG Xiujuan
1,2, WANG Yanyan
1,2, ZHANG Like
1,2, YA Fuli
1,2, LU Minqi
1, ZHANG Qing
3, YANG Yan
1,2,*
(1. School of Public Health, Sun Yat-sen University, Guangzhou 510080, China; 2. Guangdong Provincial Key Laboratory of Food, Nutrition and Health, Guangzhou 510080, China; 3. School of Life Sciences, Sun Yat-sen University, Guangzhou 510275, China)
Abstrac t:Purpose: To investigate the effects of cyanidin-3-O-β-glucoside (Cy-3-g) on the proliferation and differentiation of human megakaryocytes cell line (Dami). Methods: Megakaryocytes were cultured with or without different concentrations of Cy-3-g (0.05, 0.50, 5.00, 50.00 and 100.00 μmol/L). Cell viability and proliferation were respectively measured by typan blue staining and MTT test. Colony formation of megakaryocytes in soft agar medium from different groups was assayed. After culturing the cells from each group, giem sa staining was used to observe cell morphology. Polyploidy of megakaryocyte DNA and CD41 expression rate were tested by fl ow cytometry. Results: Cy-3-g at concentrations of 50.00 and 100.00 μmol/L effectively enhanced the viability of Dami cells when compared with the control group (P < 0.05). Dami cells treated with Cy-3-g showed higher cell proliferation than the cells from the control group (P < 0.01). Cy-3-g at 50.00 and 100.00 μmol/L signifi cantly increased the number of colony formation, DNA polyploidy and CD41 expression rate in Dami cells compared to the control group (all P < 0.01). Conclusion: Cy-3-g can promote the proliferation and differentiation of human megakaryocytes, which provides a potential theoretical basis for platelet production induced by anthocyanins.
Key words:cyanidin-3-O-β-glucoside; megakaryocyte; proliferation; differentiation
中图分类号:R151.41
文献标志码:A
文章编号:1002-6630(2015)01-0196-05
doi:10.7506/spkx1002-6630-201501037
收稿日期:2014-07-14
基金项目:国家自然科学基金面上项目(81372978);中山大学实验室开放基金项目(KF201214)
作者简介:任婧(1988—),女,硕士研究生,研究方向为营养与慢性非传染病的预防。E-mail:1988.renjing@163.com
*通信作者:杨燕(1972—),女,教授,博士,研究方向为营养与慢性非传染病的预防。E-mail:yangyan3@mail.sysu.edu.cn