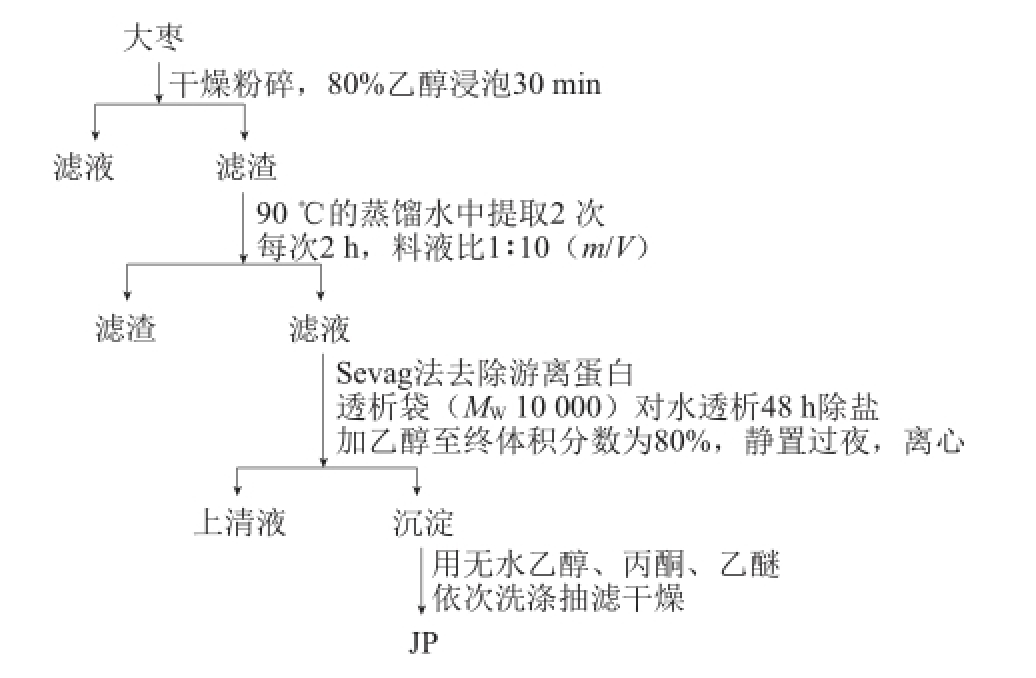
图1 JP的提取过程
Fig.1 Flowchart of JP extraction
邵长专,唐 刚
(上海海事大学体育部,上海 201306)
摘 要:目的:揭示大枣多糖(jujube polysaccharide,JP)对慢性疲劳综合症(chronic fatigue syndrome,CFS)的预防作用。方法:采用水提醇沉法对JP进行制备,同时建立大鼠CFS模型,通过服用不同剂量的JP,对大鼠的行为学方面进行检测,测定血清超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,丙二醛(malonaldehyde,MDA)水平以及脾脏指数、胸腺指数、T淋巴细胞转化情况。结果:J P能够显著提高脾脏指数,降低血清MDA含量,改善T淋巴细胞的转化能力。结论:JP对于CFS的预防效果与其调节机体的免疫能力及改善抗氧化能力有关。
关键词:大枣多糖;慢性疲劳;免疫;抗氧化
慢性疲劳综合症(chronic fatigue syndrome,CFS)是一种伴随多种症状的综合性病症 [1],多由于身体疲劳与心理疲劳的积累而致病。CFS患者往往伴随免疫力低下 [2]及抗氧化能力下降 [3]的现象。CFS患者除了应当针对性地进行自身生活习惯的调整之外,还可以选择中药调养,目前已有研究人员证实中药调养是治疗CFS的重要手段 [4]。大枣是常用于治疗CFS的中药材之一 [5-6]。近年来,研究发现大枣多糖(jujube polysaccharide,JP)能够刺激免疫功能,提高抗氧化活性 [7],提示JP可能是作为治疗CFS的主要活性成分之一。为了证实这一点,本实验通过水提醇沉法制备JP,同时建立大鼠CFS模型,通过给大鼠灌胃JP检测其作用效果,以揭示JP与CFS的关系以及治疗功效。
1.1 动物、材料与试剂
Sprague-Dawley(SD)雄性大鼠,6~8 周,体质量180~220 g,购自上海医科大学实验动物饲养中心。
大枣购自山东临沂农贸市场,粉碎后备用。
三氟乙酸(trifluoroacetic acid,TFA) 北京化学试剂公司;二甲基亚砜、RPMI-1640培养基、刀豆素(s word bean,ConA)、Hank’s液、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、透析袋(M W10 000) 北京鼎国生物技术有限责任公司;超氧化 物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxid ase,GSH-Px)试剂盒、丙二醛(malonaldehyde,MDA)试剂盒 南京建成生物制剂公司;其他试剂均为国产分析纯。
1.2 仪器与设备
752B型分光光度计 上海第三分析仪器厂;旋转蒸发器 上海亚荣生化仪器厂;Christ Alpha1-4冷冻干燥机 德国Christ公司;Tensor27红外光谱仪 德国布鲁克公司。
1.3 方法
1.3.1 JP的制备
JP的制备过程如图1所示,每1 000 g大枣提取获得29.82 g粗JP,提取率为2.98%。

图1 JP的提取过程
Fig.1 Flowchart of JP extraction
1.3.2 JP成分测定
多糖含量测定:采用蒽酮-硫酸法 [8];糖醛酸含量测定:采用硫酸-咔唑法 [9];蛋白质含量测定:采用双缩脲法 [10]。红外光谱采集:称取JP 3 mg,与适量干燥的溴化钾(KBr)混匀,在玛瑙研钵中研磨压片,在红外光谱仪上测定4 000~400 cm -1波数范围内的红外光谱。
1.3.3 CFS模型建立
将大鼠随机分为5 组(每组10 只):空白组,CFS对照组,JP低(100 mg/(kg•d))、中(200 mg/(kg•d))、高(400 mg/(kg•d))剂量组。参照文献[11-12]采用电击法、限制法和冷水游泳法诱导CFS对照组,JP低、中、高剂量组4 组大鼠形成CFS症状。4 周建模期,每周周日休息。操作细节如下:电击法:在大鼠饲养笼下方中间放置用铜丝缠绕成排状的电路板(20 cm×30 cm),每天两次喂食的期间通电,大鼠要去觅食和饮水就必须踩踏通电铜丝后才能到达放置食物的另一端。限制法:将大鼠放置在一根自制的聚氯乙烯管(长20.0 cm,直径5.0 cm)中,头部一侧封闭并留有呼吸用的小洞,尾部一侧用胶带封闭,每隔一天进行一次,每次2 h。冷水游泳法:将大鼠放置在21 ℃的水中游泳,每天1 次,每次30 min。4 周的建模期间,每天上午给JP各剂量组大鼠灌胃相应剂量的JP水溶液,空白组和CFS对照组灌胃等体积的生理盐水。
1.3.4 血清抗氧化指标与免疫器官指数的测定
4 周造模期结束后,立刻对大鼠麻醉采血,少量血液制备血清,使用试剂盒测定血清SOD、GSH-Px活性和MDA含量。大鼠处死后,立刻取脾脏和胸腺组织,按照下式计算免疫器官指数。
1.3.5 脾脏T淋巴细胞转化能力测定
将脾脏置于预冷的RPMI-1640培养基中,洗涤后剪碎,针拴研磨,经200 目筛网过滤,分离脾脏淋巴细胞,Hank’s液洗涤若干次,1 000 r/min离心10 min,取上清液,台盼蓝染色计数,活细胞需多于95%,调整细胞密度为2×10 6个/mL,置于96 孔培养板中,每孔加入细胞悬液1 mL,平行2 孔,一孔加入50 μL ConA,另一孔作为对照。置于培养箱(37 ℃,5% CO 2)中培养72 h。培养终止前4 h,每孔吸出上清液0.7 mL,加入0.7 mL RPMI-1640完全培养基,同时加入5 mg/mL MTT溶液50 μL,振荡混匀,培养箱中继续培养4 h后取出,每孔加入1 mL酸性异丙醇,振荡静置,1 500 r/min离心5 min取上清液,测定光密度值OD 570 nm。
1.4 数据处理
数据以
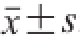 表示,用SPSS 10.0统计软件进行分析,组间比较采用t检验。
表示,用SPSS 10.0统计软件进行分析,组间比较采用t检验。
2.1 JP的组成分析
经检测,JP多糖含量为61.16%,糖醛酸含量为8.27%,蛋白质含量为12.49%。红外光谱图(图2)显示:JP为典型的多糖结构,在894.32、840.21 cm -1波数处的弱吸收峰表明其含有少量α-D-吡喃糖和β-D-吡喃糖。

图2 JP的红外光谱图
Fig.2 Infrared spectrum of JP
2.2 免疫器官指数测定结果
免疫器官指数在一定程度上反映机体免疫状况。由表1可知,与空白组相比,CFS对照组大鼠脾脏指数与胸腺指数显著下降,表明CFS模型对大鼠造成影响,使得大鼠免疫器官指数降低,进而影响机体免疫能力。补充JP后,只有JP中、高剂量组大鼠的脾脏指数较CFS对照组显著增加,而对胸腺指数的影响无统计学意义。
表1 各组大鼠免疫器官指数对比 (x ±s, , n = 8)
Table 1 Comparison of spleen index and thymus index in rats from different groups (x ±s, , n = 8)

注:*. 与空白组相比,差异显著(P<0.05);#. 与CFS对照组相比,差异显著(P<0.05)。下同。
组别脾脏指数/(mg/g)胸腺指数/(mg/g)空白组5.89±0.873.64±0.49 CFS对照组4.65±1.51*2.79±1.02* JP低剂量组4.58±1.402.98±1.46* JP中剂量组5.24±1.77 #3.21±1.53 JP高剂量组5.19±1.16 #3.43±1.08
2.3 脾脏T淋巴细胞转化实验结果
表2 大鼠T淋巴细胞转化实验结果 (x ±s, , n = 8)
Table 2 Effect of JP on T lymohocyte transformation (x ±s, , n = 8)
?
由表2可知,与空白组相比,CFS对照组大鼠T淋巴细胞转化实验测定的OD 570 nm值显著下降,表明CFS模型对大鼠的淋巴细胞活性造成影响。补充JP后,只有JP高剂量组大鼠的OD 570 nm值较CFS对照组显著增加,且与空白组相比无显著差异。
2.4 各组大鼠血清SOD、GSH-Px活性及MDA含量
表3 JP对大鼠血清抗氧化指标的影响 (x ±s, , n = 8)
Table 3 Effects of JP on the antioxidant status of CFS rats (x ±s, , n = 8)

注:**. 与空白组相比,差异极显著(P<0.01)。
MDA含量/(mmol/mL)空白组69.53±8.3635.87±4.355.17±1.62 CFS对照组62.72±5.8738.29±3.818.52±1.39** JP低剂量组64.48±9.1929.46±2.737.94±2.05 JP中剂量组72.85±10.3234.71±4.566.39±1.78 #JP高剂量组77.69±12.3337.85±3.546.55±2.28 #组别SOD活力/(U/mL)GSH-Px活力/(U/mL)
由表3可知,与空白组相比,CFS对照组大鼠血清SOD、GSH-Px活性变化不明显,但MDA含量极显著性升高(P<0.01);补充JP后,大鼠血清SOD、GSH-Px活性与CFS对照组和空白组相比,变化都无显著差异,只有JP高剂量组大鼠的MDA含量比CFS对照组显著降低。
在大枣多糖提取的过程中,虽然对游离蛋白质进行了去除,但用双缩脲法依然检测到其含有蛋白质,说明大枣多糖是一种蛋白多糖。红外光谱检测的结果显示JP属于典型的多糖结构,并含有少量α-D-吡喃糖和β-D-吡喃糖。
CFS是人体由于长期处于身体与精神双重压力下而导致身体出现多种症状的一种疾病。为了更好地研究筛选CFS的治疗药物及作用效果,一般采用如精神刺激、强迫运动、药物以及限制活动等方式建立CFS动物模型 [12-14],造模时间不少于2 周 [15]。本实验采用电击法、限制法和冷水游泳法3 种方式建立CFS模型,为期4 周。有研究报道CFS患者一般会伴随免疫能力低下及机体抗氧化能力下降的现象,如自然杀伤细胞活性降低、T淋巴细胞转化能力降低、脂质过氧化程度增加等 [16-19]。本实验通过测定大鼠脾脏指数、胸腺指数、T淋巴细胞转化程度、血清抗氧化酶活性以及脂质过氧化产物含量等指标,结果显示CFS对照组脾脏指数、胸腺指数和T淋巴细胞转化程度显著降低,血液脂质过氧化产物MDA含量显著升高,说明CFS模型建立较为成功,酶活性、部分免疫学指标和氧化损伤指标符合CFS患者的一般特征。
许多植物多糖能够提高机体免疫能力 [20-22],一些研究认为多糖提高免疫能力与其提供给免疫细胞能量有关 [23],而关于抗氧化方面的研究报道则认为多糖本身具有一定的抗氧化功能 [24-26]。大枣是传统中药治疗CFS的常用药材,大枣多糖可能是其中的主要活性成分之一。本实验结果表明一定剂量的大枣多糖对CFS模型大鼠的脾脏指数、胸腺指数、T淋巴细胞转化程度、血液脂质过氧化产物含量等指标都有一定程度的改善作用,这可能与其免疫调节活性及抗氧化性有关,这也正是大枣治疗CFS的机理之一。
参考文献:
[1] MEEUS M, van EUPEN I, van BARLE E, et al. Symptom fl uctuations and daily physical ain patients with chronic fatigue syndrome: a casecontrol study[J]. Archives of Physical Medicine and Rehabilitation, 2011, 92(11): 1820-1826.
[2] PRINSEN H, de VRIES I J, TORENSMA R, et al. Humoral and cellular immune responses after infl uenza vaccination in patients with chronic fatigue syndrome[J]. Biology Medicine Central Immunology, 2012, 13: 71. doi: 10.1186/1471-2172-13-71.
[3] GUPTA A, VIJ G, CHOPRA K. Possible role of oxidative stress and immunological activation in mouse model of chronical fatigue syndrome and its attenuation by olive extract[J]. Journal of Neuroimmunology, 2010, 226(1/2): 3-7.
[4] LIU Ya, ZHANG Haigang, LI Xiaohui. A Chinese herbal decoction, Danggui Buxue Tang, improves chronic fatigue syndrome induced by food restriction and forced swimming in rats[J]. Phytotherapy Research, 2011, 25(12): 1825-1832.
[5] CHEN Rui, MORIYA J, YAMAKAWA J, et al. Traditional Chinese medicine for chronic fatigue syndrome[J]. Evidence-Based Complementary and Alternative Medicine, 2010, 7(1): 3-10.
[6] WANG Bini, LIU Haifeng, ZHENG Jianbin, et al. Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1288-1292.
[7] WANG Bing. Chemical characterization and Ameliorating effect of polysaccharide from Chinese jujube on intestine oxidative injury by ischemia and reperfusion[J]. International Journal of Biological Macromolecules, 2011, 48(3): 386-391.
[8] 刘晓涵, 陈永刚, 林励, 等. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技, 2009, 34(9): 270-272.
[9] TIAN Lingmin, ZHAO Yan, GUO Chao, et al. A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata[J]. Carbohydrate Polymers, 2011, 83(2): 537-544.
[10] 王卫国, 吴强, 胡宝坤, 等. 几种测定灰树花多糖中蛋白质含量方法的比较研究[J]. 中国食用菌, 2002, 22(1): 27-30.
[11] LALREMRUTA V, PRASANNA G S. Evaluation of protective effect of Aegle marmelos Corr. in an animal model of chronic fatigue syndrome[J]. Indian Journal of Physiology and Pharmacology, 2012, 44(3): 351-356.
[12] ZOU Jun, YUAN Jianqi, LÜ Shuang, et al. Effects of exercise on behavior and peripheral blood lymphocyte apoptosis in a rat model of chronic fatigue syndromn[J]. Journal of Huazhong University of Science and Technology: Medical Sciences, 2010, 30(2): 258-264.
[13] SHEVCHUK N A. Possible use of repeated cold stress for reducing fatigue in chronic fatigue syndrome: a hypothesis[J]. Behavioral and Brain Functions, 2007, 3: 55. doi: 10.1186/1744-9081-3-55.
[14] LYLE N, GOMES A, SUR T, et al. The role of antioxidant properties of Nardostachys jatamansi in alleviation of the symptoms of the chronic fatigue syndrome[J]. Behavioural Brain Research, 2009, 202(2): 285-290.
[15] SINGH A, NAIDU P S, GUPTA S, et al. Effect of natural and synthetic antioxidants in a mouse model of chronic fatigue syndrome[J]. Journal of Medicinal Food, 2002, 5(4): 211-220.
[16] CHEN Rui, MORIYA J, LUO Xianwen, et al. Hochu-ekki-to combined with interferon-gamma moderately enhances daily activity of chronic fatigue syndrome mice by increasing NK cell activity, but not neuroprotection[J]. Immunopharmacology Immunotoxicology, 2009, 31(2): 238-245.
[17] MAES M, KUBERA M, UYTTERHOEVEN M, et al. Increased plasma peroxides as a marker of oxidative stress in myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS)[J]. Medical Science Monitor, 2011, 17(4): 11-15.
[18] MARSHALL-GRADISNIL S, GOTTSCHALK G, RAMOS S, et al. The role of cytokines in the cerebrospinal fl uids of patients with chronic fatigue syndrome/myalgic encephalomyelitis (CFS/ME)[J]. Cytokine, 2014, 70(1): 31.
[19] BANSAL A S, BRADLEY A S, BISHOP K N, et al. Chronic fatigue syndrome, the immune system and viral infection[J]. Brain, Behavior, and Immunity, 2012, 26(1): 24-31.
[20] YUAN Chengfu, WANG Changdong, BU Youquan, et al. Antioxidative and immunoprotective effects of Pyracantha fortuneana (Maxim.) Li polysaccharides in mice[J]. Immunology Letters, 2010, 133(1): 14-18.
[21] ZHANG Yongbing, YANG Shifa, ZHAO Xue, et al. Immune enhancement of Taishan Robinia pseudoacacia polysaccharide on recombinant Proteus mirabilis OmpA in chickens[J]. International Immunopharmacology, 2014, 22(1): 236-241.
[22] WANG Nan, YANG Jingyue, LU Jianguo, et al. A polysaccharide from Salvia miltiorrhiza Bunge improves immune function in gastric cancer rats[J]. Carbohydrate Polymers, 2014, 111: 47-55.
[23] MITCHELL J B, PIZZA F X, PAQUET A, et al. Influence of carbohydrate status on immune responses before and after endurance exercise[J]. Journal of Applied Physiology, 1998, 84(6): 1917-1925.
[24] 孙曦晓, 刘再枝, 杜新琦, 等. 超声辅助提取杜仲多糖及其抗氧化活性[J]. 植物研究, 2014, 34(3): 428-432.
[25] SUN Liqin, WANG Ling, LI Jing, et al. Characterization and antioxidant activities of degraded polysaccharides from two marine Chrysophyta[J]. Food Chemistry, 2014, 160: 1-7.
[26] PAN Saikun, WU Shengjun. Cellulase-assisted extraction and antioxidant activity of the polysaccharides from garlic[J]. Carbohydrate Polymers, 2014, 111: 606-609.
Preventive Effect of Jujube Polysaccharide on Chronic Fatigue Syndrome in Rats
SHAO Changzhuan, TANG Gang
(Department of Sport, Shanghai Maritime University, Shanghai 201306, China)
Abstract:Objective: To reveal the preventive effect of jujube polysaccharides (JP) on chronic fatigue syndrome (CFS). Methods: JP were prepared from jujube fruits by water extraction and ethanol precipitation and their physicochemical properties were determined. A four-week old rat CFS model was established. The rats were orally administrated with JP and the b ehavior experiments were conducted after induction of CFS. The activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px), and the levels of malondialdehyde (MDA) in rat serum were eassayed. Spleen index, thymus index and T lymohocyte transformation were analyzed. Results: JP markedly decreased MDA levels in serum, and increased spleen index and T lymohocyte transformation. Conclusions: The preventive effects of JP on CFS are closely related to their immune-regulating function and antioxidant activity.
Key words:jujube polysaccharide; chronic fatigue; immune; antioxidant
中图分类号:G804.7
文献标志码:A
文章编号:1002-6630(2015)01-0205-04
doi:10.7506/spkx1002-6630-201501039
收稿日期:2014-07-01
基金项目:教育部博士点基金联合资助项目(20123121120004);上海海事大学科研基金项目(20130474)
作者简介:邵长专(1971—),男,副教授,硕士,研究方向为体育教育与健康。E-mail:scz1971@126.com