申 剑,崔晓东,李玉英,王转花*
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
摘 要:目的:从苦荞麦种子中提取、纯化苦荞凝集素,对其凝血及酶学活性等性质进行初步研究。方法: 采用缓冲液抽提、硫酸铵沉淀、透析及DEAE-纤维素阴离子交换层析(DEAE fast flow,DEAE FF)纯化凝集素;高碘酸希夫(periodic acid-Schiff,PAS)染色鉴定其蛋白种类,硫酸-苯酚法测定糖含量;凝血实验和糖抑制实验检测其凝血活性和结合糖特异性;以对硝基苯磷酸二钠为底物,测定磷酸酯酶活性。结果:从苦荞麦种子中获得了一种具有凝血功能的蛋白质——苦荞凝集素(tartary buckwheat lectin,TBL)。纯化的TBL在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)图谱上显示单一条带,根据SDS-PAGE计算其分子质量约为62 kD。PAS染色证明TBL为糖蛋白,糖含量为5.8%。凝血实验表明TBL对人的O型血红细胞具有特异性凝集作用,效价为15 μg/mL,对其他血型的红细胞没有凝血效应。血凝活性被D-甘露糖和D-葡萄糖抑制,推测其是一种甘露糖结合凝集素。酶学性质鉴定显示,TBL具有磷酸酯酶活性,米氏常数K m= 9.86×10 -3mol/L。结论:TBL可能是苦荞麦种子中的一种具有多种酶学功能的甘露糖凝集素。
关键词:苦荞;凝集素;糖蛋白;磷酸酯酶
凝集素是一类能与细胞表面的糖蛋白、糖脂中的寡糖结构可逆结合的天然蛋白,在自然界中分布非常广泛 [1-2]。舒晓燕等 [3]报道,早在1888年,Herman Stillmark在蓖麻籽中发现了具有细胞毒性的凝集素,命名为蓖麻毒素(ricin)。经过数十年的研究,Ricin的线性一维和空间结构已经清楚,由于其具有很强的抑制蛋白质合成和细胞毒性等功能,已被广泛用于抗癌免疫毒素和作为生物杀虫剂 [4]。1916年,Jones等 [5]首次从直生刀豆中分离出一种能特异性结合甘露糖/葡萄糖的凝集素-伴刀豆球蛋白(concanavalin A,Con A)。随后,Con A的结晶体和三级结构陆续被解析,从而揭开了研究植物凝集素分子结构和功能的序幕 [6-7]。目前,凝集素的研究主要包括凝集素的分类,糖结合特性及生物活性等 [8]。凝集素最显著的特征是能与红细胞表面特异糖基发生专一性结合,使红细胞发生凝集,发挥其生物学功能 [9]。此外,凝集素在生物识别、胚胎发育、癌症和免疫应答等方面都起着重要作用 [10]。根据氨基酸序列同源性及其在进化上的关系,植物凝集素可以分为以下7 个家族:豆科凝集素、几丁质结合凝集素、单子叶甘露糖结合凝集素、Ⅱ型核糖体失活蛋白(ribosome inactivating protein,RIP)、木菠萝素家族、葫芦科韧皮部凝集素以及苋科凝集素 [11]。RIP不仅具有凝血活性,还有RNA-水解酶、RNA N-糖苷酶和水解超螺旋环状DNA的酶活性等许多生物酶活性,是一种具有酶活性的特殊凝集素 [12]。目前人们已经从10多个科,大约50多种植物中得到了RIPs,并对这些特殊凝集素的理化性质等进行了相应的研究。但是有关荞麦中的凝集素的制备及凝血作用等研究尚未见报道。
荞麦是一种重要的蓼科杂粮作物,也是一种传统的药食同源植物 [13],被誉为“五谷之王”。苦荞麦所含蛋白质及氨基酸种类丰富,其中赖氨酸含量高达0.69%,为大米的2.7 倍 [14]。有报道证明,荞麦中的矿物质钾、镁、铜、锌、钙、锰等元素的含量也高于大宗粮食作物。荞麦的化学成分独特,生物类黄酮含量较高,这些黄酮类物质具有明显的降血脂、降血糖以及降尿糖作用 [15-16],对高血脂、脑血管硬化、心血管病和高血压等症有积极的预防和治疗作用,在调理和预防疾病中有良好的药用价值。近年来,随着人们对荞麦食产品在保健和辅助药物治疗中的独特作用,有关荞麦中的抗营养因子,蛋白酶抑制剂及特异性抗原等功能蛋白的研究也取得了长足进展。本课题组的前期研究发现来自荞麦中的蛋白酶抑制剂rBTI具有一定的抗肿瘤作用,能明显抑制肝癌、乳腺癌等肿瘤细胞的增殖,并诱导其凋亡或自噬 [17-18]。荞麦中的多肽表现出了抗菌、抗肿瘤等生物活性 [19-20],而荞麦中的过敏原能致接触或食用者产生哮喘等过敏症状 [21]。但有关荞麦中的更多生物活性成分,包括凝集素及其在植物源凝集素中的分类、功能等的研究还有待揭示。本实验首次采用缓冲液抽提、硫酸铵沉淀、透析及DEAE-纤维素阴离子交换层析(DEAE fast flow,DEAE FF)等方法获得一种具有凝血活性的苦荞麦凝集素(tartary buckwheat lectin,TBL),并对其酶学活性及糖结合专一性等性质进行了初步研究。这为深入研究凝集素的生物学功能及应用提供了理论基础。
1.1 材料与试剂
苦荞麦种子为云荞一号,由云南省农业科学院生物技术与种质资源研究所馈赠;凝血实验所用人A、B、AB及O型血采自志愿者。
96孔U型板 丹麦Nunc公司;DEAE FF离子交换层析柱(1 mL) 美国GE Healthcare公司;碱性品红、对硝基苯磷酸二钠(4-nitrophenyl phosphate disodium salt hexahydrate,pNpp) 生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BL310电子天平 德国赛多利斯公司;TB20-1000梯度搅拌器 上海新波无线电公司;5417 R离心机德国艾本德公司;CR 22G Ⅱ高速离心机 日本日立公司;恒温水浴锅 太仓仪器厂;756MC紫外-可见分光光度计 上海光学仪器厂;PowerPac 300电泳仪 美国伯乐公司;AKTA Explorer蛋白纯化系统 美国通用电气公司。
1.3 方法
1.3.1 TBL的分离纯化
苦荞麦种子脱壳粉碎,过40 目筛,称取100 g粉末于烧杯中,加入1 L 20 mmol/L、pH 5.0 的乙酸铵-乙酸缓冲液,冷水浴4 ℃搅拌抽提6 h,8 000 r/min 离心30 min除去沉淀,上清液中缓慢、均匀地加入固体硫酸铵,使之饱和度达到80%,即质量浓度达到559 g/L,4 ℃搅拌6 h。8 000 r/min 离心30 min收集沉淀,用80 mL 20 mmol/L、pH 7.0的磷酸盐缓冲液(phosphate buffer saline,PBS)重新溶解沉淀,并用相同缓冲液透析,除去硫酸铵。得到的粗品上样于DEAE FF柱,在AKTA Explore进行纯化,平衡液为20 mmol/L、pH 7.0的PBS,洗脱液为20 mmol/L、pH 7.0的PBS和0.5 mol/L的NaCl,流速为1 mL/min,收集洗脱峰并进行活性检测。纯化得到的TBL采用Folin-酚法进行蛋白质量浓度测定,分装于1.5 mL离心管中备用。
1.3.2 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDSPAGE)分析
参考Laemmli [22]方法进行,分离胶质量分数为12%,浓缩胶质量分数为4%,考马斯亮蓝R250进行染色,电泳结果采用Gene Genius Bio Imaging System 拍照进行分析。以标准蛋白分子质量对数值(lgM r对相对迁移距离做标准曲线,得回归方程为y=-1.388 7x+2.514 0(R 2=0.997 1)。根据电泳结果按照下式计算相对迁移率,通过样品的迁移率计算分子质量。
1.3.3 高碘酸希夫(periodic acid-Schiff,PAS)染色及糖含量测定
糖蛋白鉴定采用PAS染色法 [23]。首先进行SDSPAGE,胶用10%三氯乙酸(trichloroacetic acid,TCA)处理5 min;再用1%高碘酸处理15 min;之后蒸馏水洗3 次,每次5 min;倒入Schiff试剂避光染色30 min;再用0.5%偏重亚硫酸钠漂洗3 次,每次5 min;于7%乙酸溶液中保存。糖含量测定采用硫酸-苯酚法 [24],以葡萄糖为标准。
1.3.4 TBL的凝血活性测定
取适量人A、B、AB及O型血分别用20 mmol/L的PBS漂洗数次,每次2 000 r/min离心5 min,去上清液,按红细胞压积用PBS配制成2% PBS-红细胞悬浮液。按照文献[25]操作,血凝板各孔加入PBS 25 μL,第二列加入25 μL、质量浓度为60 μg/mL的TBL,逐行进行倍比稀释,最后每孔中加入25 μL不同血型的2%红细胞悬浮液,在微型振荡器振荡2 min,室温静置30 min后观察结果。以能使红细胞发生凝集反应的TBL的最小质量浓度为效价。
1.3.5 糖抑制实验
将D-甘露糖、D-葡萄糖、N-乙酰氨基葡萄糖、D-半乳糖及L-岩藻糖分别溶于PBS缓冲液中,配制成400 mmol/L的糖溶液。血凝板各孔中加入PBS 25 μL,在第一列各孔中加入25 μL不同糖溶液(并进行倍比稀释)及25 μL的TBL,室温孵育5 min,以下操作同1.3.4节。糖的结合能力以抑制TBL血凝活性的最低糖浓度为标准。每种糖溶液的抑凝实验重复3 次。
1.3.6 磷酸酯酶活性测定
参照文献[26]方法,以pNpp(对硝基苯磷酸二钠)为底物,检测TBL磷酸酯酶活性。反应总体积为5 mL:3 mL 0.2 mol/L CH 3COONa-CH 3COOH pH 5.0缓冲液,1 mL 10 mmol/L的MgSO 4及1 mL不同浓度(5、10、15、20、25、30 mmol/L)的底物pNpp。在37 ℃下,预热5 min,加100 μL酶液,反应10 min,然后用2 mL 0.2 mol/L NaOH溶液终止反应,以蒸馏水代替酶液作对照,在420 nm波长处测光密度值。酶活力单位定义为:在37 ℃条件下,以pNpp为底物,每升酶液每分钟水解底物后生成产物的微摩尔数作为一个酶活力单位(U)。按照Lineweaver Burk作图法求出该酶的米氏常数(K m)值。
2.1 TBL的DEAE FF层析分离及纯度和分子质量鉴定
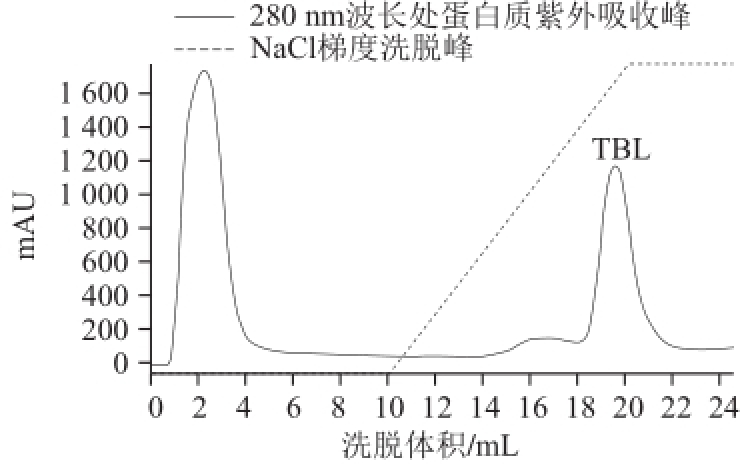
图1 TBL的离子交换层析图谱
Fig.1 Ion exchange chromatography of TBL
由图1可知,经20 mmol/L、pH 7.0的PBS和0.5 mol/L的NaCl洗脱后,在18.6~21.0 mL范围内出现TBL特征吸收峰。将收集的目的蛋白进行纯度分析,结果见图2,TBL经胶质量分数为12%的SDS-PAGE分离后呈现单一条带,纯度达到95%以上。纯化的蛋白可满足后续活性分析等,经计算得TBL的分子质量约为62 kD,与预期结果一致。
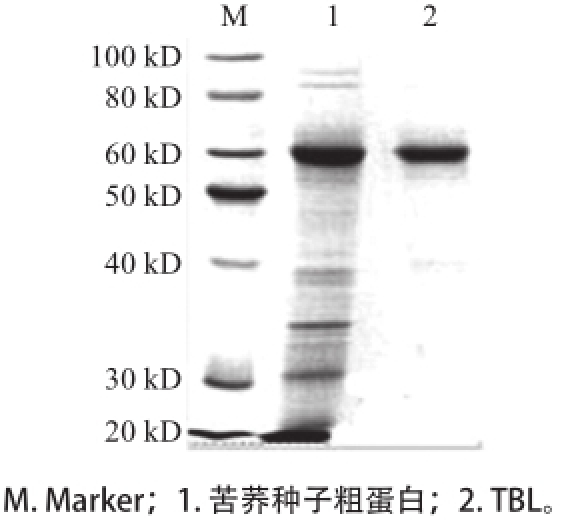
图2 TBL的SDS-PAGE分析结果
Fig.2 SDS-PAGE analysis and molecular weight determination of TBL
2.2 PAS染色鉴定TBL及糖含量的测定结果

图3 TBL的考马斯亮蓝R250染色和PAS染色结果
Fig.3 Coomassie brilliant blue R250 staining and PAS staining of TBL
高碘酸是一种氧化剂,能将多糖残基中的二醇基(CHOH—CHOH)氧化为二醛(CHO—CHO),二醛能与希夫试剂(Schiff reagent)反应生成红色不溶性复合物 [27]。由图3A可知,TBL经考马斯亮蓝R250染色,在含还原剂二硫苏糖醇(dithiothreitol,DTT)和不含DTT的Loading Buffer条件处理下,都显示出单一条带,证明TBL分子内不存在二硫键;PAS染色图谱(图3B)表明:在还原和非还原条件下,TBL条带均呈现红色,证明TBL为一种糖结合蛋白。另外,根据硫酸-苯酚法,绘制出葡萄糖标准曲线,测得TBL含糖量为5.8%,相当于每个TBL分子上结合约20 个单糖。
2.3 TBL的凝血活性

图4 TBL对人不同血型(A、B、AB及O)的血凝反应
Fig.4 Hemagglutination reaction of TBL on different human blood types
通常发生血凝反应的红细胞应均匀地分布在孔中,未凝集的应在孔底沉积呈小红点状。如图4所示,第一列为对照组(呈小红点累积于孔底),A、B和AB型血实验组(第二列之后)与对照组相比均未发生血凝反应。O型血第二列全部凝集,第三列部分凝集,第三列以后的红细胞未凝集,而是沉降于孔底,形成红色圆点,表明第三列之后的TBL质量浓度不足以发生血凝效应。实验结果证明TBL可以特异性地凝集人的O型血,血凝效价为15 μg/mL。TBL对不同血型血凝效果见表1。
表1 TBL对不同血型血凝效果
Table1 Effect of TBL concentration on hemagglutination of different human blood types
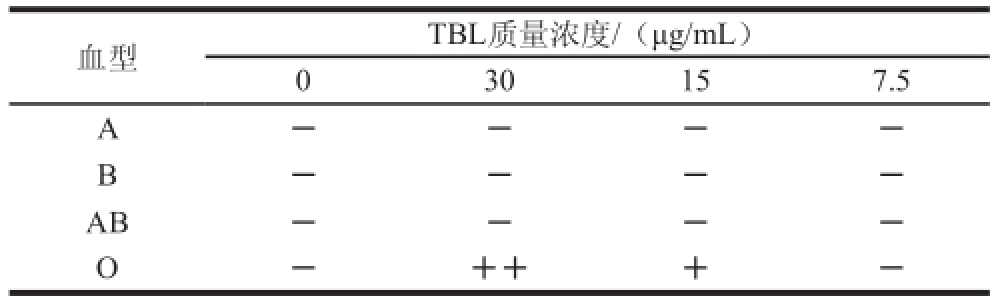
注:++. 中度凝集;+. 低度凝集;-. 不凝集。下表同。
血型TBL质量浓度/(μg/mL)0 30157.5 A ----B ----AB----O -+++-
2.4 TBL的特异结合糖类型
目前已知的植物凝集素均可以特异性地与糖结合,且细胞表面糖类都可以被某种凝集素所识别。本研究选择5 种单糖分别和红细胞悬液作用,观察并分析在不同稀释倍数下对TBL的凝血抑制作用,从而确定苦荞凝集素结合单糖的特异性。由表2可知,D-甘露糖(D-mannose)和D-葡萄糖(D-glucose)在浓度为66 mmol/L时,可以完全抑制TBL的血凝活性,而D-半乳糖(D-galactose)、N-乙酰氨基葡萄糖(GluNAc)及L-岩藻糖(L-fucose)未能完全抑制TBL的血凝活性。结果表明,TBL的血凝活性可能被D-甘露糖和D-葡萄糖特异性抑制。从而推断来源于苦荞麦中的凝集素属于D-甘露糖凝集素。
表2 TBL糖抑制实验结果
Table2 Hemagglutination-inhibitory activity of TBL
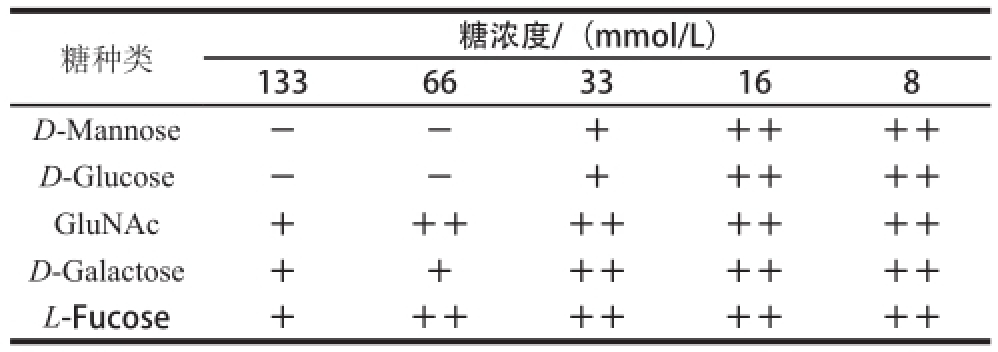
糖种类糖浓度/(mmol/L)1336633168 D-Mannose--+++++ D-Glucose--+++++ GluNAc+++++++++ D-Galactose++++++++ L-Fucose+++++++++
2.5 TBL的磷酸酯酶活性
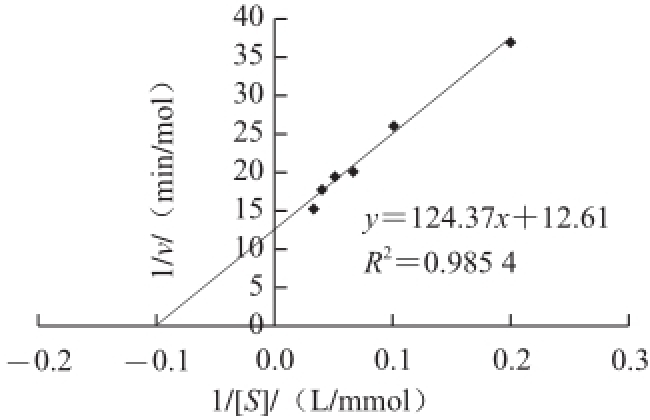
图5 TBL的磷酸酯酶活性Fig.5 Lineweaver-Burk plot for phosphatase activity of TBL
有研究表明来源于植物体内的部分凝集素有磷酸酯酶等酶活性,为了初步判断TBL的酶活性功能,实验以pNpp为底物,研究TBL的磷酸酯酶活性。pNpp是一种小分子化合物,若被测物质具有磷酸酯酶活性,在适宜的反应条件下,pNpp会脱去一分子磷酸,生成的硝基酚黄色化合物在420 nm波长处有特征吸收。实验结果表明,在37 ℃水浴10 min的条件下,与对照组相比,TBL与pNpp发生了明显反应,可将pNpp水解成硝基酚,证明其具有磷酸酯酶活性。以1/v对1/[S]作图,结果如图5所示,从图中求出TBL的磷酸酯酶活性的K m为9.86×10 -3mol/L。已知草鱼酸性磷酸酯酶和斑玉蕈磷酸酯酶Ⅰ、酶Ⅱ与pNpp反应的K m分别为3.56×10 -3、4.095×10 -3mol/L和36.3×10 -3mol/L [26-28]。本实验获得的TBL的磷酸酯酶的米氏常数与上述几种来源的酶相当,表明对底物pNpp的亲和力相近。但与蕹菜类囊体膜磷酸酯酶的米氏常数(K m为1.76×10 -6mol/L)相比 [29],TBL对底物pNpp的亲和力较低。不同磷酸酯酶对pNpp反应的米氏常数的差异可能与蛋白质结构、性质及酶作用专一性等有关。详细酶活性及催化机理有待进一步研究。
近年的研究表明,凝集素作为一种蛋白质或糖蛋白,能与糖专一地、非共价地可逆结合。部分凝集素除了具有凝集细胞和沉淀聚糖或糖复合物的作用外 [30],还具有多种酶性功能,能选择性地水解不同底物,如Ⅱ型核糖体失活蛋白类凝集素 [31],由于其结构的特殊性,使其既具有N-糖苷酶活性(结构中的A链),又具有凝集素的特性(结构中的B链),依靠其糖结合活性可使Ⅱ型核糖体失活蛋白结合于哺乳动物细胞表面,触发受体介导的细胞内吞作用,进入细胞后,A链选择性地水解真核生物28S核糖体RNA,从而抑制蛋白质合成的肽链延伸过程,说明此类凝集素具有酶的催化活性。
本实验采用粗提及离子交换柱层析等步骤,首次从苦荞麦种子中获得一种分子质量约为62 kD的蛋白质。通过优化粗提缓冲体系,发现采用生理盐水或PBS提取TBL均不能获得满意的提取率,而以20 mmol/L、pH 5.0乙酸铵-乙酸缓冲液作为溶剂时,TBL的提取质量和活力都最高,说明不同的缓冲体系对植物源凝集素的提取效果有明显的影响。获得的粗蛋白经DEAE FF离子交换层析柱一步分离纯化即可获得纯度达95%以上的TBL蛋白。纯化的蛋白经血凝实验证明其具有血凝活性,对人的O型血的血凝效价为15 μg/mL。糖抑制实验表明,TBL血凝活性可被D-甘露糖和D-葡萄糖特异性抑制,推测其可能属于D-甘露糖凝集素(mannose binding lectin,MBL)。为了揭示本研究获得的TBL的生物学功能,实验中以pNpp为底物,初步探讨了其酶性功能,结果表明,TBL能水解底物中的磷酸酯键,具有磷酸酯酶的活性。经比较,发现TBL的催化活性与草鱼中的酸性磷酸酯酶 [26]和斑玉蕈磷酸酯酶Ⅰ、酶Ⅱ [28]的作用类似。
目前已知的植物凝集素种类较多,功能各异,根据其来源、作用方式以及氨基酸系列同源性等命名的7 个家族中,具有磷酸酯酶活性的植物凝集素仅在Ⅱ型核糖体失活蛋白中发现。本实验初步表明TBL具有磷酸酯酶的活性,同时还具有切割质粒DNA的活性,经TBL作用后的质粒可产生线性DNA和缺刻环DNA(数据未附),说明该蛋白具有类似Ⅱ型核糖体失活蛋白的功能,但有关苦荞麦凝集素是否具有其他酶学特性,TBL的结构与功能之间的关系等还需要对其RNA-水解酶、RNA N-糖苷酶和水解超螺旋环状DNA的酶活性及结构和性质等进行深入研究。
参考文献:
[1] 鲍锦库. 植物凝集素的功能[J]. 生命科学, 2011, 23(6): 533-540.
[2] GEETHANANDAN K, JOSEPH A, SADASIVAN C, et al. Carbohydrate binding and unfolding of Spatholobus parviflorus Lectin: fluorescence and circular dichroism spectroscopic study[J]. Applied Biochemistry and Biotechnology, 2013, 171(1): 80-92.
[3] 舒晓燕, 阮期平, 侯大斌. 植物凝集素的研究进展[J]. 现代中药研究与实践, 2006, 20(6): 53-56.
[4] 罗嘉惠. 蓖麻毒素的研究与应用[J]. 氨基酸和生物资源, 1999, 21(2):56-58.
[5] JONES D B, JOHNS C O. Some proteins from the jack bean,Canavalia ensiformis[J]. Journal of Biological Chemistry, 1916, 28(1):67-75.
[6] SUMNER J B, HOWELL S F. Identifi cation of hemagglutinin of jack bean with concanavalin A[J]. Journal of Bacteriology, 1936, 32(2):227-237.
[7] BECKER J W, REEKE G N, WANG J L, et al. The covalent and three-dimensional structure of concanavalin A. Ⅲ. Structure of the monomer and its interactions with metals and saccharides[J]. Journal of Biological Chemistry, 1975, 250(4): 1513-1524.
[8] 蔡茜茜, 李巧玲, 刘舒云, 等. 植物凝集素研究与展望[J]. 食品科学技术学报, 2013, 31(6): 51-57.
[9] 李笑梅, 韩春然. 菜豆凝集素血凝活性与品种的关系及稳定性的研究[J]. 中国食品学报, 2009, 9(6): 66-71.
[10] R☒DIGER H, GABIUS H J. Plant lectins: occurrence, biochemistry,functions and applications[J]. Glycoconjugate Journal, 2001, 18(8): 589-613.
[11] van DAMME E J, LANNOO N, PEUMANS W J. Plant lectins[J]. Advances in Botanical Research, 2008, 48: 107-209.
[12] di MARO A, CITORES L, RUSSO R, et al. Sequence comparison and phylogenetic analysis by the Maximum Likelihood method of ribosome-inactivating proteins from angiosperms[J]. Plant Molecular Biology, 2014, 85(6): 575-588.
[13] 王岚, 李玉英, 蔡桂红, 等. 重组苦荞麦过敏蛋白TBa的原核表达及其免疫活性鉴定[J]. 中国生物化学与分子生物学报, 2006, 22(4):308-312.
[14] 王红育, 李颖. 荞麦的研究现状及应用前景[J]. 食品科学, 2004,25(10): 388-391.
[15] 闫斐艳, 崔晓东, 李玉英, 等. 苦荞麦黄酮对人食管癌细胞EC9706增殖的影响[J]. 中草药, 2010, 41(7): 1142-1145.
[16] 林汝法, 周小理, 仁贵兴, 等. 中国荞麦的生产与贸易 、营养与食品[J].食品科学, 2005, 26(1): 259-263.
[17] CUI Xiaodong, WANG Zhuanhua, L I Yuying, et al. B uckwheat trypsin inhibitor enters Hep G2 cells by clathrin-dependent endocytosis[J]. Food Chemistry, 2013, 141(6): 2625-2633.
[18] LI Yuying, ZHANG Zheng, WANG Zhuanhua, et al. rBTI induces apoptosis in human solid tumor cell lines by loss in mitochondrial transmembrane potential and caspase activation[J]. Toxicology Letters,2009, 189(2): 166-175.
[19] LEUNQ E H, NQ T B. A relatively stable antifungal peptide from buckwheat seeds with antiproliferative activity toward cancer cells[J]. Journal of Peptide of Science, 2007, 13(11): 762-767.
[20] GUO Xiaona, ZHU Kexue, ZHANG Hui, et al. Purification and characterization of the antitumor protein from Chinese tartary buckwheat (Fagopyrum tataricum Gaertn.) water-soluble extracts[J]. Journal of Agricultural and Food Chemistry, 2007, 55(17): 6958-6961.
[21] YANG Zhenhuang, LI Chen, LI Yuying, et al. Effects of Maillard reaction on allergenicity of buckwheat allergen Fag t 3 during thermal processing[J]. Journal of the Science of Food and Agriculture, 2013,93(6): 1510-1515.
[22] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[23] 王玉琪, 巫光宏, 林先丰, 等. 多糖和糖蛋白聚丙烯酰胺凝胶电泳染色方法的改进[J]. 植物生理学通讯, 2009, 45(2): 169-172.
[24] DUBOIS M, GILLIS K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Biochemistry, 1956, 28(3): 350-356.
[25] 孙册. 临床医学新工具: 凝集素[J]. 生命的化学, 1991, 11(3): 34-35.
[26] 杨立红, 肖波, 王晓洁, 等. 草鱼酸性磷酸酯酶的性质及金属离子对其活性的影响[J]. 中国水产科学, 2010, 17(5): 969-976.
[27] 张世雄, 程立均. 一种改进的糖蛋白染色鉴别方法的建立[J]. 中国生物制品学杂志, 2012, 25(1): 108-110.
[28] 杨立红, 高兴喜, 缪静, 等. 斑玉蕈酸性磷酸酯酶的酶学性质研究[J].菌物学报, 2011, 30(5): 744-752.
[29] 刘映秋, 杜林方. 蕹菜类囊体膜磷酸酯酶的分离纯化和部分性质[J].应用与环境生物学报, 2003, 9(3): 239-242.
[30] JIMENEZ P, CABRERO P, BASTERRECHEA J E, et al. Isolation and molecular characterization of two lectins from dwarf elder(Sambucus ebulus L.) blossoms related to the sam n1 allergen[J]. Toxins, 2013, 5(10): 1767-1779.
[31] PEUMANS W J, HAO Q, van DAMME D E J. Ribosome-inactivating proteins from plants: more than RNA N-glycosidases[J]. The Journal of the Federation of American Societies for Experimental Biology,2001, 15(9): 1493-1506.
Purification and Identification of Tartary Buckwheat Lectin
SHEN Jian, CUI Xiaodong, LI Yuying, WANG Zhuanhua
*
(Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education, Institute of Biotechnology,Shanxi University, Taiyuan 030006, China)
Abstract:Purpose: To purify lectin from tartary buckwheat (TBL) and identify its hemagglutination and enzymatic activity. Methods: TBL was extracted and purifi ed by ammonium sulfate precipitation, dialysis, and anion exchange chromatography. Periodic acid-Schiff (PAS) staining was used to identify its glycoprotein nature and sulfuric acid-phenol method was used to measure the sugar contents. The hemagglutination activity and sugar binding specifi city of the purifi ed TBL were tested by hemagglutination reaction and hemagglutination inhibition assays, and the phosphatase activity was measured by using 4-nitrophenyl phosphate disodium salt hexahydrate (pNpp) as the substrate. Results: The purifi ed TBL displayed a single band and a molecular weight of 62 kD, as determined by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDSPAGE). PAS staining indicated that TBL was a glycoprotein with a sugar content of 5.8%. Hemagglutination reaction demonstrated that TBL could agglutinate the O type of human blood with titer of 15 μg/mL. The hemagglutination activity was inhibited by D-glucose and D-mannose, from which, TBL can be deduced as a mannose-binding lectin. Further experiments demonstrated that TBL had phosphatase activity with a Michaelis constant K mof 9.86×10 -3mol/L. Conclusions:The TBL obtained in this study was a mannose-binding lectin (MBL) with enzymatic functions.
Key words:tartary buckwheat; lectin; glycoprotein; phosphatase
中图分类号:Q556
文献标志码:A
文章编号:1002-6630(2015)03-0001-05
doi:10.7506/spkx1002-6630-201503001
收稿日期:2014-08-27
基金项目:国家自然科学基金面上项目(31171659);国家自然科学基金青年科学基金项目(31300653);山西省科技创新项目(2014091028)
作者简介:申剑(1989—),男,硕士研究生,研究方向为蛋白质化学与工程。E-mail:419139257@qq.com
*通信作者:王转花(1956—),女,教授,博士,研究方向为蛋白质工程与生物活性物质。E-mail:zhwang@sxu.edu.cn