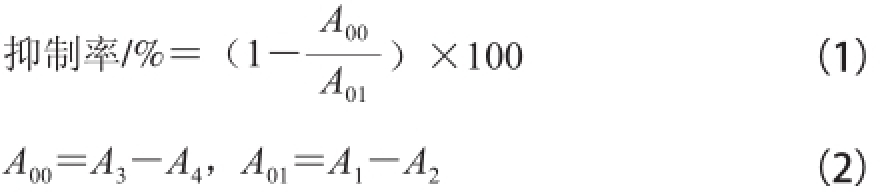没食子酸对猪胰α-淀粉酶和蛋白酶的抑制作用
秦 昱,邵元元,熊 硕,滕 杰,丰金玉,肖文军*
(湖南农业大学 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
摘 要:以没食子酸为材料,通过考察酶质量浓度、反应体系中底物和酶及没食子酸添加顺序、不同反应时间、不同没食 子酸质量浓度对猪胰α-淀粉酶、蛋白酶的活性影响,研究没食子酸对两种酶的 抑制作用。结果表明,在底物质量浓度为1 g/100 mL、体系添加顺序为酶液与抑制剂没食子酸溶液37 ℃预温5 min后加入底物溶液的条件下,没食子酸抑制猪胰α-淀粉酶活性最优条件为:α-淀粉酶质量浓度0.64 mg/mL,反应时间15 min,没食子酸对α-淀粉酶的最大抑制率为95.52%;在体系添加顺序为酶液与抑制剂没食子酸溶液40 ℃预温5 min后加入底物溶液的条件下,没食子酸抑制猪胰蛋白酶活性的最优条件为:胰蛋白酶质量浓度0.63 mg/mL,反应时间30 min,没食子酸对胰蛋白酶的最大抑制率为99.24%。没食子酸对两种酶的抑制效果均随没食子酸质量浓度的增大而增强。
关键词:没食子酸;猪胰α-淀粉酶;猪胰蛋白酶;抑制作用
没食子酸为3,4,5-三羟基苯甲酸,具有抗炎
[1]、抑菌
[2]、抗氧化
[3]、抗病毒
[4]、抗肿瘤
[5]、杀锥虫
[6]等多种生物学活性,广泛用于食品、医药、化工、有机合成、轻工及电子等行业
[7-10]。研究表明,对脂质代谢相关酶类的抑制作用是探讨降糖降脂作用机理的一种有效方法
[11],利用α-淀粉酶抑制剂开发的新型口服抗糖尿病药物,可以降低血糖和血脂水平,防治糖尿病、高血脂、肥胖症等疾病
[12]。胰蛋白酶抑制剂在临床上主要用于治疗急性胰腺炎、心脑血管疾病、抑制肿瘤细胞的浸润和转移等
[13],相关资料表明,胰蛋白酶抑制剂也具有降糖降脂活性
[14-15]。有研究利用碘-淀粉比色法探讨没食子酸对α-淀粉酶活性的影响作用
[11,16],但就其影响作用究竟是抑制还是促进效果未能得出一致结论,同时,当前尚未见有关没食子酸对胰蛋白酶活性影响的研究报道。因此,深入研究没食子酸对猪胰α-淀粉酶和蛋白酶的抑制作用,揭示其调节脂质代谢作用效果,将对没食子酸的开发利用和调节脂质代谢功能产品的开发具有重要意义。
1 材料与方法
1.1 材料与试剂
没食子酸(纯度≥98%,批号:NO.20120914)湖南张家界奥威生物科技有限公司;猪胰α-淀粉酶(A3176,500 U/mg)、猪胰蛋白酶(T4799,1 000~2 000 BAEE units/mg) 美国Sigma公司;拜唐平拜耳医药保健有限公司;其他试剂均为国产分析纯。
3,5-二硝基水杨酸(3,5-nitro salicylic acid,DNS)溶液、三氯乙酸(trichloroacetic acid,TCA)溶液分别为终止α-淀粉酶和蛋白酶反应的终止剂。
1.2 仪器与设备
AUW220D精密电子天平 日本岛津公司;pHS22C型pH计 上海雷磁仪器厂;HH数显恒温水浴锅 江苏省金坛市金城国胜实验仪器厂;SK3300LH超声波清洗器上海科导超声仪器有限公司;UV-2600型紫外-可见分光光度计 上海尤尼柯仪器有限公司。
1.3 方法
没食子酸对猪胰α-淀粉酶及胰蛋白酶的抑制作用采用非连续测定和作图法,α-淀粉酶酶活力测定参照Bernfeld法
[17-18]进行,胰蛋白酶酶活力测定参照文献[19]方法,IC
50的计算采用SPSS软件中Profit分析方法,其中响应频率为抑制剂的抑制率,协变量为抑制剂质量浓度。
1.3.1 没食子酸对猪胰α-淀粉酶活性影响条件优化
1.3.1.1 葡萄糖标准曲线制作
称取葡萄糖0.1 g,加蒸馏水定容至50 mL,配制成葡萄糖标准液。准确量取标准液0、0.05、0.10、0.15、0.20、0.25、0.30 mL,分别置于10mL容量瓶中,37 ℃预温5 min后,各加入0.5mL DNS溶液,沸水浴5 min,冷却,加水定容至刻度。以不加葡萄糖溶液为空白,于540 nm波长处测定吸光度。得到标准曲线方程为y = 13.400 5 x+0.069 2(R
2= 0.995 9)。
1.3.1.2 酶质量浓度筛选
取7 支试管,于不同试管中加入不同质量浓度的α-淀粉酶溶液(0.16、0.32、0.48、0.64、0.80、0.96、1.12 mg/mL),与1.0 g/100 mL可溶性淀粉溶液反应,测定不同质量浓度α-淀粉酶与底物反应的关系,并作图考察,选出合适的反应酶质量浓度。
1.3.1.3 反应时间筛选
取5 支试管,于每根试管中分别加入一定质量浓度的α-淀粉酶溶液,测定不同反应时间(5、10、15、20、25 min)下还原性糖生成量,作图确定α-淀粉酶的最适反应时间。
1.3.1.4 底物、酶、抑制剂添加顺序筛选
以1.3.1.3节最适反应时间为基础,将底物可溶性淀粉溶液、猪胰α-淀粉酶、抑制剂没食子酸按以下3 种顺序加入:A)可溶性淀粉溶液、α-淀粉酶、没食子酸于37 ℃分别预热5 min后,一起加入到试管中反应;B)可溶性淀粉溶液与没食子酸37 ℃预热5 min,然后加入α-淀粉酶反应;C)没食子酸与α-淀粉酶37 ℃预热5 min,然后加入可溶性淀粉溶液反应;分析3 种方式下各抑制效果,筛选最佳添加顺序。
1.3.1.5 最优条件下没食子酸对猪胰α-淀粉酶的抑制效果
在不同试管中分别加入质量浓度为1、3、5、7、9、
11、13、15 mg/mL的没食子酸,经过预实验探索,酶与底物反应体积均选0.3 mL。按表1所示添加反应物后,沸水浴5 min,冷却、稀释,于540 nm波长处测定吸光度。其中,阳性对照为拜糖平溶液,背景对照为对应质量浓度的抑制剂及底物溶液。α-淀粉酶抑制剂活力单位定义为:在37 ℃,pH 6.8条件下降低1 个酶活力单位为抑制剂一个抑制活力单位。
表1 猪胰-淀粉酶活性抑制体系
Table1 Reaction systems for inhibition of porcine pancreatic-amylase

加入试剂体积/mL无抑制剂组空白组加抑制剂组阳性对照组背景对照组淀粉溶液0.30.30.30.30.3 α-淀粉酶溶液0.300.30.30没食子酸溶液000.300.3拜糖平溶液0000.30 DNS溶液0.50.50.50.50.5蒸馏水8.99.28.68.68.9
抑制剂对α-淀粉酶的抑制率计算公式为:
式中:A
1、A
2、A
3、A
4分别为540 nm波长处无抑制剂组、空白组、加抑制剂组和背景对照组的吸光度。
1.3.2 没食子酸对猪胰蛋白酶活性影响条件优化
1.3.2.1 酪氨酸标准曲线制作
称取L-酪氨酸0.100 g,用1 mol/L的盐酸60 mL溶解后定容至100 mL,即为1.00 mg/mL的酪氨酸溶液。吸取1.8 mL酪氨酸溶液,用0.1 mol/L盐酸定容至10 mL,即得0.18 mg/mL L-酪氨酸标准溶液。按表2顺序添加后,离心,取上清液,以1号试管为空白,280 nm波长处测定吸光度,并绘制不同质量浓度酪氨酸与吸光度的关系图,获得标准曲线方程为y = 65.944 x+0.024 9(R
2= 0.998 9)。
表2 酪氨酸标准曲线试剂加入量
Table2 Amounts of reagents used for preparation of tyrosine standard curve mL
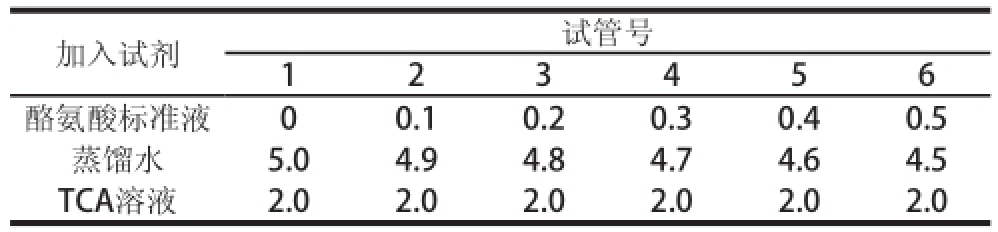
加入试剂试管号1 2 3 4 5 6酪氨酸标准液00.10.20.30.40.5蒸馏水5.04.94.84.74.6 4.5 TCA溶液2.0 2.02.0 2.02.02.0
1.3.2.2 酶质量浓度筛选
取6 支试管,于不同试管中加入不同质量浓度的胰蛋白酶溶液(0.126、0.252、0.378、0.504、0.630、0.756 mg/mL),与1.0 g/100 mL酪蛋白溶液反应,测定不同质量浓度胰蛋白酶与底物反应的关系,并作图考察,选出合适的反应酶质量浓度。
1.3.2.3 反应时间筛选
取6 支试管,于每根试管中分别加入一定质量浓度的胰蛋白酶溶液,测定不同反应时间(5、10、20、30、40、50 min)下产物生成量,作图确定胰蛋白酶的最适反应时间。
1.3.2.4 底物、酶、抑制剂添加顺序筛选
以1.3.2.3节中筛选出的最适反应时间为基础,将底物酪蛋白溶液、猪胰蛋白酶、抑制剂没食子酸按以下3 种顺序加入:A)酪蛋白溶液、胰蛋白酶、没食子酸于40 ℃分别预热5 min后,一起加入到试管中反应;B)酪蛋白溶液与没食子酸40 ℃预热5 min,然后加入胰蛋白酶反应;C)没食子酸与胰蛋白酶40 ℃预热5 min,然后加入酪蛋白溶液反应;分析3 种方式下各抑制效果,筛选最佳添加顺序。
1.3.2.5 最优条件下没食子酸对猪胰蛋白酶的抑制效果
在不同试管中分别加入质量浓度为0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2 mg/mL的没食子酸,经过预实验探索,酶与底物反应体积分别选0.5 mL和1.0 mL。按表3所示添加反应后,立即加入TCA溶液终止反应,摇匀静置,加蒸馏水稀释,离心,取上清液,于280 nm波长处测定吸光度。猪胰蛋白酶抑制剂活力单位定义为:在40 ℃,pH 8.0条件下降低1 个酶活力单位为抑制剂一个抑制活力单位。
抑制剂对猪胰蛋白酶的抑制率计算公式同猪胰α-淀粉酶抑制率计算公式,公式(1)、(2)中A值均为在280 nm波长处的吸光度。
表3 猪胰蛋白酶活性抑制体系
Table3 Reaction systems for inhibition of porcine pancreatic trypsin

加入试剂体积/mL无抑制剂组空白组加抑制剂组背景对照组酪蛋白溶液1.0 1.0 1.0 1.0胰蛋白酶溶液0.5 00.5 0没食子酸溶液000.5 0.5 TCA溶液2.0 2.0 2.0 2.0蒸馏水3.5 4.0 3.0 3.5
2 结果与分析
2.1 没食子酸对猪胰α-淀粉酶酶活性抑制作用
2.1.1 酶质量浓度确定

图1 猪胰α-淀粉酶质量浓度对酶活性的影响
Fig.1 Effect of pancreatic α-amylase concentration on the enzymatic activity
由图1可知,随着酶质量浓度的增加,吸光度增大,淀粉酶质量浓度在0.16~0.64 mg/mL范围内,有较好的线性关系,随着酶质量浓度的增加,底物被快速消耗,酶与底物的反应速率减慢,最终将达到平衡。由图中可以看出,要使酶与底物保持最大反应速率,α-淀粉酶质量浓度选择在0.64 mg/mL较为合适。
2.1.2 反应时间确定
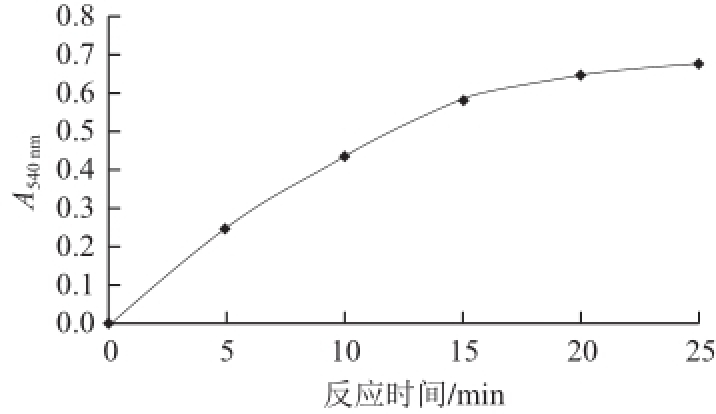
图2 最佳反应时间的选择
Fig.2 Selection of optimal reaction time
还原性糖生成量随反应时间变化的关系如图2所示,当反应时间在0~15 min时,吸光度与时间基本呈线性关系,随着时间延长,吸光度变化减小,还原性糖含量增长 减慢,说明在15 min内的反应速率可认为近似达到初始速率。因此,体系最适反应时间选择15min较为合适。
2.1.3 酶、底物、抑制剂(没食子酸)添加顺序确定
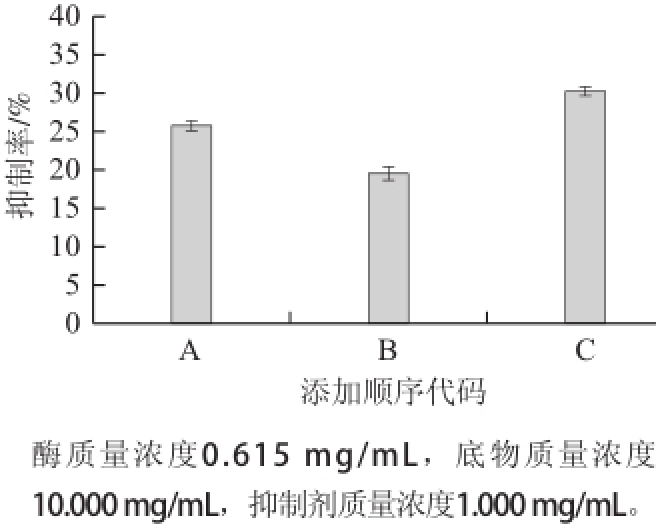
图3 反应体系中添加顺序对抑制作用的影响
Fig.3 Effect of addition sequence of reactants on α-amylase inhibition
由图3可知,没食子酸的A、B、C 3 种加入顺序的抑制率分别为25.97%、19.54%、30.36%。结果表明,A、B、C 3 种添加顺序的抑制率差异不显著(P>0.05),从图3可以看出顺序C(没食子酸与α-淀粉酶先进行预热,再加入淀粉溶液反应)的抑制效果最佳,而顺序B的抑制率相对较小,以顺序C为最佳添加顺序,与庄玲玲
[20]、刘雯
[21]等实验中淀粉酶抑制作用建立所用的添加顺序一致。
2.1.4 最优条件下没食子酸对猪胰α-淀粉酶的抑制效果
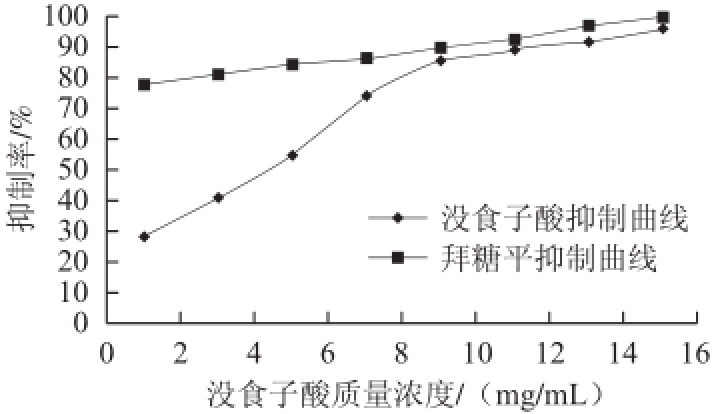
图4 不同质量浓度没食子酸对猪胰α-淀粉酶活性的抑制作用
Fig.4 Inhibitory effect of gallic acid on the activity of porcine pancreatic α-amylase
由图4可知,不同质量浓度的没食子酸对α-淀粉酶活性均有一定的抑制作用,且随着质量浓度的增加,抑制能力逐渐增强。在实验设定的初始质量浓度时,没食子酸的抑制率最低,仅为28.27%。在质量浓度为1~9 mg/mL区间时,没食子酸对α-淀粉酶活性的抑制呈剂量依赖关系,抑制率随着剂量的加大而增大。在此之后,随样品质量浓度的加大,抑制率无明显增长。当没食子酸单体质量浓度达到15 mg/mL时,抑制率达到95.52%。通过测定没食子酸对α-淀粉酶的半抑制浓度I C
50,并与阳性对照药物拜糖平对α-淀粉酶的IC
50进行比较,IC
50越小,表明抑制效果越小。经计算得到,没食子酸对α-淀粉酶的IC
50为3.01 mg/mL,拜糖平对α-淀粉酶的IC
50为0.236 mg/mL。
2.2 没食子酸对猪胰蛋白酶酶活性的抑制作用
2.2.1 酶质量浓度筛选
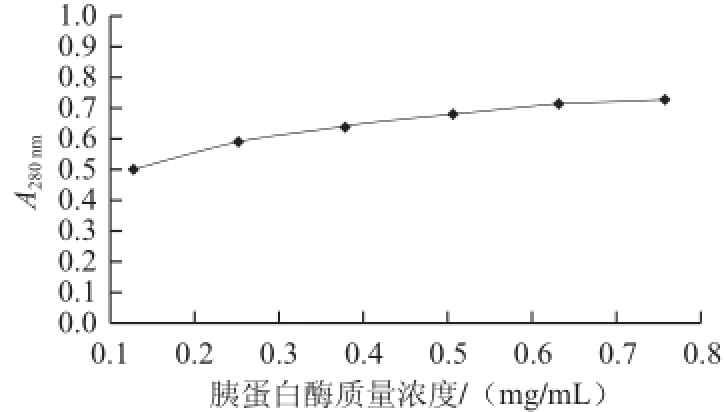
图5 猪胰蛋白酶质量浓度对酶活性的影响
Fig.5 Effect on trypsin concentration on its activity
由图5所示,随着酶质量浓度的增加,吸光度增大。当酶质量浓度达到0.63 mg/mL时,吸光度已趋于饱和,说明酶在这一范围内基本反应完全。因此,酶质量浓度选择在0.63 mg/mL能够保证酶的充分反应。
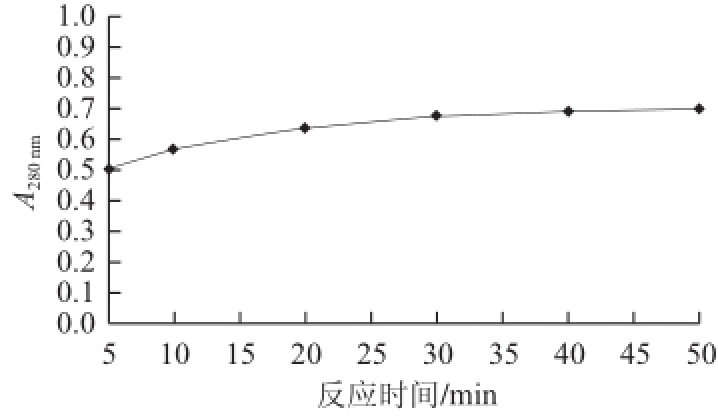
图6 最佳反应时间的选择
Fig.6 Selection of optimal reaction time
2.2.2 反应时间的筛选酪氨酸生成量随反应时间变化的关系如图6所示,当反应时间在0~30 min时,随着时间的增加,酶与底物在不断地反应生成产物。30 min之后,随着时间的延长,吸光度变化很小,说明产物生成速率减慢,酶与底物的反应已较为完全。因此,体系最适反应时间选择30最为合适。
2.2.3 酶、底物、抑制剂(没食子酸)添加顺序筛选
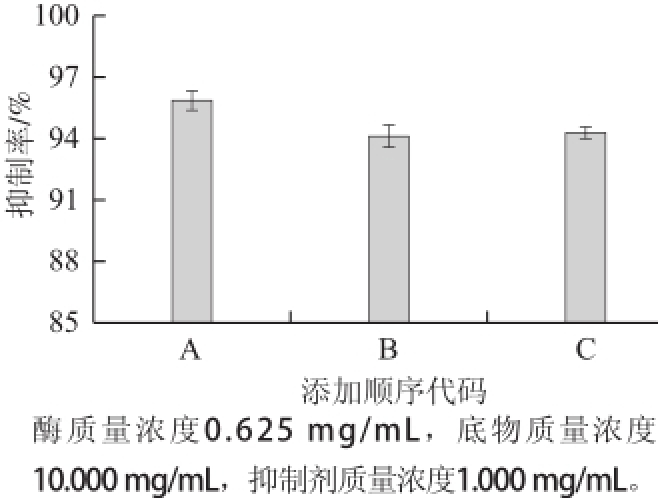
图7 反应体系中添加顺序对抑制作用的影响
Fig.7 Effect of addition sequence of reactants on trypsin inhibition
由图7可知,没食子酸的A、B、C 3种加入顺序的抑制率分别为95.91%、94.08%、94.35%。结果表明,3 种添加顺序的抑制率差异不显著(P>0.05)。对于没食子酸来说,A、B、C 3种添加顺序的抑制率十分接近,其中顺序A的抑制率稍高,顺序C仅比顺序B高出0.27%,说明添加顺序的不同对没食子酸单体抑制作用的影响很小。为了研究没食子酸对胰蛋白酶的抑制作用,避免底物的干扰,结合α-淀粉酶添加顺序的实验结果,选取顺序C为添加顺序。
2.2.4 最优条件下没食子酸对猪胰蛋白酶活性的抑制作用
由图8可知,不同质量浓度的没食子酸对胰蛋白酶活性均呈现很强的抑制作用。在质量浓度仅为0.4 mg/mL时,抑制率就达到94.56%,当质量浓度上升到3.2 mg/mL时,其抑制率为99.24%,已无明显增长。经SPSS软件分析得到,没食子酸对胰蛋白酶的IC
50为0.019 mg/mL。
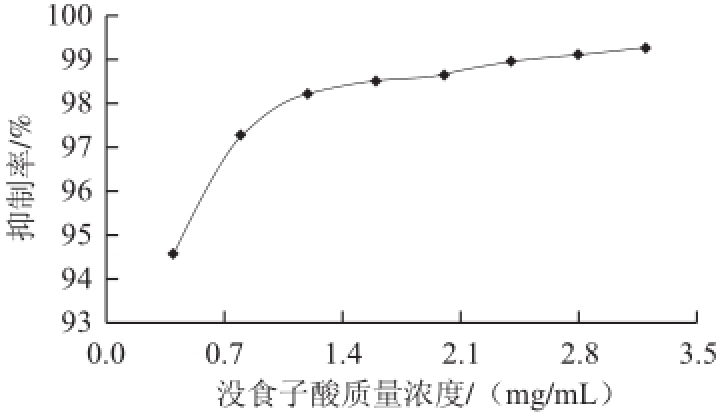
图8 不同质量浓度没食子酸对猪胰蛋白酶活性的抑制作用
Fig.8 Inhibitory effect of gallic acid at various concentrations on the activity of porcine pancreatic trypsin
3 结 论
研究表明,没食子酸对胰α-淀粉酶和胰蛋白酶均有良好的抑制效果,与之前文献报道的没食子酸对α-淀粉酶活性影响效果相符
[11]。当没食子酸质量浓度达到15 mg/mL时,对α-淀粉酶活性最大抑制率为95.52%;当其质量浓度为3.2 mg/mL时,对胰蛋白酶活性最大抑制率达到99.24%。本结果对没食子酸抑制两种胰酶的作用进行了初步研究,为后续揭示其抑制作用机理及没食子酸调节脂质代谢功能产品的开发利用提供了参考。
参考文献:
[1] KIM S H, JUN C D, SUK K, et al. Gallic acid inhibits histamine release and pro-inflammatory cytokine production in mast cells[J]. Toxicological Sciences, 2006, 91(1): 123-131.
[2] CHANWITHEESUK A, TEERAWUTGULRAG A, KILBUM J D, et al. Antimicrobial gallic acid from Caesalpinia mimosoides Lamk[J]. Food Chemistry, 2007, 100(3): 1044-1048.
[3] PRISCILLA D H, PRINCE P. Cardioprotective effect of gallic acid on cardiac troponin-T, cardiac marker enzymes, lipid peroxidation products and antioxidants in experimentally induced myocardial infarction in Wistar rats[J]. Chemico-Biological Interactions, 2009,179(2): 118-124.
[4] KRATZ J M, ANDRIGHETTI-FROHNER C R, LEAL P C, et al. Evaluation of anti-HSV-2 activity of gallic acid and pentyl gallate[J]. Biological and Pharmaceutical Bulletin, 2008, 31(5): 903-907.
[5] LU Yong, JIANG Feng, JIANG Hao, et al. Gallic acid suppresses cell viability, proliferation, invasion and angiogenesis in human glioma cells[J]. European Journal of Pharmacology, 2010, 641(2): 102-107.
[6] 柯发敏. 没食子酸的研究进展[J]. 泸州医学院学报, 2011, 32(4): 440-442.
[7] 常连举, 张宗和, 黄嘉玲, 等. 没食子酸的制备与应用综述[J]. 生物质化学工程, 2010, 44(4): 48-52.
[8] RASOOL M K, SABINA E P, RAMYA S R, et al. Hepatoprotective and antioxidant effects of gallic acid in paracetamol-induced liver damage in mice[J]. Journal of Pharmacy and Pharmacology, 2010,62(5): 638-643.
[9] 杨顺楷, 杨亚力. 酶法转化五倍子单宁酸生产没食子酸[J]. 精细与专用化学品, 2005, 13(5): 12-15.
[10] PASANPHAN W, CHIRACHANCHAI S. Conjugation of gallic acid onto chitosan: an approach for green and water-based antioxidant[J]. Carbohydrate Polymers, 2008, 72(1): 169-177.
[11] 张冬英, 邵宛芳, 刘仲华, 等. 普洱茶功能成分单体降糖降脂作用研究[J]. 茶叶科学, 2009, 29(1): 41-46.
[12] 张琪, 陈宁, 陈国广, 等. 小麦α-淀粉酶抑制剂降血糖作用的实验研究[J]. 中国新药杂志, 2006, 15(6): 433-435.
[13] 李夏, 曾名勇, 董士远, 等. 胰蛋白酶抑制剂及其抗肿瘤活性研究进展[J]. 食品研究与开发, 2007, 28(4): 163-166.
[14] 陈晓明, 郭瑞华. 大豆胰蛋白酶抑制剂的分离提纯及降糖活性研究[J].时珍国医国药, 2009, 20(4): 903-904.
[15] KISHIMURA H, FUKUMORITA K, ADACHI K, et al. A trypsin inhibitor in the viscera of Japanese common squid (Todarodes pacifi cus) elicits insulinotropic effects in diabetic GK rats[J]. Journal of Food Biochemistry, 2012, 36(1): 93-98.
[16] 丁阳平, 张曦, 周洁, 等. 没食子酸及其衍生物对α-淀粉酶作用机制研究[J]. 食品工业科技, 2012, 33(2): 167-169.
[17] 施特尔巴赫B. 酶的测定方法[M]. 钱喜渊, 译. 北京: 中国轻工业出版社, 1992: 37-41.
[18] 李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J].食品工业科技, 2013, 34(18): 75-77.
[19] 陈文峰, 屠幼英, 吴媛媛, 等. 黑茶紧压茶浸提物对胰蛋白酶活性的影响[J]. 中国茶叶, 2002, 24(3): 16-17.
[20] 庄玲玲, 丁婷, 吴慧平. 夏枯草提取物对α-淀粉酶抑制作用的初步研究[J]. 现代中西医结合杂志, 2009, 18(19): 2243-2245.
[21] 刘雯, 裘晓丹, 雷芳, 等. 茶碱对胰α-淀粉酶的抑制类型及光谱性质[J].天然产物研究与开发, 2008, 20(2): 298-301.
Inhibitory Effect of Gallic Acid on Pancreatic α-Amylase and Trypsin
QIN Yu, SHAO Yuanyuan, XIONG Shuo, TENG Jie, FENG Jinyu, XIAO Wenjun*
(National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients,Hunan Agricultural University, Changsha 410128, China)
Abstract:The inhibitory effect of gallic acid on the activities of pancreatic α-amylase and trypsin was studied by varying enzyme concentration, the sequence of adding substrate, enzyme and gallic acid in reaction systems, reaction time and gallic acid concentration. Results showed that the maximum inhibition rate (95.52%) of pancreatic α-amylase was achieved by pre warming the enzyme at a c oncentration of 0. 64 mg/mL in the presence of gallic acid at 37 ℃ for 5 min before addition of 1 g/100 mL starch and allowing the reaction to proceed for 15 min. Gallic acid exhibited the strongest inhibition on pancreatic trypsin (by 99.24%) by prewarming their mixture at 40 ℃ for 5 min followed by addition of 1 g/100 mL casein as the substrate and permitting the reaction to take place for 30 min. The inhibitory effect of gallic acid on both en zyme activities was positively associated with its concentration.
Key words:gallic acid; pancreatic α-amylase; pancreatic trypsin; inhibitory effect
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2015)03-0041-05
doi:10.7506/spkx1002-6630-201503008
收稿日期:2014-02-22
基金项目:“十二五”国家科技支撑计划项目(2011BAD10B00;2012BAD33B11)
作者简介:秦昱(1991—),女,硕士研究生,研究方向为茶及植物功能成分化学。E-mail:qinyu199175@163.com
*通信作者:肖文军(1969—),男,教授,博士,研究方向为植物功能成分利用。E-mail:xiaowenjun88@sina.com