表1 样品编号和对应名称
Table1 Numbers and names of the samples

样品编号12345678样品名称鲜叶萎凋2 h萎凋4 h萎凋6 h萎凋8 h萎凋10 h萎凋12 h萎凋14 h样品编号9101112131415样品名称萎凋16 h揉捻1 h揉捻2 h发酵2 h发酵4 h发酵2 h干燥样发酵4 h干燥样
罗理勇 1,2,曾 亮 1,2,李洪军 1,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学茶叶研究所,重庆 400715)
摘 要:以四川小叶种群体品种的一芽二叶为原料,采用传统工艺制备川红工夫,检测其茶多酚、黄酮、儿茶素、茶黄素、茶红素的含量,以及多酚氧化酶和过氧化物酶活性的变化,分析多酚类化合物含量与其形成相关酶活性之间的关系。结果表明:茶多酚和儿茶素含量在加工过程中呈现下降趋势;黄酮、茶黄素和茶红素含量在揉捻阶段显著增加,黄酮和茶黄素含量在发酵过程中较揉捻时降低;多酚氧化酶和过氧化物酶活性在揉捻阶段呈较显著下降趋势。通过相关性分析发现:茶多酚含量与多酚氧化酶(polyphenoloxidase,PPO)和过氧化物酶(peroxidase,POD)活性之间存在极显著正相关;茶黄素含量与POD活性呈极显著负相关;茶红素含量与POD活性及PPO活性分别呈极显著和显著负相关。适当延长揉捻时间和减少发酵时间,或是在发酵过程中采用提高多酚形成相关酶活性的方法,可制备出高茶黄素含量的川红工夫。
关键词:川红工夫;多酚;多酚氧化酶;过氧化物酶;相关性分析
四川工夫红茶(简称川红工夫)诞生于20世纪50年代,是四川、重庆地区采用当地品种加工制成的一种独特风味红茶,也是我国的传统出口茶类之一。川红工夫原产于四川省宜宾地区,在国际市场上有较高的声誉,其品质特点是条索紧细、毫峰显露、色泽乌润、香气鲜嫩、滋味鲜爽、汤色红亮、叶底嫩匀 [1]。制作川红工夫常用的品种有早白尖和四川小叶种(群体品种),其中四川小叶种群体品种是最常用且最具特色的,常被选为制作高品质川红工夫的原材料。
红茶的加工工序有萎凋、揉捻、发酵和干燥,其中萎凋和发酵对红茶品质的形成有至关重要的作用。茶鲜叶中的化学成分及部分酶活性决定了制成红茶的品质特征,其中对品质影响最为重要的是多酚类物质、多酚氧化酶(polyphenoloxidase,PPO)和过氧化物酶(peroxidase,POD)。红茶萎凋工序中的PPO活性高低,对红茶后期的发酵程度有较大影响 [2]。发酵工序中对多酚类物质转化起关键作用的酶类主要为PPO和POD [3]。针对酶活性对红茶品质的影响,前人研究了红茶发酵过程中添加外源多酚来提高发酵叶中的PPO活性,结果表明可提高茶黄素含量,改善红茶汤色,并增加红茶香气 [4]。红茶发酵过程中,儿茶素发生氧化聚合反应,主要生成茶黄素和茶红素 [5]。自1957年Robert发现茶叶中的茶黄素以来,大量的科学研究证明其具有多种功效,如抗氧化、预防心血管疾病、降血糖等作用 [6-7],并作为一种天然色素广泛使用。当前研究表明茶黄素和茶红素是红茶重要的呈味物质与色泽因子,且与红茶品质呈正相关 [3];影响茶黄素和茶红素形成的重要工艺环节是萎凋和发酵工艺 [8]。
由于川渝地区茶叶的内含成分丰富,特别是多酚类物质含量较东部茶区高,因此生产的工夫红茶也具有其独特的品质。基于红茶加工过程中多酚类物质的转化是形成红茶主要滋味特征的关键,本研究依据传统川红工夫的加工工艺,从鲜叶到制成品系统研究加工过程中多酚类物质及其相关酶的变化规律,为加工高茶黄素含量川红工夫提供理论参考。
1.1 材料与试剂
茶树鲜叶:2013年4月采集重庆市茶业集团二圣茶厂的四川小叶种群体品种,采摘标准为一芽二叶。
硫酸亚铁、酒石酸钾钠、芦丁、三氯化铝、草酸、4-甲基-2-戊酮、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、柠檬酸、磷酸氢二钠、邻苯二酚、愈创木酚、30%过氧化氢等 重庆滴水实验仪器有限公司;二苯基硼酸-2-氨基乙基酯 北京百灵威科技有限公司;表没食子儿茶素((-)-epigallocatechin,EGC)、儿茶素(catechin,C)、表没食子儿茶素没食子酸酯((-)-epigallocatechingallate,EGCG)、表儿茶素(L-epicatechin,EC)、没食子儿茶素没食子酸酯((-)-gallocatechingallate,GCG)、表儿茶素没食子酸酯((-)-epicatechingallate,ECG)标准品 成都普瑞法科技开发有限公司。
1.2 仪器与设备
LC-20A高效液相色谱、UV-2450紫外-可见分光光度计 日本岛津公司;SCIENTZ-30ND冷冻干燥设备宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 加工方法和取样方法
川红工夫加工工艺流程:鲜叶(10 kg)→ 萎凋(16 h)→ 揉捻(2 h)→发酵(4 h)→干燥(整个加工过程的环境温度控制在(30±2)℃)
加工过程中取样方法:萎凋阶段,从鲜叶(萎凋0 h)开始,每2 h取样1 次,至萎凋16 h;揉捻阶段,在揉捻1、2 h时各取样1 次;发酵阶段,在发酵2、4 h时各取样1 次;干燥阶段,分别取发酵2、4 h样品烘至水分含量低于5%。取样编号和名称见表1。
表1 样品编号和对应名称
Table1 Numbers and names of the samples

样品编号12345678样品名称鲜叶萎凋2 h萎凋4 h萎凋6 h萎凋8 h萎凋10 h萎凋12 h萎凋14 h样品编号9101112131415样品名称萎凋16 h揉捻1 h揉捻2 h发酵2 h发酵4 h发酵2 h干燥样发酵4 h干燥样
加工过程样品前处理方法:萎凋、揉捻和发酵阶段样品各取230 g,采用液氮速冻,其中200 g样品真空冷冻干燥后,保存于-20 ℃冰箱用于生化成分测定;另30 g样品保存于液氮中用于酶活性分析。干燥阶段样品分别取2、4 h发酵叶1 kg,于90 ℃下烘至水分含量低于5%,保存于-20 ℃冰箱用于检测生化成分。
1.3.2 茶样干物质(dry matter,DM)含量的测定
参照GB/T 8303—2013《茶 磨碎试样的制备及其干物质含量测定》 [9]。
1.3.3 茶多酚(tea polyphenols,TP)含量的测定
采用酒石酸亚铁比色法 [10]。
1.3.4 儿茶素(catechins)含量的测定
茶溶液制备 [9]后用0.45 μm微孔滤膜过滤,滤液采用高效液相色谱检测 [11]。色谱条件:色谱柱:Hypersil BDS C 18柱(250 mm×4.6 mm,5 μm);流速:0.9 mL/min;检测波长:278 nm;柱温:35 ℃;进样量:10 μL;流动相:A 2%冰乙酸,B 纯甲醇,梯度洗脱程序见表2。
表2 儿茶素各组分检测梯度洗脱程序
Table2 Linear gradient elution for separation of catechins components

时间/min流动相A体积分数/%流动相B体积分数/%持续时间/min 0.01821825 25.0075255 30.0065352 32.0085157 37.00Stop
1.3.5 黄酮化合物含量的测定
采用三氯化铝比色法 [12]。
1.3.6 茶黄素(theafl avins,TF)和茶红素(thearubigins,TR)含量的测定
茶黄素和茶红素检测分别采用Snell [13]和Roberts [5]等所使用的方法。准确称取9.00 g(精确至0.01 g)磨碎茶样,加沸蒸馏水375 mL,在水浴中提取10 min,取出摇匀,趁热用滤纸过滤于干燥的三角瓶中,作为检测茶黄素和茶红素的母液。
茶黄素含量测定:取10 mL母液于分液漏斗中,加入10 mL 4-甲基-2-戊酮(isobutylmethylketone,IBMK),振荡10 min,静置分层。取2 mL上层溶液,加入4 mL无水乙醇和2 mL二苯基硼酸-2-氨基乙基酯溶液,混匀,反应15 min,在625 nm波长处测定吸光度A,以无水乙醇与IBMK体积比为1:1的溶液作为空白对照。按照式(1)计算茶黄素含量。
式中:A 625 nm为待测样品溶液在625 nm波长处的吸光度;47.9为茶黄素标准液在625 nm波长处的转换因子;DM表示茶叶干物质百分含量/%。
茶红素含量测定:取30 mL母液于分液漏斗中,加入30 mL IBMK,轻轻混匀(避免产生乳化层),静置,待分层用。取4 mL的IBMK层溶液,用甲醇定容25 mL,为A液,待测;取2 mL的水层溶液,加入2 mL饱和草酸溶液和6 mL去离子水,用甲醇定容25 mL,为B液,待测;取15 mL的IBMK层溶液,加入15 mL 2.5%的碳酸氢钠溶液,在分液漏斗中迅速强烈振荡30 s,立即去掉水层;取4 mL IBMK层溶液,用甲醇定容至25 mL,为C液,待测。以甲醇作为空白对照,在380 nm波长处测定吸光度A。按照式(2)计算茶红素含量。
式中:A A、A B、A C分别为A、B和C液在380 nm波长处的吸光度;0.02、0.733为0.02%的茶红素在380 nm波长处的吸光度;375、9表示9 g茶样采用375 mL蒸馏水浸提;6.25为A、B、C液的稀释倍数;DM表示茶叶干物质百分含量/%。
1.3.7 酶活性的测定
粗酶液的提制:称取茶叶(加工过程样品)1.25 g,液氮研磨,加聚乙烯吡咯烷酮1.25 g,石英砂1.25 g,研磨充分后加入pH 5.6柠檬酸-磷酸氢二钠缓冲液定容至25 mL,于4 ℃条件下、4 000 r/min离心5 min,取上清液再于4 ℃、10 000 r/min离心20 min,上清液即为粗酶液。
多酚氧化酶活力测定 [14]:取3 mL反应混合液(0.1 mol/L pH 5.6柠檬酸-磷酸氢二钠缓冲液、0.1%脯氨酸、1%邻苯二酚体积比10:2:3)于37 ℃水浴5 min,加0.5 mL上述粗酶液于37 ℃条件下反应10 min,加入3 mL 1 mol/L偏磷酸终止反应,以不含邻苯二酚的反应液为空白对照,420 nm波长处检测吸光度(A 420 nm)。以每克样品每分钟A 420 nm增加0.01为1个酶活力单位(U)。
过氧化物酶活力测定 [15]:取上述粗酶液1 mL,加入1 mL 0.05 mol/L愈创木酚,2 mL 0.1 mol/L pH 5.6柠檬酸-磷酸氢二钠缓冲液、1 mL 0.8%过氧化氢,混合均匀,立即放入紫外分光光度计中于435 nm波长处测定其5 min内吸光度(A 435 nm)变化。以每克样品每分钟A 435 nm增加0.01为1个酶活力单位(U)。
1.4 数据处理
每个样品均设3 次重复。数据以
 表示,方差分析和相关性分析采用SPSS 19.0软件进行运算。
表示,方差分析和相关性分析采用SPSS 19.0软件进行运算。
2.1 川红工夫加工过程中主要酚类物质的变化
茶叶中的多酚类物质是形成红茶品质最重要的物质之一,其在鲜叶中的含量以及加工过程中量与质的变化是红茶制造中品质形成的关键。川红工夫加工过程中茶多酚含量、儿茶素总量(total catechins,TC)和黄酮含量的变化见图1。
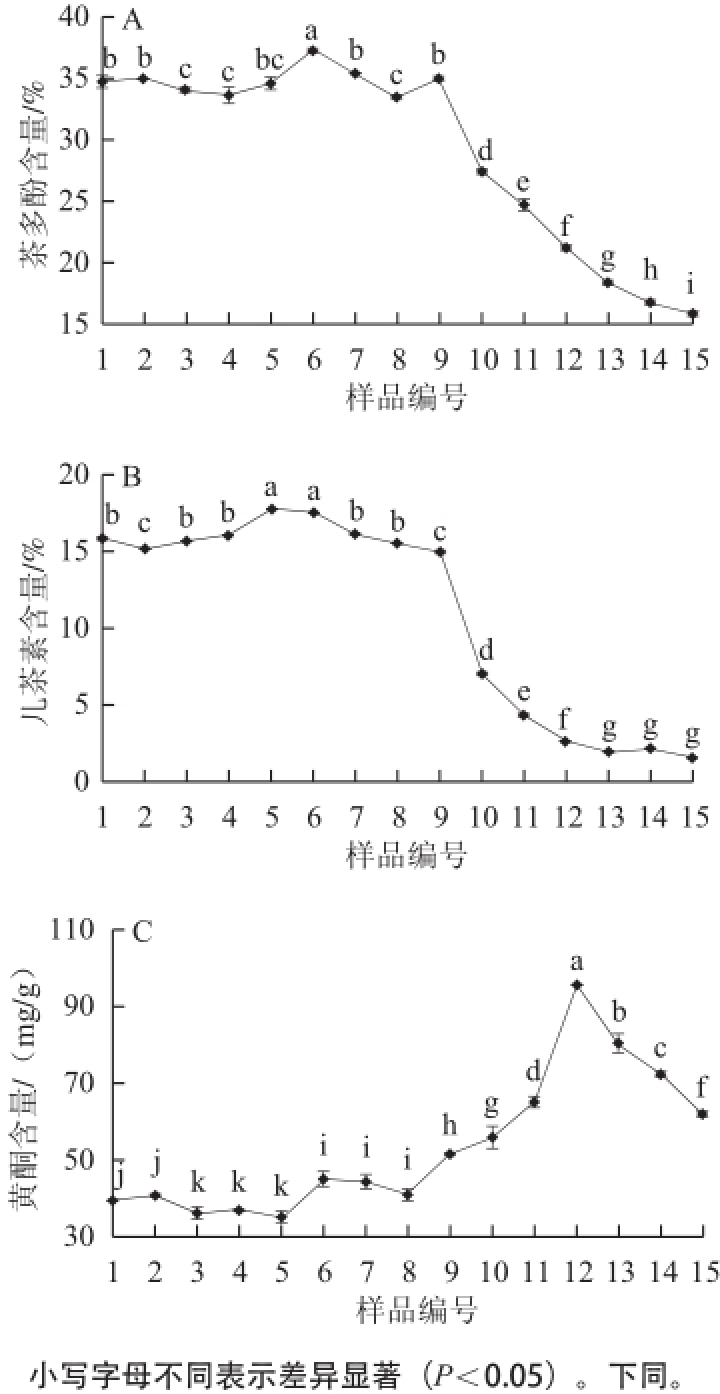
图1 川红工夫红茶加工过程中主要酚类物质含量的变化
Fig.1 Changes in phenolic compound contents during the manufacturing process of Chuanhong Gongfu tea
如图1所示,茶多酚在鲜叶萎凋阶段变化比较平稳,在萎凋10 h时达到最高水平;进入揉捻阶段以后含量急剧下降,可能是由于多酚类物质在PPO和POD的作用下发生酶促氧化反应,生成茶黄素类和茶红素类等物质,并有部分与蛋白质结合成不溶性化合物;2 h和4 h发酵叶制成的川红工夫干燥茶样中的茶多酚含量分别仅保留鲜叶的48.40%和45.38%。儿茶素作为多酚类物质的主体,在鲜叶萎凋阶段,随着鲜叶的失水其含量有一个先增加后降低的趋势,萎凋8 h时达到最高;在揉捻、发酵、干燥阶段儿茶素氧化转化的进一步加强,儿茶素发生氧化缩合作用生成茶黄素类和茶红素类,导致其含量急剧减少;最后2 h和4 h发酵叶制成的川红工夫干燥茶样中的儿茶素转化率分别达到86.69%和89.91%。黄酮化合物在制成品中的含量较鲜叶中显著增加,主要表现为在鲜叶萎凋阶段变化不明显;进入揉捻阶段以后含量明显增加;发酵2 h时达到最高,而后逐渐下降;2 h和4 h发酵叶制成的川红工夫干燥茶样中的黄酮含量分别为72.21、62.18mg/g,对比鲜叶分别增加了179.25%和151.02%,制成的川红工夫干燥茶样中黄酮化合物含量显著上升,可能与黄酮苷在红茶加工过程中的转化有关 [16-17]。
2.2 川红工夫加工过程中儿茶素含量的变化
表3 川红工夫加工过程中儿茶素组分含量变化
Table3 Changes in contents of catechins components during the manufacturing process of Chuanhong Gongfu tea

注:同列小写字母不同表示差异显著(P<0.05)。
样品编号EGC含量 /%C含量/%EC含量/%非酯型儿茶素含量/%EGCG含量/%GCG含量/%ECG含量/%酯型儿茶素含量/% 12.75±0.03 b0.20±0.01 f0.97±0.01 d3.92±0.05 i9.58±0.03 d0.18±0.01 d2.15±0.01 d11.91±0.02 j22.35±0.03 e0.26±0.01 e0.94±0.02 d3.55±0.04 g9.30±0.02 f0.18±0.01 cd2.17±0.02 cd11.65±0.03 h32.66±0.22 c0.25±0.01 e0.96±0.02 d3.88±0.05 i9.37±0.02 e0.19±0.01 c2.19±0.03 cd11.75±0.02 i42.68±0.04 c0.41±0.02 b1.04±0.03 c4.13±0.07 j9.57±0.01 d0.18±0.01 cd2.20±0.02 c11.95±0.01j 53.01±0.02 a0.37±0.04 c1.09±0.02 b4.47±0.02 k10.70±0.03 a0.19±0.01 cd2.36±0.02 b13.25±0.05 l62.56±0.03 d0.44±0.02 ab1.18±0.02 a4.18±0.04 j10.25±0.03 b0.21±0.01 b2.90±0.03 a13.36±0.00 m72.67±0.02 c0.30±0.04 d0.94±0.01 d3.90±0.08 i9.82±0.02 c0.22±0.01 a2.18±0.04 cd12.22±0.02 k82.65±0.15 c0.29±0.01 de0.88±0.02 e3.82±0.02 h9.36±0.04 e0.22±0.01 a2.16±0.03 cd11.74±0.01 i92.71±0.05 bc0.29±0.01 de0.83±0.02 f3.83±0.01 h8.78±0.05 g0.23±0.01 a2.13±0.02 d11.14±0.03 g101.13±0.03 f0.45±0.03 a0.42±0.03 g2.00±0.04 f3.37±0.04 h0.19±0.01 c1.40±0.03 e4.96±0.01 f110.88±0.04 g0.44±0.01 ab0.36±0.03 h1.68±0.09 e1.50±0.03 i0.19±0.01 cd0.90±0.01 f2.59±0.02 e120.66±0.03 h0.39±0.02 bc0.22±0.01 i1.27±0.06 d0.75±0.02 j0.15±0.01 e0.41±0.04 g1.30±0.06 d130.57±0.04 i0.34±0.01 cd0.20±0.02 ij1.11±0.07 c0.47±0.02 l0.14±0.01 f0.19±0.02 h0.80±0.00 b140.56±0.03 i0.31±0.01 d0.19±0.01 ij1.06±0.05 b0.68±0.01 k0.13±0.01 f0.23±0.04 h1.04±0.04 c150.47±0.04 k0.30±0.01 d0.18±0.02 j0.96±0.07 a0.35±0.01 m0.12±0.01 f0.11±0.02 i0.58±0.02 a
儿茶素是茶叶中主要的多酚类物质,其含量约占茶多酚总量的70%~80%;研究较多的儿茶素主要包括6 种:EGCG、C、EGC、EC、GCG和ECG。川红工夫加工过程中儿茶素含量变化见表3。EGCG在萎凋阶段,萎凋8 h含量达到最高,为10.70%,可能是在酶的作用下,促进了前体物质的转化,同时由于含水量的下降导致EGCG占干质量的比例增加,进而导致其含量有上升过程 [3];随着萎凋的继续,茶叶进一步失水,儿茶素开始发生转化,在萎凋16 h含量下降至8.78%;进入到揉捻阶段,EGCG转化速率迅速,在揉捻2 h时,其含量仅为1.50%;发酵和干燥后EGCG的含量进一步减少,最终含量下降至0.35%;2 h和4 h发酵叶制成的川红工夫干燥茶样中的EGCG含量分别为最初鲜叶中的0.07%和0.04%。EGC、ECG和EC的变化规律类似EGCG,在萎凋阶段出现先上升后下降的趋势,EGC含量在萎凋8 h时达到最高,ECG和EC含量在萎凋10 h时达到最高,且这3 种儿茶素在进入揉捻后转化非常迅速,2 h和4 h发酵叶制成的川红工夫干燥茶样中的EGC、ECG和EC含量分别为 0.56%、0.23%、0.19%和0.47%、0.11%、0.18%,且分别为最初鲜叶中含量的20.36%、10.70%、19.59%和17.09%、5.12%、18.56%,主要是因为在PPO的催化下,EC和ECG被氧化成邻醌,EGC和EGCG被氧化成联苯邻醌,邻醌类物质在发酵过程中可氧化其他物质而还原,其中部分还原形成双黄烷醇,另外部分经氧化缩合形成茶黄素类物质和茶红素类物质 [17-18]。C和GCG在整个加工过程中变化较小,C略有增加,可能是儿茶素或是茶多酚的转化形成C [19]。非酯型儿茶素的含量从揉捻过程开始呈现较明显下降,揉捻1 h和2 h分别降低为鲜叶中含量的51.02%和42.86%;之后的发酵和干燥过程继续下降,发酵2 h和发酵4 h干燥样的非酯型儿茶素含量分别为鲜叶含量的27.04%和24.49%。在整个川红工夫加工过程取样中,酯型儿茶素含量的变化趋势类似非酯型儿茶素,但是从发酵开始其下降程度较非酯型儿茶素更强,发酵2 h和发酵4 h的茶样其酯型儿茶素含量分别降至鲜叶中含量的10.92%和6.72%。
2.3 川红工夫加工过程中茶黄素和茶红素含量的变化

图2 川红工夫加工过程中茶黄素(A)和茶红素(B)含量的变化
Fig.2 Changes in contents of theaflavins (A) and thearubigins (B)during the manufacturing process of Chuanhong Gongfu
由图2A可知,茶黄素含量在萎凋过程中随着鲜叶失水量的增加以及萎凋的进行呈现递增趋势,萎凋16 h茶黄素含量增加至5.20 μmol/g,是鲜叶中含量的6.67 倍;进入揉捻阶段后增加趋势更明显,揉捻2 h时达到最高水平为15.91 μmol/g,是鲜叶中含量的20.39 倍;但是随着后期的发酵和干燥,茶黄素的量呈现下降趋势,2 h和4 h发酵叶制成的川红工夫干燥茶样中的茶黄素含量分别为12.52、11.33 μmol/g,分别为鲜叶中含量的16.05 倍和14.53 倍,可能是因为茶黄素本身的自动氧化和偶联氧化作用,形成了茶红素类等物质 [3,19]。
由图2B可知,差红素含量在萎凋2~16 h的变化都比较平缓;在进入揉捻过程中,随着儿茶素发生酶促反应,茶红素类物质开始大量形成,含量急剧增加 [3],揉捻2 h时茶红素的含量为12.61%,是鲜叶中含量的2.79 倍;在后期发酵和干燥过程中,部分茶黄素和茶黄素形成过程中的中间产物发生氧化作用,茶红素类物质的含量仍在稳定增加,2 h和4 h发酵叶制成的川红工夫干燥茶样中的茶红素含量分别为17.43%和18.90%,分别为鲜叶中含量的的3.86 倍和4.19 倍。
2.4 川红工夫加工过程中多酚氧化酶和过氧化物酶活性的变化
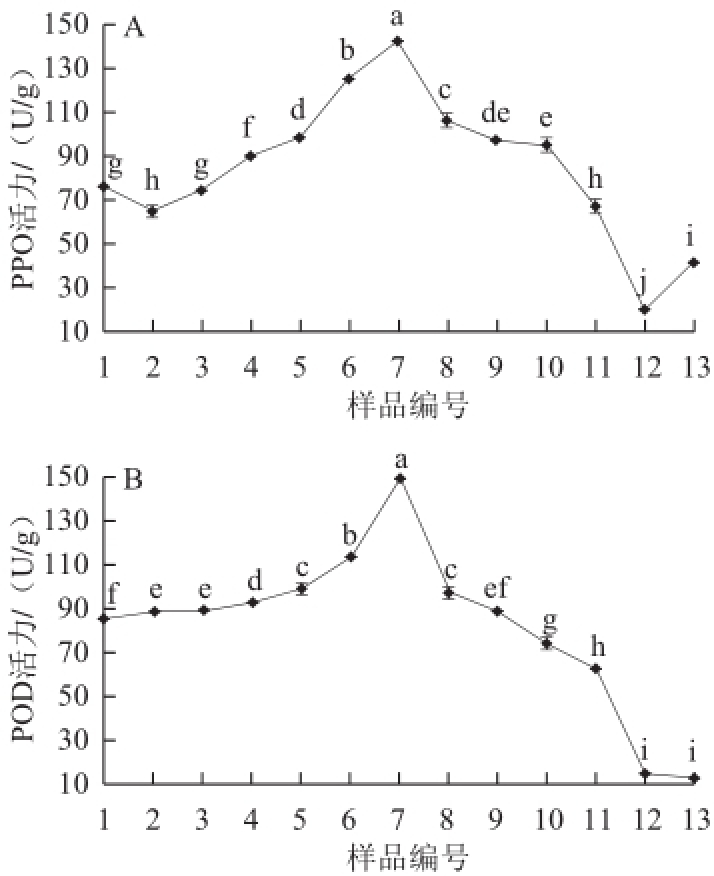
图3 川红工夫加工过程中多酚氧化酶(A)和过氧化物酶(B)活性变化
Fig.3 Changes in PPO (A) and POD (B) activities in the manufacturing process of Chuanhong Gongfu tea
PPO和POD是茶叶中的两种主要氧化酶,也是茶叶中多酚类物质形成和转化的关键酶类,它们在红茶萎凋和发酵过程中起着非常重要的作用 [17,20]。由图3可知,随着萎凋时间的延长,鲜叶中PPO和POD活性均在萎凋12 h出现了一个高峰。由图3A可知,鲜叶萎凋过程前期时呈下降趋势,在萎凋2 h和4 h时,PPO的活力分别为64.53、74.27 U/g,下降为鲜叶中酶活力的84.32%和97.04%,之后的萎凋过程中PPO活性逐渐上升,并在萎凋12 h的时候达到最高值,此时PPO活力为142.67 U/g,为鲜叶中酶活力的191.07%,这可能因为是萎凋伴随着一系列的物理化学变化,使pH向酸性方向偏移,有利于保持萎凋叶PPO的较高活性 [17,21-23];至萎凋16 h时PPO活力为97.20 U/g,为鲜叶中酶活力的127.00%,其原因可能是继续萎凋,样品将失水过多,从而导致酶蛋白分解,故PPO活性呈现下降趋势。在揉捻阶段,酶活性呈现下降趋势,从揉捻1 h的酶活力95.07 U/g降至揉捻2 h酶活力66.93 U/g,相比鲜叶中的酶活力从124.22%降至87.46%,可能是萎凋叶经揉捻,破坏了细胞的结构,膜透性增加,使细胞质的PPO酶蛋白和液泡中的多酚类物质充分接触并结合形成不溶性复合物,同时机械摩擦产热和有机物质的氧化放热,更加快了这种不溶性复合物的形成,导致PPO活性下降速度的加快 [21,23]。在发酵阶段,由于多酚类物质和酶结合形成不溶性的复合物,而且酶促氧化产物的剧增对PPO活性产生了反馈抑制,所以酶的活性持续下降,PPO活性继续降低 [22,24],在发酵2 h时PPO酶活力为20.00 U/g,降至鲜叶中酶活力的26.13%,而在发酵4 h时,PPO活性又有所上升,相比鲜叶中的酶活力上升至53.66%。
由图3B可知,鲜叶中POD酶活力为85.80 U/g,在萎凋0~12 h酶活性呈现一个上升趋势,12 h时酶活力达到最高 [23],为149.73 U/g,增加为鲜叶酶活力的174.51%,12~16 h的萎凋过程中酶活性呈现下降趋势,至萎凋16 h,POD酶活力为88.60 U/g,为鲜叶酶活力的103.27%。之后的揉捻和发酵过程中POD的酶活性均呈现下降趋势,揉捻2 h酶活力为62.87 U/g,降至为鲜叶中酶活力的73.27%;发酵4 h酶活力为12.87 U/g,降至为鲜叶中酶活力的15.00%。
2.5 多酚类物质含量及相关酶活性的相关性分析
表4 多酚类物质含量及相关酶活性的相关性分析
Table4 Correlation analyses of polyphenols contents and the activities of enzymes responsible for their formation

注:**. 表示在 0.01 水平(双侧)上显著相关;*. 表示在 0.05 水平(双侧)上显著相关。
项目茶多酚含量茶黄素含量茶红素含量PPO活性POD活性儿茶素总量酯型儿茶素含量茶黄素含量-0.889**茶红素含量-0.929**0.888** PPO活性0.743**-0.524-0.654* POD活性0.890**-0.701**-0.812**0.920**儿茶素总量0.976**-0.932**-0.894**0.713**0.855**酯型儿茶素含量0.978**-0.935**-0.896**0.713**0.857**1.000**非酯型儿茶素含量0.963**-0.917**-0.876**0.700**0.834**0.995**0.993**
对多酚类物质含量及相关酶活性进行Pearson分析,结果见表4。除茶黄素含量和PPO活性之间没有显著相关性外,其他的多酚类物质含量与其相关酶活性之间都存在着显著或极显著相关性。其中茶多酚含量与茶黄素、茶红素、儿茶素总量、酯型儿茶素和非酯型儿茶素含量,以及PPO和POD活性之间都存在极显著相关性;茶黄素含量与茶红素、儿茶素总量、酯型儿茶素、非酯型儿茶素含量,以及POD活性之间也都存在极显著相关性;茶红素含量与儿茶素总量、酯型儿茶素、非酯型儿茶素含量和POD活性之间存在极显著相关性,与PPO活性之间存在显著相关性;PPO活性与儿茶素总量、酯型儿茶素和非酯型儿茶素含量,以及POD活性之间都存在极显著相关性;POD活性与儿茶素总量、酯型儿茶素和非酯型儿茶素含量之间都存在极显著相关性;儿茶素总量与酯型儿茶素和非酯型儿茶素含量之间都存在极显著相关性;酯型儿茶素含量与非酯型儿茶素含量之间存在极显著相关性。
以制作高茶黄素红茶为主要研究目的,对茶黄素含量与其他的多酚类物质含量和相关酶活性之间的相关性作进一步的了解;且对茶黄素与儿茶素总量和PPO和POD活性(E PPO、E POD)做线性回归分析,结果如下。
茶黄素含量与儿茶素总量相关系数为-0.932,呈现极显著负相关,即茶黄素含量越高,儿茶素总量则会越低;茶黄素含量与POD和PPO活性之间的相关系数分别为-0.701和-0.524,说明茶黄素的生成与POD和PPO有负相关,即茶黄素生成量的增多,伴随着POD和PPO活性的下降;茶黄素含量与酯型儿茶素和非酯型儿茶素含量之间的相关系数分别为-0.935和-0.917,说明茶黄素的生成伴随着酯型儿茶素和非酯型儿茶素含量的降低。
川红工夫中的茶多酚、儿茶素和黄酮总量在萎凋过程中的变化趋势不大,基本趋于平衡;茶多酚和儿茶素总量在揉捻、发酵和干燥过程中呈现明显的下降趋势;黄酮物质在揉捻过程和发酵2 h时呈现一个上升趋势,之后的干燥过程呈现下降趋势 [22]。儿茶素的6 种主要组成成分中EGC、EGCG、ECG和EC含量的变化趋势是萎凋过程中变化不大趋于平稳,进入揉捻后,直至后期的干燥一直都是较明显的下降;而C和GCG的变化都不大,C在整个加工过程中有一定的增加趋势,GCG则是在萎凋后期有一定的增加,但是在揉捻、发酵和干燥过程中又表现为较平缓的增加趋势。茶黄素和茶红素含量随着萎凋的延长呈现较平缓的增加;茶黄素含量在揉捻过程中的增加最为明显,在揉捻2 h时达到最高水平,到后期的发酵和干燥过程中茶黄素含量又呈现下降趋势;茶红素含量在揉捻、发酵和干燥过程中均呈现明显的增长趋势 [19,23]。
川红工夫的品质是随着茶叶发酵作用的进展,慢慢形成的,多酚氧化酶等酶促氧化作用是形成其品质的根本。但研究发现发酵过程中PPO酶活性并不是一直呈现上升趋势;在萎凋期间PPO活性波动较大,主要是由于随着萎凋时间的延长,叶中失水,pH值酸化等内部环境的影响,PPO同工酶活性及组分变化较大 [20]。萎凋期间总的PPO活性最高点出现在12~16 h内,而在进入揉捻和发酵后酶活性是呈现下降趋势 [23]。
根据川红工夫的多酚物质含量变化结果可推断,适当地延长揉捻时间和减少发酵时间,可提高茶黄素含量。通过多酚含量和形成相关酶酶活性变化规律可知,发酵期间茶多酚和黄酮类物质的含量较高,但此过程中的多酚氧化酶和过氧化物酶酶活性都处于较低水平,这样就限制了茶多酚和黄酮类物质的继续氧化生成茶黄素;通过多酚形成相关酶活性与多酚类物质相关性分析可知,PPO和POD活性与茶多酚含量呈现极显著正相关,与茶黄素含量呈现负相关,POD活性与茶红素含量呈现极显著负相关 [17,19,22];所以可考虑在发酵过程中提高酶活性来实现制备出更高茶黄素含量且高品质的川红工夫。
参考文献:
[1] 蔡红兵. 川红精制工艺[J]. 茶业通报, 1989(3): 20-22.
[2] 刘仲华, 施兆鹏. 红茶制造中多酚氧化酶同工酶谱与活性的变化[J].茶叶科学, 1989, 9(2): 141-150.
[3] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2003.
[4] 陈东生, 王坤波, 黄建安, 等. 茶树多酚氧化酶研究进展[J]. 茶叶通讯, 2012, 39(2): 17-21.
[5] ROBERTS E A H, SMITH R F. Spectrophotometric measurements of theafl avins and thearubigins in black tea liquors in assessments of quality in teas[J]. Analyst, 1961, 86: 94-98.
[6] PAN M H, LAI C S, WANG H, et al. Black tea in chemo-prevention of cancer and other human diseases[J]. Food Science and Human Wellness, 2013, 2(1): 12-21.
[7] 李彩蓉, 蔡飞, 赵辛元, 等. 茶黄素对糖尿病大鼠肾小球系膜细胞p38丝裂原活化蛋白激酶及细胞外基质合成的影响[J]. 茶叶科学,2009, 29(6): 470-474.
[8] 黄建琴. 不同加工方式祁红与肯尼亚、斯里兰卡红茶品质成分比较研究[J]. 中国茶叶加工, 2003(1): 16-18.
[9] 中国国家标准化管理委员会. GB/T 8303—2013 茶 磨碎试样的制备及其干物质含量测定[S]. 北京: 中国标准出版社, 2013.
[10] LIANG Yuerong, LU Jianliang, ZHANG Lingyun, et al. Estimation of black tea quality by analysis of chemical composition and colour difference of tea infusions[J]. Food Chemistry, 2003, 80(2): 283-290.
[11] 马梦君, 胡文卿, 傅丽亚, 等. 温度和质量浓度对茶多酚水溶液稳定性的影响[J]. 食品科学, 2014, 35(11): 11-16.
[12] 何书美, 刘敬兰. 茶叶中总黄酮含量测定方法的研究[J]. 分析化学,2007, 35(9): 1365-1368.
[13] SNELL F D, ETTRE L S, HILTON P J, et al. Encyclopedia of industrial chemical analysis[M]. New York: John Wiley and Sons Inc., 1973: 455-516.
[14] 李忠光, 龚明. 植物多酚氧化酶活性测定方法的改进[J]. 云南师范大学学报: 自然科学版, 2005, 25(1): 44-45; 49.
[15] 王伟玲, 王展, 王晶英. 植物过氧化物酶活性测定方法优化[J]. 实验室研究与探索, 2010, 29(4): 21-23.
[16] PRICE K R, RHODES M J, BARNES K A. Flavonol glycoside content and composition of tea infusions made from commercially available teas and tea products[J]. Journal of Agricultural and Food Chemistry, 1998, 46(7): 2517-2522.
[17] FINGER A. in vitro studies on the effect of polyphenol oxidase and peroxidase on the formation of polyphenolic black tea constituents[J]. Journal of the Science of Food and Agriculture, 1994, 66(3): 293-305.
[18] OBANDA M, OKINDA OWUOR P, MANG’OKA R. Changes in the chemical and sensory quality parameters of black tea due to variations of fermentation time and temperature[J]. Food Chemistry,2001, 75(4): 395-404.
[19] BALENTINE D A, WISEMAN S A, BOUWENS L C. The chemistry of tea fl avonoids[J]. Critical Reviews in Food Science and Nutrition,1997, 37(8): 693-704.
[20] SUBRAMANIAN N, VENKATESH P, GANGULI S, et al. Role of polyphenol oxidase and peroxidase in the generation of black tea theaflavins[J]. Journal of Agricultural and Food Chemistry, 1999,47(7): 2571-2578.
[21] 吴小崇. 萎凋中可溶性多酚氧化酶活性的变化[J]. 茶叶科学, 1990,10(1): 44.
[22] RAVICHANDRAN R, PARTHIBAN R. Changes in enzyme activities(polyphenol oxidase and phenylalanine ammonia lyase) with type of tea leaf and during black tea manufacture and the effect of enzyme supplementation of dhool on black tea quality[J]. Food Chemistry, 1998, 62(3): 277-281.
[23] BARUAH A M, MAHANTA P K. Fermentation characteristics of some assamica clones and process optimization of black tea manufacturing[J]. Journal of Agricultural and Food Chemistry, 2003,51(22): 6578-6588.
[24] 李远志. 茶叶中多酚氧化酶的性质及其在茶叶加工中的作用[J]. 食品科学, 1988, 9(11): 5-8.
Changes in Polyphenols and Enzymes Responsible for Their Formation during Processing of Chuanhong Gongfu Tea
LUO Liyong
1,2, ZENG Liang
1,2, LI Hongjun
1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Tea Research Institute, Southwest University, Chongqing 400715, China)
Abstract:Chuanhong Gongfu tea was made by the traditional process from one bud with two leaves from a small-leaf variety in Sichuan. The contents of tea polyphenols, flavonols, catechins, theaflavins, thearubigins, and the activities of polyphenoloxidase and peroxidase in Chuanhong Gongfu tea were investigated to study the correlation between the contents of tea polyphenols and the activities of the enzymes responsible for their formation. The results showed that the contents of tea polyphenols and catechins displayed a downward trend whereas the contents of fl avonols, theafl avins and thearubigins at the rolling stage increased significantly, and the activities of polyphenoloxidase and peroxidase decreased. However,the contents of fl avonols and theafl avins during the subsequent fermentation process declined. There were signifi cant or extremely signifi cant correlations between the contents of tea polyphenols and the activities of the enzymes responsible for their formation during the manufacturing process of Chuanhong Gongfu tea. High contents of theafl avins in Chuanhong Gongfu tea can be achieved by prolonging the rolling time and reducing the fermentation time, as well as by improving the activities of the enzymes related to polyphenols formation.
Key words:Chuanhong Gongfu tea; polyphenols; polyphenoloxidase; peroxidase; correlation analysis
中图分类号:TS272
文献标志码:A
文章编号:1002-6630(2015)03-0057-06
doi:10.7506/spkx1002-6630-201503011
收稿日期:2014-07-24
基金项目:国家现代农业(兔)产业技术体系建设专项(CARS-44-D-1);肉鸡特色产品精深加工及现代物流配送关键技术研究与产业化示范项目(12ZC2439)
作者简介:罗理勇(1979—),男,实验师,博士研究生,研究方向为茶叶加工与深加工。E-mail:liyongluo1979@126.com
*通信作者:李洪军(1961—),男,教授,博士,研究方向为食品安全和功能食品研究开发。E-mail:983362225@qq.com