
图1 单菌种发酵甘蓝菜中亚硝酸盐含量在发酵过程中的变化
Fig.1 Changes in nitrite content during single-strain fermentation of cabbages
燕平梅,陈燕飞,赵文婧,乔宏萍,单树花,张 腾
(太原师范学院生物系,山西 太原 030031)
摘 要:为了选择适合蔬菜发酵的发酵菌种,本研究从四川泡菜老汤中分离的6 种乳酸菌Lactobacillus plantarum、Lactobacillus fermentum、Lactobacillus brevi、Lactobacillus pentosus、Leuconostoc mesenteroides、Lactobacillus lactics筛选发酵菌种。6 种乳酸菌接入亚硝酸盐的MRS培养液中,6 种乳酸菌还原亚硝酸盐的大小顺序为Lactobacillus pentosus>Lactobacillus plantarum>Leuconostoc mesenteroides>Lactobacillus fermentum>Lactobacillus lactics>Lactobacillus brevis。以pH值降低的速率为发酵速率,Lactobacillus plantarum、Lactobacillus pentosus、Leuconostoc mesenteroides这3 种发酵剂的发酵速率较其他3 种快,并且通过乳酸菌的全细胞蛋白电泳实验得出此3 种乳酸菌在甘蓝发酵过程中能够成为优势菌。从乳酸菌还原亚硝酸盐的能力、发酵速率、发酵菌种的生存能力(是否能成为优势菌)的实验结果表明Lactobacillus plantarum、Lactobacillus pentosus、Leuconostoc mesenteroides这3 种乳酸菌作为蔬菜发酵的发酵剂。通过对3 种发酵菌种发酵特性的研究可知,Leuconostoc mesenteroides较另两种生长周期短,稳定期维持时间短,很快进入衰退期。Lactobacillus plantarum菌较Lactobacillus pentosus、Leuconostoc mesenteroides耐酸,Leuconostoc mesenteroides对酸敏感。Leuconostoc mesenteroides最适生长温度为30 ℃,Lactobacillus plantarum、Lactobacillus plantarum两种菌的最适生长温度是37 ℃。15 ℃条件下Leuconostoc mesenteroides的光密度(OD 600 nm)值很低,说明Leuconostoc mesenteroides较Lactobacillus plantarum、Lactobacillus pentosus对低温敏感。
关键词:乳酸菌;蔬菜;发酵剂;泡菜;接种发酵
蔬菜发酵过程中,蔬菜代谢过程积累的硝酸盐被还原为亚硝酸盐,并在发酵过程中出现亚硝酸盐含量高峰,称为“亚硝峰”,之后亚硝酸盐含量快速减少 [1-7]。关于“亚硝峰”的产生,许多学者 [8-10]都曾做过观察,不同蔬菜品种、不同的发酵温度及不同的氯化钠浓度发酵蔬菜过程初期均形成亚硝高峰,发酵中期亚硝酸盐快速下降,后期亚硝酸盐含量很低,其含量低于我国GB 15198—1994《食品中亚硝酸盐限量卫生标准》中规定了各类食品中关于亚硝酸盐的卫生限量标准。
提高发酵蔬菜产业的生产效率和发酵蔬菜的品质,提早“亚硝峰”出现时间,降低“亚硝峰”的峰值是科研人员研究的焦点。前人通过调发酵液的pH值 [11]和添加大蒜 [12]、酸菜鲜 [13]、VC [14]和采用纯种发酵方法 [15-18]降低发酵蔬菜中“亚硝峰”的峰值。其中纯种发酵方法不仅可以降低发酵蔬菜中“亚硝峰”的峰值,而且能将自然发酵的诸多不足受控于人工操作之下,可以实现泡菜生产的现代化、工业化和规模化。因此纯种发酵方法将成为泡菜产业发展的主流方向。为了选择适合蔬菜发酵的发酵菌种,本研究团队在前期采用非培养和培养方法研究发酵蔬菜乳酸菌的多样性的基础上 [19-20],选择了从四川泡菜老汤中分离的6 种乳酸菌,从乳酸菌还原亚硝酸的能力、发酵速率、发酵菌种的生存能力方面来选择发酵剂。并对发酵菌种的性能进行研究。
1.1 材料与菌种
甘蓝来自中国农业大学附近的菜市场。
本实验所用的乳酸菌是从泡菜老汤和泡菜卤中分离的乳酸菌,有Lactobacillus plantarum(编号为BC1)、Lactobacillus fermentum(编号为W)、Lactobacillus brevis(编号为hp2)、Lactobacillus pentosus(编号为SPc)、Leuconostoc mesenteroides(编号为nPb)、Lactobacillus lactics(编号为Z)。
1.2 方法
1.2.1 发酵菌种的制备
制备流程如下:冰箱保存种→转接MRS固体培养基活化→扩大培养(乳酸菌在液体MRS培养基中于30 ℃培养24 h)→离心分离(4 000×g,5 min)集菌→称质量。
1.2.2 接种发酵甘蓝的制备
称取50 g洗净沥干的甘蓝,放入灭菌的三角瓶中,加入含5 g/100 mL NaCl煮沸凉到室温的盐水100 mL,接入乳酸菌发酵剂(发酵剂/菜为0.5 g/100 mL),置于30 ℃培养箱中厌氧发酵。
在无菌条件下取发酵甘蓝样品,隔天测定发酵甘蓝的亚硝酸盐含量和可滴定酸浓度,发酵第4天取发酵菜水稀释到适当的浓度涂布到含5% CaCO 3MRS固体培养基中,挑取10 株乳酸菌,做发酵剂生存能力的实验。
1.2.3 发酵甘蓝中亚硝酸盐含量和可滴定酸的测定方法
可滴定酸的测定是由0.1 mol/L氢氧化钠滴定,酚酞为滴定终点指示剂 [21]。
泡菜卤pH值测定用数字pH计,pH计的校准用厂商供给的pH值为4.0和7.0的标准缓冲溶液。
亚硝酸盐含量的测定按GB/T 5009.33—1996《食品中亚硝酸盐和硝酸盐的测定方法》 [22]。
1.2.4 乳酸菌生存能力实验(用全细胞蛋白指纹图谱法)
1.2.4.1 乳酸菌全细胞蛋白的提取
将保藏的乳酸菌活化(用试管斜面或平皿),挑取5~7 环接种于10 mL MRS液体培养基中于37 ℃培养3~8 h时,在4 000 r/min离心10 min,倒掉上清液,用灭菌的蒸馏水冲洗离心管的菌体,然后加入5 mL的灭菌的蒸馏水在4 000 r/min离心10 min,倒掉上清液,加入0.5 mL的处理缓冲溶液(0.062 5 mol/L Tris-HCl,pH 6.8;2 g/100 mL SDS;10%甘油),放入100 ℃沸水中煮5~8 min,然后放入-20 ℃冰箱中反复冻融2 次,在13 000×g离心10 min,收集上清液 [14](蛋白提取液),进行电泳。
1.2.4.2 乳酸菌全细胞蛋白的琼脂糖凝胶电泳
按照Isabel等 [23]的方法,测定乳酸菌全细胞蛋白亚基组成,所用条件为12.5%分离胶,4.5%浓缩胶,交联度3.6%,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE),单板恒流10 mA,样品溶液先与等体积样品变性剂混合,沸水浴加热5 min后,蛋白质提取液15 μL上样,电泳后的分离胶用考马斯亮蓝R-250染色显现蛋白带。
1.2.5 菌种发酵特性的实验
经过活化的发酵菌种接入MRS液体培养基中30 ℃培养箱中厌氧培养,每隔3 h测定MRS液体培养基的OD 600 nm值,连续测定30 h。
分别将MRS液体培养基调不同pH值(3、4、5、6、7)和不同盐质量浓度(2、4、6、8、12 g/100 mL),把培养18 h的菌株接种于其中,培养24 h后,600 nm波长处测培养液OD值。
将培养18 h的菌株接种于MRS液体培养基中,放于15、20、25、30、37、45 ℃条件下培养24 h,600 nm波长处测培养液OD值。
将培养18 h的菌株接种于含100 mg/L NaNO 2的MRS液体培养基中,于30 ℃条件下培养3 d,测定培养液中NaNO 2的含量。
2.1 发酵菌种的筛选
2.1.1 单菌种发酵甘蓝中亚硝酸盐含量在发酵过程中的变化

图1 单菌种发酵甘蓝菜中亚硝酸盐含量在发酵过程中的变化
Fig.1 Changes in nitrite content during single-strain fermentation of cabbages
6 种来源于泡菜乳酸菌为发酵剂发酵甘蓝菜中亚硝酸盐含量随发酵时间的变化如图1所示,纯种发酵甘蓝亚硝酸盐含量比自然发酵(空白)低。以W为发酵剂发酵甘蓝亚硝酸盐含量较其他5 种纯种发酵高,且在发酵2 周内出现两次亚硝高峰,第一次高峰值出现在发酵第4天,较空白(自然发酵)晚2 d,第二次高峰值出现在发酵第12天,其峰值相对第一峰值低得多;Z为发酵剂时,亚硝酸盐含量高峰在发酵第10天出现,且峰值较另外4 种发酵剂的高;SPc为发酵剂亚硝酸盐含量高峰在发酵第2天出现;nPb作为发酵剂时,亚硝酸盐含量高峰在第1天出现;hp2、BC1为发酵剂时,发酵甘蓝中亚硝酸盐含量在发酵过程中呈波动变化,但亚硝峰值较上述几种发酵剂的低。本实验发酵剂的选择的标准是发酵中亚硝酸盐高峰低、且“亚硝峰”出现早的发酵菌种。基于此条件,乳酸菌Z和W不适合作发酵菌种。
2.1.2 单菌种发酵甘蓝菜卤pH值的变化
表1 单菌种发酵甘蓝菜卤pH值的变化
Table1 Change in pH values during single-strain fermentation of cabbages
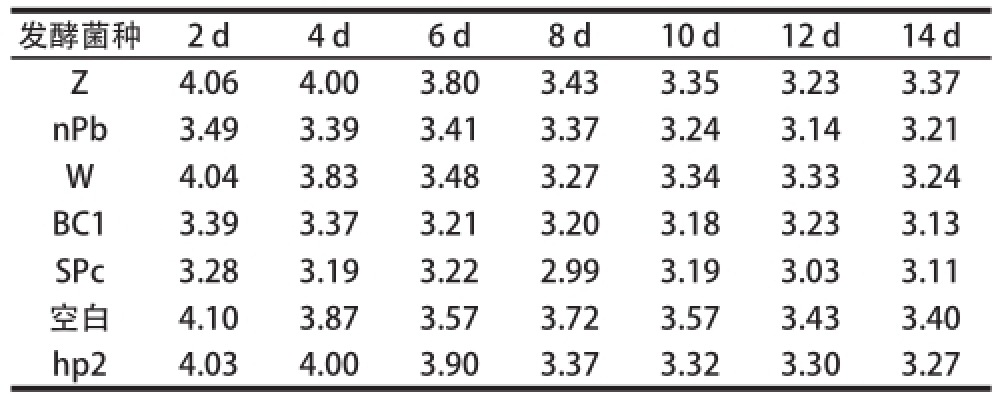
发酵菌种2 d4 d6 d8 d10 d12 d14 d Z4.064.003.803.433.353.233.37 nPb3.493.393.413.373.243.143.21 W4.043.833.483.273.343.333.24 BC13.393.373.213.203.183.233.13 SPc3.283.193.222.993.193.033.11空白4.103.873.573.723.573.433.40 hp24.034.003.903.373.323.303.27
此实验考察发酵剂的发酵蔬菜的速率,测试指标为发酵甘蓝菜卤pH值。如表1所示,Z、W和hp2为发酵剂时,发酵初期甘蓝菜卤的pH值降低缓慢。以nPb、BC1和SPc为发酵剂,甘蓝菜卤的pH值降低较hp2、Z和W快。从本实验的结果得出,从发酵速率看nPb、BC1、SPc乳酸菌作为发酵剂较hp2、Z和W为好。
2.1.3 乳酸菌作为发酵剂的生存生长能力
本实验通过用全细胞蛋白电泳(蛋白指纹图谱)的方法考察了接入菌种和其接入蔬菜发酵4 d的发酵卤中随机分离乳酸菌的电泳带谱,如图2A~2C所示,接入的BC1、nPb、SPc和含有接入菌的泡菜卤中随机分离7 株、9 株乳酸菌全细胞蛋白电泳图谱是完全一样,说明接入的菌种在蔬菜原料所带的众多野生菌环境中生存并成为优势的乳酸菌,在发酵过程中起优势主导菌群的作用。因此3 株菌株可以作为甘蓝接种发酵的发酵剂。未接菌的泡菜中乳酸菌的全细胞蛋白带谱不一样(图2D)。

图2 BC1(A)、nPb(B)、SPc(C)菌种和未接菌(D)泡菜中乳酸菌的全细胞蛋白SDS-PAGE图谱AGE
Fig.2 SDS-PAGE of whole cell proteins of LAB
2.2 发酵菌种的生长性能
由上述实验选出SPc、BC1、nPb为发酵菌株。对这3 株菌进行一系列性能测定,测定菌株的生长曲线,了解其生长周期及生长情况;对不同pH值的适应性是衡量菌株在不同酸碱条件下活动能力的一项重要指标;合适的发酵温度可以兼顾发酵得快速进行,同时确保发酵产品的质地与口感;菌株对不同盐量的适应能力则可拓展的应用范围从而满足不同地区对不同盐量发酵要求。
2.2.1 发酵菌株培养30 h的生长曲线和pH值的变化

图3 菌液OODD
60000
nnmm值随培养时间变化曲线
Fig.3 Plot of OD
600
nmof bacterial cells versus culture time
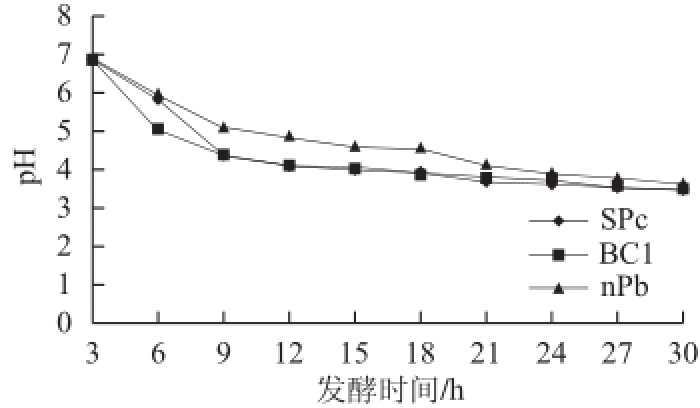
图4 菌液pH值随培养时间变化曲线
Fig.4 Plot of pH versus culture time
由图3、4可知,nPb生长周期短,培养12 h进入稳定期,稳定期维持时间短,很快进入衰退期。培养液中产酸较慢,培养30 h时pH值下降为3.6左右。SPc、BC1培养16~18 h进入稳定期,产酸快,24 h后pH值下降为3.6左右。
2.2.2 发酵菌株对不同pH值和盐质量浓度的适应性

图5 不同pH值条件菌体的生长情况
Fig.5 Effect of pH on the growth of bacterial cells
由图5可知,nPb、BC1两种菌株在pH值为6 h时OD 600 nm最大,SPc在pH值为5 h时OD 600 nm最高。SPc、nPb、BC1的最适生长pH值分别为5、6、6。BC1菌在pH值为3仍能生长,SPc、nPb生长微弱,说明BC1菌较SPc、nPb耐酸。nPb对酸敏感,在pH值为3的培养液中生长较SPc微弱,说明nPb对酸敏感。
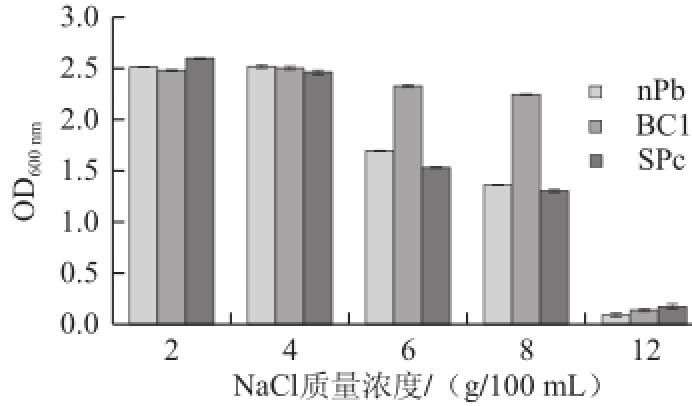
图6 不同盐质量浓度下菌体的生长情况
Fig.6 Effect of NaCl concentration on the growth of bacterial cells
图6 表示在不同盐质量浓度条件下SPc、nPb、BC1这3 种菌株的OD 600 nm值,NaCl质量浓度在2~4 g/100 mL范围内,SPc、nPb、BC1这3 种菌株生长良好。NaCl质量浓度为12 g/100 mL,3 种菌生长很微弱。BC1菌较SPc、nPb耐盐,NaCl质量浓度达8 g/100 mL时,仍能很好地生长。nPb对盐较SPc、BC1敏感,在NaCl质量浓度为12 g/100 mL时生长弱于其他两株菌。
2.2.3 发酵菌株的最适温度
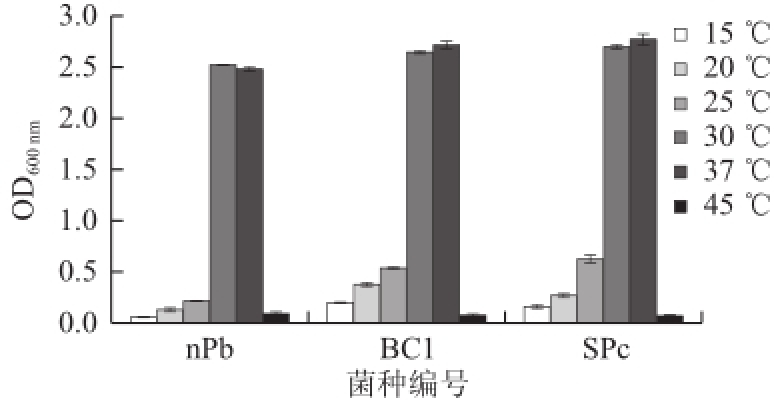
图7 不同培养温度下菌株生长情况
Fig.7 Effect of cultivation temperature on the growth of bacterial cells over a 24-h cultivation period
由图7可知,SPc、nPb、BC1这3 种菌在30、37 ℃条件下生长均旺盛。在45 ℃条件下生长都微弱。nPb最适生长温度为30 ℃,SPc、BC1两种菌的最适生长温度是37 ℃。15 ℃条件下nPb的OD 600 nm很低,说明nPb较BC1、SPc对低温敏感。
2.2.4 乳酸菌还原亚硝酸盐的能力
表2 6 种乳酸菌还原亚硝酸盐能力的比较
Table2 Comparisons of the nitrite-reducing abilities of six strains of lactic acid bacteria
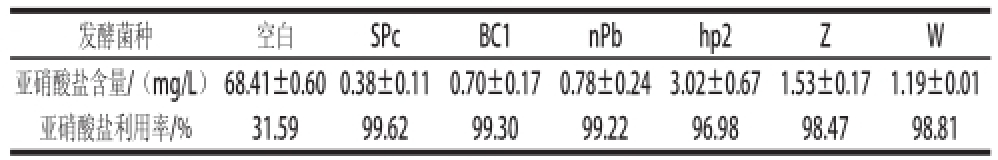
发酵菌种空白SPcBC1nPbhp2ZW亚硝酸盐含量/(mg/L)68.41±0.60 0.38±0.11 0.70±0.17 0.78±0.24 3.02±0.67 1.53±0.17 1.19±0.01亚硝酸盐利用率/%31.5999.6299.3099.2296.9898.4798.81
如表2所示,6 种乳酸菌接入含100 mg/L亚硝酸盐的MRS培养液中,3 d后培养液中的亚硝酸盐含量不一样。说明它们还原亚硝酸盐的能力有差异,每种乳酸菌还原亚硝酸盐的的大小顺序为SPc>BC1>nPb>W>Z>hp2。
将发酵蔬菜的发酵模式由传统的自然发酵模式向纯种发酵的现代模式过渡并且达到快速、稳定和优质的关键基础在于菌种。迄今,纯种发酵研究所用的发酵剂大多数来自乳制品或其他发酵食品 [24-26]。因其在泡菜制作基质中适应性差,生长繁殖困难,配制出的菜品无泡菜独有的品位。导致人工接种发酵蔬菜技术不能大面积推广应用。
目前纯种乳酸发酵采用的生产工艺模式是一种半人工半自然的特殊模式,接种前原料不经过热烫处理,发酵原料中附着的自然微生物依然存在并参与发酵,而接入的纯菌种只在发酵过程中起优势主导菌群的作用。这种纯种发酵方法是常用的加工方法。接入的菌种能否在蔬菜原料所带的众多野生菌环境中生存并成为优势的乳酸菌是筛选发酵菌种的重要指标。本实验通过用全细胞蛋白电泳(蛋白指纹图谱)的方法考察了接入菌种和其接入蔬菜发酵4 d的发酵卤中随机分离乳酸菌的电泳带谱,考察了从接种发酵亚硝酸盐高峰值低和发酵过程pH值快速降低两个指标筛选的菌种在蔬菜发酵体系中的生存生长能力,得出Lactobacillus plantarum、Lactobacillus pentosus、Leuconostoc mesenteroides能稳定存在蔬菜发酵体系中并成为优势菌。
亚硝酸盐的形成是发酵蔬菜的普遍规律,接种发酵选择能够使亚硝酸盐含量降低的发酵剂是筛选发酵菌种的重要条件。蔬菜发酵过程中pH值快速降低不仅有效抑制其他不耐酸杂菌的繁殖,而且低pH值可以还原亚硝酸盐。因此,选择发酵速率快的发酵剂发酵对于得到优质安全的泡菜产品是非常重要的。本研究先从发酵蔬菜制品中亚硝酸盐含量和pH值两个指标选择发酵剂后检验其在发酵过程中生存及生长能力,确定作为蔬菜发酵的发酵菌种。然后研究其发酵特性,以为蔬菜人工接种发酵提供适宜的发酵剂。
参考文献:
[1] 郭晓红, 杨洁彬, 张建军. 甘蓝乳酸发酵过程中亚硝峰消长机制及抑制途径的研究[J]. 食品与发酵工业, 1989, 15(4): 26-34.
[2] 李基银. 蔬菜腌渍过程中亚硝酸盐生成规律与危害防治[J]. 食品科学, 1988, 9(3): 1-6.
[3] 郑桂富, 许晖, 武杰. 亚硝酸盐在雪里蕻腌制过程中生成规律的研究[J]. 四川大学学报: 工程科学版, 2000, 32(3): 85-87.
[4] 潘鹤枫, 刘秀珠. 北方酸菜中亚硝酸盐生成规律的研究[J]. 中国酿造, 1988, 7(6): 28-31.
[5] 纪淑娟, 孟宪军. 大白菜发酵过程中亚硝酸盐消长规律的研究[J].食品与发酵工业, 2001, 27(2): 42-46.
[6] 刘玉龙. 大白菜腌制过程中亚硝酸盐形成规律的研究[D]. 沈阳: 沈阳农业大学, 1985: 5.
[7] 纪凤娣. 蔬菜发酵过程微生物变化和亚硝酸盐形成降解规律研究[D].北京: 中国农业大学, 2007.
[8] PARK K Y, CHEIGH H S. Kimchi and nitrosamines[J]. Korean Jounal of Food Nutrition, 1992, 21: 109-116.
[9] SPOELSTRA S F. Nitrate in silage[J]. Crass and Forage Science,1985, 40: 1-11.
[10] 燕平梅. 发酵蔬菜中亚硝酸盐含量及优良发酵菌种筛选的研究[D].北京: 中国农业大学, 2006.
[11] 李基银. 腌菜质量与卫生[M]. 北京: 中国轻工业出版社, 1988: 56-59.
[12] 张建军, 蔡同一, 张箎, 等. 甘蓝乳酸发酵及莴笋纯接种乳酸发酵的研究[J]. 中国调味品, 1987, 12(1): 17-21.
[13] 马兰. 酸菜鲜对酸菜腌制过程中微生物菌系及酸菜品质的影响[J].食品工业, 1995, 16(4): 47-49.
[14] 王勤, 高祖民. 姜汁与维生素C阻断腌渍蔬菜产生亚硝酸盐的研究[J].南京农业大学学报, 1991, 14(4): 99-103.
[15] 赵书欣, 甄清. 接种乳酸菌腌渍菜过程中亚硝酸盐变化规律的研究[J].中国畜产与食品, 1998(4): 153-154.
[16] 杨性民, 刘青梅, 徐喜圆, 等. 人工接种对泡菜品质及亚硝酸含量的影响[J]. 浙江大学学报: 农业与生命科学版, 2003, 29(3): 291-294.
[17] 范利华, 杨洁彬, 张篪. 番茄汁乳酸发酵饮料的研究[J]. 食品与发酵工业, 1991, 17(2): 22-29.
[18] 张庆芳, 迟乃玉, 郑燕, 等. 乳酸菌还原亚硝酸盐机理的研究[J]. 食品与发酵工业, 2002, 28(8): 27-31.
[19] 燕平梅, 柴政, 薛文通, 等. 培养和非培养方法分析发酵白菜卤乳酸菌的多样性[J]. 微生物学报, 2009, 49(3): 345-349.
[20] 燕平梅, 张惠, 薛文通, 等. 16S rRNA基因序列方法分析传统发酵菜中乳酸菌多样性[J]. 中国食品学报, 2007, 7(2): 134-136.
[21] HELDRICH K. Official Methods of Analysis of the Association of Official Analytical Chemists[N/OL]. 19th ed. Virginia: AOAC,2012[2014-01-10]. http://www.aoac.org/imis15_prod/AOAC/ Publications/Official_Methods_of_Analysis/AOAC_Member/Pubs/ OMA/AOAC_Official_Methods_of_Analysis.aspx?hkey=5142c478-ab50-4856-8939-a7a491756f48.
[22] 黄伟坤. 食品检验与分析[M]. 北京: 中国轻工业出版社, 1989: 19-21.
[23] ISABEL S, SUSANA S, LLANOS P. Identification of lactic acid bacteria from spontaneous fermentation of ‘Almagro’ eggplants by SDS-PAGE whole cell protein fingerprinting[J]. International Journal of Food Microbiology, 2003, 82(2): 181-189.
[24] BRUNKOW O R, PETERSON W H, FRED E B, et al. A study of the influence of inoculation upon the fermentation of sauerkraut[J]. Journal of Agricultural Research, 1925, 30: 955-960.
[25] 沈国华, 卢英, 何丁喜, 等. 纯菌接种发酵技术在腌渍蔬菜加工上的应用研究(一)[J]. 中国调味品, 2002, 27(3): 22-25.
[26] 沈国华, 卢英, 何丁喜, 等. 纯菌接种发酵技术在腌渍蔬菜加工上的应用研究(二)[J]. 中国调味品, 2002, 27(6): 24-31.
Screening and Fermentation Characteristics of Strains for Fermented Vegetables
YAN Pingmei, CHEN Yanfei, ZHAO Wenjing, QIAO Hongping, SHAN Shuhua, ZHANG Teng
(Department of Biology, Taiyuan Normal University, Taiyuan 030031, China)
Abstract:This study aimed to screen the suitable strains for vegetable fermentation from six Lactobacillus species present in pickled vegetable, namely Lactobacillus plantarum, L. fermentum, L. brevis, L. Pentosus, L. mesenteroides and L. lactics. During culture in an MRS medium containing nitrite, these six strains of Lactobacillus could reduce the nitrite in the decreasing order: Lactobacillus pentosus > Lactobacillus plantarum > Leuconostoc mesenteroides > Lactobacillus fermentum > Lactobacillus lactics > Lactobacillus brevis. The fermentation rates of L. plantarum, L. pentosus and L. mesenteroides, as indicated by pH reduction rates, were higher than those of three other strains. Furthermore, whole-cell protein electrophoresis indicated that L. plantarum, L. pentosus and L. mesenteroides were the dominant bacteria in cabbage fermentation. Their applicability as starter cultures for vegetable fermentation was also confirmed based on nitrite-reducing ability, fermentation rate and viability. Comparing their fermentation characteristics, it was found that the growth cycle and stationary phase of Leuconostoc mesenteroides were shorter than those of the other two strains, and entered the decline phase earlier. L. plantarum was more resistant to acids than L. pentosus and L. mesenteroides and Leuconostoc mesenteroides was more sensitive to acids. The optimal growth temperature for Leuconostoc mesenteroides was 30 ℃ whereas the optimal growth temperature for both L. plantarum and L. plantarum was 37 ℃. At 15 ℃, the optical density (OD 600 nm) of Leuconostoc mesenteroides was very low, indicating that it is more sensitive to low temperature than L. pentosus and L. plantarum.
Key words:lactic acid bacteria; vegetables; fermentation starter; pickle; inoculated fermentation
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2015)03-0099-05
doi:10.7506/spkx1002-6630-201503019
收稿日期:2014-03-05
基金项目:国家自然科学基金面上项目(31171743);山西省科技基础条件平台项目(2014091003-0107)
作者简介:燕平梅(1968—),女,教授,博士,研究方向为食品科学与食品微生物。E-mail:yanpingmei@sohu.com