罗 章 1,陈历水 2,陈历俊 3,刘继超 3,姜铁民 3
(1.西藏大学农牧学院食品科学学院,西藏 林芝 860000;2.中粮营养健康研究院,品牌食品研发中心,北京 102209;3.北京三元食品股份有限公司科研中心,北京 100086)
摘 要:为了得到具有抗氧化活性的乳酸菌,采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法和抑制脂质过氧化法对11 株来源于西藏藏灵菇乳的乳酸菌抗氧化活性进行测定,包括它们的完整细胞和无细胞提取物,发现HN05菌株有较好的抗氧化活性。根据菌株的表型、生理生化特征和基因型的特性,初步将HN05菌株鉴定为清酒乳杆菌清酒亚种(Lactobacillus sakei subsp. sakei)。
关键词:藏灵菇乳;抗氧化活性;乳酸菌;鉴定
有研究表明自由基是导致机体氧化损伤的原因,如癌症、肺气肿、肝硬化、动脉粥样硬化和关节炎等都与氧化损伤有关。因此,清除体内多余的自由基直接关系到生物体的健康。虽然人类与其他生物体都具有抗氧化防御和修复系统,可以保护机体免遭氧化损伤,但这些系统不能完全有效地防止损害。所以,通过补充抗氧化剂或含有抗氧化剂的食品可以帮助人体减少氧化损伤 [1-2]。有报道 [3-4]发现有的乳酸菌及其相关制品可减少体内的自由基含量,具有抗氧化活性,可预防和抑制脂质过氧化和减少一些相关疾病的发生。
藏灵菇乳是西藏传统发酵乳制品,这类饮品由于其独特的保健效果,在民间广为流传,长期饮用能够增强人体免疫力、补充维生素、延缓衰老、消除疲劳,特别适合胃病、肾病和肝胆病患者。其发酵剂开菲尔粒(Kefir grain)是一种由数种乳酸菌、酵母菌和醋酸菌共生而成的多菌种复合体,呈乳白色、胶质状,外形酷似米粒,可在鲜乳中生长、分裂并将其特性传给下一代以产生新粒,藏灵菇由于其经过在牛奶中培养,体积会增大很多,形状如盛开的雪莲,所以又称之为“西藏雪莲” [5]。基于藏灵菇乳独特的营养价值和生理功能,目前,开发适应大规模产业化生产的藏灵菇发酵剂,已成为国内外研究的热点,藏灵菇的菌相研究尤为重要。本课题组对藏灵菇乳中筛选得到的乳酸菌进行体外抗氧化实验,并将筛选得到的具有较强抗氧化活性的菌株进行进一步鉴定,为菌株的后期应用提供理论基础。
1.1 菌株、试剂与培养基
被测乳酸菌均为西藏农牧民家自然发酵藏灵菇中分离得到。标准菌株鼠李糖乳杆菌(Lactobacillus rhamnosus GG)ATCC 53103和对照菌株德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)均为实验室保藏。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、亚油酸 美国Sigma公司;吐温-20、磷酸盐缓冲液(phosphate buffered saline,PBS)及其他试剂均为国产分析纯。
MRS液体/固体培养基 北京陆桥生物技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)用酶、核酸分离试剂、电泳相关试剂与材料 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
BD150L型厌氧培养箱 德国Binder股份有限公司;UV-2100型紫外-可见分光光度计 尤尼柯(上海)有限公司;BX53型微生物显微镜 日本奥林巴斯公司;Scientz-IID超声波细胞粉碎机 宁波新芝科技有限公司;PCR仪 日本TaKaRa公司。
1.3 方法
1.3.1 样品预处理
对藏灵菇进行无菌采样,经低温冰盒运输,取样品25 g加入到225 g无菌PBS(pH 7.4,含0.5 g/L半胱氨酸盐酸盐)置于均质仪中拍打均质5 min,然后经过标准系列稀释,制备成不同稀释度的样品供微生物分离使用。
1.3.2 菌株活化
取4 ℃冰箱中贮存的2 代菌株,以1%接种量接种于灭菌的MRS培养基中,置于37 ℃振荡培养箱中培养12 h,获得新鲜的第3代培养物用于实验。
1.3.3 乳酸菌的培养
所有菌株都接种于MRS(液体/固体)培养基中(牛肉膏3 g、酵母提取物5 g、吐温-80 1 mL、MgSO 4·7H 2O 0.64 g、K 2HPO 45.0 g、冰乙酸4.30 mL、MnSO 40.17 g、蛋白胨7.0 g、葡萄糖20.0 g、乙酸钠5.0 g、柠檬酸铵2.0 g、胰蛋白胨7.0 g、L-半胱氨酸0.5 g,加蒸馏水定容至1 L,调节至pH 6.2~6.5)高压灭菌(1.01 MPa,121 ℃)15 min后备用。
1.3.4 无细胞培养物的制备
所有的菌株经过3 次传代。培养液5 000 r/min离心20 min,收集菌体,用PBS洗涤3 次,重悬浮于PBS溶液中,调整菌数到10 8CFU/mL,冰水浴中超声破碎25 min细胞后,于4 ℃、12 000 r/min离心30 min,收集上清液得无细胞提取物。
1.3.5 清除DPPH自由基能力的测定
对DPPH自由基清除能力的测定参照参考文献[6]。
1.3.6 抗脂质过氧化能力的测定
参照文献[7]方法略加改动。0.5 mL样品与0.5 mL的PBS溶液(0.02 mol/L,pH 7.4)、1 mL亚油酸的乳化液(18.8 mL水中添加1 mL亚油酸,0.2 mL吐温-20)混合,然后加入0.2 mL 0.01% FeSO 4和0.2 mL 20 mmol/L H 2O 2在37 ℃水浴中反应12 h。反应液加入0.2 mL的三氯乙酸(trichloroacetic acid,TCA),2 mL的硫代巴比妥酸(2-thiobarbituric acid,TBA),0.2 mL 0.4%的二丁基羟基甲苯(butylated hydroxytoluene,BHT),在100℃反应30 min,冷却后加入2.5 mL三氯甲烷抽提,离心收集上清液在532 nm波长处测吸光度(A)。实验中以PBS作为对照,抗脂质过氧化率以下式计算得出。
1.3.7 乳酸菌的形态学鉴定及生理生化鉴定
乳酸菌在MRS培养基上培养24 h后进行革兰氏染色和形态学检测。过氧化氢酶活性检测及发酵葡萄糖产气实验按照凌代文等 [8]的方法进行。选择在5、10、40、45 ℃不同温度条件下进行生长实验,其中5 ℃和10 ℃条件下培养14 d;40 ℃和45 ℃条件下培养7 d,分别在pH 3.0、3.5、4.0、4.5、5.0、7.5和8.0条件下培养7 d,观察乳酸菌的生长状况 [9]。分别在质量分数为 3.0%和6.5%的NaCl溶液中观察乳酸菌的耐盐能力。接触酶实验、葡萄糖产气实验及糖发酵实验等生理生化特征的分析参照有关文献[10]。
1.3.8 乳酸菌的16S rDNA鉴定和进化分析
将确定的乳酸菌分离物涂布在MRS平板上厌氧37 ℃培养72 h后,观察菌落形态和细胞显微形态,利用通用引物(27F:5’-GAGTTTGATCCTGGCTCAG-3’,1525R:5’-AGAAAGGAGGTGATCCAGCC-3’)扩增乳酸菌16S rDNA,送生工生物工程(上海)股份有限公司进行测序,将测序结果在NCBI BLAST中的核酸库进行比对,根据相似度及评分来判断菌株种属,并应用Cluxtal X和MEGA 5.0软件采用邻位相连法构建系统发育树。
1.3.9 生长曲线的测定
用待测菌株24 h的培养液,以3%的接种量接入MRS液体培养基中,于37 ℃培养箱中培养36 h,每隔2 h取一次样品,放于4 ℃冰箱中,最后以培养基为空白,在620 nm波长处测定样品的光密度(OD)值,同时测定pH值,并以培养时间为横坐标,相对应的OD 620 nm和pH值为纵坐标分别绘制生长曲线 [11]。
1.4 数据分析
所有实验数据均采用SPSS统计软件(16.0版)分析,每组实验重复3 次,数据结果以
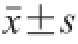 的方式表示。
的方式表示。
2.1 具有抗氧化活性乳酸菌的筛选
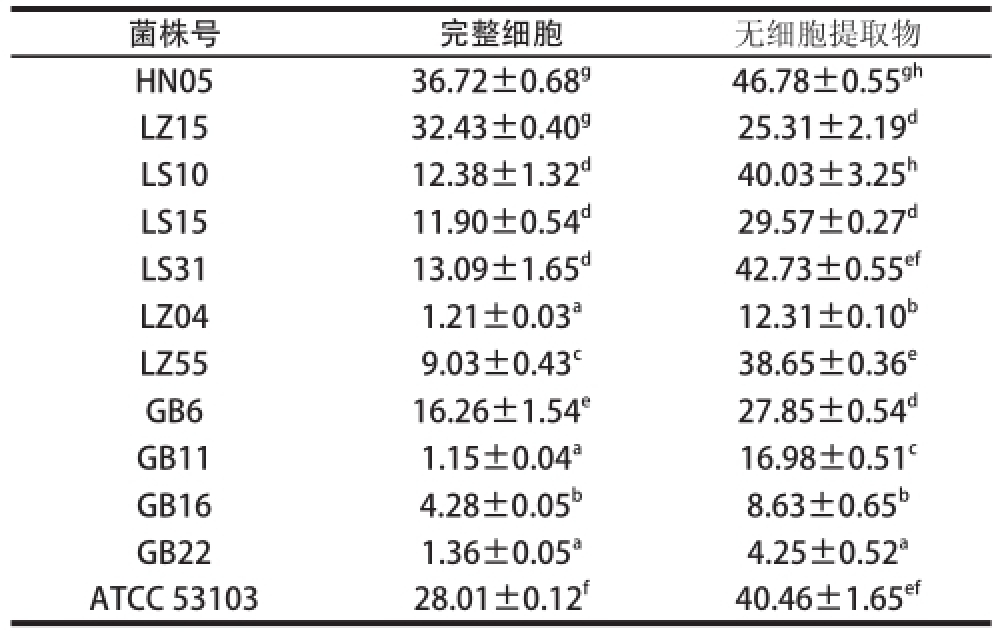
清除DPPH自由基活性及抑制脂质过氧化活性的测定是筛选具有抗氧化活性菌株常用的方法 [12]。当DPPH自由基遇到提供质子的物质抗氧化剂时就会被清除,表现为吸光度的降低。基于此原理,抗氧化物质的抗氧化能力可以用其清除DPPH自由基的能力来表示。本实验对11 株来源于藏灵菇乳中得到的乳酸菌和1 株标准菌株ATCC 53103(所有测试菌浓度均约为10 8CFU/mL)清除DPPH的能力进行了测定,结果如表1所示。可知不同的乳酸菌表现出不同的清除活性,而且乳酸菌完整细胞的活性一般要比相对应的提取物的活性低,比如完整细胞的活性为1%~37%不等,而提取物的活性范围则在4%~47%之间。其中活性最强的为菌株HN05,其次是菌株LS31,这2 株菌的活性显著高于包括标准菌株ATCC 53103的其他菌株(P<0.05)。
表1 乳酸菌的清除DPPH自由基活性

Table1 DPPH radical scavenging activity of LAB isolates
注:同列小写字母不同表示差异显著(P<0.05)。表2同。
菌株号完整细胞无细胞提取物HN0536.72±0.68 g46.78±0.55 ghLZ1532.43±0.40 g25.31±2.19 dLS1012.38±1.32 d40.03±3.25 hLS1511.90±0.54 d29.57±0.27 dLS3113.09±1.65 d42.73±0.55 efLZ041.21±0.03 a12.31±0.10 bLZ559.03±0.43 c38.65±0.36 eGB616.26±1.54 e27.85±0.54 dGB111.15±0.04 a16.98±0.51 cGB164.28±0.05 b8.63±0.65 bGB221.36±0.05 a4.25±0.52 aATCC 5310328.01±0.12 f40.46±1.65 ef
由于不饱和脂肪酸(LH)在活性氧的引发下可以发生过氧化反应,在脂类过氧化过程中产生L·、LO·、LOO·等自由基与LOOH。其中LOOH可使I -释放,生成共轭二烯、乙烷等气体及丙二醛等中间产物,通过测定中间产物可以得到抑制过氧化反应的能力 [13]。通过测定12 株不同乳酸菌在亚油酸氧化体系中抑制脂肪过氧化的能力,结果如表2所示。乳酸菌完整细胞活性为6.48%~59.38%,低于相应的无细胞提取物的活性(45.78%~72.43%),这一结果与报道过的长双歧杆菌ATCC 15708和乳酸菌ATCC 4356及其他乳酸菌趋势相同 [14]。
Lee等 [15]曾对4 株乳杆菌的总抗氧化能力和对活性氧的耐受性进行测定后发现L. casei KCTC 3260的完整细胞和无细胞提取物抑制亚油酸过氧化的能力很强,抑制率分别达到了46.2%和72.9%。Lin等 [16]对11 株乳酸菌进行抑制脂质过氧化反应和清除活性氧自由基能力的研究发现5 株L. delbrueckii ssp. bulgaricus和6 株St. thermophilus都显示了较好的抑制亚油酸过氧化的能力,所有菌株的无细胞提取物都具有清除自由基能力。进一步研究发现Lacidophilus ATCC 4356和B. longum ATCC 15708的完整细胞对亚油酸过氧化反应的抑制率分别为48%和28%,对DPPH自由基的清除率分别为52%和21% [17],与本实验结果相近。本实验发现菌株HN05具有较强的清除DPPH自由基活性,而且抑制脂质过氧化活性也比较高,所以选择该菌株进行下一步研究;菌株LS31虽然有较强的清除DPPH自由基的能力,抑制脂质过氧化的能力却比较低,所以没有将该菌株做进一步研究。
表2 乳酸菌的抑制脂质过氧化活性
Table2 Inhibitory activity of LAB isolates on lipid peroxidation %
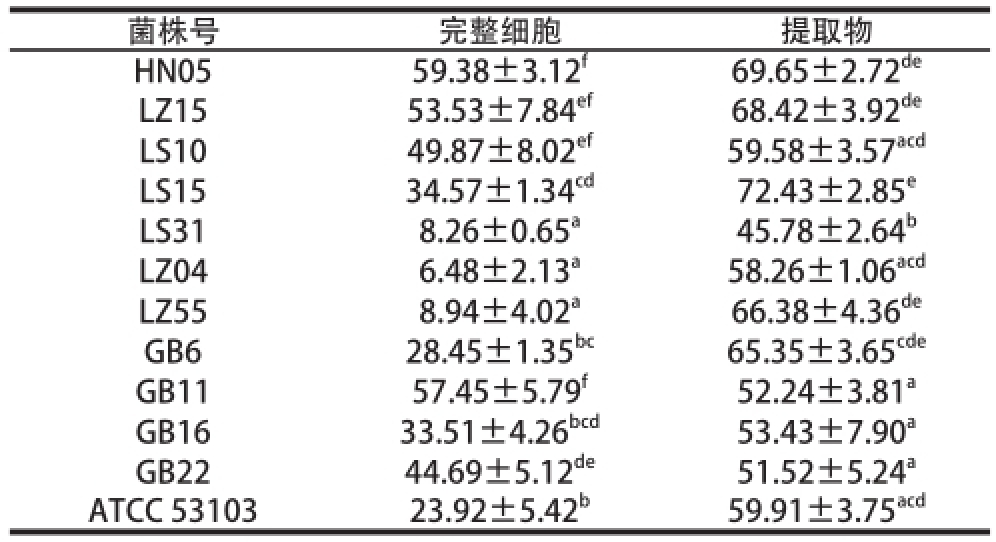
菌株号完整细胞提取物HN0559.38±3.12 f69.65±2.72 deLZ1553.53±7.84 ef68.42±3.92 deLS1049.87±8.02 ef59.58±3.57 acdLS1534.57±1.34 cd72.43±2.85 eLS318.26±0.65 a45.78±2.64 bLZ046.48±2.13 a58.26±1.06 acdLZ558.94±4.02 a66.38±4.36 deGB628.45±1.35 bc65.35±3.65 cdeGB1157.45±5.79 f52.24±3.81 aGB1633.51±4.26 bcd53.43±7.90 aGB2244.69±5.12 de51.52±5.24 aATCC 5310323.92±5.42 b59.91±3.75 acd
2.2 乳酸菌的鉴定
2.2.1 乳酸菌的形态学与生理生化特征
经实验检测,HN05菌株为杆状,革兰氏阳性、过氧化氢酶阴性、同型发酵乳酸菌,具有一般乳杆菌的特性。采用德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)为对照菌株进行研究,所分离到的革兰氏阳性杆菌在硝酸盐还原实验、明胶液化实验、溶血实验、联苯胺实验、H 2S产生实验以及运动性实验均呈阴性,在10~45 ℃之间均能生长,在pH 4.5的环境中生长,其结果与对照菌株一致,鉴定为乳杆菌属的细菌,结果见表3。
表3 菌株 HN05的具乳杆菌属鉴定结果
Table3 Identification of strain HN05 with Latbcillus
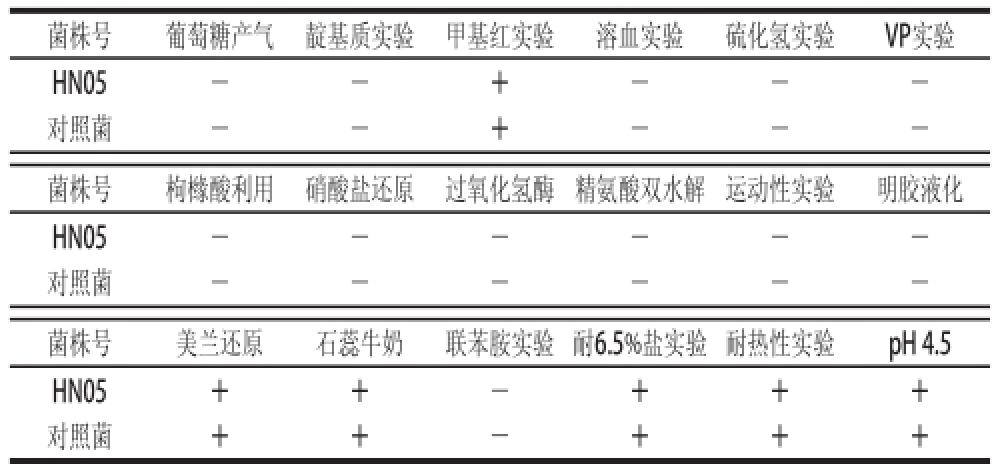
注:+. 反应为阳性;-. 反应为阴性;±. 反应微弱。表4同。
菌株号葡萄糖产气靛基质实验甲基红实验溶血实验硫化氢实验VP实验HN05--+---对照菌--+---菌株号枸橼酸利用硝酸盐还原过氧化氢酶精氨酸双水解运动性实验明胶液化HN05------对照菌------菌株号美兰还原石蕊牛奶联苯胺实验耐6.5%盐实验耐热性实验pH 4.5 HN05++-+++对照菌++-+++
菌株HN05除具有乳杆菌属的特征外,能分解多种单糖、双糖和多糖,但不能发酵鼠李糖、木糖,也不利用麦芽糖、棉子糖,15 ℃能生长分解七叶苷,水解精氨酸,初步鉴定为清酒乳杆菌(Lactobacillus sakei),结果见表4。
表4 菌株 HN05的具清酒乳杆菌鉴定结果
Table4 Identification of strain HN05 with Lactobacillus sakei
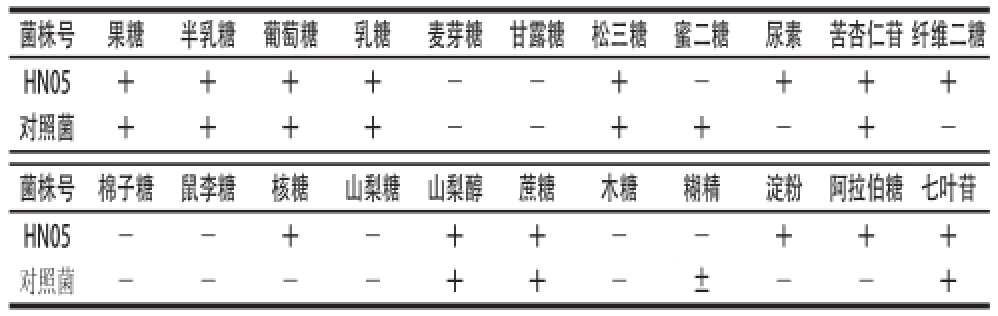
菌株号果糖半乳糖葡萄糖乳糖麦芽糖甘露糖松三糖蜜二糖尿素苦杏仁苷纤维二糖HN05++++--+-+++对照菌++++--++-+-菌株号棉子糖鼠李糖核糖山梨糖山梨醇蔗糖木糖糊精淀粉阿拉伯糖七叶苷HN05--+-++--+++对照菌----++-±--+
2.2.2 乳酸菌菌株16S rDNA序列测定及系统进化树的构建
通过乳酸菌16S rDNA的特异性对HN05菌株进行鉴定。提取该菌的总DNA,在灭过菌的PCR管中加入Taq酶、ddH 2O、模板、上游引物UNI-F和下游引物UNI-R。离心后放入PCR仪中对其16S rDNA序列进行PCR扩增,扩增后进行电泳检测,如图1所示,发现该菌株的序列在1 000 bp与2 000 bp之间,将所得部分序列送生工生物工程(上海)股份有限公司测序,得到菌株HN05的16S rDNA序列为1 453 bp。将测得的序列以BLAST软件在GenBank中进行相似性检索,用DNAStar软件分析,结果发现菌株HN05和序列号为NR_075032.1(一株来源于美国的Lactobacillus sakei subsp. sakei 23K)的同源性达100%。将得到的序列同GenBank中16 株同源性高于98%的乳酸菌进行BLAST分析,构建系统发育树,如图2所示。结果显示菌株HN05与Lactobacillus sakei亲缘关系最近。由此初步确定这株菌为Lactobacillus sakei。
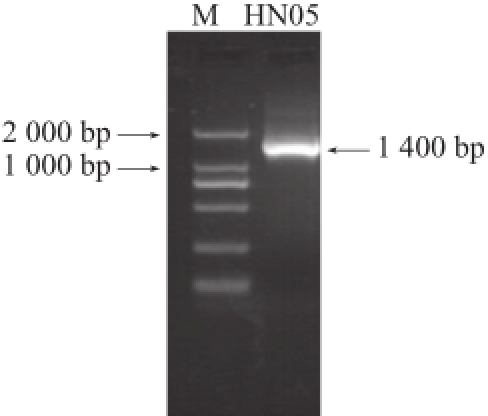
图1 菌株HN05 16S rDNA PCR产物扩增图
Fig.1 Electrophorogram of 16S rDNA PCR products from strain HN05
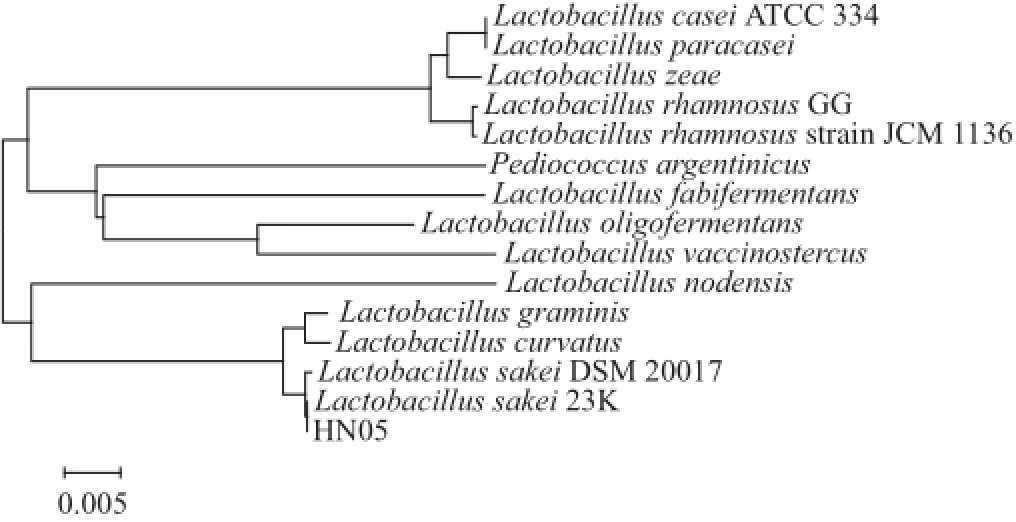
图2 HN05菌株 16S rDNA序列系统进化树
Fig.2 Phylogenetic tree based 16S rDNA sequences of strain HN05
2.3 乳酸菌的生长曲线
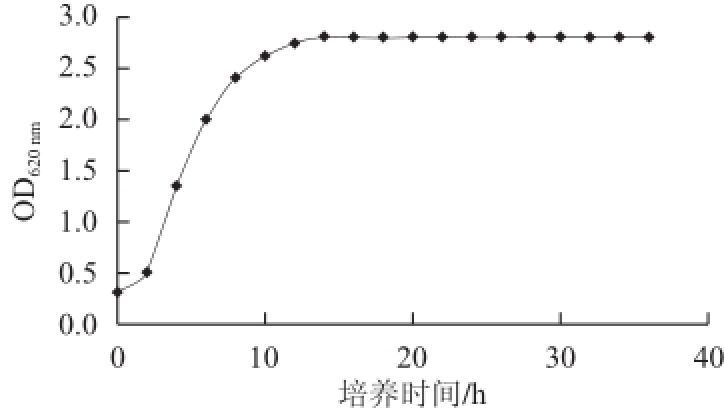
图3 乳酸菌HN05的生长曲线
Fig.3 Growth curve of strain HN05
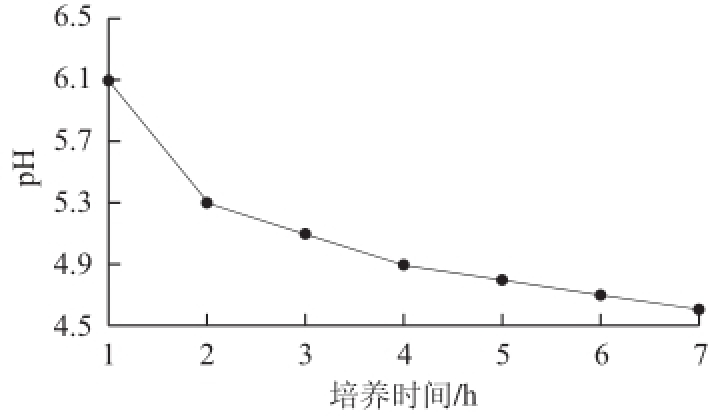
图4 乳酸菌HN05的pH值变化
Fig.4 The pH change of strain HN05
本研究对从西藏藏灵菇乳中筛选得到的11 株乳酸菌进行抗氧化实验后,得到一株具有抗氧化活性的菌株HN05,通过对该菌株的形态分析、生理生化分析及16S rDNA序列的测定,结果显示该菌株为清酒乳杆菌(Lactobacillus sakei)。该菌株的对数生长期为2~12 h,12 h的生长速率达到最快,然后进入稳定期,此后OD 620 nm值变化较小,但稍有增加的趋势,pH值逐渐下降直到7 h之后,逐渐稳定。
参考文献:
[1] HALLIWELL B, GUTTERIDGE J M, CROSS C E. Free radicals,antioxidants and human disease: where are we now?[J]. Journal of Laboratory and Clinical Medicine, 1992, 119(6): 598-615.
[2] SHAHIDI F. Antioxidants in food and food antioxidants[J]. Food/ Nahrung, 2000, 44(3): 158-163.
[3] SAIDE J A O, GILLILAND S E. Anti-oxidative activity of lactobacilli measured by oxygen radical absorbance capacity[J]. Journal of Dairy Science, 2005, 88(4): 1352-1357.
[4] SONGISEPP E, KULLISAAR T, HUTT P, et a1. A new probiotic cheese with anti-oxidative and antimicrobial activity[J]. Journal of Dairy Science, 2004, 87(7): 2017-2023.
[5] 罗章, 陈历俊, 陈历水, 等. 西藏乳及发酵乳制品中乳酸菌与酵母菌分布[J]. 食品工业科技, 2013, 34(11): 392-395.
[6] 陈历水. 乳源潜在益生酵母菌的筛选鉴定及其对类Camembert干酪特性影响[D]. 哈尔滨: 哈尔滨工业大学, 2010: 1-20.
[7] KULLISAAR T, SONGISEPP E, MIKELSAAR M, et al. Antioxidative probiotic fermented goats’ milk decreases oxidative stress-mediated atherogenicity in human subjects[J]. British Journal of Nutrition, 2003, 90(2): 449-456.
[8] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999.
[9] CAI Y, SUYANANDANA P, SAMAN P, et al. Classification and characterization of lactic acid bacteria isolated from the intestines of common carp and fresh water prawns[J]. Journal of General and Applied Microbiology, 1999, 45(4): 177-184.
[10] 周德庆. 微生物学实验教程[M]. 2版. 北京: 高等教育出版社, 2006.
[11] 张慧杰, 玉柱, 王林, 等. 青贮饲料中乳酸菌的分离鉴定及优良菌株筛选[J]. 草地学报, 2011, 19(1): 137-140.
[12] 刘天祎, 潘道东. 抗氧化活性乳酸菌的筛选[J]. 食品科学, 2011,32(19): 125-129.
[13] 张天博. 具有抗氧化活性乳酸菌的研究[D]. 上海: 上海水产大学,2007: 1-10.
[14] USKOVA M A, KRAVCHENKO L V. Antioxidant properties of lactic acid bacteria: probiotic and yogurt strains[J]. Voprosy Pitaniia,2009, 78(2): 18-23.
[15] LEE J, HWANG K, CHUNG M Y, et al. Resistance of Lactobacillus casei KCTC 3260 to reactive oxygen species (ROS): role for a metal ion chelating effect[J]. Journal of Food Science, 2005, 70(8): 388-391.
[16] LIN M Y, CHANG F J. Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356[J]. Digestive Diseases and Sciences, 2000, 45(8): 1617-1622.
[17] SHORI A B. Antioxidant activity and viability of lactic acid bacteria in soybean-yogurt made from cow and camel milk[J]. Journal of Taibah University for Science, 2013, 7(4): 202-208.
[18] 许女, 王艳萍, 习傲登, 等. 西藏Kefir粒中菌相的初步研究[J]. 中国酿造, 2011, 30(10): 133-136.
[19] 努尔古丽·热合曼, 陈晓红, 古丽苏木·托克逊, 等. 清酒乳杆菌对新疆酸驼乳发酵特性的影响[J]. 食品科学, 2011, 32(13): 275-279.
Screening and Identification of Lactic Acid Bacteria with High Antioxidant Activity from Tibetan Kefir
LUO Zhang
1, CHEN Lishui
2, CHEN Lijun
3, LIU Jichao
3, JIANG Tiemin
3
(1. College of Food Science, Agricultural and Animal Husbandry College of Tibet University, Linzhi 860000, China;2. Brand Food Center of R&D, COFCO Nutrition and Health Research Institute, Beijing 102209, China;3. R&D Center, Beijing Sanyuan Food Co. Ltd., Beijing 100086, China)
Abstract:This study aimed to obtain lactic acid bacteria (LAB) with high antioxidant activity. Intact cells and cell-free extracts of 11 LAB isolates from Tibetan Kefir were evaluated for antioxidant activities by 1,1-diphenyl-2-picrylhydrazl(DPPH) free radical scavenging and linoleic acid peroxidation inhibition assays. Strain HN05 possessing excellent antioxidant activity was screened. Based on its morphological, biochemical, physiological and genotypic characteristics, this strain was identified as Lactobacillus sakei subsp. sakei.
Key words:Tibetan Kefir; antioxidant activity; lactic acid bacteria; identification
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2015)03-0109-05
doi:10.7506/spkx1002-6630-201503021
收稿日期:2014-02-08
基金项目:国家高技术研究发展计划(863计划)项目(2011AA100903)
作者简介:罗章(1965—),男,副教授,博士,研究方向为畜产品加工及贮藏。E-mail:luozhang1759@sohu.com