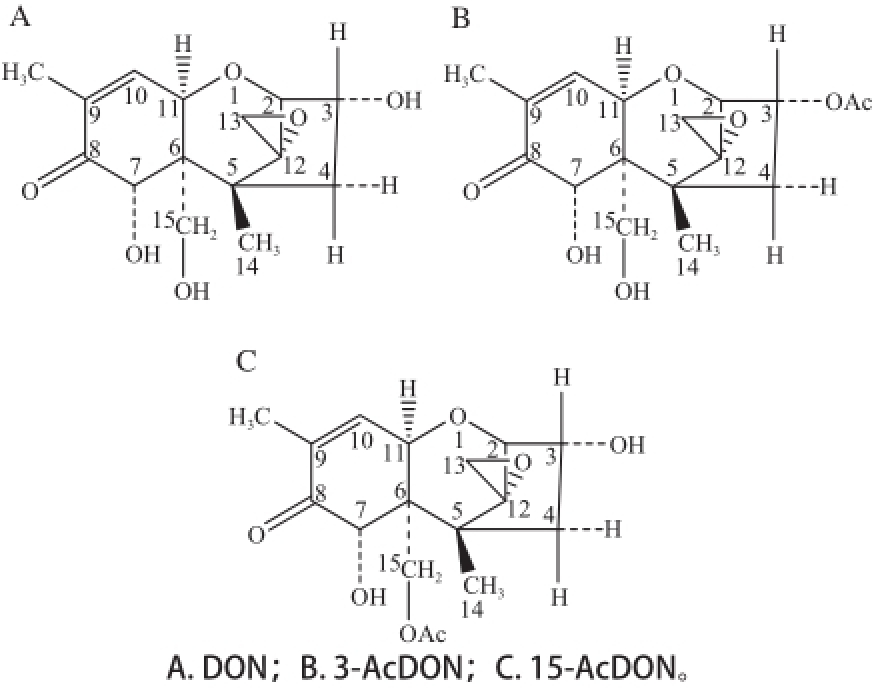
图1 化合物DON及乙酰化DON的结构
Fig.1 Structures of mycotoxin deoxynivalenol (DON) and acetyldeoxynivalenol (AcDON)
徐 华,吴弼东,郭 磊,陈 佳,林妮妮,谢剑炜*
(军事医学科学院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
摘 要:以禾谷镰刀菌Fusarium graminearum大型分生孢子定量接种大米培养物,制备毒素粗提液,采用硅胶柱一步洗脱分离、分段收集可同时获得脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和乙酰化脱氧雪腐镰刀菌烯醇(acetyldeoxynivalenol,AcDON),采用一步结晶法即可分别制备获得毒素纯品,并经红外光谱法、液相色谱-质谱联用技术及核磁共振氢谱等分析确证,液相色谱分析表明两种毒素纯度均大于98%。该培养提取及分离制备方法改变了常规多步骤繁琐过程,提供了一种切实有效的、大量制备纯化DON及乙酰化DON毒素的简便方法。
关键词:禾谷镰刀菌;脱氧雪腐镰刀菌烯醇;乙酰化脱氧雪腐镰刀菌烯醇;培养;制备
由镰刀菌引起的赤霉病(Fusarium head blight)是危害小麦、大麦、燕麦、玉米、水稻、黑麦等多种禾谷类作物的一种重要病害,广泛分布于亚洲、欧洲和北美等温暖潮湿地区,近年来随着全球气候变暖呈逐步蔓延之势。农作物在生长或储藏过程中均可感染镰刀菌,不但造成作物产量下降,更重要的是产生的镰刀菌毒素直接蓄积于禾谷类籽粒中,严重威胁人畜健康 [1-4]。
在我国,禾谷镰刀菌(Fusarium graminearum)是赤霉病的主要病原菌。禾谷镰刀菌主要产生B族单端孢霉烯族毒素,其中以脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),又名呕吐毒素(vomitoxin,VT)为主。DON利用其倍半萜烯结构作用于真核细胞蛋白质翻译过程的不同阶段,抑制蛋白质合成,破坏人畜的免疫系统,使中毒者出现腹泻、呕吐和头晕等症状,是最主要的导致食物中毒的真菌毒素之一 [5-9]。目前,各国针对谷物及其制品中DON的含量制定了严格的限量标准,我国谷物中DON的限量标准为1.0 mg/kg [10-12]。
DON的乙酰化主要发生在其3’和15’位点,产生两种乙酰化产物,分别为3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyldeoxynivalenol,3-AcDON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyldeoxynivalenol,15-AcDON)。DON及3-AcDON、15-AcDON的结构如图1所示。一般认为,乙酰化DON的毒性与DON相当。亦有研究报道,产生3-AcDON的镰刀菌具有更强的产孢率和生长速率,对麦类作物的危害更为严重,并且正在取代产生其他毒素的镰刀菌,表现出更强的适应性 [13-14]。因此,需重视DON乙酰化产物的相关研究。

图1 化合物DON及乙酰化DON的结构
Fig.1 Structures of mycotoxin deoxynivalenol (DON) and acetyldeoxynivalenol (AcDON)
鉴于真菌毒素DON和乙酰化DON在小麦等谷物中普遍存在,继而对人类和动物的安全造成严重威胁的现实,近年来,针对DON及DON相关毒素的分析检测、体内外毒性研究及安全性评价等已引起国外广泛关注 [15-19]。由于目前欧美多国遵循禁止向非澳大利亚公约组织国家出售毒素及其代谢物标准品的禁运规定,而我国DON相关毒素参考品的制备尚属空白,因而国内DON毒素的相关研究存在较大迟滞。因此,亟需研发一种简便的、可有效制备大量DON及乙酰化DON化合物的方法。
1.1 菌株、培养基与试剂
禾谷镰刀菌菌株Fusarium graminearum ACCC31058和ACCC31057购自中国农业微生物菌种保藏管理中心。
马铃薯葡萄糖(PDA)培养基购自北京奥博星生物有限公司。
DON、3-AcDON和15-AcDON毒素参考品是本实验室储存品,均配成1 mg/mL的丙酮或乙腈溶液备用;其他所有试剂均为分析纯及以上纯度。
1.2 仪器与设备
Acquity UPLC-Xevo G2 Q-TOF-MS仪器(配有电喷雾离子源(ESI)及Masslynx 4.1数据采集处理系统)美国Waters公司;XDB C 18色谱柱 美国Agilent公司;Thermo 6700傅里叶变换红外光谱仪 美国Thermo公司;ECS400MHz超导傅里叶变换核磁共振谱仪 日本Jeol公司。
1.3 方法
1.3.1 菌株培养和毒素生产
将禾谷镰刀菌菌株ACCC31058从冷藏斜面转接到PDA培养基平板上活化,25 ℃培养3~5 d,挑取少量的菌丝接种到质量分数4%绿豆汤培养基中,其瓶底预先铺满约1/2底表面积的直径约4~5 mm的玻璃珠,于25 ℃条件下200~250 r/min摇床振荡培养3~5 d,获得种子液。种子液经无菌纱布过滤除去菌丝,用血球计数器对大型分生孢子进行计数。在500 mL三角烧瓶中加入87.5 g大米,然后加入37.5 mL蒸馏水,高压制备无菌米饭培养基。接种1×10 6个孢子至米饭培养基中,拍打混匀,20~25 ℃静置培养,每日拍打瓶子底部防止培养基结块,分别于10、20、30、40、50、60、100 d收获大米固体培养物。
1.3.2 粗毒素提取及鉴定
每瓶大米固体培养物先后分别用400 mL 70%甲醇溶液和250 mL纯甲醇溶液浸泡过夜,合并两次浸提液,减压蒸去甲醇,加入1/3体积的饱和氯化钠水溶液,静置1 h后去除沉淀,再用乙酸乙酯萃取2 次,每次100 mL。收集乙酸乙酯相,合并后减压蒸馏浓缩,获得毒素的粗提液,并经薄层层析(thin layer chromatography,TLC)鉴定:将毒素粗提液,用二氯甲烷和四氢呋喃体积比为10:3的展开剂在F254薄层硅胶板上展开,以20%三氯化铝乙醇水溶液喷板显色。
1.3.3 液相色谱-质谱分析毒素粗提液
将毒素粗提液旋干后,用等量甲醇溶液重悬后,取2 μL上清液进样分析。色谱条件:XDB C 18色谱柱(3.0 mm×100 mm,1.8 μm),流动相A为含5 mmol/L乙酸铵的纯水溶液,流动相B为含5 mmol/L乙酸铵的甲醇溶液,梯度洗脱程序:0~1 min,20% B;1~7 min,20% B~70% B(线性);7~9 min,70% B。柱温40 ℃,流速0.2 mL/min。质谱条件:电喷雾离子源,毛细管电压2 500 V,锥孔电压20 V,萃取电压4 V,离子源温度100 ℃,脱溶剂气温度300 ℃,锥孔气流量50 L/h,脱溶剂气流量800 L/h。通过Acquity UPLC-Xevo G2 Q-TOF-MS仪器所配采集系统软件Masslynx 4.1进行谱图数据的采集,分析毒素粗提液成分。
1.3.4 毒素制备
1.3.4.1 毒素粗提液一步分离
毒素粗提液过制备型硅胶柱(300目,20 cm×2.5 cm),以二氯甲烷和四氢呋喃体积比为10:3的混合洗脱液一步洗脱,保持流速约为1 mL/min。
1.3.4.2 乙酰化DON毒素制备
首先收集第30~80 mL流分,将目标流分合并蒸干后用正己烷提取3 次,弃去正己烷相,剩余溶液浓缩获得棕红色油状物。将此棕红色油状物过干法制备的硅胶柱(300 目,25 cm×1.0 cm),以正己烷和乙酸乙酯体积比为1:1的混合液常压洗脱,保持流速约为1 mL/min,收集第60~100 mL流分,旋蒸至干,获得产物呈淡黄色油状物。将获得的产物在乙酸乙酯和正己烷混合体系中放置结晶,抽滤后得白色晶体,即为纯化的乙酰化DON。
1.3.4.3 DON毒素制备
另收集第200~330 mL流分,用薄层层析检测每管洗脱液中含有DON的情况,合并含有DON的收集管并旋转蒸干,溶解于少量的正己烷和乙醚体系中,抽滤后得白色晶体,即为纯化的DON。
1.3.5 毒素鉴定
分别采用红外光谱法(infrared spectroscopy,IR)、质谱法(mass spectrometry,MS)和核磁共振氢谱(nuclear magnetic resonance hydrogen spectrum, 1H-NMR)方法对制备纯化的两种毒素进行鉴定。
2.1 薄层色谱鉴定
大米培养物提取的毒素粗提液经薄层色谱鉴定,结果表明硅胶板上出现2 个明显的蓝紫色荧光斑点,分别与DON参考品和3-AcDON或15-AcDON参考品的Rf值相同。
2.2 毒素粗提液的液相色谱-质谱定性鉴定结果
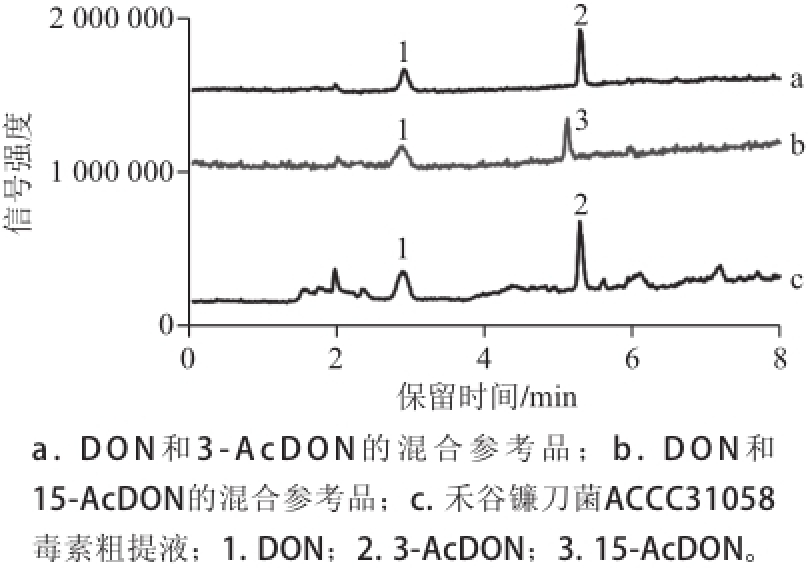
图2 禾谷镰刀菌ACCC31058毒物粗提液的液相色谱--质谱鉴定总离子流图
Fig.2 Total ion chromatography of the crude extracts from Fusarium graminearum ACCC31058 cultures
由图2可知,在大米培养物提取的粗毒素产物中,除了DON色谱峰外,还有一个明显的产物峰,其MS图中的基峰m/z为307.16,结合TLC鉴定结果,推测为乙酰化DON产物,由于常见的DON乙酰化位点存在于3’和15’位,需要进一步确认其位点信息。由于3-AcDON和15-AcDON的结构和极性均极其相似,两者在液相色谱柱上的保留行为几乎一致。在考察不同液相色谱条件的基础上,最终成功实现了两者的液相色谱分离,结果如图2所示。从而确认了该培养物中主要存在的乙酰化DON产物为3-AcDON。
2.3 DON和3-AcDON的培养时间-质量浓度曲线
考察大米培养物中DON和乙酰化DON的质量浓度随培养时间的变化曲线,结果如图3所示,在25 ℃条件下培养50 d时,DON产量达到高峰,而乙酰化DON则随着培养时间的延长呈下降趋势,尤其在培养50 d时下降显著,综合考虑,最终选择最佳培养时间为40~50 d。

图3 DON及3-AcDON的培养时间-质量浓度曲线
Fig.3 Culture time-concentration curves of DON and 3-AcDON
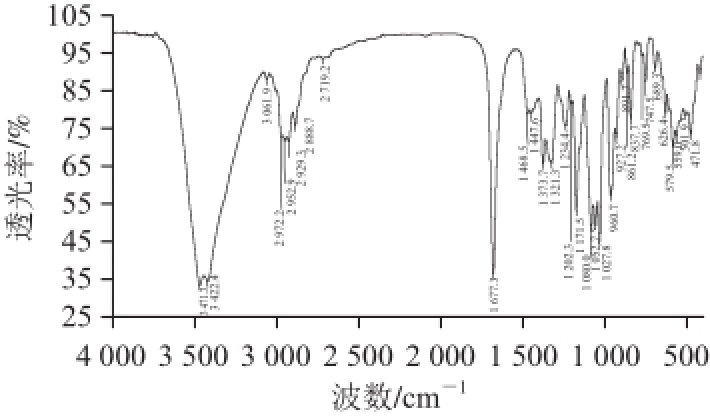
图4 化合物DON的红外光谱鉴定图
Fig.4 Infrared spectrum of DON
两种化合物结晶物的红外光谱与相应的参考谱图完全一致 [20],鉴定结果见图4和图5。其中,DON红外光谱的特征峰为3 471 cm -1(-OH)、2 972 cm -1(-CH 3)、1 677 cm -1(-C=O)、1 468 cm -1(-CH 3)、1 171 cm -1(-C-O)和1 080 cm -1(-C-O)。3-AcDON红外光谱的特征峰为3 492 cm -1(-OH)、3 422 cm -1(-OH)、1 740 cm -1(-C=O)和1 680 cm -1(-C=O)。
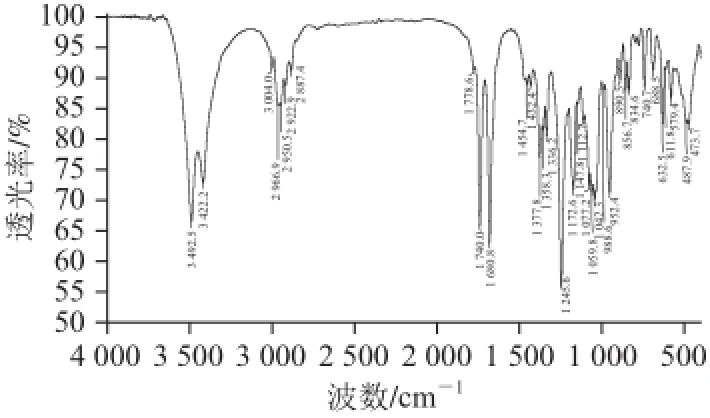
图5 化合物3-AcDON的红外光谱鉴定图
Fig.5 Infrared spectrum of 3-AcDON
2.5 质谱鉴定
DON的一级质谱中(图6A),其分子离子峰[M-H] -为m/z 295.1,与其相对分子质量296.1相吻合,同时可观察到其乙酸加合峰为m/z 355.1[M+CH 3COO]。其主要碎片离子峰(图6B)与参考品谱图及文献报道均一致 [21-22],分别为m/z 265.1[M-CH 2O-H] -,m/z 247.1[M-CH 2OH 2O-H] -和m/z 217.1[M-2CH 2O-H 2O-H] -等。
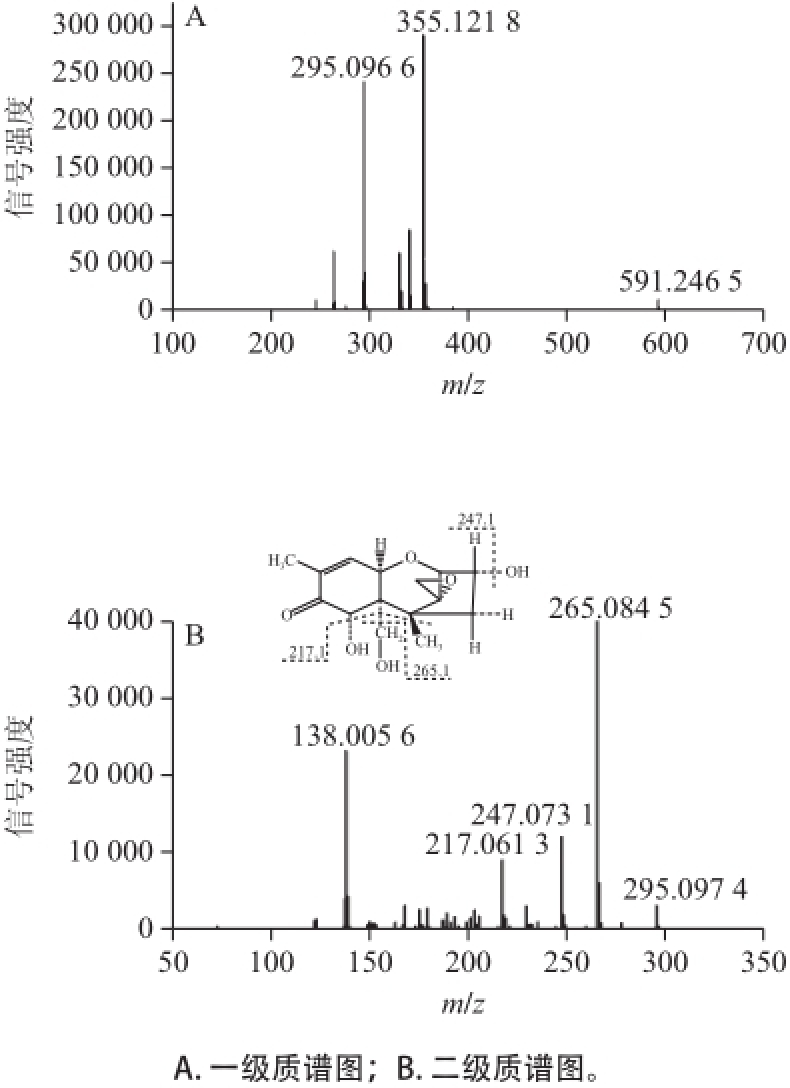
图6 化合物DON的液相色谱-质谱鉴定图
Fig.6 HPLC-MS spectra of DON
3-AcDON的一级质谱中(图7A),其分子离子峰[M-H] -为m/z 337.1,与其相对分子质量338.1相吻合,同时可观察到其乙酸加合峰为m/z 397.1[M+CH 3COO] -。其主要碎片离子峰(图7B)裂解规律与DON类似,分别为m/z 307.1[M-CH 2O-H] -,m/z 247.1[M-CH 2OCH 2CO-H 2O-H] -和m/z 217.1[M-2CH 2O-CH 2COH 2O-H] -等。

图7 化合物3-AcDON的液相色谱-质谱鉴定图Fig.7 HPLC-MS spectra of 3-AcDON
2.6 核磁共振氢谱鉴定
DON的 1H-NMR图谱为δ H2,3.66;H3,4.63;H4,2.20;H7,4.95;H10,6.79;H11,4.50;H13a,3.14;13b,3.25;H14,1.15;H15a,3.66;H15b,3.98;H16,1.92。3-AcDON的 1H-NMR图谱为δ H2,3.91;H3,5.23;H4b,2.18;H4a,2.36;H7,4.68;H10,6.62;H11,4.84;H13a,3.13;H13b,3.19;H14,1.17;H15a,3.80;H15b,3.87;H16,2.15。两种化合物的 1H-NMR鉴定结果表明,制备获得的DON和3-AcDON其 1H-NMR δ值与参考品的δ值一致。两种化合物可确认为DON和3-AcDON。
2.7 DON和3-AcDON的纯度鉴定
基于液相色谱法(紫外检测器)中的归一化法分析两种毒素的纯度,其纯度均达到98%以上,可以满足毒素相关科研的要求,亦为国际可比对实验结果和风险评估的准确数据提供质量保障。
本研究以打破国际禁运壁垒为导向,针对目前真菌毒素参考品的获取难题,旨在探讨一种简便易行的高纯度DON及相关毒素制备方法,为准确度高的溯源性分析检测提供物质基础。
DON属于倍半萜烯类化合物,具有较为复杂的化学结构,迄今为止尚未实现DON的化学全合成 [15,23]。一般而言,DON从菌株培养提取后制备纯化而得,其中关键步骤之一为种子液的获得,即通过培养获得足够数量的大型分生孢子以作接种扩大培养之用。但采用传统振荡式培养时,菌丝的抱团生长会对孢子的产生造成极大限制,影响其后的接种效率。本研究经大量前期实验,确定往放置种子培养基的培养瓶中加入玻璃珠,再行振荡培养,利用玻璃珠在振荡培养中产生的足够大的剪切力,能够有效抑制菌丝抱团生长,从而促进孢子的优势生长。
产毒时适用的接种培养基分为固体(米饭或者麦粒等)培养基和液体培养基。一般认为,固体培养基产生DON的效率要优于液体培养基,因此在DON毒素的制备纯化过程中,固体培养基仍是首选 [24-25]。但是,采用固体培养基培养时,由于小麦和大米中含有较丰富的蛋白质和糖类等组分,导致DON毒素粗提液中往往存在较多杂质,进而导致了制备纯化步骤较为繁琐耗力,效率较低,因此本研究对传统制备纯化中需多步分离洗脱、重复结晶的步骤 [15,21,25-27]加以改进,采用甲醇-乙酸乙酯体系获得毒素粗提液,仅需要通过两根硅胶柱串联、一步分离洗脱的途径,即可获得纯度良好的DON毒素,并且在正己烷和乙醚体系中通过一步重结晶的步骤,获得的DON纯度即大于98%。
研究中还发现,毒素粗提液中除了含有DON毒素外,还有高含量的乙酰化DON毒素存在。通过优化液相色谱及质谱方法,建立了分离鉴定3-AcDON和15-AcDON的方法,最终确定了ACCC31058菌株的毒素粗提液中主要含有DON和3-AcDON毒素。对培养物中该两种毒素的生成量随培养时间的变化趋势进行了考察,结果表明DON产量呈现近似抛物线型关系,培养时间过长造成DON产量下降的原因不明,可能在于DON的进一步转化抑或降解,其机理尚待进一步研究。在25 ℃培养50 d时,DON的产量达到最大值,此结果与文献中报道的一旦培养时间超过30 d,DON含量将急剧下降不同 [25,28],究其原因可能与菌株来源不同以及培养环境差异有关。而3-AcDON则随着培养时间的延长呈下降趋势,推测其可能在培养初期即迅速达到最高值,有待进一步考证。为了同时大量获得两种毒素,本研究确定最佳培养时间为40~50 d。在制备纯化毒素过程中,发现DON制备纯化过程中的一步洗脱步骤,同样适用于洗脱收集富含3-AcDON的流分。先行收集的该段流分浓缩后,再经过一次硅胶柱的层析纯化,即可获得纯度较好的3-AcDON,同样,采取乙酸乙酯和正己烷混合体系一步重结晶,即可获得纯度大于98%的3-AcDON。
对获得的两种化合物进行鉴定,其IR、MS以及 1H-NMR数据值均与相应的参考品及文献报道一致。从而确认两种化合物为DON和3-AcDON。经计算,ACCC31058菌株大米培养物的产毒率约为DON 320 mg/kg和3-AcDON 260 mg/kg。为了验证建立的培养及提取制备方法的适用性,对不同来源的菌株ACCC31057进行同样操作,最终也同样获得了高纯度的DON毒素及其乙酰化毒素产物,产毒率约为DON 220 mg/kg和3-AcDON 180 mg/kg。
综上所述,本研究所建立的方法摒弃了常规的多步骤分离洗脱以及反复重结晶的繁琐流程,采用一步洗脱分段收集以及一次重结晶法,从毒素粗提液中同时制备了DON毒素及乙酰化DON毒素,操作简单、实验费用低、产品收率高、纯度较高,是一种切实有效的、适用于大量制备纯化DON及相关毒素的简便方法。这为后续深入开展DON相关毒素在动物体内外的代谢转化研究,以及为食品安全风险评估等提供了坚实的物质基础。
参考文献:
[1] 邵振润, 周明国, 仇剑波, 等. 2010年小麦赤霉病发生与抗性调查研究及防控对策[J]. 农药, 2011, 50(5): 385-389.
[2] TANAKA T, HASEGAWA A, YAMAMOTO S, et al. Worldwide contamination of cereals by the Fusarium mycotoxins nivalenol,deoxynivalenol and zearalenone. 1. Survey of 19 countries[J]. Journal of Agricultural and Food Chemistry, 1988, 36(5): 979-983.
[3] PLACINTA C M, D’MELLO J P F, MACDONALD A M C. A review of worldwide contamination of cereal grains and animal feed with Fusarium mycotoxins[J]. Animal Feed Science and Technology, 1999,78(1/2): 21-37.
[4] YANG F, JACOBSEN S, JORGENSEN H J, et al. Fusarium graminearum and its interactions with cereal heads: studies in the proteomics era[J]. Frontiers in Plant Science, 2013, 4: 37. doi: 10.3389/fpls.2013.00037.
[5] ABOUZIED M M, AZCONA J I, BRASELTON W E, et al. Immunochemical assessment of mycotoxins in 1989 grain foods: evidence for deoxynivalenol (vomitoxin) contamination[J]. Applied and Environmental Microbiology, 1991, 57(3): 672-677.
[6] ROTTER B A, PRELUSKY D B, PESTKA J J. Toxicology of deoxynivalenol (vomitoxin)[J]. Journal of Toxicology and Environmental Health, 1996, 48(1): 1-34.
[7] OSSELAERE A, DEVREESE M, GOOSSENS J, et al. Toxicokinetic study and absolute oral bioavailability of deoxynivalenol, T-2 toxin and zearalenone in broiler chickens[J]. Food and Chemical Toxicology, 2013, 51: 350-355.
[8] 付杨, 李洪军, 贺稚非, 等. 脱氧雪腐镰刀菌烯醇研究进展[J]. 食品科学, 2011, 32(21): 289-292.
[9] 邹忠义, 贺稚非, 李洪军, 等. 畜禽产品中脱氧雪腐镰刀菌烯醇和T-2毒素残留分析[J]. 食品科学, 2013, 34(14): 208-211.
[10] SCHLATTER J. Toxicity data relevant for hazard characterization[J]. Toxicology Letters, 2004, 153(1): 83-89.
[11] 霍星华, 赵宝玉, 万学攀, 等. 脱氧雪腐镰刀菌烯醇的毒性研究进展[J].毒理学杂志, 2008, 22(2): 151-154.
[12] 中华人民共和国卫生部. GB 2761—2011 食品中真菌毒素限量[S].北京: 中国标准出版社, 2011.
[13] WARD T J, CLEAR R M, ROONEY A P, et al. An adaptive evolutionary shift in Fusarium head blight pathogen populations is driving the rapid spread of more toxigenic Fusarium graminearum in North America[J]. Fungal Genetics and Biology, 2008, 45(4): 473-484.
[14] VARGA E, MALACHOVA A, SCHWARTZ H, et al. Survey of deoxynivalenol and its conjugates deoxynivalenol-3-glucoside and 3-acetyldeoxynivalenol in 374 beer samples[J]. Food Additives & Contaminants Part A, 2013, 30(1): 137-146.
[15] CLIFFORD L J, JIA Q, PESKA J J. An improved method for the purification of the trichothecene deoxynivalenol (vomitoxin) from Fusarium graminearum culture[J]. Journal of Agricultural and Food Chemistry, 2003, 51(2): 521-523.
[16] SANDERS M, de BOEVRE M, DUMOULIN F, et al. Sampling of wheat dust and subsequent analysis of deoxynivalenol by LC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2013, 61(26): 6259-6264.
[17] PINTON P, OSWALD I P. Effect of deoxynivalenol and other type B trichothecenes on the intestine: a review[J]. Toxins (Basel), 2014, 6(5): 1615-1643.
[18] SREY C, KIMANYA M E, ROUTLEDGE M N, et al. Deoxynivalenol exposure assessment in young children in Tanzania[J]. Molecular Nutrition & Food Research, 2014. doi: 10.1002/mnfr.201400012.
[19] TAKAKURA N, NESSLANY F, FESSARD V, et al. Absence of in vitro genotoxicity potential of the mycotoxin deoxynivalenol in bacteria and in human TK6 and HepaRG cell lines[J]. Food and Chemical Toxicology, 2014, 66: 113-121.
[20] COLE R J, COX R H. Handbook of toxic fungal metabolites[M]. New York: Academic Press, 1981: 202-203; 209-210.
[21] HE Jianwei, YANG R, ZHOU Ting, et al. Purification of deoxynivalenol from Fusarium graminearum rice culture and mouldy corn by high-speed counter-current chromatography[J]. Journal of Chromatography A, 2007, 1151(1/2): 187-192.
[22] 梁颖, 张春晖, 刘邻渭. 液相色谱-质谱测定小麦中B类单端袍霉烯族毒素[J]. 中华预防医学杂志, 2006, 40(4): 293-295.
[23] COLVIN E W, THOM I G. A synthetic approach to the trichothecene deoxynivalenol[J]. Tetrahedron, 1986, 42(12): 3137-3146.
[24] 王裕中, MILLER J D, NEISH G A. 中国南京三个禾谷镰刀菌菌株所产生的毒素[J]. 植物病理学报, 1987, 19(1): 40.
[25] 陆鸣, 王裕中, 陈怀谷, 等. 禾谷镰刀菌产毒素培养条件及粗毒素提取法[J]. 江苏农业学报, 1992, 8(1): 30-40.
[26] WITT M F, HART L P, PESTKA J J. Purification of deoxynivalenol(vomitoxin) by water-saturated silica gel chromatography[J]. Journal of Agricultural and Food Chemistry, 1985, 33(4): 745-748.
[27] 马其云, 袁越, 匡开元, 等. 人工培养物中脱氧雪腐镰刀菌烯醇的提取分离[J]. 上海农业学报, 1993, 9(2): 68-71.
[28] 陆仕华, 魏春妹, 徐素珍, 等. 禾谷镰刀菌株产毒: 脱氧雪腐镰刀菌烯醇的液体培养条件[J]. 上海农业学报, 1988, 4(2): 57-64.
A Convenient Method for Preparation and Purification of Deoxynivalenol and Acetyldeoxynivalenol from Fusarium graminearum Culture
XU Hua, WU Bidong, GUO Lei, CHEN Jia, LIN Nini, XIE Jianwei
*
(State Key Laboratory of Toxicology and Medical Countermeasures, Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences, Beijing 100850, China)
Abstract:Fusarium graminearum macroconidia were quantitatively inoculated in rice culture, and the crude extracts of the toxins were prepared and subjected to silica gel column chromatography. Deoxynivalenol (DON) and acetyldeoxynivalenol(AcDON) isolates were monitored by thin-layer chromatography and the fractions rich in these toxins were pooled and concentrated, respectively. Both fractions yielded a crystalline material through a simple crystallization step. The two compounds were identified and confirmed by infrared spectroscopy, liquid chromatography-mass spectrometry and 1H NMR analysis in comparison to the reference standards or the published data. The liquid chromatography analysis showed that the purity of the two toxins were both greater than 98%. This method developed here has overcome the disadvantages of the conventional cumbersome multi-step procedure, and provided a simplified and efficient strategy suitable for large-scale production and purification of the mycotoxin DON and its acetylated products AcDON from Fusarium graminearum rice cultures.
Key words:Fusarium graminearum; deoxynivalenol; acetyldeoxynivalenol; culture; preparation
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2015)03-0132-05
doi:10.7506/spkx1002-6630-201503025
收稿日期:2014-03-21
基金项目:“十二五”国家科技支撑计划项目(2011BAK10B07-1)
作者简介:徐华(1979—),女,助理研究员,博士,研究方向为毒物药物分析。E-mail:xuhua-1979@163.com
*通信作者:谢剑炜(1964—),男,研究员,博士,研究方向为毒物药物分析。E-mail:xiejw@bmi.ac.cn