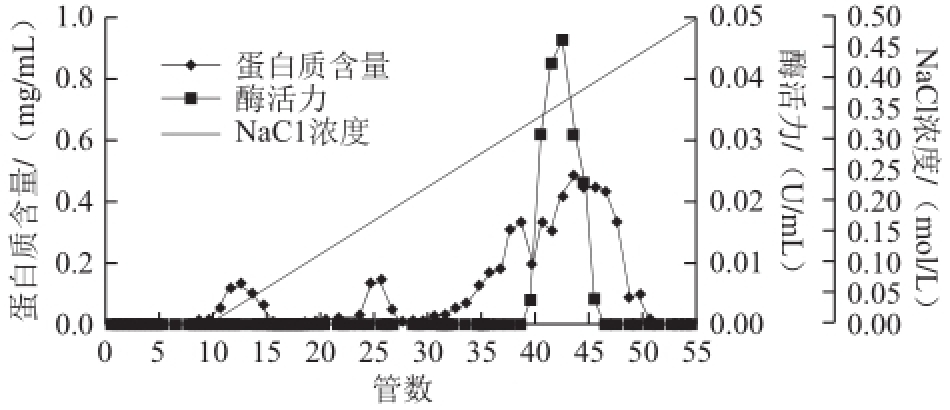
图1 猪脑乙酰胆碱酯酶DEAE-Sepharose层析洗脱图谱
Fig.1 DEAE-Sepharose chromatographic profile of AChE from porcine brain
王 洁,李 星,王红扬,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
摘 要:通过离心、硫酸铵分级沉淀、DEAE-Sepharose和Superdex-200层析等步骤,从猪脑中获得电泳纯乙酰胆碱酯酶,该酶比活力和纯化倍数分别为2.05 U/mg和26.97,酶活回收率为11.95%;该酶分子质量为257.30 kD,亚基为66.94 kD;以碘化硫代乙酰胆碱为底物时,酶的最适反应温度为37 ℃,最适pH值为7.4,且在40 ℃以下,pH 6.0~8.0有较好的稳定性;最适底物浓度为4.0 mmol/L,K m为0.94 mmol/L。Ba 2+和Zn 2+对该酶有强烈的抑制作用,而低浓度Mg 2+对该酶有激活作用。
关键词:乙酰胆碱酯酶;猪脑;分离纯化;性质
胆碱酯酶(cholinestease,ChE)是生物体内一类重要的水解酶,一般可分为乙酰胆碱酯酶(acetyl cholinesterase,AChE,EC 3.1.1.7)和丁酰胆碱酯酶(butyrycholnesterase,BChE) [1]。乙酰胆碱酯酶是动物神经系统中最重要的递质水解酶,其主要功能是将传导神经兴奋的乙酰胆碱迅速水解为乙酸和胆碱,神经系统得以进行正常的生理功能 [2-3]。
乙酰胆碱酯酶的催化活性可被有机磷或氨基甲酸酯类农药所抑制。主要是它们能够快速不可逆地与AChE的活性部位结合,使其失活,导致昆虫中毒,起到杀虫的效果。此外,人畜长期食用含有残留农药的食物,会使农药残留在体内,并累积致毒害,对人类健康造成不良影响,必须引起高度重视 [4]。AChE的活性受抑制程度,即水解产物与农药的量呈线性关系,利用这一特性形成了针对有机磷和氨基甲酸酯类检测技术,用来检测果蔬中的农药残留量 [5]。由于乙酰胆碱酯酶在神经传导中的重要作用以及它与有机磷或氨基甲酸酯类农药中毒作用的密切关系,引起了人们极大的关注。1938年,Nachmansohn和Lederer从电鳐(Torpedo mamorata)的电器官分离了AChE [6],此后不同来源的乙酰胆碱酯酶相继得到了纯化和研究。如海参肠 [7]、骚扰角蝇 [8]、中国丁氏双鳍电鳐 [9]、鲅鱼脑 [3]、黄姑鱼肌肉 [10]、眼睛蛇毒液 [11]、鸭血清 [12]和胎牛血清 [13]等。乙酰胆碱酯酶作为生物标志物,在农业、食品、环境、军事、医学等领域中有重要用途 [14]。我国是世界上第一养猪大国,养猪量约占全世界的一半。从猪脑中分离纯化乙酰胆碱酯酶,这对于提高养猪收益,同时丰富乙酰胆碱酯酶研究内容具有重要的实践和理论意义。因此,本实验从猪脑中分离纯化乙酰胆碱酯酶并研究其酶学性质,以期为该酶的来源及进一步研究和猪脑的综合开发利用提供科学参考。
1.1 材料、试剂与仪器
新鲜猪脑购于重庆市天生农贸市场,于-20 ℃冰箱中冷冻保存备用。
牛血清白蛋白、碘化硫代乙酰胆碱(acetylthiocholine iodide,ATCh)、碘化硫代丁酰胆碱(S-butyrylthiocholine iodide,BTCh)、二硫代双硝基苯甲酸(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)、丙烯酰胺、甲叉-双丙烯酰胺 美国Fluka公司;DEAE-Sepharose、Superdex-200、凝胶层析分子质量标准品、蛋白质SDSPAGE标准品 美国GE公司;三羟甲基氨基甲烷 香港Farco公司;Triton X-100、考马斯亮蓝R-250 美国Bio-Rad公司;其他试剂均为国产分析纯。
UV-2550型分光光度计、核酸蛋白分析仪 日本岛津公司;AKTA Prime plus纯化系统 美国GE公司;5804R高速冷冻离心机 德国Eppendorf公司;AL204精密电子天平、Seven Easy pH计 瑞士Mettler-Toledo公司;Mill-Q plus纯水仪 美国Millipore公司;垂直电泳槽和电泳仪 美国Bio-Rad公司;MC4L冷冻干燥机德国Uni-Equip公司。
1.2 方法
1.2.1 粗酶液的制备
新鲜猪脑称质量后,用自来水洗净,除去脑膜和大血管,再用蒸馏水反复冲洗数次,剪碎,然后以1:3(m/V)的比例加入预冷的0.02 mol/L pH 7.4 Tris-HCl缓冲液(含1% Triton X-100,15 mmol/L NaCl),匀浆后于4 ℃冰箱静置抽提2 h。在4 ℃条件下12 000 r/min离心30 min,收集上清液,并且缓慢滴入0.1 mo/L硫酸溶液调整pH值至5.5 [15-16],4 ℃条件下静置3 h后,8 000 r/min离心30 min,收集上清液加入硫酸铵至30%饱和度,4 ℃条件下静置2 h后,8 000 r/min离心30 min,收集上清液加入硫酸铵至饱和度为50%,4 ℃盐析2 h,8 000 r/min离心30 min,沉淀用0.02 mol/L pH 7.4 Tris-HCl缓冲液溶解,4 ℃条件下透析过夜即得粗酶液。
1.2.2 DEAE-Sepharose层析
DEAE-Sepharose层析柱用0.02 mol/L pH 7.4 Tris-HCl缓冲液平衡后,取透析后的酶液10 mL上样,用0~0.5 mol/L NaCl(0.02 mol/L pH 7.4 Tris-HCl缓冲液配制)进行线性梯度洗脱,流速0.5 mL/min,测定各管酶活性和蛋白质含量,收集活性较高的酶液,4 ℃透析过夜,冷冻干燥后进行凝胶层析。
1.2.3 Superdex-200层析
Superdex-200层析柱(16 mm×835 mm)经0.02 mol/L pH 7.4 Tris-HCl缓冲液平衡后,取经DEAE-Sepharose层析收集浓缩后的酶液5 mL上样,用Tris-HCl(0.02 mol/L pH 7.4)缓冲液洗脱,流速为0.3 mL/min,测定每管酶活性和蛋白质含量,收集活性较高的酶液,4 ℃透析除盐,冷冻干燥后保存于-20 ℃备用。
1.2.4 乙酰胆碱酯酶活性的测定
参照Ellman等 [17]的方法进行,具体操作为:在试管中加入3 mL 0.02 mol/L pH 7.4 Tris-HCl缓冲液(pH 7.4),加入20 μL乙酰胆碱酯酶酶液,混匀,在30 ℃恒温水浴保温10 min,然后依次加入100 μL 10 mmol/L DTNB溶液,20 μL 75 mmol/L碘化硫代乙酰胆碱溶液,总体积为3.14 mL,充分混匀,在412 nm波长处进行比色,每隔0.5 min读数一次,连续测定3 min,根据1 min内OD 412 nm值变化来计算酶活力。每分钟催化分解1 μmol碘化硫代乙酰胆碱所需的酶量为一个酶活力单位(U)。
1.2.5 蛋白质含量的测定
采用Bradford方法 [18]和紫外分光光度法 [19]。
1.2.6 乙酰胆碱酯酶纯度的鉴定及分子质量测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)进行纯度鉴定 [20],5%浓缩胶,10%分离胶。全分子质量测定采用凝胶过滤法 [21],酶亚基分子质量的确定采用SDS-PAGE法测定 [22]。
1.2.7 乙酰胆碱酯酶性质的测定
1.2.7.1 温度和pH值对乙酰胆碱酯酶活性的影响
分别在20、30、37、40、50、60、70 ℃,以及pH 4.0、5.0、6.0、7.0、8.0、9.0条件下,测定乙酰胆碱酯酶的活性,以确定温度和pH值对AChE活性的影响。
1.2.7.2 底物对乙酰胆碱酯酶活力的影响
分别将碘化硫代乙酰胆碱和碘化硫代丁酰胆碱配制成0.5~10.0 mmol/L的底物溶液,测定其相应的酶活力,以确定底物对酶活性的影响。
1.2.7.3 乙酰胆碱酯酶米氏常数的测定
将碘化硫代乙酰胆碱配制成不同浓度(0.5~4.0 mmol/L)的溶液,按酶活力测定方法测定相应的酶活力,根据Lineweaver-Burk双倒数作图法 [23],求出K m值。
1.2.7.4 部分金属离子对乙酰胆碱酯酶活力的影响
用0.02 mol/L pH 7.4 Tris-HCl缓冲液将不同的金属离子溶液稀释成1.0、2.0、4.0、6.0、8.0、10.0 mmol/L的溶液。取上述溶液3 mL添加到酶反应体系中,按酶活力测定方法测定相应的酶活力,以确定某些金属离子对该酶的影响。
2.1 猪脑乙酰胆碱酯酶的分离纯化
猪脑乙酰胆碱酯酶粗提液经DEAE-Sepharose层析(每管收集5 mL)的洗脱图谱如图1所示。乙酰胆碱酯酶的活性峰出现在41~47 管之间,其中44 管酶活性最高。经透析、冷冻浓缩后,再经Superdex-200层析(每管收集3 mL)的洗脱图谱见图2,乙酰胆碱酯酶活性峰23~28 管,其中26 管酶活性最高。收集活性管酶液经透析冷冻干燥浓缩后备用。酶的整个分离纯化结果见表1,该酶的比活力较低,还需优化实验条件进一步提高纯化倍数。

图1 猪脑乙酰胆碱酯酶DEAE-Sepharose层析洗脱图谱
Fig.1 DEAE-Sepharose chromatographic profile of AChE from porcine brain
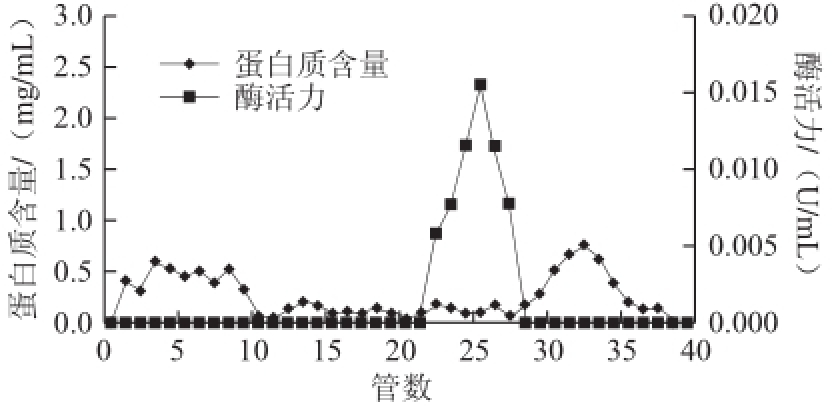
图2 猪脑乙酰胆碱酯酶Superdex-200层析图谱
Fig.2 Superdex-200 chromatographic profile of AChE from porcine brain
表1 猪脑乙酰胆碱酯酶的纯化结果
Table1 Purification of AChE from porcine brain
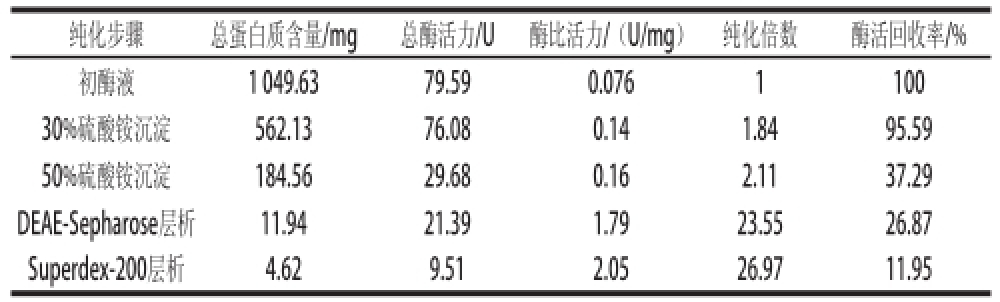
纯化步骤总蛋白质含量/mg总酶活力/U酶比活力/(U/mg)纯化倍数酶活回收率/%初酶液1 049.6379.590.0761100 30%硫酸铵沉淀562.1376.080.141.8495.59 50%硫酸铵沉淀184.5629.680.162.1137.29 DEAE-Sepharose层析11.9421.391.7923.5526.87 Superdex-200层析4.629.512.0526.9711.95
2.2 猪脑乙酰胆碱酯酶的分子质量
所得的猪脑乙酰胆碱酯酶经SDS-PAGE鉴定为单一条带,见图3,说明该酶已达到电泳纯。测定其亚基分子质量为66.94 kD,经Superdex-200层析法测定猪脑AChE的全酶分子质量为257.30 kD,因此,推测猪脑AChE由4 个相同的亚基组成。
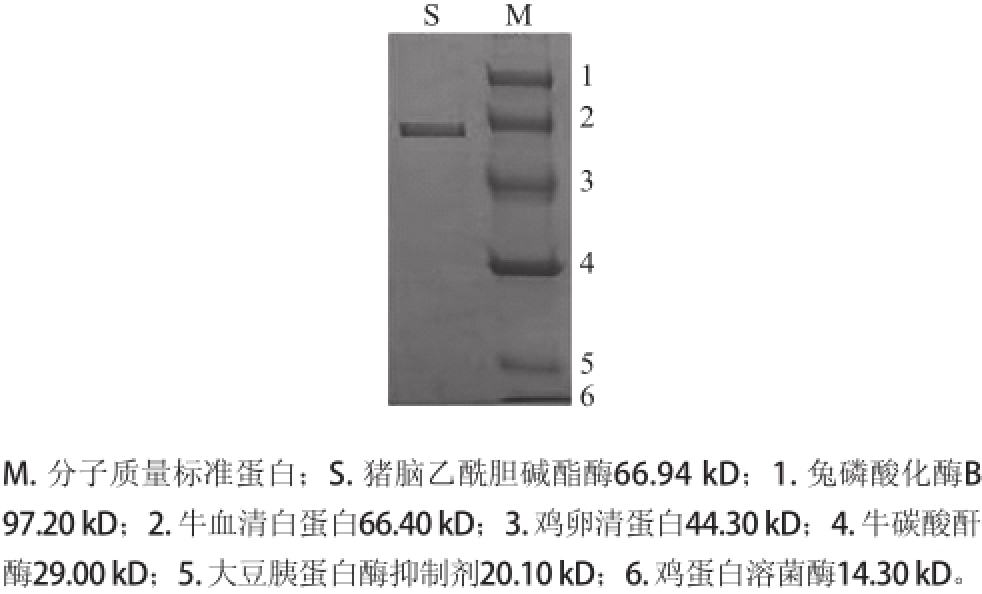
图3 猪脑乙酰胆碱酯酶SDS-PAGGEE图
Fig.3 SDS-PAGE of purified AChE from porcine brain
2.3 猪脑乙酰胆碱酯酶的性质
2.3.1 猪脑乙酰胆碱酯酶的最适温度与热稳定性
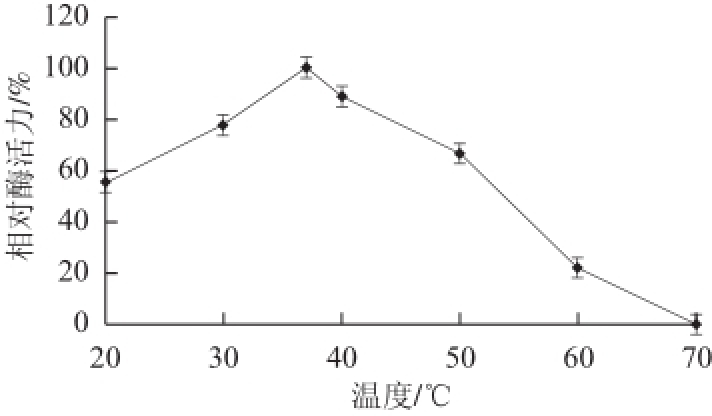
图4 温度对猪脑乙酰胆碱酯酶活力的影响
Fig.4 Effect of temperature on the activity of AChE from porcine brain
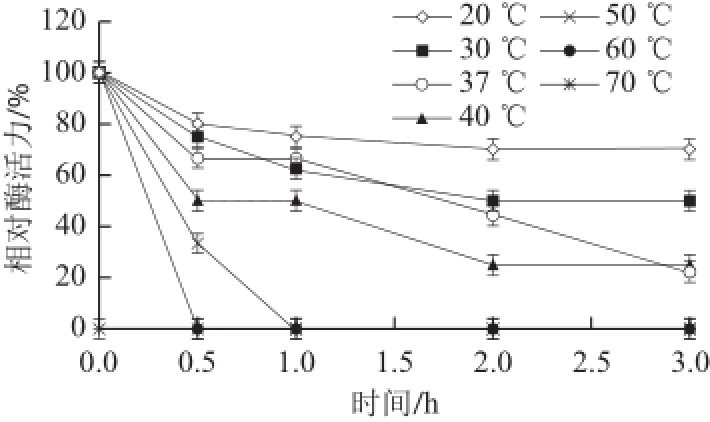
图5 猪脑乙酰胆碱酯酶的热稳定性
Fig.5 Effects of temperature on the stability of AChE from porcine brain
在20~70 ℃条件下,分别测定AChE的活性,其他条件不变。以酶活力最高值为100%,结果见图4。AChE的最适反应温度在37 ℃。酶液在20~60 ℃条件下分别保温0.5、1.0、2.0、3.0 h后,测定酶活力,以酶液不保温时的酶活力为100%,结果如图5所示,在20~40 ℃内,酶活性较稳定。保温0.5 h活性保留原有活性的50%以上。50 ℃保温1.0 h,酶活力损失90%以上,60 ℃保温0.5 h,酶失活。随着温度的升高,酶活力迅速降低,温度为70 ℃时,酶完全失活。说明该酶在低于40 ℃条件下,具有一定的稳定性。
2.3.2 猪脑乙酰胆碱酯酶的最适pH值及稳定性
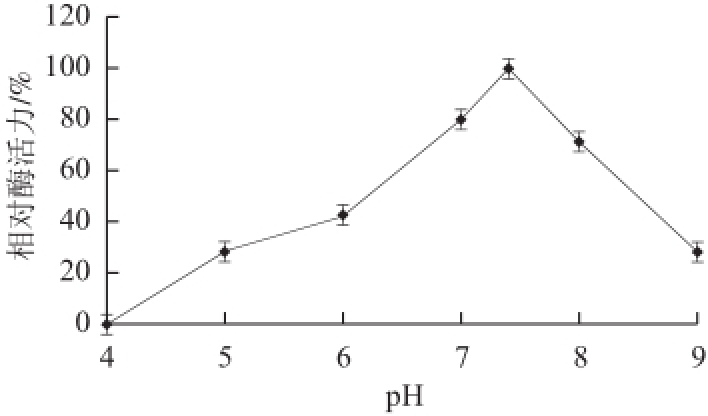
图6 pH值对猪脑乙酰胆碱酯酶活力的影响
Fig.6 Effect of pH on the activity of AChE from porcine brain
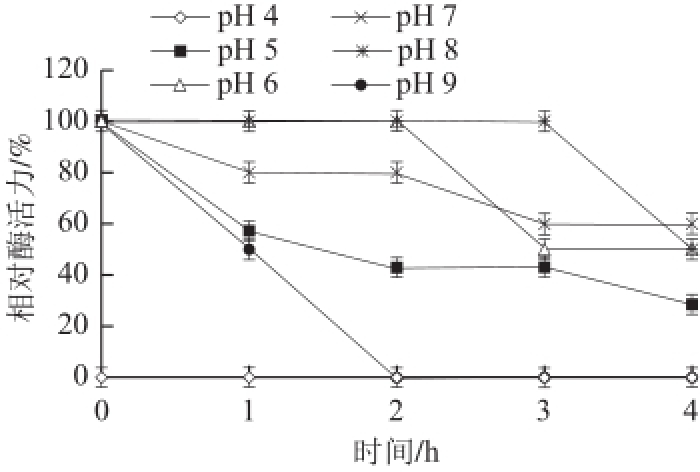
图7 猪脑乙酰胆碱酯酶的pH值稳定性
Fig.7 pH-dependent stability of AChE from porcine brain
在pH 4.0~9.0的缓冲液中测定AChE的活性,以酶活力最高值为100%,如图6所示。酶的最适pH值为7.4。在pH 7.0~8.0范围内AChE的活力均可达到最高酶活力的70%以上,pH值低于7.0或高于8.0酶活力均下降。将纯化的酶液与pH 4.0~9.0的缓冲液相混合,室温条件下,分别放置1.0、2.0、3.0、4.0 h,测定酶活力,以酶活力最高值为100%,计算pH 4.0~9.0条件下的相对酶活力,结果见图7,表明当pH 7.0~8.0范围内,放置时间2.0 h,酶活力保持在80%以上。当pH值为4.0时,酶完全失活。pH 9.0时,2.0 h后酶活力完全丧失,当pH 5.0、4.0 h后,酶活力仅剩40%。
2.3.3 底物对猪脑乙酰胆碱酯酶活力的影响
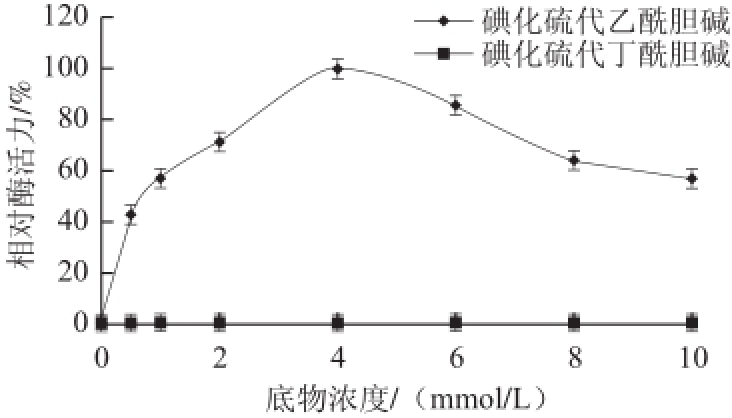
图8 底物对猪脑乙酰胆碱酯酶活力的影响
Fig.8 Effects of concentrations of the substrates ATCh and BTCh on the activity of AChE from porcine brain
在最适反应条件下,分别以0.5~10.0 mmol/L碘化硫代乙酰胆碱和0.5~10.0 mmol/L碘化硫代丁酰胆碱为底物,测定猪脑AChE的酶活力,以最高酶活力为100%作图,结果如图8所示。发现当以碘化硫代丁酰胆碱为底物时,酶活力很难检测,几乎没有酶活力,以碘化硫代乙酰胆碱为底物时,底物浓度较低时,酶活力随着浓度的增加而增大,当浓度超过4.0 mmol/L时,酶活力随着底物浓度的增加而降低,说明猪脑AChE最佳底物为碘化硫代乙酰胆碱,以碘化硫代乙酰胆碱为底物时,表现底物过量抑制现象。
2.3.4 猪脑乙酰胆碱酯酶的米氏常数
用不同浓度(0.5~4.0 mmol/L)的碘化硫代乙酰胆碱溶液,在pH 7.4、37 ℃条件下测定猪脑AChE的酶活力,采用双倒数作图法(Lineweaver-Burk),得图9,求得猪脑AChE对碘化硫代乙酰胆碱的K m为0.94 mmol/L。
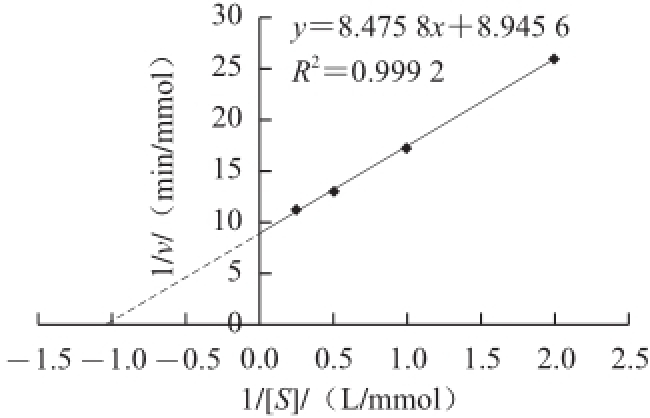
图9 双倒数法测得猪脑乙酰胆碱酯酶的米氏常数
Fig.9 Lineweaver-Burk plot for K
mdetermination of AChE from porcine brain
2.3.5 不同金属离子对猪脑乙酰胆碱酯酶活力的影响
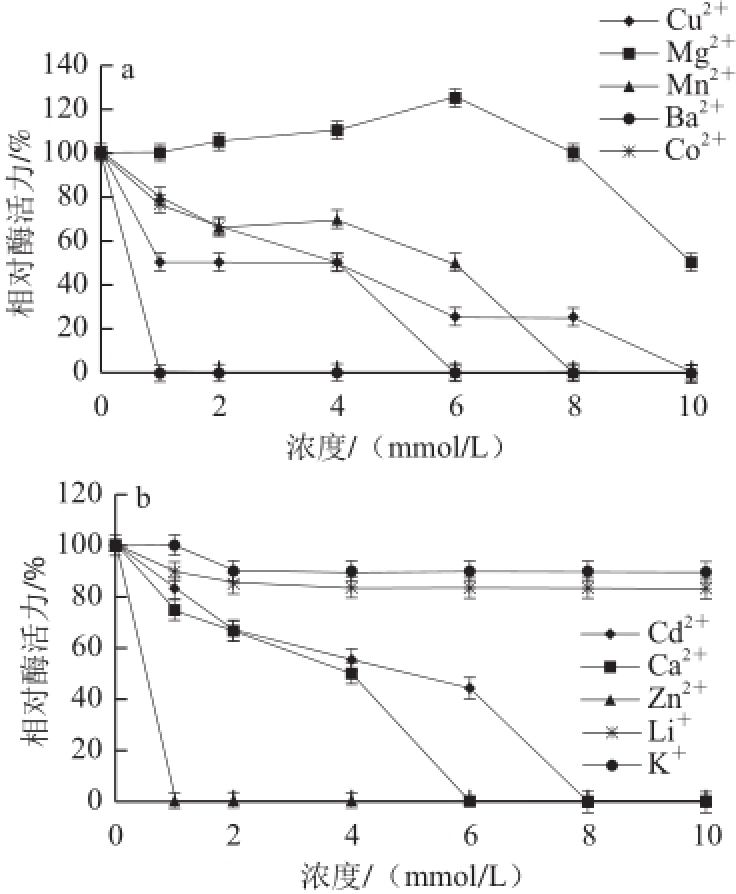
图10 金属离子对猪脑乙酰胆碱酯酶活力的影响
Fig.10 Effects of various metal ions on the activity of AChE from porcine brain
不同浓度(1.0~10.0 mmol/L)的金属离子溶液添加到酶反应体系中,以0 mmol/L的酶活力作为100%,计算其他浓度的相对酶活力,结果如图10所示,低浓度的Mg 2+溶液对该酶具有激活作用,超过一定浓度后,随着溶液浓度的增加,出现抑制作用,其他金属离子对该酶表现出不同的抑制作用,尤其Ba 2+和Zn 2+的抑制作用最为明显;K +和Li +对酶的抑制作用随浓度的升高而有所下降。
本研究以来源广泛、廉价的猪脑为分离纯化材料;通过匀浆离心、硫酸铵分级沉淀、DEAE-Sepharose层析和Superdex-200层析等方法,从猪脑中获得了回收率为11.95%、纯化倍数26.97 倍、酶比活力为2.05 U/mg的乙酰胆碱酯酶,经SDS-PAGE凝胶电泳可得单一条带,说明该酶达到了电泳纯。许多胆碱酯酶是存在于膜上的酶 [10],用表面活性剂将膜上的胆碱酯酶溶解下来是一种温和有效的方法。Triton X-100是一种非离子表面活性剂,蛋白质的疏水区及膜脂与之形成共胶束,从而提高Triton X-100与膜的亲和性,使AChE从膜上脱落。因此本实验提取液中添加体积分数为1%的Triton X-100,使酶从膜上分离下来。
从猪脑中分离纯化得到的乙酰胆碱酯酶,经Superdex-200层析测得全酶分子质量为257.30 kD,经SDS-PAGE测定亚基分子质量为66.94 kD,则该酶由4 个相同亚基组成;该酶催化碘化硫代乙酰胆碱最适温度为37 ℃,最适pH值为7.4,温度在40 ℃以下,该酶有较好热稳定性,在pH 6.0~8.0范围内,该酶相对稳定。不同来源的乙酰胆碱酯酶的最适温度和最适pH值略有差别,如来源于蚯蚓的AChE最适温度为39 ℃ [24];来源于黄鱼脑组织的AChE最适温度是35 ℃,最适pH值是8.0 [25];来源于鲅鱼脑组织AChE最适温度为30 ℃,最适pH值为7.5 [3]。
猪脑乙酰胆碱酯酶的K m值为0.94 mmol/L,与其他不同生物来源的乙酰胆碱酯酶K m值相比较,高于家蚕头部来源的乙酰胆碱酯酶K m0.392 mmol/L [26]和来源于罗非鱼肌肉AChE的表观K m0.229 mmol/L [27];低于来源于胎牛血清的乙酰胆碱酯酶K m7.48 mmol/L [13],与无脊椎动物真宽水蚤乙酰胆碱酯酶K m0.02 mmol/L [28]存在明显的差异。底物过量抑制是区别乙酰胆碱酯酶和丁酰胆碱酯酶的一个重要依据 [29],猪脑乙酰胆碱酯酶的最佳底物是碘化硫代乙酰胆碱,当底物浓度超过4.0 mmol/L时,表现出过量底物抑制现象,并且该酶不能催化分解碘化硫代丁酰胆碱。Ba 2+和Zn 2+对猪脑乙酰胆碱酯酶有显著的抑制作用;低浓度的Mg 2+对AChE具有激活作用,高浓度时则抑制其活性,Mg 2+的加入,可能会降低酶催化反应的活化能,以加快酶促反应的速率 [30]。
参考文献:
[1] 张纯丽, 马美湖. 活性肽提取分离方法研究进展[J]. 农产品加工: 学刊, 2006(3): 27-32.
[2] 罗春元. 胆碱酯酶结构与功能及磷酰化酶重活化机理[J]. 生物化学与生物物理学进展, 1996, 23(4): 329-333.
[3] 朱小山, 孟范平, 何东海. 鲅鱼脑组织AChE的分离纯化及某些生化性质[J]. 青岛大学学报: 工程技术版, 2006, 21(2): 35-41.
[4] LI F, ZHAO J H. Purification and characterization of acetylcholinesterase from ctton aphid (Aphis gossypii Glover)[J]. Archives of Insect Biochemistry and Physiology, 2002, 51(1): 37-54.
[5] SIEGFRIED B D, SCOTT J G. Properties and inhibition of acetylcholinesterase in resistant and susceptibe German cockroaches(Blatella gemanica L.)[J]. Pesticide Biochemistry and Physiology,1990, 38(2): 122-129.
[6] NACHMANSOHN D, LEDERER E. Sur la biochimie de la cholinesterase[J]. Bulletin of the Polish Academy of Sciences Chemistry Biology, 1939, 21: 797-808.
[7] 杜英, 朱蓓薇, 吴海涛, 等. 海参肠乙酰胆碱酯酶亲和层析洗脱条件的优化[J]. 食品科学, 2012, 33(8): 6-10.
[8] XU G, BULL D L. Acetylcholinesterase from the horn fly (Diptera: Muscidae): distribution and purification[J]. Journal of Economic Entomology, 1994, 87(1): 22-26.
[9] 孙曼霁, 高天栋, 邢志勇, 等. 中国丁氏双鳍电鳐乙酰胆碱酯酶的制备和层析[J]. 生物化学杂志, 1985, 1(2): 47-55.
[10] 施善平, 张景园. 黄姑鱼肌肉胆碱酯酶的纯化及其某些性质[J]. 生物化学与生物物理学报, 1981, 13(1): 9-16.
[11] 余微明, 屈贤铭, 邱雪贞. 浙江产眼睛蛇毒胆碱酯酶的研究[J]. 生物化学与生物物理学报, 1981, 13(1): 45-54.
[12] 郭胜清, 曹树桂, 程玉华, 等. 鸭血清胆碱酯酶的纯化及性质研究[J].生物化学与生物物理进展, 1993, 20(2): 119-124.
[13] 黄永春, 刘红梅, 彭祎, 等. 胎牛血清乙酰胆碱酯酶的酶学性质研究[J]. 安全与环境学报, 2009, 9(4): 29-32.
[14] 张千, 王取南. 乙酰胆碱酯酶生物功能的研究进展及其应用[J]. 国外医学: 卫生分册, 2008, 35(3): 143-147.
[15] ZHU Hong, LI Xiangyun, DENG Yu. Purification and characterization of the butyrylcholinesterase from duck liver[J]. Science and Technology of Food Industry, 2011, 32(1): 95-99.
[16] 周祖新, 丁蕙, 周萍. 鸡血中乙酰胆碱酯酶的提取比较[J]. 化学世界,2009(1): 49-51.
[17] ELLMAN G L, COURTNEY D, ANDRES V, et al. A new and rapid colorimeteric determination of acetylcholinesterase activity[J]. Biochemical Pharmacology, 1961, 7(1): 88-95.
[18] BRADFORD M M. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.
[19] LAYNE E. Spectrophotometric and turbidimetric methods for measuring proteins[J]. Methods in Enzymology, 1957, 3: 447-454.
[20] 朱广廉, 杨中汉. SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量[J].植物生理学通讯, 1992(2): 43-47.
[21] 杨安钢. 生物化学与分子生物学实验技术[M]. 北京: 高等教育出版社, 2001: 248-252.
[22] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[23] 陈钧辉, 陶力, 朱婉华, 等. 生物化学实验[M]. 北京: 科学出版社, 2004.
[24] DING Shihua, LI Qingyi. Purification and characterization of the cholinesterase from Eisenia foctida[J]. Chinese Journal of Applied and Environmental Biology, 1997, 3(3): 246-251.
[25] 朱小山, 孟范平, 何东海. 黄鱼(Hexagrammos otakii)脑组织AChE的亲和层析[J]. 中国海洋大学学报: 自然科学版, 2004, 34(2): 231-237.
[26] 彭霞, 陶科, 滕云, 等. 农药靶标乙酰胆碱酯酶的分离纯化及性质研究[J]. 四川大学学报: 自然科学版, 2008, 45(1): 189-193.
[27] DING Yunhua, WU Xiaomin, FANG Junbin. Purification and characterization of muscle acetylcholinesterase of Oreochromis aurea and its sensitivity to insecticides[J]. Journal of Hydroecology, 2012,33(1): 120-125.
[28] FORGET J, BOCQENE G. Partial purification and enzymatic characterization of acetylcholinesterase from the intertial marine copepod Tigriopus brevicornis[J]. Comparative Biochemistry and Physiology, 1999, 123(4): 345-350.
[29] AUGUSTINSSON K B. Cholinestery[J]. Acta Physiologica Scandinavica, 1948, 52: 1-182.
[30] 王健. 金属离子对酶功能所起的作用[J]. 宜宾师专学报, 1993(2): 65-71.
Purification and Characterization of Acetylcholinesterase from Porcine Brain
WANG Jie, LI Xing, WANG Hongyang, TANG Yunming
*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweet-potato Engineering Research Center, College of Life Science, Southwest University, Chongqing 400715, China)
Abstract:Acetylcholinesterase (AChE) was purified from porcine brain by consecutive steps including centrifugation,ammonium sulfate fractionation, DEAE-Sepharose chromatography and Superdex-200 gel filtration chromatography. The purified AChE exhibited a specific activity of 2.05 U/mg, with 26.97-fold purification and an activity yield of 11.95%. The relative molecular weight of AChE was 257.30 kD, and the subunit molecular weight was 66.94 kD. The optimal pH and temperature for the enzyme were 7.4 and 37 ℃, respectively. The enzyme was stable below 40 ℃ and in the pH range of 6.0-8.0. At an optimal substrate concentration of 4.0 mmol/L, the apparent K mwas 0.94 mmol/L. The activity of AChE was inhibited by Ba 2+or Zn 2+, but enhanced by Mg 2+.
Key words:acetylcholinesterase; porcine brain; isolation and purification; characterization
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2015)03-0137-05
doi:10.7506/spkx1002-6630-201503026
收稿日期:2014-03-01
基金项目:重庆市科委重点攻关项目(CSTC2011AB1027)
作者简介:王洁(1985—),女,硕士研究生,主要从事生化遗传学研究。E-mail:wangjie51031@163.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn