牛乳源金黄色葡萄球菌耐药性变迁及β-内酰胺类药物耐药基因分析
凡 琴
1,2,刘书亮
1,*,吴聪明
3,韩新锋
1,周 康
1,刘冬香
1,侯小刚
1
(1.四川农业大学食品学院,四川 雅安 625014;2.宜宾市南溪区食品药品监督管理局,四川 宜宾 644100;3.中国农业大学动物医学院,北京 100194)
摘 要:采用肉汤微量稀释法,对203 株源于2006—2011年四川牛乳源金黄色葡萄球菌(Staphylococcus aureus,Sa)进行10 种常用抗生素药敏性检测,多重聚合酶链式反应(multiplex polymerase chain reaction,M-PCR)法对其耐甲氧西林基因(mecA)和β-内酰胺类药物耐药基因(blaZ)进行分析,了解Sa耐药性变迁。结果表明:牛乳源Sa菌株对青霉素、氨苄西林耐药率一直居高不下;对阿莫西林/克拉维酸、红霉素、甲氧苄啶/磺胺甲噁唑耐药率有增强趋势;对林可霉素、四环素耐药率呈降低趋势;对环丙沙星耐药率不定;对苯唑西林和头孢噻呋敏感;Sa分离株多重耐药率介于72.1%~100.0%,显示出不尽相同的耐药谱,却呈现出不断增宽的趋势。M-PCR检测显示,2006—2011年分离Sa菌株未从基因水平扩增出mecA基因;不同年度分离株均不同程度携带blaZ基因,不同年度分离株blaZ
+检出率介于49.1%~87.5%。药敏实验结果与相关耐药基因检测结果存在对应关系,部分菌株的耐药性与耐药基因的检出率不一致,推测还存在其他耐药机制。结论:四川地区牛乳源金黄色葡萄球菌耐药性不容乐观。
关键词:生牛乳;金黄色葡萄球菌;耐药性;多重聚合酶链式反应;β-内酰胺类耐药基因
金黄色葡萄球菌(Staphylococcus aureus,Sa)是临床菌株耐药的典范。近年,随着“食品中耐药细菌的危险性”引起重视,人们也开始对食源Sa的耐药性进行研究。β-内酰胺类药物应用广泛,Sa产生由blaZ基因编码的β-内酰胺酶,特别是产生由mecA基因编码的PBP2a对该类药物严重耐药已引起广泛关注。国外多项研究表明具有高传染性的、多重耐药性的Sa在欧盟、土耳其、朝鲜、日本、加拿大和美国的猪肉、方便食品、乳及乳制品等食品中大量存在并流行,且呈现逐步增强的情况
[1-7],在中国,Sa是引起奶牛乳腺炎疾病的重要致病菌之一,该菌在牛乳中广泛存在且对多种药物产生耐药性
[8]。为研究牛乳源Sa耐药性与其相关耐药基因的关系,实时监控Sa耐药性年度变迁规律,本实验通过对2006—2011年四川省部分乳品生产企业生鲜牛乳中的Sa分离株进行耐药性分析及blaZ、mecA耐药基因监测,以期对四川省生鲜牛乳中不同年度金黄色葡萄球菌的耐药性进行监测,为牛乳源Sa耐药性的安全评价提供依据,为我国政府及食品卫生监督机构建立、发展和完善食源性致病菌及食源性疾病的监测、预警系统提供参考。
1 材料与方法
1.1 菌株、培养基及试剂
实验菌株:203 株金黄色葡萄球菌(其中2006年8 株,2007年44 株,2008年17 株,2009年53 株,2010年38 株,2011年43 株),于2006—2011年度自四川省部分牛乳生产企业的生牛乳中分离鉴定,由四川农业大学食品微生物室保存。
标准菌株:金黄色葡萄球菌ATCC 29213,用于药敏实验的质量控制;金黄色葡萄球菌ATCC 33591(nuc
+、mecA
+、blaZ
+),用于多重聚合酶链式反应(multiplex polymerase chain reaction,M-PCR)扩增nuc、mecA、blaZ基因的阳性对照,均为四川农业大学食品微生物实验室保存。
Mueller-Hinton(M-H)肉汤、Mueller-Hinton Agar(M-H琼脂) 杭州微生物试剂有限公司;LB培养基自配。
红四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC) 上海灵锦精细化工有限公司;PCR用溶菌酶、2×Taq PCR MasterMix、DL2000 DNA Marker、GoldView
TMDNA染料 天根生化科技有限公司。
药敏实验用抗生素均为原药粉,购自中国兽医药品监察所,具体信息见表1。
表1 药敏实验用抗生素(组合)
Table1 Individual or combined antibiotics for susceptibility testing
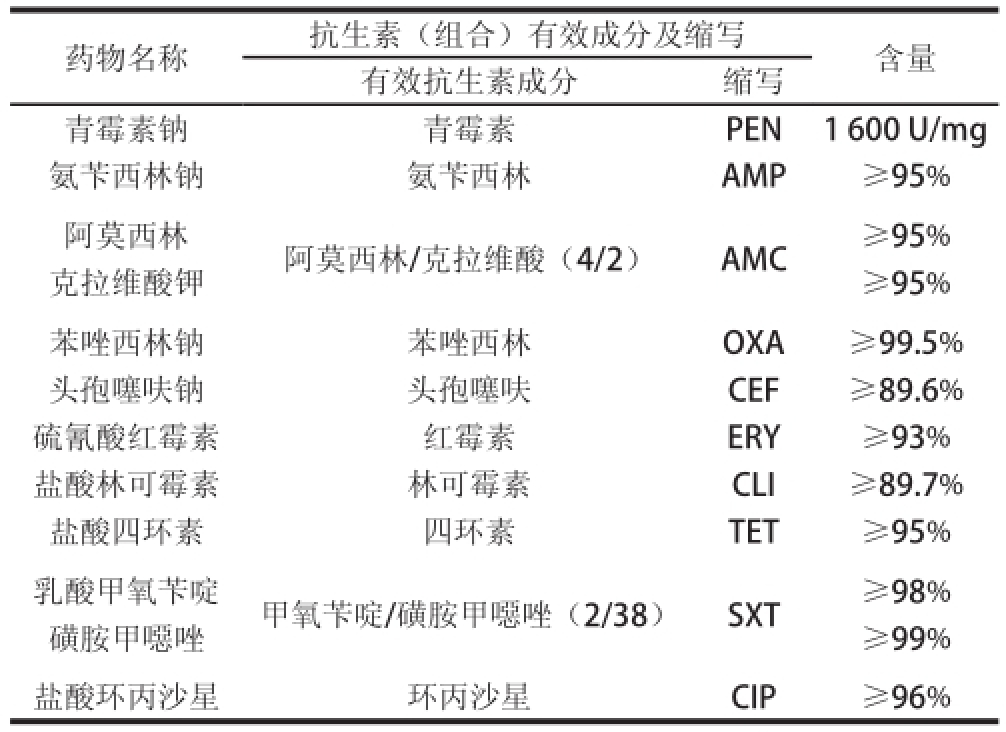
药物名称抗生素(组合)有效成分及缩写含量有效抗生素成分缩写青霉素钠青霉素PEN1 600 U/mg氨苄西林钠氨苄西林AMP≥95%阿莫西林阿莫西林/克拉维酸(4/2)AMC≥95%克拉维酸钾≥95%苯唑西林钠苯唑西林OXA≥99.5%头孢噻呋钠头孢噻呋CEF≥89.6%硫氰酸红霉素红霉素ERY≥93%盐酸林可霉素林可霉素CLI≥89.7%盐酸四环素四环素TET≥95%乳酸甲氧苄啶甲氧苄啶/磺胺甲噁唑(2/38)SXT≥98%磺胺甲噁唑≥99%盐酸环丙沙星环丙沙星CIP≥96%
1.2 方法
1.2.1 药物敏感性测定方法
将保存的Sa菌株划线于M-H平板,37 ℃培养24 h,再传代一次,恢复其活性;按照美国临床实验室标准委员会(CLSI 2010)微量肉汤稀释法对Sa菌株进行10 种抗生素的敏感性测定,以Sa标准菌株ATCC 29213为质控菌株。
当质控菌在CLSI(2010)规定的药敏范围时,参考CLSI(2010)(表2)药敏标准,对受试菌的最小抑菌浓度(minimum inhibitory concentration,MIC)进行判定。将供试菌分为敏感(S)、中介(I)和耐药(R)3 种。
将对3 类或3 类以上抗菌药物同时呈现耐药的供试菌判定为多重耐药菌(multidrug-resistant organism,MDRO),即判定该供试菌具有多重耐药性。
表2 药敏实验用抗生素及耐药判定标准
Table2 Antibiotics and breakpoints of drug-resistance
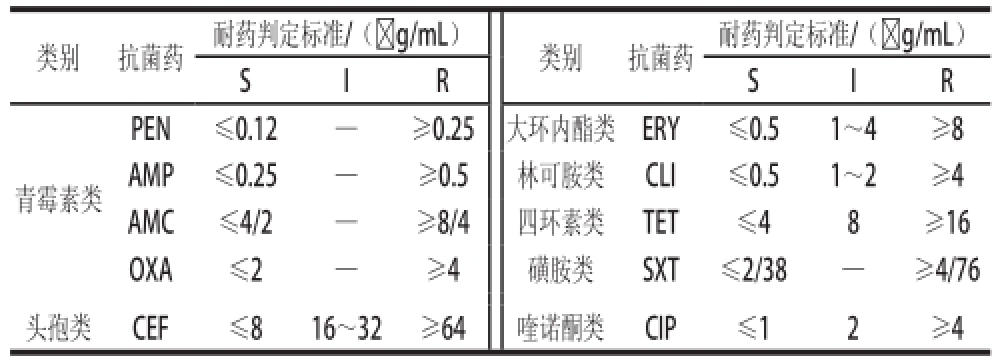
注:S. 敏感;I. 中介耐药;R. 耐药;—. 不存在中介耐药。
类别抗菌药耐药判定标准/(☒g/mL)类别抗菌药耐药判定标准/(☒g/mL)SIRSIR PEN≤0.12—≥0.25大环内酯类ERY≤0.51~4≥8 AMP≤0.25—≥0.5林可胺类CLI≤0.51~2≥4 AMC≤4/2—≥8/4四环素类TET≤48≥16 OXA≤2—≥4磺胺类SXT≤2/38—≥4/76头孢类CEF≤816~32≥64喹诺酮类CIP≤12≥4青霉素类
1.2.2 M-PCR检测nuc、blaZ及mecA基因
根据天根细菌基因组DNA提取试剂盒提取Sa总DNA,制备PCR模板,参考刘书亮等
[9]的方法进行M-PCR检测Sa分离株中的nuc、blaZ及mecA基因,以金黄色葡萄球菌ATCC 33951为阳性对照菌(nuc
+、blaZ
+、mecA
+)。
2 结果与分析
2.1 Sa对10 种常见抗生素的药敏性
采用肉汤微量稀释法对10 种抗生素(组合)药敏实验结果(表3)表明,所有Sa菌株对PEN的耐药率(93.1%)最高,其次AMP(92.1%)、AMC(52.7%)、SXT(48.8%)、TET(42.9%)、CLI(30.0%)、ERY(29.6%)、CIP(1.5%);对CLI、ERY、TET、CIP的中介耐药率分别为18.2%、9.9%、4.4%、3.4%;对OXA和CEF敏感。
表3 不同年度金黄色葡萄球菌的耐药率
Table3 Drug resistant rate ofSSaa from different yearss
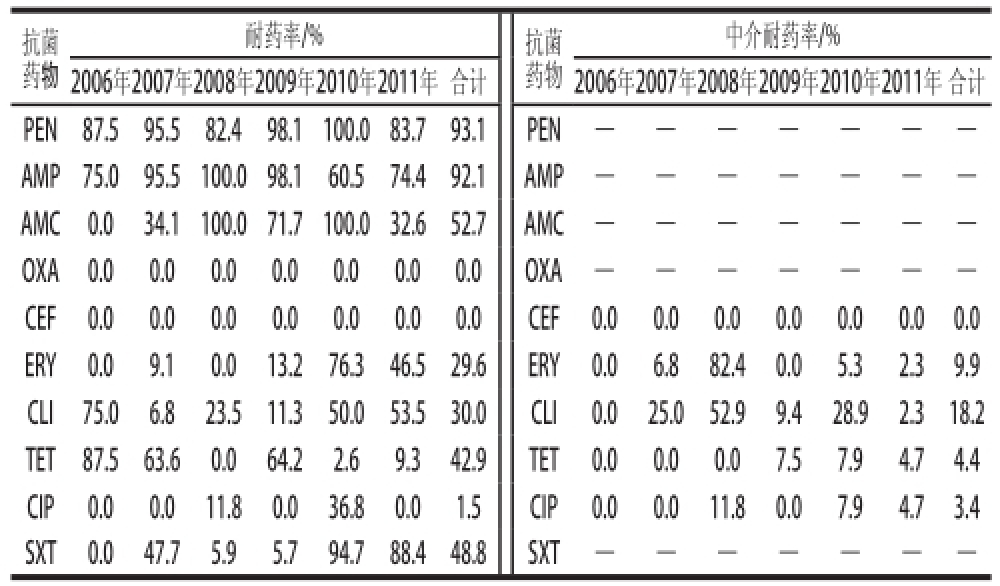
注:-. 未检出。
中介耐药率/% 2006年2007年2008年2009年2010年2011年合计2006年2007年2008年2009年2010年2011年合计PEN87.595.582.498.1100.083.793.1 PEN——AMP75.095.5100.098.160.574.492.1AMP——AMC0.034.1100.071.7100.032.652.7AMC——OXA0.00.00.00.00.00.00.0OXA——CEF0.00.00.00.00.00.00.0CEF0.00.00.00.00.00.00.0 ERY0.09.10.013.276.346.529.6ERY0.06.882.40.05.32.39.9 CLI75.06.823.511.350.053.530.0CLI0.025.052.99.428.92.318.2 TET87.563.60.064.22.69.342.9TET0.00.00.07.57.94.74.4 CIP0.00.011.80.036.80.01.5CIP0.00.011.80.07.94.73.4 SXT0.047.75.95.794.788.448.8SXT——抗菌药物耐药率/%抗菌药物
随着年度变迁,S a对抗生素的耐药性有差异。2006—2011年Sa分离株对PEN、AMP具有很强的耐药性,其耐药率范围分别在82.5%~100%及60.5%~100%;对AMC、ERY、SXT及CIP耐药性明显增强,从敏感逐步变迁到耐药,其耐药率最高分别达100.0%、82.4%、94.7%及36.8%;对CLI、TET的耐药率明显降低,最低耐药率均分别为6.8%和2.6%。不同年度Sa分离株对同一抗生素耐药率有差异,这可能与奶牛养殖过程中抗生素违规使用及使用频率相关。
2.2 Sa的多重耐药性
203 株Sa分离株中仅有2 株对10 种抗生素均敏感,其余菌株至少耐受一种药物。多重(≥3)耐药Sa检出率为83.7%(表4),其中4 重耐药菌株最多,占全部菌株的28.1%,其次为3 重(23.2%)、5 重(18.2%)、6 重(12.3%)、7 重(2.0%)。
本实验中,Sa随着年度变迁,多重耐药性增强。多重耐药Sa在2010年最为严重,分离率达100.0%,其他依次是2009年84.9%、2008年82.4%、2007年81.8%、2006年75.0%、2011年72.1%。不同年度Sa可耐受的抗生素种数不同,最多可耐受7 种抗生素。2006年分离Sa可耐受抗生素是4 重(62.50%)、3 重(12.50%);2007年分离Sa可耐受药物主要为3 重、4 重、5 重,分别占2007年Sa总菌数的36.4%、22.7%、18.2%;2008年分离Sa可耐受抗生素为3 重(52.9%)、4 重(23.5%)、6 重(5.9%);2009年分离Sa以4 重(47.2%)、3 重(22.6%)、5 重(11.3%)耐药菌株居多;2010年分离Sa中发现7 重耐药菌株,6 重(36.8%)、5 重(26.3%)、4 重(18.4%)、3 重(10.5%)、7 重(7.9%)等多重耐药菌株较为常见;与2010年Sa分离株相同,2011年Sa亦有耐受7 重耐药菌株出现(2.3%),以5 重(30.2%)、4 重(14.0%)、6 重(14.0%)、3 重(11.6%)为主要耐药模式。不同年度分离的Sa的多重耐药性变迁分析表明,Sa耐受抗生素种类有增加的趋势。
表4 不同年度金黄色葡萄球菌的多重耐药率
Table4 Percentage of multi-drug resistance strains of SaSa from rom different years ears
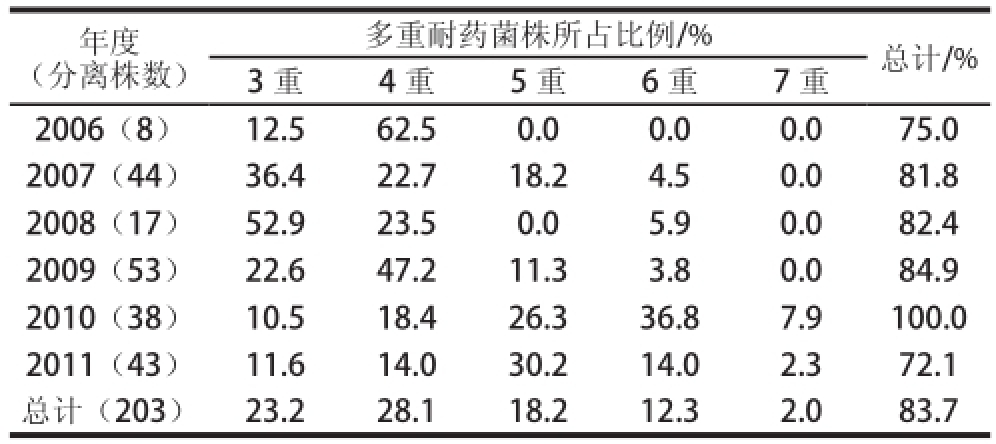
年度(分离株数)多重耐药菌株所占比例/%总计/% 3 重4 重5 重6 重7 重2006(8)12.562.50.00.00.075.0 2007(44)36.422.718.24.50.081.8 2008(17)52.923.50.05.90.082.4 2009(53)22.647.211.33.80.084.9 2010(38)10.518.426.336.87.9100.0 2011(43)11.614.030.214.02.372.1总计(203)23.228.118.212.32.083.7
2.3 不同年度菌株耐药谱的变化规律
由表4可知,203 株Sa对10 种常见抗生素(组合)共产生42 种耐药谱,其中较为优势耐药谱为:PEN-AMPAMC-TET(28/203),PEN-AMC-AMP-ERY-CLI-TET(20/203),PEN-AMC-AMP(17/203),PEN-AMP-TET(15/203),PEN-AMP-ERY-CLI-SXT(14/203),PENAMP(13/203),PEN-AMP-AMC-TET-SXT(11/203)。不同年度菌株耐受抗菌药物有所不同,2006年菌株耐药谱极窄,仅对PEN、AMP、TET、CLI这4 种抗生素耐药(75.0%);2007年以耐PEN、AMP、TET或兼耐SET、AMC、ERY、CLI为主(81.8%),耐药谱增宽;2008年菌株对PEN、AMC、AMP的耐药性已趋于稳定(>82.4%),并兼对CLI、SXT、CIP等药物耐药,耐药谱又增宽,2009年分离株以耐PEN、AMP、AMC、TET或兼耐CLI、SXT、ERY为主(84.9%),2010年分离株对PEN、AMP、AMP、ERY、CLI、SXT的耐药性已趋于稳定,并兼对TET、CIP等药物耐药,耐药谱又增宽,在上述药物的基础上,2011年菌株主要对PEN、AMC、AMP、ERY、SXT、CLI等药物产生抗性,对TET也表现出一定的耐药性,耐药谱较2010年有了明显的增宽。
2.4 M-PCR检测nuc、blaZ及mecA结果
对203 株Sa进行M-PCR检测的结果(图1)显示,98.0%(199/203)的分离株nuc
+,63.1%(128/203)的菌株携带blaZ基因,所有菌株均未检出mecA基因。不同年度分离株均不同程度携带blaZ基因,不同年代分离株blaZ
+检出率依次是:2006年87.5%(7/8)、2007年63.6%(28/44)、2008年58.8%(10/17)、2009年49.1%(26/53)、2010年81.6%(31/38)、2011年60.5%(26/43)。该结果表明,随着年度增加,Sa分离株blaZ基因检出率有先降后升趋势,这可能与不同年度奶牛养殖过程中抗生素使用频率及高耐药水平菌株为抵御相关环境高抗生素水平压力作用在传代过程中有“适者生存”的选择规律相关。

图1 部分SSaa菌株多重PCRR检测结果
Fig.1 Multiplex PCR test results of some Sa strains
基因与表型有一定的对应关系,blaZ编码β-内酰胺酶,导致菌株对β-内酰胺类抗生素(PEN、AMP、AMC)耐药。203 株Sa分离株的β-内酰胺类抗生素敏感性结果与PCR结果进行比较,对一种及以上β-内酰胺类抗生素(PEN、AMP、AMC)耐药、blaZ阳性和对β-内酰胺类抗生素(PEN、AMP、AMC)同时敏感、blaZ阴性的菌株各占65.8%(127/193)和90.0%(9/10),对β-内酰胺类抗生素(PEN、AMP、AMC)敏感性分析结果和blaZ扩增结果同时符合的菌株占67.0%(136/203)。不同年度分离株对β-内酰胺类抗生素(PEN、AMP、AMC)敏感性分析结果和blaZ扩增结果比较详见表5,可以看出2006—2011年表型耐β-内酰胺类抗生素菌株与基因型符合率分别为100.0%、65.1%、58.8%、50.0%、81.6%、69.4%,部分表型耐β-内酰胺类抗生素菌株blaZ检测结果呈阴性。
表5 Sa对β-内酰胺类抗生素敏感性结果与blaZ扩增结果对比分析
Table5 Comparisons between the sensitivity to -lactams and the detection of blaZ gene using PCR
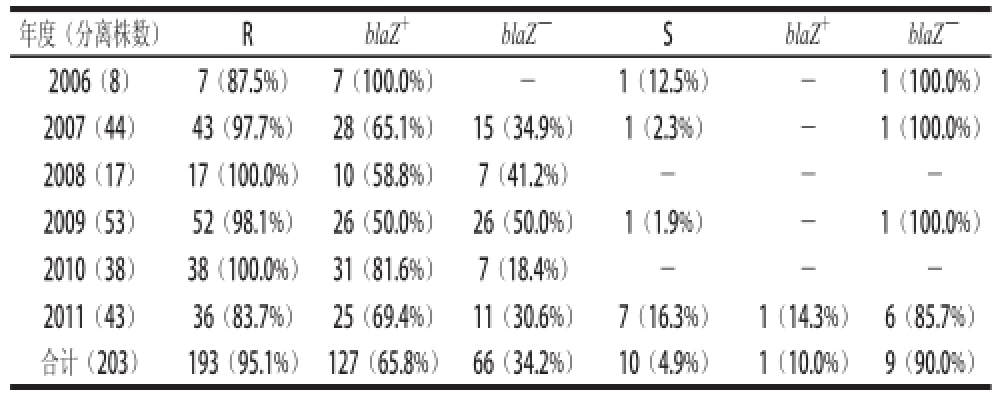
注:-. 未检出;R.对一种及以上β-内酰胺类抗生素(PEN、AMP、AMC)耐药;S. 对3 种β-内酰胺类抗生素(PEN、AMP、AMC)同时敏感;blaZ
+. PCR扩增blaZ基因结果为阳性,blaZ
-. PCR扩增blaZ基因结果为阴性。
年度(分离株数)RblaZ
+blaZ
-SblaZ
+blaZ
-2006(8)7(87.5%)7(100.0%)-1(12.5%)-1(100.0%)2007(44)43(97.7%)28(65.1%)15(34.9%)1(2.3%)-1(100.0%)2008(17)17(100.0%)10(58.8%)7(41.2%)---2009(53)52(98.1%)26(50.0%)26(50.0%)1(1.9%)-1(100.0%)2010(38)38(100.0%)31(81.6%)7(18.4%)---2011(43)36(83.7%)25(69.4%)11(30.6%)7(16.3%)1(14.3%)6(85.7%)合计(203)193(95.1%)127(65.8%)66(34.2%)10(4.9%)1(10.0%)9(90.0%)
3 结论与讨论
药敏实验结果表明,Sa分离株对PEN(93.1%)、AMP(92.1%)、AMC(52.7%)、SXT(48.8%)、TET(42.9%)、CLI(30.0%)、ERY(29.6%)具有较高耐药性,这与蔡雪凤等
[8](PEN 88%、AMP 68%、ERY 56%、TET 38%)、Pereira等
[10](PEN 73%、AMP 70%)、刘冬香等
[11](PEN93.8%、AMP 92.92%、CLI 47.79%、TET 42.48%、ERY 41.59%、SXT 38.05%)、Nemati等
[12](TET 56.8%、PEN 44.4%、ERY 37%)、Pesavento等
[13](AMP 42.86%、TET 19.04%、SXT 4.76%、CLI 21.43%、PEN 16.66%)相关文献对食源性Sa耐药性研究结果基本一致,但耐药率研究结果存在异同,且各文献报道也存在差异
[8,10-13]。这可能与不同国家和地区养殖业中抗生素使用频率相关。研究表明四川地区牛乳源Sa对PEN、AMP、AMC、TET、SXT耐药现象仍较为严重,在年度变迁中,Sa对CLI、TET的耐药性有降低趋势,CIP、CEF仍是治疗奶牛疾病的有效兽药。
细菌多重耐药性的产生是各种抗生素使用的结果,本实验结果显示,四川地区牛乳源Sa多重耐药性严重(83.7%),主要表现对抗生素3~6 重耐药(81.8%)。其中2010年Sa分离株多重耐药最为严重,多重耐药率达100.0%,且检出7 重(7.9%)耐药菌。在6 年时间里,牛乳源Sa分离株耐药率大幅度上升,多重耐药菌株急剧增多,耐药谱也迅速增宽,并对常用抗菌药物广谱耐药。临床上抗生素的广泛使用及不合理使用是细菌耐药性产生的主要原因,如Sa菌株对青霉素类药物、红霉素、磺胺类药物、环丙沙星的耐药性。
PEN、AMP及AMC都是临床常用β-内酰胺类抗生素。Sa菌株通过blaZ基因编码产生β-内酰胺酶继而破坏β-内酰胺环从而对青霉素类耐药及捕获mecA基因并编码与药物亲和力低的青霉素结合蛋白PBP2a,保持细胞壁的合成,使抗生素无法进入细胞内破碎病原菌是Sa菌株对β-内酰胺类抗生素耐药的两种主要机制
[2]。本实验就2006—2011年Sa分离株进行耐甲氧西林的Sa(methicillin-resistant Staphylococcus aureus,MRSA)监测,药敏实验表型检测MRSA与PCR扩增mecA基因从基因水平检测MRSA均阴性,符合率100.0%,表明近年来该地区乳品源Sa中无MRSA存在;相反blaZ
+检出符合率在50.0%~100.0%,表型耐β-内酰胺类药物(PEN、AMP、AMC)菌株与PCR扩增blaZ
+符合率为65.8%(127/193),该结果表明,药敏实验结果与相关耐药基因检测结果存在对应关系,菌株内源blaZ基因编码β-内酰胺酶是本实验Sa分离株对β-内酰胺类药物耐受的主要原因,但部分菌株的耐药性与相关耐药基因的检出率不一致,推测还存在其他耐药机制,具体原因有待进一步研究。
Sa和MRSA进入食物链已是不争的事实
[1,14-18](Lee
[14]研究发现22%的用于食品加工的动物性样品被Sa污染,其中3.6%携带mecA基因;Inge等
[15]研究发现42.2%的猪肉样品和33.3%的牛肉样品中含有Sa,MRSA分离率为2.5%;Lozano等
[16]研究发现1.6%的西班牙动物性食品含MRSA;Pu等
[17]研究发现45.6%的猪肉样品和20%的牛肉样品Sa阳性,检测出6 株MRSA。Bystron等
[18]研究发现从132 株食源Sa中检出8 株(6.1%)苯唑西林耐药菌株,包括2 株来自猪肉的mecA阳性MRSA。Waters等
[1]研究发现77%的火鸡肉、42%的猪肉,41%的鸡肉,37%的牛肉被Sa污染,在牛肉、猪肉及火鸡肉中各检出一株MRSA)。耐药性Sa可能具有更多的致病机会,并有可能引起一定程度的食品安全问题,如社区感染性疾病
[19]、食物中毒事件
[20]。近年MRSA在社区的流行,由Sa引起的中毒和疾病事件不可避免将给临床治疗带来非常棘手的问题。四川地区牛乳源金黄色葡萄球菌耐药性不容乐观。因此,为防止牛乳源Sa尤其MRSA通过食物链进入人体肠道使肠道正常菌群产生耐药性或耐药性增强,威胁人体健康,有必要加强牛乳源Sa尤其是MRSA的耐药性持续监测,了解耐药性的动态变迁,为乳品源Sa耐药性的安全评价提供依据。
参考文献:
[1] WATERS A E, CONTENTE-CUOMO T, BUCHHAGEN J, et al. Multidrug-resistant Staphylococcus aureus in US meat and poultry[J]. Clinical Infectious Diseases, 2011, 52(10): 1227-1230.
[2] MURPHY J T, WALSHE R, DEVOCELLE M, et al. A computational model of antibiotic-resistance mechanisms in methicillin resistant Staphylococcus aureus(MRSA)[J]. Journal of Theretical Biology,2008, 254(2): 284-293.
[3] NORMANNO G, FIRINUB A, VIRGILIO S, et al. Coagulase-positive Staphylococci and Staphylococcus aureus in food products marketed in Italy[J]. International Journal of Food Microbiology, 2005, 98(1): 73-79.
[4] ERTAS N, GONULALAN Z, YILDIRIM Y, et al. Detection of Staphylococcus aureus enterotoxins in sheep cheese and dairy dessertsby multiplex PCR technique[J]. International Journal of Food Microbiology, 2010, 142(1/2): 74-77.
[5] CENCI-GOGA B T, KARAMA M, ROSSITTO P V, et al. Enterotoxin production by Staphylococcus aureus isolated from mastitic cows[J]. Journal of Food Protection, 2003, 66(9): 1693-1696.
[6] CAN H Y, CELIK T H. Detection of enterotoxigenic and antimicrobial resistant Saureus in Turkish cheeses[J]. Food Control, 2012, 24(1/2): 100-103.
[7] RIZEK C F, DROPA M, MAMIZUKA E M, et al. Identification of Staphylococcus aureus carrying the mecA gene in ready-to-eat food products sold in Brazil[J]. Foodborne Pathogens and Disease, 2011,8(4): 561-563.
[8] 蔡雪凤, 曹宝森, 刘艳琴, 等. 50株食源性金黄色葡萄球菌肠毒素特性及耐药分析[J]. 中国卫生检验杂志, 2011, 21(2): 419-421.
[9] 刘书亮, 刘冬香, 贾仁勇, 等. 多重检测食源金黄色葡萄球菌nuc、blaZ和mecA基因方法的建立与应用[J]. 中国人兽共患病学报, 2010,25(5): 475-480.
[10] PEREIRA V, LOPES C, CASTRO A, et al. Characterization for enterotoxin production, virulence factors, and antibiotic susceptibility of Staphylococcus aureus isolates from various foods in portugal[J]. Food Microbiology, 2009, 26(3): 278-282.
[11] 刘冬香, 刘书亮, 张晓利, 等. 四川省动物性食品源金黄色葡萄球菌的耐药性分析[J]. 中国兽医杂志, 2009, 45(5): 6-8.
[12] NEMATI M, HERMANS K, LIPINSKA U, et al. Antimicrobial resistance of old and recent Staphylococcus aureus isolates from poultry: first detection of livestock-associated methicillin-resistant strain ST398[J]. Antimicrobial Agents and Chemotherapy, 2008,52(10): 3817-3819.
[13] PESAVENTO G, DUCCI B, COMODO N, et al. Antimicrobial resistance profile of Staphylococcus aureus isolated from raw meat: a research for methicillin resistant Staphylococcus aureus (MRSA)[J]. Food Control, 2007, 18(3): 196-200.
[14] LEE J H. Methicillin (oxacillin)-resistant Staphylococcus aureus strains isolated from major food animals and their potential transmission to humans[J]. Applied and Environmental Microbiology,2003, 69(11): 6489-6494.
[15] INGE H M, LOO V J, BRAM M W, et al. Methicillin-resistant Staphylococcus aureus in meat products, the Netherlands[J]. Emerging Infectious Diseases, 2007, 13(11): 1753-1755.
[16] LOZANO C, LOPEZ M, GOMEZ-SANZ E, et al. Detection of methicillin-resistant Staphylococcus aureus ST398 in food samples of animal origin[J]. Journal of Antimicrobial Chemotherapy, 2009, 64(6): 1325-1326.
[17] PU S, HAN F, GE B. Isolation and characterization of methicillinresistant Staphylococcus aureus strains from Louisiana retail meats[J]. Applied and Environmental Microbiology, 2009, 75(1): 265-267.
[18] BYSTRON J, PODKOWIK M, KORZEKWA K, et al. Characterization of borderline oxacillin-resistant Staphylococcus aureus isolated from food of animal origin[J]. Journal of Food Protection, 2010, 73(7): 1325-1327.
[19] JONES T F, KELLUM M E, PORRER S S, et al. An outbreak of community-acquired foodborne illness caused by methicillin resistant Staphylococcus aureus[J]. Emerging Infectious Diseases, 2002, 8(1): 82-84.
[20] 李孝权, 李钏华, 邓志爱, 等. 广州地区七年细菌性食物中毒的病原特征研究[J]. 中国卫生检验杂志, 2011, 21(3): 622-624.
Drug Resistance Changes and Analysis of Beta-Lactam Drug Resistance Genes in Staphylococcus aureus from Fresh Milk
FAN Qin
1,2, LIU Shuliang
1,*, WU Congming
3, HAN Xinfeng
1, ZHOU Kang
1, LIU Dongxiang
1, HOU Xiaogang
1
(1. College of Food Science, Sichuan Agricultural University, Ya’an 625014, China;2. Nan Xi Food and Drug Administration, Yibin 644100, China;3. College of Veterinary Medicine, China Agricultural University, Beijing 100194, China)
Abstract:This study aimed to understand the changes in drug resistance of Staphylococcus aureus (Sa). A total of 203 strains of Sa collected during 2006 to 2011 were tested against 10 antibiotics by broth micro-dilution method for determining their antibiotic susceptibility. With multiplex polymerase chain reaction (M-PCR) method, the methicillin-resistant gene(mecA) and beta-lactam drug resistance gene (blaZ) of Sa were analyzed. The results showed that the resistance rates of Sa isolates to penicillin and ampicillin acid were high. An increasing trend was observed for the resistance rates of Sa to amoxicillin/clavulanic, erythromycin, and trimethoprim/sulfamethoxazole. There was an uncertain resistance rate to ciprofloxacin whereas the resistance rates of Sa isolates to clindamycin and tetracycline showed a decreasing trend. All the strains tested were sensitive to both oxacillin and ceftiofur. The multidrug-drug resistant rates of Sa from different years ranged from 72.1% to 100.0%, with different drug-resistant spectra, but at the same time, they presented a continuously widened trend. M-PCR analysis showed that no mecA gene was amplified from Sa strains collected during 2006 to 2011. During different years, more or less isolates carrying the gene blaZ were detected, and the detection rates of blaZ
+from different years ranged from 49.1% to 87.5%. There was a certain relationship between the susceptibility test results and the related drug resistance gene detection results. The detection rates of some drug-resistant strains were inconsistent with their resistance genes suggesting that there are other resistance mechanisms for Sa. The drug resistance of Sa from fresh milk in Sichuan was not optimistic.
Key words:fresh milk; Staphylococcus aureus; drug resistance; multiplex polymerase chain reaction (M-PCR); β-lactam drug resistance genes
中图分类号:R155.31
文献标志码:A
文章编号:1002-6630(2015)03-0147-05
doi:10.7506/spkx1002-6630-201503028
收稿日期:2014-02-27
基金项目:公益性行业(农业)科研专项(200903055)
作者简介:凡琴(1986—),女,硕士研究生,研究方向为食品微生物与发酵工程。E-mail:shellamimosa@126.com
*通信作者:刘书亮(1968—),男,教授,博士,研究方向为食品微生物与发酵工程。E-mail:lsliang999@163.com






