
图1 蕹菜POD的DEAE-Sepharose层析图
Fig.1 DEAE-Sepharose chromatography of POD from Ipomoea aquatica Forsk.
王红扬,王 洁,李 星,唐云明*
(西南大学生命科学学院,重庆市甘薯工程研究中心,三峡库区生态环境教育部重点实验室,重庆 400715)
摘 要:新鲜蕹菜经硫酸铵分级沉淀、DEAE-Sepharose离子交换层析和Superdex-200凝胶过滤层析后获得电泳纯的过氧化物酶(peroxidase,POD),该酶的比活力、回收率、纯化倍数和产率分别为35 972.96 U/mg、12.21%、168.48和211.07 U/g。该酶的亚基分子质量为42.7 kD,最适温度为40 ℃,最适pH值为 6,并且在20~50 ℃及pH 5~8的范围内具有良好的稳定性。以不同浓度的H 2O 2为底物,测得该酶的K m值为18.32 mmol/L。NaCl、尿素(Urea)、Zn 2+、Mg 2+对该酶都具有较强的激活作用,十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、硫氰化钾(potassium thiocyanate,KSCN)、抗坏血酸(ascorbic acid,AsA)、Ba 2+、Mn 2+、Fe 2+、甲醇、乙醇、正丁醇和异丙醇对蕹菜POD活力均有抑制作用,其中抗坏血酸对POD有极强的抑制作用,当浓度为0.01 mol/L时,酶活力接近于0。
关键词:蕹菜;过氧化物酶;分离纯化;酶活力
过氧化物酶(peroxidase,POD)是一类在生物体内普遍存在的、由单一肽链和铁卟啉组成的血红蛋白类氧化酶,它催化由H 2O 2参与的氧化反应,例如参与胺类和酚类化合物的氧化反应。POD在生物体内发挥多种重要功能,例如参与分解吲哚乙酸 [1]、合成木质素 [2]和植物体内防御反应 [3]。当今,该酶不仅被广泛用于免疫印迹 [4]、酶联反应 [5]和电镜技术 [6]等生物学研究,而且在污水处理 [7]、生物传感器 [8]等领域发挥重要作用。
目前,该酶商品化生产的主要原料是辣根,但是辣根生长条件严格,我国种植量少,主要靠进口,因此价格昂贵。目前虽然已有从韭菜 [9]、枇杷 [10]、莲藕 [11]、甘薯叶 [12]、荔枝果皮 [13]、苦瓜 [14]等植物中分离纯化该酶的相关报道,但是从廉价来源的植物中筛选出富含POD的样品,并希望在大规模工业生产中提高产量、降低成本的研究迄今鲜有报道。蕹菜,又称空心菜(Ipomoea aquatica Forsk.),不但在我国华南、华中、华东和西南各地普遍栽种,而且相对于其他植物,例如韭菜、芒果、洋葱、苦瓜等,可持续收割、价格低廉、亩产高达5 000 kg,是生产廉价POD的理想材料。因此,本实验以蕹菜为材料对POD进行分离纯化并且对其部分性质进行研究,为POD的生产提供新的原料和方法,同时为其应用于食品工业、环境保护及生物医学领域提供参考。
1.1 材料与试剂
新鲜蕹菜购于重庆市北碚区文星湾永辉超市。
DEAE-Sepharose、Superdex-200、分子排阻层析标准样品、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDSPAGE)蛋白标准品 美国GE公司;Tris 香港Farco公司;丙烯酰胺、甲叉双丙烯酰胺 美国Fluka公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AKTA prime plus蛋白质纯化系统 美国GE公司;冷冻干燥仪 德国Uni Equip公司;Milli-Q plus超纯水仪美国Millipore公司;垂直板电泳槽和电泳仪 美国Bio-Rad公司;UV-2550型分光光度计 日本岛津公司;GL-21M高速冷冻离心机 湖南湘仪公司;精密电子天平、SevenEasy精密pH计 瑞士Mettler-Toledo公司。
1.3 方法
1.3.1 粗酶液的提取
取新鲜蕹菜,洗净晾干后称质量,按照1:3(m/V)的比例加入预冷的0.05 mol/L pH 7.5的磷酸盐缓冲液,匀浆后于4 ℃静置抽提3 h。4 ℃、10 000 r/min离心两次,每次30 min,收集上清液,得到粗酶液。
1.3.2 硫酸铵分级沉淀
在搅拌的同时向粗酶液中缓慢加入研磨后的干燥硫酸铵到20%饱和度,4 ℃条件下盐析2 h,12 000 r/min离心30 min收集上清液;再向所得上清液缓慢加入硫酸铵至60%饱和度,4 ℃条件下盐析2 h,12 000 r/min离心30 min后向沉淀中加入提取缓冲液使沉淀充分溶解;4 ℃透析除盐过夜,即可得到初步纯化的POD酶液。
1.3.3 DEAE-Sepharose层析
经0.05 mol/L磷酸盐缓冲液平衡柱子后,取10 mL粗酶液上柱,用0~1 mol/L NaCl(pH7.5的磷酸盐缓冲液配制)进行线性梯度洗脱,流速设定为0.5 mL/min,每管收集4 mL;测定各管蛋白质含量及其酶活性,收集活性相对较高的酶液,经透析脱盐后,冷冻干燥保存。
1.3.4 Superdex-200层析
1.3.3 节所得的冻干酶用提取缓冲液溶解,取5 mL上样于Superdex-200层析柱,用提取缓冲液洗脱,流速为0.5 mL/min,每管收集4 mL,测定各管蛋白质含量及其酶活性,收集活性相对较高的酶液,透析脱盐后,冷冻干燥后于-20 ℃条件下保存。
1.3.5 POD活力的测定
参考Chen等 [15]的方法。反应体系为3 mL,包括2.775 mL 50 mmol/L磷酸盐缓冲液(pH 7.0)、0.1 mL 1% H 2O 2、0.1 mL 4%愈创木酚和0.025 mL酶液。操作过程如下:在加入底物和缓冲液后,再加入0.025 mL酶液并混匀,在25 ℃条件下记录2 min内每分钟光密度(OD 470 nm)值的变化值。以测定条件下每分钟光密度值变化0.01所需要的酶量为一个酶活力单位(U)。
1.3.6 蕹菜POD纯度鉴定与分子质量测定 [16]207-223
采用SDS-PAGE进行纯度鉴定,其中分离胶为12%,浓缩胶为5%,加样量为20 μL。经SDS-PAGE和凝胶过滤层析分别测定该酶亚基分子质量与全分子质量。
1.3.7 蛋白质浓度的测定
分别用紫外分光光度法与Bradford法 [16]171-176测定。
1.3.8 蕹菜POD性质的研究
1.3.8.1 最适温度和热稳定性的测定
分别在不同温度(20~80 ℃,相差5 ℃)下测定酶活力,确定最适温度,在此条件下酶活力为100%;将酶液放置于不同温度(20~70 ℃,相差10 ℃)下保存,每隔1 h测定相对酶活力(以25 ℃条件下的酶活力为100%)。
1.3.8.2 最适pH值和pH值稳定性的测定
在pH 3~8条件下测定酶的活力,以确定最适pH值(酶活力为100%);将酶液放置于pH 3~8条件下保存,每隔1 h测定酶活力(以pH 7.0时测得的酶活力作为100%)。
1.3.8.3 米氏常数(K m)的测定
以不同浓度的H 2O 2(10~50 mmol/L)为底物,在酶活力测定条件下(25 ℃、pH 7.0),测得蕹菜POD的酶活力。采用双倒数作图(Lineweaver-Burk)法 [17]233-234求得该酶的K m值。
1.3.8.4 有机溶剂对POD活性的影响
分别将甲醇、乙醇、正丁醇、异丙醇4 种有机溶剂与缓冲液混合,混合后体积分数分别为10%、20%、30%、40%、50%、60%,之后再与酶液混合,25 ℃条件下作用30 min,加入底物后,测定酶活力(以不加有机溶剂的酶活力为100%)。
1.3.8.5 部分化合物对POD活性的影响
分用将NaCl、抗坏血酸(ascorbic acid,AsA)、SDS、硫氰化钾(potassium thiocyanate,KSCN)、尿素(Urea)5 种化合物配制成100 mmol/L母液,再按相应比例分别与缓冲液及酶液混合(终浓度分别达到为10、20、30、40、50 mmol/L),置于25 ℃条件下作用30 min,之后再加底物测定POD活力(以不加化合物时的酶活力为100%)。
1.3.8.6 部分金属离子对POD活性的影响
在酶活力测定体系中加入一定的0.1 mol/L金属离子,得到不同终浓度的金属离子(0.01~0.05 mol/L)体系,随后加入0.025 mL酶液,置于25 ℃条件下作用30 min,加入底物,测定酶活力(以不加金属离子的酶活力为100%)。
2.1 蕹菜POD的分离纯化结果

图1 蕹菜POD的DEAE-Sepharose层析图
Fig.1 DEAE-Sepharose chromatography of POD from Ipomoea aquatica Forsk.

图2 蕹菜POD的Superdex-200层析图
Fig.2 Superdex-200 chromatography of POD from Ipomoea aquatica Forsk.
表1 蕹菜POD的分离纯化效果
Table1 Isolation and purification of POD from Ipomoea aquatica Forsk.

纯化步骤总蛋白含量/mg总活力/U比活力/(U/mg)回收率/%纯化倍数粗酶液4 040.56862 700.00213.51100.001.00硫酸铵分级沉淀1 128.23558 857.00495.2564.782.32 DEAE-Sepharose30.37237 760.127 828.0927.5636.66 Superdex-2002.93105 335.6735 972.9612.21168.48
蕹菜POD粗酶液经DEAE-Sepharose层析后,结果如图1所示,蛋白质含量最高的是第11管,而酶活力最高的是第18管,通过该步骤有效地去除了杂蛋白,纯化了目的蛋白。经DEAE-Sepharose层析所得样品通过Superdex-200分子排阻层析,结果如图2所示,蛋白质含量较高的是第22和第47管,而酶活力最高的是第34管,目的蛋白与杂蛋白得到有效分离。经SDS-PAGE为单一条带(图3),说明该酶达到了电泳纯。该酶的分离纯化结果见表1,蕹菜POD的纯化倍数为168.48,回收率为12.21%,比活力为35 972.96 U/mg,产率为211.07 U/g。
2.2 蕹菜POD分子质量测定结果
SDS-PAGE测得该酶的亚基分子质量为42.7 kD(图3),经Superdex-200凝胶过滤层析测得该酶的全分子质量约为43 kD,由此可以判定蕹菜POD由单一亚基构成。

图3 蕹菜POD的SDS-PAGGEE图
Fig.3 SDS-PAGE of purified POD from Ipomoea aquatica Forsk.
2.3 蕹菜POD的理化性质
2.3.1 最适温度和热稳定性
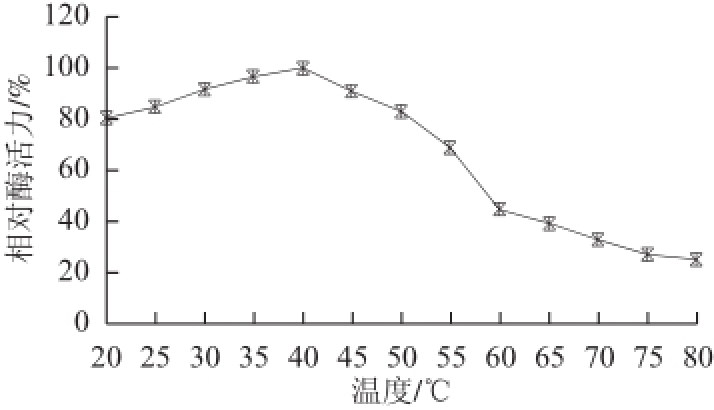
图4 温度对蕹菜POD活力的影响
Fig.4 Effect of temperature on the activity of POD from Ipomoea aquatica Forsk.

图5 蕹菜POD的热稳定性
Fig.5 Effect of temperature on the stability of POD from Ipomoea aquatica Forsk.
由图4可知,蕹菜POD的最适反应温度为40 ℃。由图5可知,蕹菜POD在20~50 ℃之间具有很好的热稳定性,其中在50 ℃条件下保温5 h后相对酶活力仍可达到82%;但是在温度高于60 ℃后,热稳定性迅速降低,相对酶活力丧失高达60%以上,之后维持在低酶活性状态。
2.3.2 最适pH值和pH值稳定性
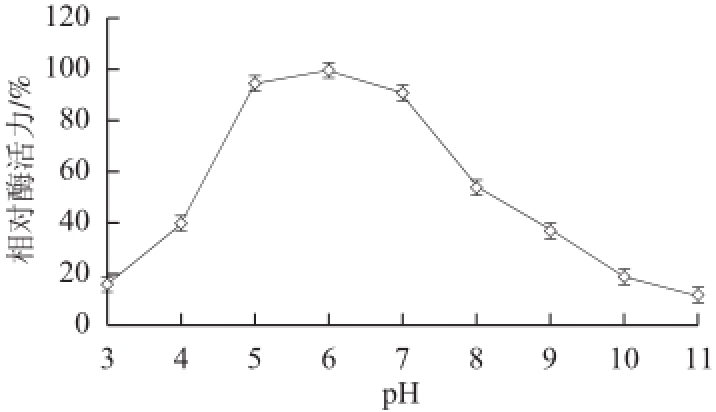
图6 pH值对蕹菜POD活力的影响
Fig. 6 Effect of pH on the activity of POD from Ipomoea aquatica Forsk.
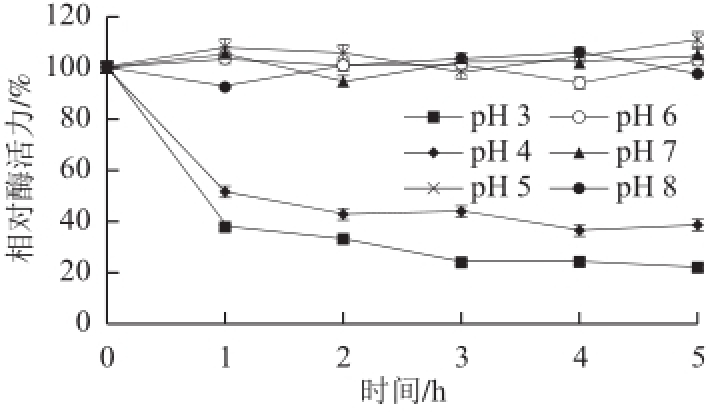
图7 蕹菜POD的pH值稳定性
Fig.7 pH Stability of POD from Ipomoea aquatica Forsk.
实验结果表明,蕹菜POD的最适pH值为6(图6),在pH 5~7范围内均能保持90%以上活性;蕹菜POD在pH 5~8范围内稳定性良好,保持5 h后相对酶活力还接近90%。但是,当pH值低于4以后,保持1 h,相对酶活力即降低至50%以下,并且随着时间延长,酶活力持续缓慢降低(图7)。
2.3.3 蕹菜POD米氏常数(K m)的测定结果
在POD活性测定系统中,用蕹菜POD催化不同浓度(0.02~0.1 mol/L)的过氧化氢与愈创木酚的反应,测定蕹菜POD活力。以双倒数作图法求得蕹菜POD的K m值为18.32 mmol/L(图8),其中v表示酶促反应速率。
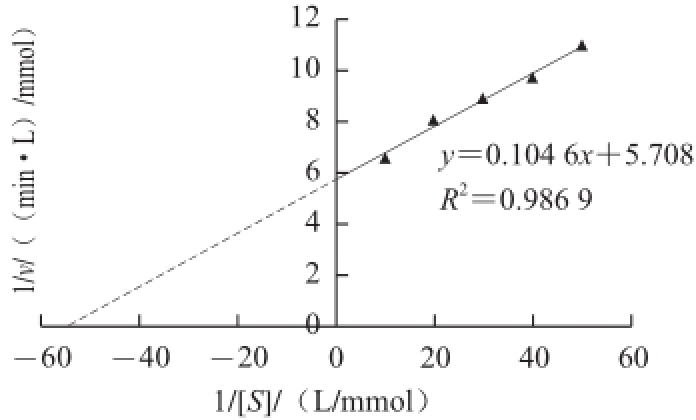
图8 双倒数法测定蕹菜POD的米氏常数
Fig.8 Determination of K
mof POD from Ipomoea aquatica Forsk. by Lineweaver-Burk plot
2.3.4 有机溶剂对蕹菜POD活性的影响
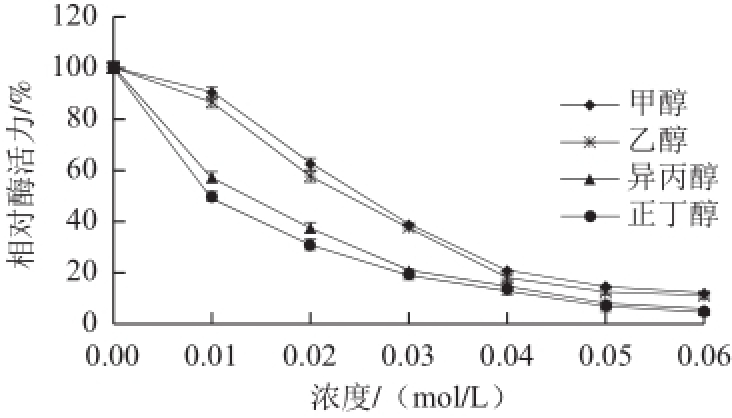
图9 甲醇、乙醇、正丁醇、异丙醇对蕹菜POD活力的影响
Fig.9 Effects of methanol, ethanol, isopropyl alcohol and n-butyl alcohol on the activity of POD from Ipomoea aquatica Forsk.
由图9可知,甲醇、乙醇、正丁醇和异丙醇这4种有机溶剂对蕹菜POD活力均有抑制作用,并且随着有机溶剂浓度的增大,抑制作用不断增强。其中正丁醇和异丙醇抑制作用较为显著,乙醇和甲醇抑制作用相对较弱。
2.3.5 不同化合物对蕹菜POD活性的影响
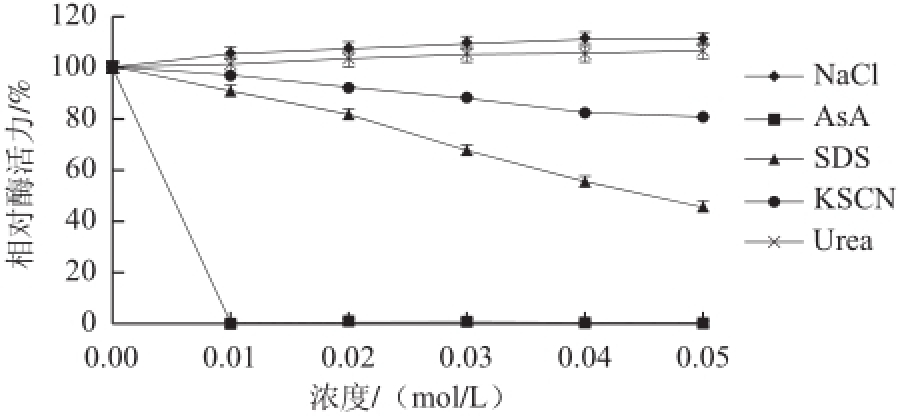
图10 不同化合物对蕹菜POD活力的影响
Fig.10 Effects of various compounds on the activity of POD from Ipomoea aquatica Forsk.
由图10可知,NaCl、Urea对POD有非常轻微的激活作用,最大激活相对酶活力到106%;SDS、KSCN对POD均有较强的抑制作用,其中当SDS浓度为0.05 mol/L时,相对酶活力不到46%;AsA对POD则有极强的抑制作用,其中当浓度仅为0.01 mol/L时,酶活力就被完全抑制。
2.3.6 不同金属离子对蕹菜POD活性的影响
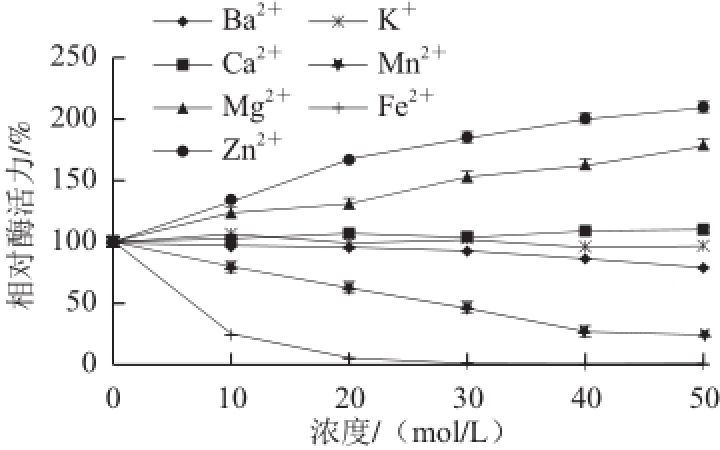
图11 不同金属离子对蕹菜POD活力的影响
Fig.11 Effects of metal ions on the activity of POD from Ipomoea aquatica Forsk.
由图11可知,Zn 2+、Mg 2+对蕹菜叶POD明显的激活作用,并且随着浓度的增加,激活作用明显增强,其中Zn 2+最大可以使其达到初始酶活力的211%;Ba 2+对蕹菜POD有轻微的抑制作用;Mn 2+、Fe 2+对蕹菜POD则具有明显的抑制作用,尤为明显的是Fe 2+在0.01 mol/L时,相对酶活力只剩下23%,0.02 mol/L时POD几乎完全抑制;K +、Ca 2+对蕹菜POD作用不明显。
与从其他植物中分离纯化的POD相比较,本实验研究的蕹菜POD具有以下特点:首先,在我国华南、华中、华东和西南各地普遍栽种,分布范围广分布范围广、产量高,能能为大规模工业化生产提供充足原料;其次,材料酶含量高,分离纯化步骤简单,比活力、纯化倍数和单位产量均相对较高,分别达到35 972.96 U/mg、168.48和211.07 U/g。
蕹菜POD最适温度为40℃,与女贞果实 [18]、莲藕 [11]、荔枝果皮 [13]的POD最适温度接近,低于甘薯叶POD的60 ℃ [12]和棕榈叶的55 ℃ [19]。在20~40 ℃均有很高的稳定性,但是当温度过高时,活性中心遭到破坏,从而酶与底物结合效率下降,酶活性降低。该酶的最适pH值为6,与辣根 [20]相同,在pH 5~8范围内稳定性较好,保温5 h其相对酶活力均保持在90%以上,耐受范围广泛,在低pH值条件下,POD失去活性中心必需的亚铁原卟啉,从而活性降低。大多数植物的过氧化物酶分子质量在30~70 kD范围内,该酶的亚基分子质量为42.7 kD,与莲藕的41.5 kD [11]、红薯的42 kD [21]、苦瓜的43 kD [22]来源的POD相近,低于木瓜的69.4 kD [23],高于枇杷果肉的22.6 kD [10],具有一定的物种差异性。同时采用愈创木酚为底物,该酶的K m值为18.32 mmol/L,低于豆壳的0.41 mmol/L [24]、红甜菜的98.61 mmol/L [25]和甘薯叶的291 mmol/L [12],具有较高的底物亲和力。
常见的有机溶剂、化合物、金属离子对POD的活性均有不同程度的影响,这是POD的结构特点决定的。Halpin等 [26]研究表明,铁离子是POD活性中心的必需成分,即POD是由单一肽链与卟啉构成的血红素蛋白,脱辅基蛋白分子必须与血红素结合才能构成全酶。甲醇、乙醇、异丙醇和正丁醇对该酶均有抑制作用,主要是由于随着有机溶剂浓度的不断增加,破坏了由氢键、疏水键和范德华力构成的极性水化层,POD空间结构发生改变,从而使酶活性降低。KSCN、SDS、AsA对该酶都有显著的抑制作用,SDS作为一种常见变性剂,能够破坏蛋白酶分子中的氢键和疏水作用,使分子去折叠,破坏空间构象,从而导致酶活力下降 [17]378-380。而KSCN和AsA均能破坏血红素亚基,从而使该酶失活 [27]。金属离子对蕹菜POD活性的影响差异较大,其中Zn 2+、Mg 2+对蕹菜POD有明显的激活作用,并且随着浓度的增加,激活作用明显增强;Mn 2+、Fe 2+对蕹菜POD则具有明显的抑制作用,尤为明显的是Fe 2+在0.01 mol/L时,相对酶活力只剩下23%,而当Fe 2+浓度达到0.02 mol/L时几乎完全抑制;K +、Ca 2+对蕹菜POD作用不明显。
参考文献:
[1] ZHENG X, van HUYSTEE R B. Oxidation of tyrosine by peroxidase isozymes derived from peanut suspension culture medium and by isolated cell walls[J]. Plant Cell, Tissue and Organ Culture, 1991,25(1): 35-44.
[2] CHRISTENSEN J H, BAUW G, WELINDER K G, et al. Purification and characterization of peroxidases correlated with lignification in poplar xylem[J]. Plant Physiology, 1998, 118(1): 125-135.
[3] PASSARDI F, PENEL C, DUNAND C. Performing the paradoxical: how plant peroxidases modify the cell wall[J]. Trends in Plant Science,2004, 9(11): 534-540.
[4] 丁薪源, 建康. 果蔬过氧化物酶酶学特性研究进展[J]. 食品科技,2012, 37(10): 62-66.
[5] 李宗妍, 曹立民, 林洪, 等. 水产品中恩诺沙星残留的一步法酶联免疫检测研究[J]. 食品科学, 2009, 30(10): 231-235.
[6] 钟薇, 秦培勇, 刘长霞, 等. 辣根过氧化物酶修饰电极的电化学研究[J].北京化工大学学报: 自然科学版, 2009, 36(2): 18-22.
[7] la ROTTA C E, BON E P. 4-Chlorophenol degradation by chloroperoxidase from Caldariomyces fumago: formation of insoluble products[J]. Applied Biochemistry and Biotechnology, 2002, 98(3): 191-204.
[8] 冯东, 李雪梅, 王丙莲, 等. 用辣根过氧化物酶生物传感器测定啤酒中的过氧化氢[J]. 酿酒科技, 2011(12): 37-39.
[9] 敬海明, 邓玉, 成丽丽, 等. 韭菜过氧化物酶的分离纯化及性质[J].食品科学, 2012, 33(15): 226-230.
[10] 林建城, 吴智雄, 彭在勤. 枇杷果肉过氧化物酶的分离纯化及其性质研究[J]. 四川农业大学学报, 2007, 25(4): 419-424.
[11] 阙瑞琦, 张丽丽, 郭小路, 等. 莲藕过氧化物酶的分离纯化及性质研究[J]. 西南大学学报: 自然科学版, 2007, 29(12): 63-67.
[12] 付伟丽, 唐靓婷, 王松, 等. 甘薯叶过氧化物酶的分离纯化及其部分性质研究[J]. 食品科学, 2010, 31(7): 223-227.
[13] 庞学群, 段学武, 张昭其, 等. 荔枝果皮过氧化物酶的纯化及部分酶学性质的研究[J]. 热带亚热带植物学报, 2004, 12(5): 449-454.
[14] 刘金磊, 苏涛, 李典鹏, 等. 苦瓜过氧化物酶的提取分离及性质测定[J].广西科学, 2007, 14(4): 407-410.
[15] CHEN Y Z, WANG Y R. A study on peroxidase in litchi pericarp[J]. Acta Botanica Austro Sinica, 1989(5): 47-52.
[16] 李建武, 余瑞元. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994: 171-176; 207-223.
[17] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社,2002: 233-234; 378-380.
[18] 王瑧, 廖祥儒, 张建国, 等. 女贞果实过氧化物酶的纯化及热稳定性研究[J]. 河北农业大学学报, 2007, 30(5): 23-27.
[19] ABURRAHMAN M A, MOHAMMAD A I. Purification and characterization of membrane-bound peroxidase from date palm leaves(Phoenix dactylifera L.)[J]. Saudi Journal of Biological Sciences,2011, 18(3): 293-298.
[20] MOHAMED S A, ABULNAJA K O, ADS A S, et al. Characterisation of an anionic peroxidase from horseradish cv. Balady[J]. Food Chemistry, 2011, 128(3): 725-730.
[21] ANNETTE R, MICHAEL A, GERDEMANN C, et al. Purification,cloning and characterization of a novel peroxidase isozyme from sweet potatoes (Ipomoea batatas)[J]. Biochimica et Biophysica Acta, 2007,1774(11): 1422-1430.
[22] FATIMA A, HUSAIN Q. A role of glycosyl moieties in the stabilization of bitter gourd (Momordica charantia) peroxidase[J]. International Journal of Biological Macromolecules, 2007, 41(1): 56-63.
[23] CHEN Lichun, CHUNG Yunchin, CHANG Chentien. Characterisation of an acidic peroxidase from papaya (Carica papaya L. cv Tainung No. 2) latex and its application in the determination of micromolar hydrogen peroxide in milk[J]. Food Chemistry, 2012, 35(4): 2529-2535.
[24] 赵杨. 豆壳过氧化物酶的分离纯化、酶学性质及固定化研究[D]. 长春: 长春工业大学, 2011.
[25] RUDRAPPA T, LAKSHMANAN V, KAUNAIN R, et al. Purification and characterization of an intracellular peroxidase from genetically transformed roots of red beet (Beta vulgaris L.)[J]. Food Chemistry,2007, 105(3): 1312-1320.
[26] HALPIN B, PRESSEY R, JEN J, et al. Purification and characterization of peroxidase isoenzymes from green peas (Pisum sativum)[J]. Journal of Food Science, 1989, 54(3): 644-649.
[27] POPP J L, KALYANARAMAN B, KIRK T K. Lignin peroxidase oxidation of Mn 2+in the presence of veratryl alcohol, malonic or oxalic acid, and oxygen[J]. Biochemistry, 1990, 29(46): 10475-10480.
Isolation, Purification and Characterization of Peroxidase from Ipomoea aquatica Forsk.
WANG Hongyang, WANG Jie, LI Xing, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing Sweet-potato Engineering Research Center, School of Life Science, Southwest University, Chongqing 400715, China)
Abstract:Electrophoresis-purity peroxidase (POD) was extracted and purified from Ipomoea aquatica Forsk. through ammonium sulfate precipitation, DEAE-Sepharose and Superdex-200 chromatography. The specific activity of the purified peroxidase was 35 972.96 U/mg and the yield was 211.07 U/g with a recovery rate of 12.21% and a purification fold of 168.48. Its molecular mass was around 42.7 kD as determined by sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE). Besides, the POD with the optimal temperature and pH of 40 ℃ and 6, respectively, was relatively stable in the temperature range of 20-50 ℃ and pH range of 5-8. This enzyme showed a K mvalue of 18.32 mmol/L towards the substrate hydrogen peroxide. In addition, the POD was found to be activated by NaCl, urea, Zn 2+and Mg 2+but inhibited by SDS, KSCN, ascorbic acid (AsA), Ba 2+, Mn 2+, Fe 2+, methanol, ethanol, n-butyl alcohol and isopropanol, and completely inactivated by 0.01 mmol/L AsA.
Key words:Ipomoea aquatica Forsk.; peroxidase; isolation and purification; enzyme activity
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2015)03-0166-05
doi:10.7506/spkx1002-6630-201503032
收稿日期:2014-03-02
基金项目:重庆市科委重点攻关项目(CSTC2011AB1027)
作者简介:王红扬(1987—),男,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:wanghongyang123@hotmail.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn