
郭 苗,杨小兰*
(山西大学生命科学学院,山西 太原 030006)
摘 要:啤酒酿造废酒花(超临界CO 2萃余物)中富含多酚,评价从废酒花中分离的多酚提取物(hop polyphenol extract,HPE,纯度为88.7%)对高脂血症小鼠的降脂抗氧化作用,并与同剂量的茶多酚降脂抗氧化效果进行比较。用HPE以200~800 mg/(kg·d)的剂量持续灌胃高脂小鼠5 周,高脂血症小鼠血清和肝脏中的总胆固醇和甘油三酯以及血清中的低密度脂蛋白胆固醇水平和动脉粥样硬化指数显著下降,血清中高密度脂蛋白水平显著升高。另外,小鼠血液、肝脏中的脂质过氧化产物丙二醛含量显著减少,过氧化氢酶活力显著提高,红细胞和肝脏中的超氧化物歧化酶活力、全血和肝脏中谷胱甘肽过氧化物酶活力均显著提高。研究结果表明,HPE对高脂血症小鼠具有显著的降脂和抗氧化作用。
关键词:酒花多酚;高脂血症;脂质过氧化;小鼠
啤酒花(Humulus lupulus L.)属于桑科葎草属多年生草本植物,简称酒花 [1]。它是一种应用历史悠久的药食同源植物,能治疗肺结核、麻风病、镇静和失眠等症 [2],还可用于啤酒酿造,能给啤酒提供独特的苦味、香气和抑菌力。目前,采用超临界CO 2萃取酒花酿造有效成分制成酒花浸膏用于啤酒生产的方法已被广泛应用。但是酒花中含有4%~14%的多酚 [3],由于其极性原因不能被超临界CO 2萃取出来,而残留在萃余物(废酒花)中 [4],王旭苹 [5]和杨小兰 [6]等研究了从废酒花中提取多酚和黄酮的方法。
有研究表明酒花多酚与绿茶多酚一样是很有前途的功能性成分,酒花多酚具有抗氧化 [7-8]、抗病毒、抗菌 [9-10]和抗炎 [11-12]作用。酒花多酚对变形链球菌引起的龋齿的抑制作用优于同浓度的茶多酚 [13]。脂代谢紊乱引起的高脂血症是导致心血管病蔓延和恶化的最重要的风险因素之一 [14]。流行病学资料表明,在中国成年人血脂异常症的患病率为18.6%,也就是说,血脂异常患者的数目已达1亿6千万 [15],还有报道称全世界每年大约有1 200万人死于心血管病和脑中风。因此,采用各种方法对高脂血症进行早期预防和控制非常重要。由于降脂药物的成本昂贵,且有潜在的副作用,因而现在越来越多的人寻找天然资源来降低脂质水平。以植物为基础的饮食疗法,因为一般很少或无副作用 [16]而被公认为在治疗应用方面具有潜力。大量研究表明,植物中的多酚、类黄酮等天然抗氧化物质可降低患高脂血症的风险 [17-20]。酒花多酚对高脂血症动物体内脂质代谢的影响作用还未见报道,本研究评价从废酒花中分离的多酚提取物(hop polyphenol extract,HPE,纯度为88.7%)对高脂血症小鼠的降脂抗氧化作用,并与同剂量的茶多酚降脂抗氧化效果进行比较,以期为酒花多酚在保健食品和药品行业中的开发利用提供科学依据。
1.1 动物、材料与试剂
清洁级昆明雄性小鼠72 只,体质量(20±2)g,由山西医科大学实验动物中心提供。
酒花多酚提取物(HPE,多酚纯度88.7%),本实验室制备,参照杨小兰等 [6]的方法。
茶多酚提取物(tea polyphenol extract,TPE,多酚纯度为90%) 江西绿康天然产物有限公司;胆固醇(纯度≥90%,饲料级)、胆酸钠(纯度≥90%,饲料级)安徽天启化工科技有限公司;甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒 中生北控生物科技股份有限公司;丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、蛋白质试剂盒(考马斯亮蓝法) 南京建成生物工程研究所;猪油 市售;其他试剂均为分析纯。
1.2 仪器与设备
MR23低温冷冻离心机 美国Thermo公司;Spectra Max M5酶标仪 美国Molecular Devices公司;AnkeTGL-16G台式离心机 上海安亭科学仪器厂;25 mL玻璃组织匀浆器 海门市盛泰实验器材厂。
1.3 方法
1.3.1 动物分组及处理
雄性昆明小鼠60 只,体质量(20±2)g,分笼饲养(控制光照12 h明/12 h暗,室内温度(20±1)℃,相对湿度为(55±10)%,自由饮食(基础饲料)和进水,室内无菌消毒,每两天换一次垫料,饲养7 d以适应环境后,随机将其分为6 组,每组10 只。正常对照组(NG组):饲喂基础饲料(饲料组成依照GB 14924.3—2001《实验动物 配合饲料营养成分》配制);高脂模型组(HG组):饲喂高脂饲料(熟猪油10%、胆固醇2%、胆酸钠0.5%、基础饲料87.5%);3 个酒花多酚实验组(HPL、HPM、HPH组)均饲喂高脂饲料,同时分别以200、400、800 mg/(kg·d)的多酚剂量给小鼠灌胃HPE(用蒸馏水将HPE配制成不同剂量的混悬液);茶多酚组(TPM组):饲喂高脂饲料,同时以400 mg/(kg·d)的多酚剂量给小鼠灌胃TPE。NG组和HG组每天灌胃蒸馏水。每组自由进食和饮水。每隔7 d称一次体质量,在实验第35天时,禁食12 h(不禁水),摘除眼球取血,3 000 r/min离心5~10 min,分离血清,分装后于-20 ℃冷冻保存测定生化指标 [21]。颈锥脱臼法处死小鼠,分离肝脏,用冷生理盐水漂洗,拭干,用灭菌生理盐水4 ℃条件下制得质量分数10%肝匀浆,3 000 r/min低温离心10 min,取上清液用于测定生化指标。
1.3.2 全血溶血液制备
取肝素抗凝全血20 μL,以蒸馏水稀释至1 mL,配成1:49(V/V)溶血液。充分混匀,放置5 min直至玻璃管中的溶血液对光呈完全透明状,方可检测溶血液中GSH-Px活力。
1.3.3 红细胞抽提液制备
在装有3 mL生理盐水的带刻度离心管中,加入肝素抗凝血50 μL,2 000 r/min离心3 min。用玻璃吸管吸去上清液,在余留下沉淀的红细胞中加入双蒸水0.2 mL,混匀。再加入95%的乙醇0.1 mL,振荡30 s,加入三氯甲烷0.1 mL置旋涡混匀器充分抽提混匀1 min,然后3 500 r/min离心8 min。此时液体分为3 层:上层为红细胞抽提液,中层为血红蛋白沉淀物,下层为三氯甲烷。分离上层的红细胞抽提液,冷冻保存 [21],用于红细胞SOD活力的测定。
1.3.4 小鼠血脂和肝脂水平测定
小鼠血清和肝脏中TC、TG含量以及血清中HDL-C水平按照试剂盒说明书方法测定,肝匀浆蛋白质的测定按照试剂盒说明书采用考马斯亮蓝G250法测定。血清中的低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)和动脉粥样硬化指数(atherosclerosis index,AI)按公式(1)、(2)计算。

式中:LDL-C含量、TC含量、HDL-C含量的单位均为mmol/L。
1.3.5 小鼠血液和肝脏抗氧化指标的测定
小鼠血清和肝脏MDA含量及CAT活力、红细胞和肝脏SOD活力、全血和肝脏GSH-Px活力均按照试剂盒说明书方法测定。
1.4 数据处理
各组数据用
 表示,组间数据比较采用一维方差分析(ANOVA)。用SPSS统计软件包进行统计分析处理。P<0.05被认为有显著差异。
表示,组间数据比较采用一维方差分析(ANOVA)。用SPSS统计软件包进行统计分析处理。P<0.05被认为有显著差异。
2.1 各组小鼠体质量的变化
表1 小鼠体质量变化情况

Table1 Body weight changes of mice

注:同行小写字母不同表示差异显著(P<0.05)。下同。
组别NG组HG组HPL组HPM组HPH组TPM组第1天19.86±0.60 a19.94±0.59 a19.64±0.70 a19.56±0.51 a19.86±0.78 a20.19±0.53 a第3周29.72±1.54 a29.99±1.63 a29.86±1.54 a29.19±1.97 a28.14±1.95 a29.60±1.58 a第5周36.38±2.27 a37.98±2.31 a35.46±3.14 a35.59±1.73 a35.46±2.97 a35.79±1.70 a
实验期间各组小鼠的健康情况良好,摄食量无明显差别,小鼠行为、排便及精神状态正常。由表1可知,5 周后多酚组(HPE和TPE)体质量增加较少,但6 组小鼠之间体质量变化没有统计学差异(P>0.05)。
2.2 HPE对高血脂症小鼠血脂和肝脂水平的影响
表2 5 周后各组小鼠血脂、肝脂水平

Table2 Lipid levels in serum and liver of mice fed with experimental diets for 5 weeks

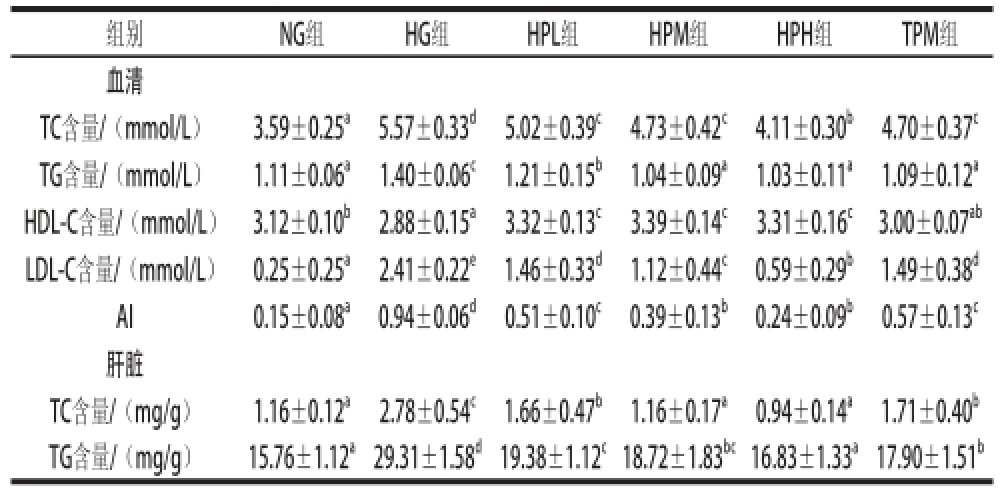
组别NG组HG组HPL组HPM组HPH组TPM组血清TC含量/(mmol/L)3.59±0.25 a5.57±0.33 d5.02±0.39 c4.73±0.42 c4.11±0.30 b4.70±0.37 cTG含量/(mmol/L)1.11±0.06 a1.40±0.06 c1.21±0.15 b1.04±0.09 a1.03±0.11 a1.09±0.12 aHDL-C含量/(mmol/L)3.12±0.10 b2.88±0.15 a3.32±0.13 c3.39±0.14 c3.31±0.16 c3.00±0.07 abLDL-C含量/(mmol/L)0.25±0.25 a2.41±0.22 e1.46±0.33 d1.12±0.44 c0.59±0.29 b1.49±0.38 dAI0.15±0.08 a0.94±0.06 d0.51±0.10 c0.39±0.13 b0.24±0.09 b0.57±0.13 c肝脏TC含量/(mg/g)1.16±0.12 a2.78±0.54 c1.66±0.47 b1.16±0.17 a0.94±0.14 a1.71±0.40 bTG含量/(mg/g)15.76±1.12 a29.31±1.58 d19.38±1.12 c18.72±1.83 bc16.83±1.33 a17.90±1.51 b
实验末各组小鼠的血脂、肝脂水平如表2所示。与NG组相比,HG组小鼠血清和肝脏中TC、TG含量、血清LDL-C水平和AI值显著升高(P<0.05),血清HDL-C水平显著降低(P<0.05),表明高脂血症小鼠造模成功;与HG组相比,酒花多酚各剂量组(HPL、HPM、HPH组)小鼠血清和肝脏中的TC和TG含量、血清中LDL-C水平和AI值显著降低(P<0.05),HDL-C水平显著升高(P<0.05);HPM组小鼠血清LDL-C水平和AI值以及肝脏TC含量均显著低于TPM组(P<0.05),血清HDL-C水平显著高于TPM组(P<0.05),而两组间的血清和肝脏TG含量没有显著差异(P>0.05)。
2.3 HPE对高血脂症小鼠脂质过氧化物和抗氧化性的影响
实验末小鼠血液和肝脏的脂质过氧化物水平和抗氧化酶活性如表3所示。与NG组相比,HG组小鼠血清和肝脏的MDA含量显著增加(P<0.05),抗氧化酶SOD、GSH-Px和CAT活力显著降低(P<0.05);与HG组相比,酒花多酚3 个剂量组(HPL、HPM和HPH组)血清和肝脏中的MDA含量均显著降低(P<0.05),全血GSH-Px和肝脏CAT活力显著提高(P<0.05);与HG组相比,HPM和HPH组小鼠红细胞SOD、血清CAT活力和肝脏GSH-Px活力均显著提高(P<0.05)。与TPM组相比,HPM组小鼠全血GSH-Px活力和血清CAT活力均显著升高(P<0.05)。
表3 5周后小鼠血液和肝脏的各项抗氧化指标
Table3 Antioxidant capacities in blood and liver from mice fed with experimental diets for 5 weeks
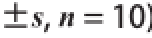
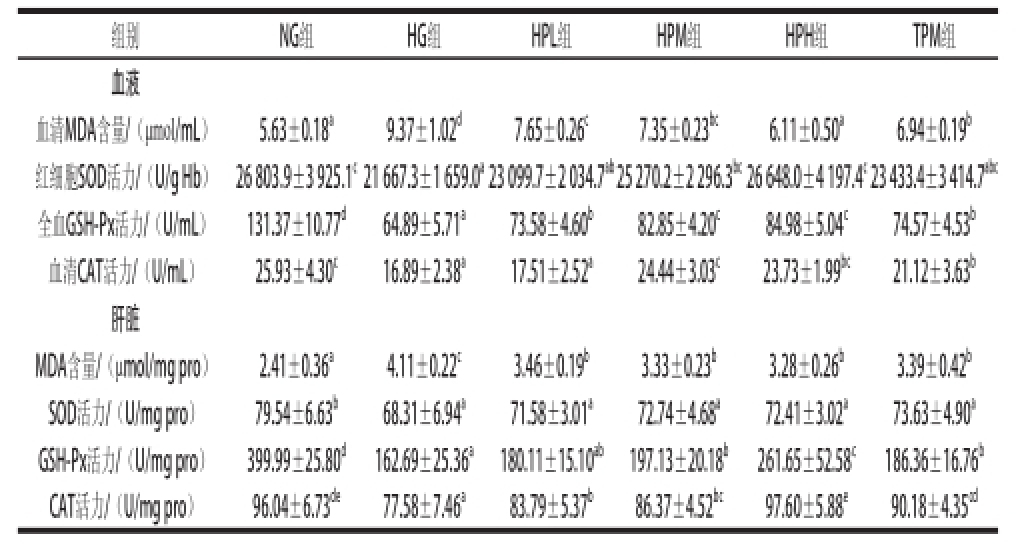
组别NG组HG组HPL组HPM组HPH组TPM组血液血清MDA含量/(μmol/mL)5.63±0.18 a9.37±1.02 d7.65±0.26 c7.35±0.23 bc6.11±0.50 a6.94±0.19 b红细胞SOD活力/(U/g Hb)26 803.9±3 925.1 c21 667.3±1 659.0 a23 099.7±2 034.7 ab25 270.2±2 296.3 bc26 648.0±4 197.4 c23 433.4±3 414.7 abc全血GSH-Px活力/(U/mL)131.37±10.77 d64.89±5.71 a73.58±4.60 b82.85±4.20 c84.98±5.04 c74.57±4.53 b血清CAT活力/(U/mL)25.93±4.30 c16.89±2.38 a17.51±2.52 a24.44±3.03 c23.73±1.99 bc21.12±3.63 b肝脏MDA含量/(μmol/mg pro)2.41±0.36 a4.11±0.22 c3.46±0.19 b3.33±0.23 b3.28±0.26 b3.39±0.42 bSOD活力/(U/mg pro)79.54±6.63 b68.31±6.94 a71.58±3.01 a72.74±4.68 a72.41±3.02 a73.63±4.90 aGSH-Px活力/(U/mg pro)399.99±25.80 d162.69±25.36 a180.11±15.10 ab197.13±20.18 b261.65±52.58 c186.36±16.76 bCAT活力/(U/mg pro)96.04±6.73 de77.58±7.46 a83.79±5.37 b86.37±4.52 bc97.60±5.88 e90.18±4.35 cd
脂质代谢紊乱与冠心病的发生和发展密切相关,血清和肝脏中TC和TG水平的长期增高是导致动脉粥样硬化、诱发心血管疾病的重要原因 [22]。TG是心血管事件的独立预测因子,同时与肥胖症也密切相关 [23]。在东方人群中,血清TC水平每升高0.16 mmol/L,冠心病发病的相对危险性升高34% [24]。因此,降低TC和TG水平对防治高脂血症和心血管疾病有重要意义。本研究结果显示,给高脂血症小鼠饲喂200~800 mg/(kg·d)剂量的HPE,可显著降低血清和肝脏的TC、TG含量,表明酒花多酚有显著的降脂作用。
已被证实高水平的HDL-C有助于抗动脉粥样硬化,包括其抑制低密度脂蛋白的氧化和保护血管内皮细胞不受低密度脂蛋白氧化对细胞毒性作用的能力 [25]。有报道称原花青素和黄酮类化合物可以增加HDL-C含量 [26-27]。Qin Yu等 [28]报道了给血脂异常患者(40~65 岁)补充原花青素胶囊(每天4 次,每次80 mg)12 周后,血清LDL-C水平显著下降了13.63%(P=0.037<0.05),HDL-C增高了12.42%(P=0.024<0.05),但血清TC、TG水平没有显著改变。本研究结果显示,饲喂酒花多酚能使高脂血症小鼠血清中HDL-C水平显著升高,LDL-C水平显著降低。这可能是由于酒花多酚中含有大量的原花青素和黄酮类化合物,本课题组已有的研究分析表明 [6],HPE中含有原花青素489.6 mg/g,黄酮类化合物261.8 mg/g,它们都有助于高脂血症动物体内HDL-C水平的增加和LDL-C水平的降低。
氧化应激与高脂血症是导致动脉粥样硬化的重要原因 [29]。自由基的生成量超出天然抗氧化剂的平衡容量则导致氧化应激,高脂饮食可使机体内自由基的生成量增加 [30-31],饮食中的胆固醇在代谢中被运至肝细胞,生成大量多种氧化产物 [32]。因此,高脂饮食导致了体内自由基的增加,从而激发了脂质过氧化产物的形成 [33]。在本研究中,高脂模型组大鼠血液和肝脏中脂质过氧化产物MDA含量的显著增加也证实了以上观点。本课题组先前 [34]报道了酒花多酚醇提物在体外有显著抗氧化活性,但体外活性不能代表真正的体内活性,多酚的抗氧化活性可能会被在体内的生物利用度和生物转化率所影响 [35]。本研究的结果显示,饲喂200~800 mg/(kg·d)剂量的酒花多酚35 d,可使高脂血症小鼠血液和肝脏的脂质过氧化产物MDA含量显著降低,抗氧化酶SOD、GSH-Px和CAT活力显著增高,表明酒花多酚在体内同样有显著的抗氧化活性。
茶多酚的降脂抗氧化作用已被证实 [36],本研究选取了茶多酚作为阳性对照组与酒花多酚的降脂抗氧化效果进行比较。实验结果显示,与同等剂量(400 mg/(kg·d))的茶多酚组相比,酒花多酚组(HPM,400 mg/(kg·d))小鼠血清LDL-C水平、AI和肝脏TC含量均显著降低,血清HDL-C水平、CAT活力和全血GSH-Px活力均显著升高,提示酒花多酚降脂抗氧化效果优于同剂量的茶多酚。这可能是由于酒花多酚比茶多酚含有更多的原花青素和黄酮类物质。先前的研究表明 [6],酒花多酚中55%以上的多酚物质是原花青素,29%以上的多酚物质是黄酮类,而茶多酚中原花青素仅占总多酚的8.75%,黄酮类物质仅占总多酚的3.72%。原花青素和黄酮类物质都是强有力的天然抗氧化剂,能激发动物体内的SOD和GSH-Px活力,降低脂质过氧化产物(MDA)含量和改善脂质代谢状况。
经分析,本实验所用啤酒花提取物HPE的多酚含量为88.7%,水分含量为4.8%,蛋白质含量为5.9%,灰分含量为0.4%,可以认为HPE中的少量非酚类物质对实验结果不构成影响,HPE对小鼠的降脂功效主要来自于酒花多酚。
综上所述,酒花多酚对高脂血症小鼠具有调节脂质代谢、抑制脂质过氧化、提高抗氧化酶活力、延缓动脉粥样硬化发展的功效。目前的研究结果证实了酒花多酚是一种甚至比茶多酚效果更好的天然降脂抗氧化成分,可以作为预防动脉粥样硬化的新药来源并应用到保健食品中。
参考文献:
[1] 中国科学院植物研究所. 中国高等植物图鉴(第一册)[M]. 北京: 科学出版社, 1994: 502.
[2] 中国人民共和国卫生部药典委员会. 中华人民共和国药典(一部)[M].北京: 人民卫生出版社, 1977: 541-542.
[3] MAGALH☒ES P J, VIEIRA J S, GON☒ALVES L M, et al. Isolation of phenolic compounds from hop extracts using polyvinylpolypyrrolidone: characterization by high-performance liquid chromatography-diode array detection-electrospray tandem mass spectrometry[J]. Journal of Chromatography A, 2010, 1217(19): 3258-3268.
[4] STEVENS J F, PAGE J E. Xanthohumol and related prenylflavonoids from hops and beer: to your good health![J]. Phytochemistry, 2004,65(10): 1317-1330.
[5] 王旭苹, 杨磊, 杨小兰, 等. 大孔树脂纯化酒花多酚及其组成分析[J].食品科学, 2013, 34(22): 15-20.
[6] 杨小兰, 郑海鹰, 胡仕屏, 等. 啤酒花超临界CO 2萃余物中总黄酮的提取与抗氧化活性研究[J]. 食品科学, 2009, 30(11): 137-141.
[7] GORJANOVIC☒ S Z, NOVAKOVIC M M, POTKONJAK N S I, et al. Application of a novel antioxidative assay in beer analysis and brewing process monitoring[J]. Journal of Agricultural and Food Chemistry,2009, 58(2): 744-751.
[8] GORINSTEIN S, CASPI A, LIBMAN I, et al. Bioactivity of beer and its in☒uence on human metabolism[J]. International Journal of Food Sciences and Nutrition, 2007, 58(2): 94-107.
[9] SHINADA K, TAGASHIRA M, WATANABLE H, et al. Hop bract polyphenols reduced three-day dental plaque regrowth[J]. Journal of Dental Research, 2007, 86(9): 848-851.
[10] YAEGAKI K, TANAKA T, SATO T, et al. Hop polyphenols suppress production of water-insoluble glucan by Streptococcus mutans and dental plaque growth in vivo[J]. The Journal of Clinical Dentistry,2007, 19(2): 74-78.
[11] KOU Y, INABA H, KATO T, et al. Inflammatory responses of gingival epithelial cells stimulated with Porphyromonas gingivalis vesicles are inhibited by hop-associated polyphenols[J]. Journal of Periodontology, 2008, 79(1): 174-180.
[12] YAMAMOTO H, KIMAMURA D, NAGANO C, et al. Separation of polyphenols in hop bract part discharged from beer breweries and their separability evaluation using solubility parameters[J]. Kagaku Kogaku Ronbunshu, 2008, 34(3): 331-338.
[13] TAGASHIRA M, UCHIYAMA K, YOSHIMURA T, et al. Inhibition by hop bract polyphenols of cellular adherence and water-insoluble glucan synthesis of mutans streptococci[J]. Bioscience, Biotechnology,and Biochemistry, 1997, 61(2): 332-335.
[14] CHOBANIAN A V. Single risk factor intervention may be inadequate to inhibit atherosclerosis progression when hypertension and hypercholesterolemia coexist[J]. Hypertension, 1991, 18(2): 130-131.
[15] CHEN Changche, LIU Likaung, HSU Jengdong, et al. Mulberry extract inhibits the development of atherosclerosis in cholesterol-fed rabbits[J]. Food Chemistry, 2005, 91(4): 601-607.
[16] SINGH B, BHAT T K, SINGH B. Potential therapeutic applications of some antinutritional plant secondary metabolites[J]. Journal of Agricultural and Food Chemistry, 2003, 51(19): 5579-5597.
[17] KRIS-ETHERTON P M, HECKER K D, BONANOME A, et al. Bioactive compounds in foods: their role in the prevention of cardiovascular disease and cancer[J]. The American Journal of Medicine, 2002, 113(9): 71-88.
[18] GRUNDY S M. Cholesterol and coronary heart disease: a new era[J]. Jama, 1986, 256(20): 2849-2858.
[19] AVIRAM M. Flavonoids-rich nutrients with potent antioxidant activity prevent atherosclerosis development: the licorice example[C]// Internati onal Congress Series. Amsterdam: Elsevier, 2004, 1262: 320-327.
[20] ENGLER M B, ENGLER M M. The vasculoprotective effects of flavonoid-rich cocoa and chocolate[J]. Nutrition Research, 2004,24(9): 695-706.
[21] 吕瑞娟, 任登先, 闫明. 脂肪肝的发病机理和治疗研究进展[J]. 甘肃科学学报, 2001, 13(2): 57-64.
[22] 周伟燕. 同位素稀释液相色谱质谱法测定血清总胆固醇和甘油三酯[D]. 北京: 北京协和医学院, 2010.
[23] 唐红珍. 中医综合减肥法对肥胖症大鼠血清总胆固醇和甘油三酯的影响[J]. 时珍国医国药, 2010, 21(7): 1587-1588.
[24] 孙炜, 王慧铭. 昆布多糖对高脂血症大鼠降胆固醇作用及其机理的研究[J]. 中国中药杂志, 2005, 29(10): 1015-1016.
[25] ASSMANN G, NOFER J R. Atheroprotective effects of high-density lipoproteins[J]. Annual Review of Medicine, 2003, 54(1): 321-341.
[26] DANIEL R S, DEVI K S, AUGUSTI K T, et al. Mechanism of action of antiatherogenic and related effects of Ficus bengalensis Linn. flavonoids in experimental animals[J]. Indian Journal of Experimental Biology, 2003, 41(4): 296-303.
[27] VINSON J A, HU S J, JUNG S, et al. A citrus extract plus ascorbic acid decreases lipids, lipid peroxides, lipoprotein oxidative susceptibility, and atherosclerosis in hypercholesterolemic hamsters[J]. Journal of Agricultural and Food Chemistry, 1998, 46(4): 1453-1459.
[28] QIN Yu, XIA Min, MA Jing, et al. Anthocyanin supplementation improves serum LDL- and HDL- cholesterol concentrations associated with the inhibition of cholesteryl ester transfer protein in dyslipidemic subjects[J]. The American Journal of Clinical Nutrition, 2009, 90(3): 485-492.
[29] YOUNG I S, MCENENY J. Lipoprotein oxidation and atherosclerosis[J]. Biochemical Society Transactions, 2001, 29: 358-362.
[30] SLIM R M, TOBOREK M, WATKINS B A, et al. Susceptibility to hepatic oxidative stress in rabbits fed different animal and plant fats[J]. Journal of the American College of Nutrition, 1996, 15(3): 289-294.
[31] DOBRIAN A D, DAVIES M J, PREWITT R L, et al. Development of hypertension in a rat model of diet-induced obesity[J]. Hypertension,2000, 35(4): 1009-1015.
[32] ERDIN☒LER D S, SEVEN A, INCI F, et al. Lipid peroxidation and antioxidant status in experimental animals: effects of aging and hypercholesterolemic diet[J]. Clinica Chimica Acta, 1997, 265(1): 77-84.
[33] 中华人民共和国卫生部. 保健食品检验与评价技术规范(2003年版)[M]. 2003: 274-275.
[34] 杨小兰, 田艳花, 师成滨, 等. 啤酒花多酚的提取工艺及抗氧化活性的研究[J]. 食品科学, 2006, 27(10): 297-302.
[35] WANG Liyan, WANG Zhiqiang, ZHANG Xi, et al. A new approach for the fabrication of an alternating multilayer film of poly (4-vinylpyridine) and poly (acrylic acid) based on hydrogen bonding[J]. Macromolecular Rapid Communications, 1997, 18(6): 509-514.
[36] JAYASEKERA S, MOLAN A L, GARG M, et al. Variation in antioxidant potential and total polyphenol content of fresh and fullyfermented Sri Lankan tea[J]. Food Chemistry, 2011, 125(2): 536-541.
Hypolipidemic and Antioxidant Effects of Hop Polyphenols in Hyperlipidemic Mice
GUO Miao, YANG Xiaolan
*
(College of Life Science, Shanxi University, Taiyuan 030006, China)
Abstract:In this study, the hop polyphenol extract (HPE, 88.7% purity) obtained from the supercritical CO 2raffinate of waste hops from beer brewing was evaluated for hypolipidemic and antioxidant effects in hyperlipidemia mice in comparison with tea polyphenols at the same dose. The hyperlipidemia mice were orally administered with HPE at doses of 200-800 mg/(kg・d) for five weeks. The results showed that total cholesterol and triglyceride contents in serum and liver,low-density lipoprotein cholesterol level in serum, and atherogenic index in hyperlipidemia mice were decreased significantly in response to HPE administration. Meanwhile, the serum level of high-density lipoprotein cholesterol was significantly increased. In addition, the contents of malondialdehyde in blood and liver were significantly reduced, and catalase activities were significantly enhanced. Superoxide dismutase activities in red blood cells and liver, and glutathione peroxidase activities in blood and liver were significantly elevated. Therefore, HPE has significant hypolipidemic and antioxidant effects in hyperlipidemic mice.
Key words:hop polyphenols; hyperlipidaemia; lipid peroxidation; mice
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2015)03-0183-05
doi:10.7506/spkx1002-6630-201503035
收稿日期:2014-03-17
基金项目:国家自然科学基金面上项目(31171748);山西省自然科学基金项目(2006011019)
作者简介:郭苗(1991—),女,硕士,研究方向为食品与生物技术。E-mail:851657762@qq.com
*通信作者:杨小兰(1956—),女,教授,本科,研究方向为食品与生物技术。E-mail:13934214833@163.com