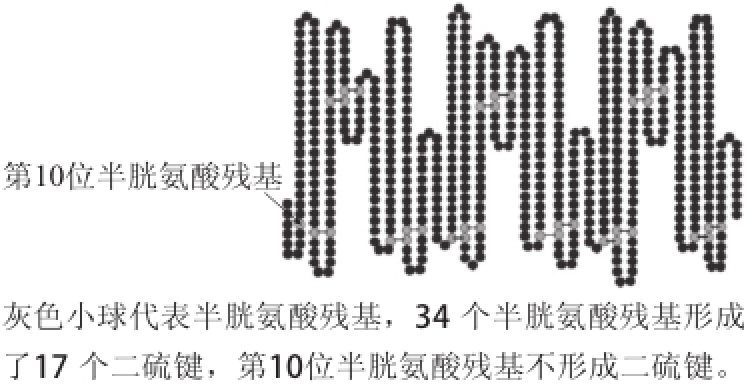
图1 牛血清白蛋白中半胱氨酸残基以及二硫键位置示意图[8]
Fig.1 Schematic illustration for the positions of cysteine residues and disulfide bonds from bovine serum albumin
[8]
张晴晴 1,吴子健 1,*,胡志和 1,王 帅 1,王连芬 2
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.北京食品科学研究院,北京 100068)
摘 要:食物过敏原所引发的食品安全问题是目前亟待解决的卫生学问题,而分析过敏原蛋白结构稳定性与致敏性的关系,对于了解食品过敏的机理以及探索消减过敏原致敏性的方法具有十分重要的意义。 本文选取几种主要食物过敏原蛋白,探讨维持过敏原蛋白结构稳定性的因素(二硫键、糖基、疏水作用以及氢键),以及结构稳定与致敏性的关系,为如何消减过敏原致敏性提供一定的理论指导。
关键词:食物过敏原;结构稳定性;致敏性;二硫键;糖基;疏水相互作用;氢键
众所周知,食品是人类赖以生存和繁衍的能量来源,而人们在享受美食的同时也面临种种食品安全问题,特别是因食品所引起的过敏,严重影响过敏者的生活质量,甚至威胁他们的生命安全。不同来源的食物过敏原的氨基酸残基序列不同,但是却有着较为相似的物理、化学以及生物学性质 [1]:过敏原蛋白一般在其来 源 过敏食品中的含量较高,蛋白组成中 含有一定量糖基,一般具有抗热、抗变性剂的变性作用、耐受酸碱以及抑制蛋白酶酶解作用(果蔬过敏原例外 [2])等,特别是对机体消化道蛋白酶和胃酸具有一定耐受性,多数过敏原蛋白在胃液中停留时间较长,不易被水解 [3],从而致敏作用持久、作用稳定性高,致敏效果难以被消除。而导致这些性质的原因是其结构的稳定性,因此分析食源性过敏原蛋白的结构对于揭示过敏蛋白致敏性、致敏稳定性以及由IgE介导或非IgE介导的过敏反应中抗原表位的确定至关重要 [1,4]。目前已知维持空间结构稳性的因素主要有蛋白质的一级结构组成(包括二硫键和蛋白质中糖基组成)、疏水相互作用以及氢键等,当然这些因素对不同的食物过敏原蛋白结构稳定性的维系作用又有着不同的侧重点。本文选取较为典型的食源性过敏原(分别来自牛乳、花生、鸡蛋以及水产品),从这些过敏原蛋白的结构特点出发,分析讨论这些因素在维持过敏原蛋白结构稳定的同时又是如何影响其过敏原性,具有重要的理论指导意义。
1.1 牛血清白蛋白
牛乳中引起过敏反应的蛋白包括 [5]:β-乳球蛋白(β-lactoglobulin,β-LG)、酪蛋白(casein,CAS)、α-乳白蛋白(α-lactoalbumin,α-LA)、牛血清白蛋白(bovine serum albumin,BSA)、乳铁蛋白(lactoferrin,LF)以及免疫球蛋白(immunoglobulin,Ig)等。其中BSA的致敏性较为常见,美国约有50%牛乳过敏患者对BSA产生过敏,且其引发的过敏反应不受其他过敏原的影响 [6]。并且该蛋白在酸性环境或加热条件下仍能够保持其三级结构的一定稳定性,是目前人们了解过敏原蛋白空间结构及过敏性关系的模式蛋白 [7-8]。BSA蛋白上有诸多已确定的致敏线性表位:2001年Beretta等 [9]指出BSA的一个线性表位位于Lys524~Gln542;2008年Tanabe [10]报道BSA中至少存在两个IgE结合区域,即His337~Leu346和Leu452~Cys460,其核心区域为Glu339~Val342(EYAV)和Leu454~Arg458(LILNR);另外,在该序列中也存在3个诱导T细胞增殖的区域,即Asp107~Asp123,Pro365~Pro383和Leu452~Cys460。
成熟BSA的分子质量为66.5 ku,由583 个氨基酸残基组成 [11],其中半胱氨酸残基有35 个,形成了17 个二硫键(第10位没有形成二硫键),这些半胱氨酸残基以及二硫键的位置如图1所示,目前已知BSA中二硫键多数位于蛋白中难以接触溶剂的疏水核心区域,不易受到破坏,二硫键的存在又进一步使整个蛋白内形成了9 个环状结构。2001年Beretta等 [9]免疫印迹实验结果表明二硫键的存在可维护BSA过敏原性,其引发形成的9 个环状结构能使BSA不易遭受胃蛋白酶酶解消化,因而维持了BSA过敏性所必须的构象表位,提高了其致敏的稳定性。

图1 牛血清白蛋白中半胱氨酸残基以及二硫键位置示意图[8]
Fig.1 Schematic illustration for the positions of cysteine residues and disulfide bonds from bovine serum albumin
[8]
1.2 鸡卵类黏蛋白
鸡蛋中有4 种主要过敏原(即溶菌酶、卵转铁蛋白、卵白蛋白以及卵类黏蛋白),其中鸡卵类黏蛋白(hen’s egg ovomucoid,HOVM)是鸡蛋过敏反应中致敏性最强、最普遍的蛋白质 [12-13],在组成HOVM部分的186 个氨基酸残基中有18 个半胱氨酸残基 [14],均形成二硫键,这是维持结构以及致敏稳定性的重要因素之一。目前已知HOVM分子内含有3 个相对独立的同源结构域,即Gal d 1.1(氨基酸残基1~68)、Gal d 1.2(氨基酸残基65~130)和Gal d 1.3(氨基酸残基131~186) [14],且每个域都含有3 个域内二硫键,但域间并无二硫键链接 [15]。其中Gal d 1.3构象呈大小约为3.5 nm×2.7 nm×1.9 nm的球形,具有2 个反平行β-片层(残基Pro22~Gly32)和1 个α-螺旋(残基Asn33~Ser44),结构中约70%残基属于规正二级结构或疏水核心的部分。域内的3 个二硫键极大地限制结构域的空间构型的变化,进而维系其构象稳定性。另外,若还原改变二硫键就会使HOVM与不同过敏者血清中IgE的结合活性受到影响。1991年Djurtoft等 [16]发现二硫键经二硫苏糖醇等还原剂还原,然后再烷基化作用会发生断裂,此时的HOVM与许多鸡蛋过敏症患者血清中IgE/ IgG的结合活性几乎丧失;1998年Zhang Jiewei等 [17]发现该蛋白中二硫键经还原再羧甲基化后,并没有影响HOVM及其各结构域与HOVM特异性IgG抗体结合的数量;但还原二硫键再羧甲基化的Gal d 1.3与IgE的结合活性提高(由27.4%增至40.1%)。Besler等 [18]研究结果间接表明构象改变对不同鸡蛋过敏者血清中IgE与HOVM结合活性的影响不同:优先与构象表位发生反应的过敏者血清中的IgE与二硫键被还原的HOVM结合活性呈下降趋势;而优先与线性表位反应的过敏者血清中IgE与二硫键被还原的HOVM结合活性呈上升趋势。
1.3 花生过敏原Ara h 2
花生也是食物过敏原的重要来源,目前为止国际免疫学会联合会(International Union of Immunological Societies,IUIS)收录的花生过敏原蛋白有13 种 [19],其中Ara h 2是花生中主要的、也是致敏性最强的过敏蛋白 [20-24],在美国,95%以上花生过敏人群血清具有能特异性识别该过敏蛋白的IgE [25]。

图2 花生过敏原Ara h 2一级结构氨基酸序列
[2266]
Fig.2 Amino acid sequence of primary structure from Ara h 2
[26]
Ara h 2(16~17 ku)是一种单亚基糖蛋白 [27-28],占整个花生蛋白的5.9%~9.3% [29],由172 个氨基酸残基组成(图2),其中8 个半胱氨酸残基形成了链内4 个保守的二硫键,分别为Cys33~Cys116、Cys45~Cys103、Cys104~Cys152和Cys118~Cys160。Ara h 2蛋白属于一种典型2S白蛋白(种子贮藏蛋白中的一类),4 个保守的二硫键确保了其典型的三维结构构象,即5 个α-螺旋由环区连接形成的右手的超螺旋结构 [20,30],如图3所示。保守的二硫键不仅维系了Ara h 2蛋白的结构,而且也保证了其与IgE结合的活性以及致敏性:首先,它们确保了Ara h 2的二级结构以及三级结构的稳定性,2002年Sen等 [1]利用圆二色谱技术研究发现天然状态下该蛋白的二级结构组成中α-螺旋占18.2%,β-折叠占54%,无规卷曲结构约占27.7%,而当该蛋白二硫键经还原剂二硫苏糖醇还原后,其二级结构组成则以β-折叠为主(约占82.3%),其余部分为无规卷曲;其次,由二硫键引起的结构稳定性又进一步确保了其与IgE结合活性,免疫印迹技术检测结果表明,天然状态下的Ara h 2蛋白对胃肠道蛋白酶(如胃蛋白酶)的消化具有一定耐受性,即便是受到酶解,Ara h 2仍具有识别IgE的能力,而当二硫键被还原后其极易被胃蛋白酶酶解,其与IgE的结合活性也受到极大的损失;再次,目前由重叠肽技术定位出的10 个线性表位 [28](表1)在Ara h 2分子结构的表面均有相当多的暴露,而该空间构象的稳定性也保证了这些表位在大多数情况先是出于暴露的程度,易于IgE结合,这也可能是其作为花生中致敏性最强蛋白的原因。

图3 Ara h 2三维结构模型
[2277]
Fig.3 Ribbon diagram of three-dimensional model of Ara h 2
[27]
表1 花生过敏原Arah2IgE结合表位[26]
Table1 Arah2IgE binding epitopes of peanut allergens[26]
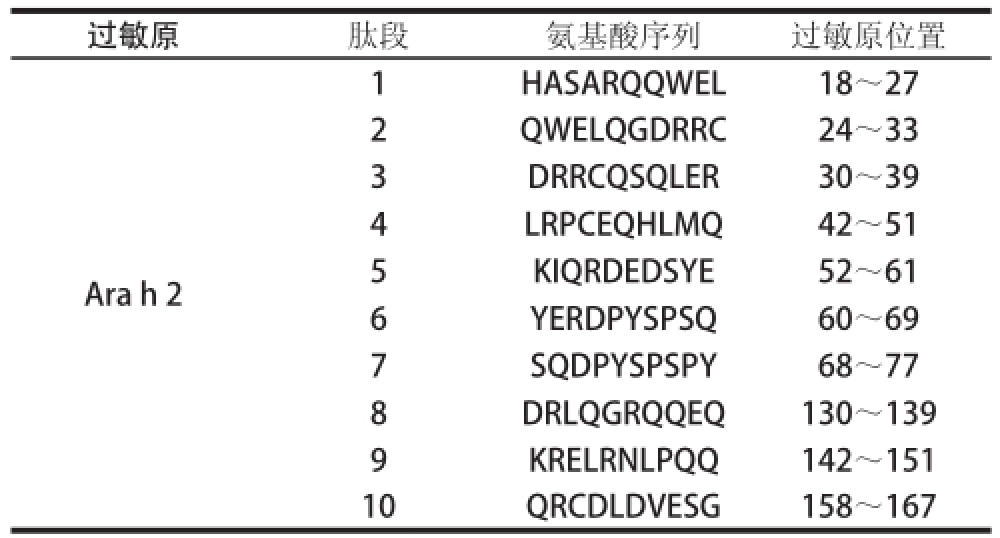
过敏原肽段氨基酸序列过敏原位置Ara h 2 1HASARQQWEL18~27 2QWELQGDRRC24~33 3DRRCQSQLER30~39 4LRPCEQHLMQ42~51 5 KIQRDEDSYE52~61 6YERDPYSPSQ60~69 7 SQDPYSPSPY68~77 8DRLQGRQQEQ130~139 9KRELRNLPQQ142~151 10QRCDLDVESG158~167
糖基会提高蛋白的热稳定性、溶解性能、抗有机溶剂沉淀作用、抗酶解作用,从而间接的提高了过敏原蛋白的致敏性能以及致敏持续性,同时有些过敏原蛋白糖基含量较高 [31-32],所连接的糖基基团空间体积相对较大,这些较大的糖基基团在一定程度上会对过敏原表位的暴露有一定的掩蔽作用。
2.1 鸡卵类黏蛋白(HOVM)
HOVM的过敏原性除了受到二硫键的影响,另个重要的影响因素是其所含有的糖基。HOVM是一种源自鸡蛋的单亚基糖蛋白,糖基部分约占20%~25%,含量相对较高。组成HOVM糖基的单糖残基主要为N-乙酰葡萄糖胺和甘露糖,以及少量的半乳糖和唾液酸等 [33],这些糖基结构示意 [34]如图4所示。而蛋白本身的一级序列含有5 个N-link糖基化位点,分别为Asn10、Asn53、Asn69、Asn75以及Asn175 [14],前4 个位点糖基化概率为100%,而Asn175位点的糖基化概率约为50%。1989年Gu等 [35]发现当HOVM经三氟甲磺酸(trifluoromethanesulfonic acid,TFMS)去除外周的半乳糖和内部的甘露糖(约40%的N-乙酰氨基葡萄糖仍保留)后去糖基化,并不能改变其免疫活性。但是糖基被去除后,HOVM的热稳定性和抗酶解性能降低,从而也使HOVM结合IgE/IgG的活性受到影响 [35-36]。另外结构域3的两种形式(含糖基和不含糖基的)对IgE/IgG的结合活性有具有一定的差异,1986年Matsuda等 [37]就指出含糖基的Gal d 1.3结合过敏血清中IgE的活性明显高于不含糖基的Gal d 1.3,且含糖基的Gal d1.3能够结合过敏血清中的IgG,而未含糖基的Gal d 1.3则几乎与之不结合,但1998年Zhang Jiewei等 [17]的研究则与Matsuda等的发现不同,糖基能够抑制Gal d1.3与IgE的结合活性。


图4 鸡卵类黏蛋白糖链结构
[3344]
Fig.4 Structures of the sugar chains from hen’s egg ovomucoid
[34]
2.2 拟穴青蟹原肌球蛋白
拟穴青蟹中的原肌球蛋白(tropomyosin,TM)是其主要过敏原之一,蛋白部分有284 个氨基酸残基,空间结构呈线性双螺旋。分子中糖基部分的含量约为0.2%,已经确定具有O-糖苷键 [38];其氨基酸序列中第132位(~Asn132~Arg133~Ser134~)具有保守的N-糖基化序列 [39],也可能存在有N-糖基化位点。2012年阮韦伟 [38]采用酶法去除其糖链后,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果表明该蛋白的免疫活性没有变化;但当采用高碘酸氧化化学法去糖基化后,拟穴青蟹TM的抗原性明显下降,免疫交叉反应明显变弱。该研究结果间接说明了糖基对于过敏源蛋白致敏作用的重要性。酶法未完全去除糖链,而高碘酸氧化化学法完全破坏了糖基结构。
另一方面,拟穴青蟹TM所包含的IgE结合位点富含赖氨酸残基,而赖氨酸残基本身易受到糖基化修饰,特别是由美拉德反应引起的糖基化。因此食品加工造成的美拉德反应,导致该蛋白IgE结合位点上赖氨酸残基的糖基化,形成新的糖基链 [40],这些新的糖基可以改变原有的结构,甚至是掩盖原有的IgE结合位点,可能会减低该蛋白致敏性 [41]。
分子内的弱相互作用(诸如疏水相互作用、静电作用、氢键、范德华力等)对于维系食源性过敏原蛋白结构及其过敏原性也具有十分重要的作用。维系蛋白质三级及以上结构的重要因素就在于分子内的弱相互作用。其中2013年Gromiha等 [42]研究发现在弱相互作用中,维系包括过敏原等的耐热性蛋白稳定的主要作用力是疏水相互作用。而有些过敏原蛋白本身就具有比较单一独特的构象,如凡纳滨对虾(Litopenaeus vannamei)中的原肌球蛋白,其天然构象中α-螺旋占主导地位,链内的氢键对于构象的稳定起了非常独特的作用。
3.1 Ara h 1中的疏水相互作用
天然状态下的Ara h 1是由3 个同源亚基通过各自末端的疏水相互作用连接而成的三聚体 [43](图5B),其中每个亚基又是由601 个氨基酸残基组成的耐热糖蛋白亚基,pI 6.36,分子质量为68.75 ku [44];这些亚基进一步可分为4 个结构域 [25],如图5A所示,其中两个α-螺旋束分别位于亚基两端,两个相对称的反平行β-折叠结构域位于亚基的中间。各个亚基间相互连接的疏水区域是IgE结合表位区域 [45],三聚体结构的形成与稳定对其过敏原性的大小有着极其重要的意义。

图5 Arah1 单体(A)及其三聚体(B)结构[4433]
Fig.5 Monomer (A) and homotrimers (B) of Ara h 1
[43]
1997年Burks等 [46]采用重叠肽合成技术确定Ara h 1(信号肽包含在内)过敏原存在1 1 个抗原区域(P1~P11),12 个IgE结合区域(D1~D12),并且该蛋白的IgE结合位点主要位于其中的两个区域部分(D2和D3,位于氨基酸序列82~133中),包含有4 个过敏原表位:90~97(ERTRGRQP)、98~105(GDYDDDRR)、108~115(RREEGGRW)和124~131(EREEDWRQ)。
每个成熟的Ara h 1单体亚基中已被确认的线性表位有21 个 [46-47],其中14 个位于蛋白三聚体的疏水核心区域,在各个亚基上的位置为170~586 [48](表2),其中大多数表位是深埋入三聚体的构象内(>50%的深埋度),有些是略微埋入三聚体的构象内(<50%的深埋度) [49],图6显示了三聚体构象下,露出甚至是位于表面的与IgE结合的表位的分布情况,这种线性表位的分布情况有可能间接地说明了三聚体构象下的Ara h 1所具有的与IgE结合活性弱于变性后的各单体亚基的结合活性。

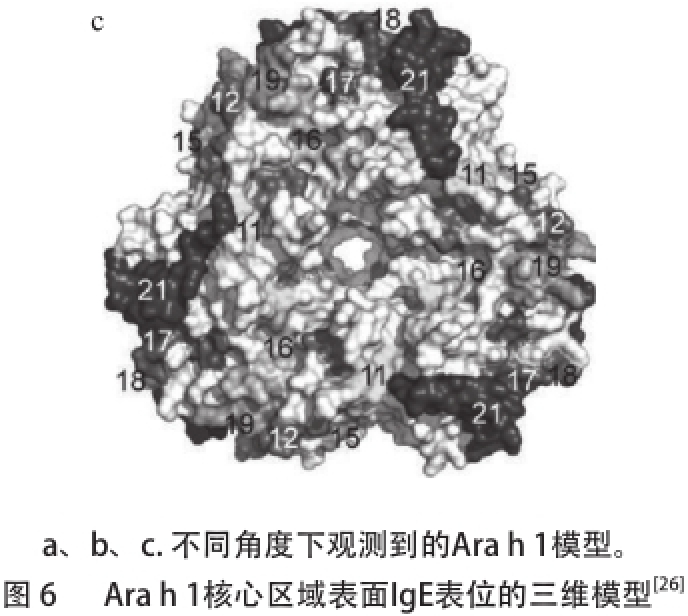
Fig.6 IgE epitopes mapped on the surface of the 3D model of Ara h 1 core region [26]
表2 花生过敏原Ara h 1核心z区域线性表位序列
[26,46]
Table2 Sequence of linear epitopes of peanut allergen Ara h 1 in the core region
[26,46]

过敏原表位氨基酸序列Ara h 1 位置Ara h 1 7 PGQFEDFF270~277 8 YLQGFSRN287~294 9 FNAEFNEIRR300~309 10QEERGQRR318~327 11DITNPINLRE368~377 12NNFGKLFEVK384~393 13GNLELV438~443 14RRYTARLKEG473~482 15ELHLLGFGIN500~509 16HRIFLAGDKD514~523 17IDQIEKQAKD526~535 18KDLAFPGSGE534~543 19KESHFVSARP553~562 21NEGVIVKVSKEHVEELTKHAKSVSK336~360
3.2 原肌球蛋白中的氢键
甲壳类动物机体中TM是一类由两条氨基酸残基序列相同的α-螺旋相互缠绕组成的卷曲之卷曲螺旋双亚基棒状糖蛋白 [50-52],是主要的交叉过敏原 [53],如凡纳滨对虾(Litopenaeus vannamei)中的TM(分子质量约为36 ku)。自优化预测法(self-optimized prediction method,SOPM) [54]预测二级结构组成的结果表明TM二级结构以α-螺旋为主,约占95.07%,而β-转角、β-折叠以及无规卷曲结构含量相对很少,分别为0.7%、1.76%及2.46%,与2012年沈海旺等 [55]采用生物信息学方法分析预测甲壳类动物TM的二级结构基本相符。研究预测该过敏原可能为抗原表位的区域为:2~61,70~65,87~108,111~199,201~225,227~278,约占99.2%,而甲壳类TM实际存在约11 个抗原表位,与实验测得的表位基本相符,而这些过敏原表位大多位于TM的超螺旋结构内(93~208位氨基酸序列) [56],其无规卷曲、β-折叠和β-转角很少。当然,维护卷曲之卷曲的超螺旋结构的稳定性除了氢键的作用,还有静电相互作用和疏水相互作用 [57],2005年,Morais等 [51]发现在离子强度较高的环境下,疏水相互作用对稳定TM卷曲结构有决定性意义,而在正常生理环境下时,静电相互作用则起主要作用。
食源性过敏原种类较多、来源广泛,不同过敏原的分子组成、分子质量大小以及结构有一定的差异,同时维系蛋白结构稳定性的各因素在特定过敏原蛋白中的贡献度大小又有一定的差异。但可以确定的是过敏原蛋白的结构稳定性与其过敏原性之间具有一定的联系,那些保持过敏原蛋白结构稳定性的重要因素(包括:作为蛋白一级结构重要组成的二硫键和糖基、疏水相互作用和氢键等分子内弱相互作用)以不同方式、不同程度地维系着蛋白分子的结构稳定性,同时也影响这些分子过敏原性的表达与剧烈程度。而如何针对这些影响因素,有效地利用物理法(加热法和非加热法)、化学法(化学修饰、酸碱水解)以及生物手段(酶法、微生物发酵法)解决由食源性过敏原引起的食品安全问题仍有待进一步的研究,另外亟待建立一系列较为通用的且能有效检测食物过敏原的方法。
参考文献:
[1] SEN M, KOPPER R, PONS L, et al. Protein structure plays a critical role in peanut allergen stability and may determine immunodominant IgE-binding epitopes[J]. The Journal of Immunology, 2002, 169(2): 882-887.
[2] 何圣发, 陈红兵, 武涌, 等. 食物过敏原构象性表位预测技术研究进展[J]. 食品科学, 2013, 34(13): 314-318.
[3] ASTWOOD J D, LEACH J N, FUCHS R L. Stability of food allergens to digestion in vitro[J]. Nature Biotechnology, 1996, 14(10): 1269-1273.
[4] 陈红兵, 高金燕. 食物过敏反应及其机制[J]. 营养学报, 2007, 29(2): 105-109.
[5] WAL J M. Structure and function of milk allergens[J]. Allergy, 2001,56(Suppl 67): 35-38.
[6] WAL J M. Cow’s milk allergens[J]. Allergy, 1998, 53(11): 1013-1022.
[7] VALENTA R, KRAFT D. Recombinant allergen molecules: tools to study effector cell activation[J]. Immunological Reviews, 2001,179(1): 119-127.
[8] RESTANI P, BALLABIO C, CATTANEO A, et al. Characterization of bovine serum albumin epitopes and their role in allergic reactions[J]. Allergy, 2004, 59(Suppl 78): 21-24.
[9] BERETTA B, CONTI A, FIOCCHI A, et al. Antigenic determinants of bovine serum albumin[J]. International Archives of Allergy and Immunology, 2001, 126(3): 188-195.
[10] TANABE S. Analysis of food allergen structures and development of foods for allergic patients[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(3): 649-659.
[11] UniProtKB. P02769-Serum albumin[DB/OL]. [2014-04-20]. http:// www.uniprot.org/uniprot/P02769.
[12] MILLER H, CAMPBELL D H. Skin test reactions to various chemicalfractions of egg white and their possible clinical significance[J]. Journal of Allergy, 1950, 21(6): 522-524.
[13] BARKHOLT V, BESLER M, SAMPSON H A. Hens egg white(Gallus domesticus)[C]//Internet Symposium on Food Allergens, 2000,2(Suppl 1): 1-29.
[14] KATO I, SCHRODE J, KOHR W J, et al. Chicken ovomucoid: determination of its amino acid sequence, determination of the trypsin reactive site, and preparation of all three of its domains[J]. Biochemistry, 1987, 26(1): 193-201.
[15] COOKE S K, SAMPSON H A. Allergenic properties of ovomucoid in man[J]. The Journal of Immunology, 1997, 159(4): 2026-2032.
[16] DJURTOFT R, PEDERSEN H S, AABIN B, et al. Studies of food allergens: soybean and egg proteins[M]//Nutritional and Toxicological Consequences of Food Processing. New York: Springer US, 1991: 281-293.
[17] ZHANG Jiewei, MINE Y. Characterization of IgE and IgG epitopes on ovomucoid using egg-white-allergic patients’ sera[J]. Biochemical and Biophysical Research Communications, 1998, 253(1): 124-127.
[18] BESLER M, PETERSEN A, STEINHART H, et al. Identification of IgE-binding peptides derived from chemical and enzymatic cleavage of ovomucoid (Gal d 1)[C]//Internet Symposium on Food Allergens,Hamburg, Germany. Institute of Biochemistry and Food Chemistry,1999, 1: 1-12.
[19] The International Union of Immunology Societies, Allergen Nomenclature Sub-Committee. Allergen nomenclature[DB/OL].[2014-04-20]. http://www.allergen.org/search.php?allergenname=&all ergensource=Arachis+hypogaea&TaxSource=&TaxOrder=&foodaller g=all&bioname=.
[20] STANLEY J S, KING N, BURKS A, et al. Identification and mutational analysis of the immunodominant IgE binding epitopes of the major peanut allergen Ara h 2[J]. Archives of Biochemistry and Biophysics, 1997, 342(2): 244-253.
[21] YU J, AHMEDNA M, GOKTEPE I, et al. Enzymatic treatment of peanut kernels to reduce allergen levels[J]. Food Chemistry, 2011,127(3): 1014-1022.
[22] 吉坤美, 陈家杰, 汤慕瑾, 等. 双抗体夹心ELISA法测定食物中花生过敏原蛋白成分[J]. 食品研究与开发, 2009, 30(6): 110-114.
[23] KOPPELMAN S J, WENSING M, ERTMANN M, et al. Relevance of Ara h 1, Ara h 2 and Ara h 3 in peanut-allergic patients, as determined by immunoglobulin E Western blotting, basophil-histamine release and intracutaneous testing: Ara h2 is the most important peanut allergen[J]. Clinical & Experimental Allergy, 2004, 34(4): 583-590.
[24] PIERSMA S R, GASPARI M, HEFLE S L, et al. Proteolytic processing of the peanut allergen Ara h 3[J]. Molecular Nutrition & Food Research, 2005, 49(8): 744-755.
[25] MALEKI S J, KOPPER R A, SHIN D S, et al. Structure of the major peanut allergen Ara h 1 may protect IgE-binding epitopes from degradation[J]. The Journal of Immunology, 2000, 164(11): 5844-5849.
[26] UniProtKB. Q6PSU2-Conglutin-7[DB/OL]. [2014-04-20]. http:// www.uniprot.org/uniprot/Q6PSU2.
[27] ZHOU Yang, WANG Jinshui, YANG Xiaojia, et al. Peanut allergy,allergen composition, and methods of reducing allergenicity: a review[J]. International Journal of Food Science, 2013. doi: 10.1155/2013/909140.
[28] RAMOS M L, HUNTEY J H, MAEKI S J, et al. Identification and characterization of a hypoallergenic ortholog of Ara h 2.01[J]. Plant Molecular Biology, 2009, 69(3): 325-335.
[29] KOPPELMAN S J, VLOOSWIJK R A A, KNIPPELS L M J, et al. Quantification of major peanut allergens Ara h 1 and Ara h 2 in the peanut varieties Runner, Spanish, Virginia, and Valencia, bred in different parts of the world[J]. Allergy, 2001, 56(2): 132-137.
[30] BARRE A, BORGES J P, CULERRIER R, et al. Homology modelling of the major peanut allergen Ara h 2 and surface mapping of IgE-binding epitopes[J]. Immunology Letters, 2005, 100(2): 153-158.
[31] MINE Y, YANG M. Recent advances in the understanding of egg allergens: basic, industrial, and clinical perspectives[J]. Journal of Agricultural and Food Chemistry, 2008, 56(13): 4874-4900.
[32] BREITENEDER H, MILLS E N. Molecular properties of food allergens[J]. Journal of Allergy and Clinical Immunology, 2005,115(1): 14-23.
[33] BEELEY J G. The isolation of ovomucoid variants differing in carbohydrate composition[J]. Biochemical Journal, 1971, 123(3): 399-405.
[34] PARENTE J P, WIERUSZESKI J M, STRECKER G, et al. A novel type of carbohydrate structure present in hen ovomucoid[J]. Journal of Biological Chemistry, 1982, 257(22): 13173-13176.
[35] GU J, MATSUDA T, NAKAMURA R, et al. Chemical deglycosylation of hen ovomucoid: protective effect of carbohydrate moiety on tryptic hydrolysis and heat denaturation[J]. Journal of Biochemistry, 1989, 106(1): 66-70.
[36] BESLER M, STEINHART H, PASCHKE A. Allergenicity of hen’s eggwhite proteins: IgE binding of native and deglycosylated ovomucoid[J]. Food and Agricultural Immunology, 1997, 9(4): 277-288.
[37] MATSUDA T, NAKASHIMA I, NAKAMURA R, et al. Specificity to ovomucoid domains of human serum antibody from allergic patients: comparison with anti-ovomucoid antibody from laboratory animals[J]. Journal of Biochemistry, 1986, 100(4): 985-988.
[38] 阮韦伟. 糖基修饰改性对拟穴青蟹过敏原性质的影响[D]. 厦门: 集美大学, 2012.
[39] LIANG Yinlong, CAO Minjie, SU Wenjin, et al. Identification and characterisation of the major allergen of Chinese mitten crab (Eriocheir sinensis)[J]. Food Chemistry, 2008, 111(4): 998-1003.
[40] WAL J M. Thermal processing and allergenicity of foods[J]. Allergy,2003, 58(8): 727-729.
[41] NAKAMURA A, WATANABE K, OJIMA T, et al. Effect of maillard reaction on allergenicity of scalloptropomyosin[J]. Journal of Agricultural and Food Chemistry, 2005, 53(19): 7559-7564.
[42] GROMIHA M M, PATHAK M C, SARABOJI K, et al. Hydrophobic environment is a key factor for thestability of thermophilic proteins[J]. Proteins: Structure, Function, and Bioinformatics, 2013, 81(4): 715-721.
[43] INDOOR Biotechnologies, Inc. Focus on … Ara h 1: a major allergen(vicilin) from peanut[DB/OL]. [2014-04-20]. http://inbio.com/images/ pdfs/arah1.pdf.
[44] ProtParam. Allergen Ara h 1, clone P41B precursor (Allergen Ara h 1)[DB/OL]. [2014-04-20]. http://web.expasy.org/cgi-bin/protparam/ protparam1?P43238@noft@.
[45] SHIN D S, COMPADRE C M, MALEKI S J, et al. Biochemical and structural analysis of the IgE binding sites on Ara h 1, an abundant and highly allergenic peanut protein[J]. Journal of Biological Chemistry,1998, 273(22): 13753-13759.
[46] BURKS A, SHIN D, COCKRELL G, et al. Mapping and mutational analysis of the IgE-binding epitopes on Ara h 1, a legume vicilin protein and a major allergen i n peanut hypersensitivity[J]. European Journal of Biochemistry, 1997, 245(2): 334-339.
[47] CABANOS C, URABE H, TANDANG-SILVAS M R, et al. Crystal structure of the major peanut allergen Ara h 1[J]. Molecular Immunology, 2011, 49(1): 115-123.
[48] CHRUSZCZ M, MALEKI S J, MAJOREK K A, et al. Structural and immunologic characterization of Ara h 1, a major peanut allergen[J]. Journal of Biological Chemistry, 2011, 286(45): 39318-39327.
[49] WICHERS H J, de BEIJER T, SAVELKOUL H F J, et al. The major peanut allergen Ara h 1 and its cleaved-off N-terminal peptide;possible implications for peanut allergen detection[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4903-4907.
[50] LEHRER S B, AYUSO R, REESE G. Seafood allergy and allergens: a review[J]. Marine Biotechnology, 2003, 5(4): 339-348.
[51] MORAIS A C, FERREIRA S T. Folding and stability of a coiledcoil investigated using chemical and physical denaturing agents: comparative analysis of polymerized and non-polymerized forms of α-tropomyosin[J]. The International Journal of Biochemistry & Cell Biology, 2005, 37(7): 1386-1395.
[52] MOTOYAMA K, ISHIZAKI S, NAGASHIMA Y, et al. Cephalopod tropomyosins: identification as major allergens and molecular cloning[J]. Food and Chemical Toxicology, 2006, 44(12): 1997-2002.
[53] HALMEPURO L, SALVAGGIO J E, LEHRER S B. Crawfish and lobster allergens: identification and structural similarities with other crustacea[J]. International Archives of Allergy and Immunology, 1987,84(2): 165-172.
[54] SOPM Secondary Structure Prediction Methods[DB/OL]. [2013-11-26]. Póle Bioinformatique Lyonnais Network Protein Sequence Analysi. http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/ NPSA/npsa_sopm.html.
[55] 沈海旺, 陈亨莉, 曹敏杰, 等. 甲壳类动物4种过敏原的序列分析, 抗原表位预测及三维结构建模[J]. 免疫学杂志, 2012, 28(7): 613-619.
[56] 张晴晴, 吴子健, 胡志和, 等. 凡纳滨对虾过敏原结构与性质的研究进展[J]. 食品科学, 2014, 35(9): 285-290.
[57] MILLIE L B. Structure and functions of tropomyosins from muscle and non-muscle sources[J]. Trends in Biochemical Sciences, 1979,4(7): 151-155.
Relationship between Structural Stability Factors and Allerginicity of Common Food Allergens
ZHANG Qingqing
1, WU Zijian
1,*, HU Zhihe
1, WANG Shuai
1, WANG Lianfen
2
(1. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce,Tianjin 300134, China; 2. Beijing Academy of Food Sciences, Beijing 100068, China)
Abstract:Nowadays, the increased prevalence of food allergy is a public health problem that needs to be solved urgently. In order to better understand the mechanism of food allergy and find out the reasonable methods for reducing or eliminating the allergenicity of food allergenic proteins (FAPs), it is important for us to explore the relationship between the structural stability of FAPs and its allergenicity. In this paper, an overall review of several critical impacting factors (including disulfide bond, glycosyl, hydrophobic interaction, and hydrogen bond etc.) involved in maintaining the structure of FAPs and the relationship between structural stability and allergenicity of several common FAPs is presented with the purpose to provide a general theoretical guidance for reducing or eliminating the allergenicity of FAPs.
Key words:food allergen; structural stability; allergenicity; disulfide bond; glycosyl; hydrophobic interaction; hydrogen bond
中图分类号:R392.1
文献标志码:A
文章编号:1002-6630(2015)03-0217-06
doi:10.7506/spkx1002-6630-201503042
收稿日期:2014-06-30
基金项目:国家自然科学基金面上项目(31271841);天津市应用基础与前沿技术研究计划面上项目(14JCYBJC30900);天津市高等学校创新团队项目(TD12-5049)
作者简介:张晴晴(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:zhangqingqingtj@163.com
*通信作者:吴子健(1973—),男,副教授,硕士,研究方向为食品生物技术。E-mail:wzjian@tjcu.edu.cn