
图1 基于TAG的植物油鉴别技术研究路径
Fig.1 Development of identification technology for vegetable oils based on TAG
刘优钱 1,2,刘 霞 1,*,李培武 2,*,王秀嫔 2
(1.湖南农业大学食品科学技术学院,食品科学与生物技 术湖南省重点实验室,湖南 长沙 410128;2.中国农业科学院油料作物研究所,农业部油料及制品质量监督检验 测试中 心,湖北 武汉 430062)
摘 要:食用植物油保真检测技术是 食用植物油打假和保证人民身体健康的重要手段。 三酰 甘油酯是占食用植物油90%以上的主要成分,但是我国目前 的检测技术仅能检测三酰甘油 酯酰基链结构,即通过甲酯化方式检测脂肪酸含量,该方法不能真实反映三酰甘油酯的结构和含量。本文综述国内外最新的三酰甘油酯分析技术和化学计量学分析三酰 甘油酯指纹谱的 食用植 物油保真检测技术研究进展,为保障我国食用植物油安全消费提供重要的技术支撑。
关键词:食用植物油;三酰甘油酯;化学计量学
食用植物油掺伪是食用植物油质量安全最重要的问题,2013年卫生部等九部委联合向社会公开征集食用植物油掺伪检测技术,至今没有官方公开的切实有效的检测技术。目前鉴别植物油的方法有理化法和仪器分析法。仪器分析法快速而精确,是最可靠的方法,但是检测得到高通量数据,而且不同油脂样品在仪器分析上的差别通常无法直接识别,需要借助计算机提取特征信息,采用统计学处理数据,因此化学计量学成为关键和核心技术。化学计量学能从大量数据中提取或挖掘有用信息,在食用植物油的掺伪和品质鉴别中与仪器分析技术相结合得到了广泛的应用,具有准确度高、分析速率快等特点,已越来越受到国内外科研者们的青睐。
三酰甘油酯(triacylglycerol,TAG)是食用植物油的主要成分,占油酯总量的95%,是评价油脂品质和安全的首要因素。国家标准《橄榄油、油橄榄果渣油》 [1]中明确规定等效碳原子数 [2](the equivalent carbon number,ECN,定义为TAG脂肪酰基碳数之和减去两倍TAG的双键数)为42的TAG含量和TAG二位上饱和脂肪酸的含量为特征值。国内外对甘油酯进行了很深入的研究,主要通过对TAG指纹图谱分析,建立植物油的保真和掺伪检测技术。化学计量学贯穿于分析的全过程,因此化学计量学结合TAG组分分析成为植物油保真研究的热点,研究路径如图1所示,高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)仪对不同类型的纯种植物油样本中TAG进行分析,得到色谱和质谱图,提取定量与定性信息的数据矩阵集,结合化学计量学识别不同的植物油,达到植物油保真的目的。

图1 基于TAG的植物油鉴别技术研究路径
Fig.1 Development of identification technology for vegetable oils based on TAG
植物油中TAG种类多且物理化学性质相似,要完全分离出来存在一定困难。目前,对于植物油脂中TAG定性与定量分析已取得了一定进展,分析方法主要有传统的酶解法、气相色谱法、液相色谱法、以及色谱-质谱联用分析。而HPLC-MS以分离检测效果好得到最广泛的应用,因此本文针对HPLC-MS分析TAG做重点介绍。
1.1 三酰甘油酯提取
食用植物油是一种特殊的复杂基质体系,主要含有三酰甘油酯、蛋白质、色素、脂肪酸、植物甾醇、生育酚、酚类化合物、挥发性化合物、维生素、总黄酮、异黄酮等成分,复杂的油溶基质给三酰甘油酯的提取、分离、测定等带来巨大的干扰,因此选择合适的提取方式是保证分析结果准确性和灵敏度的关键环节。目前提取TAG常用的方法是液液萃取 [3]。脂质提取经典方法之一起源于Folch溶剂提取 [4]:用氯仿-甲醇(2:1,V/V)溶解动物组织匀浆,过滤,然后加5 倍总体积的水分层,水层为无脂质层。此方法被Bligh等 [5]改进:用氯仿-甲醇-水(2:2:1.8,V/V)溶解生物组织,氯仿层为脂质层,能更快速提取。另一种是基于Hara等 [6]采用低毒性的正己烷-异丙醇(3:2,V/V)混合溶剂,但是提取效率不如前者。液液萃取是一种传统的提取方法,装置简单、操作容易、成本低,是目前提取TAG最常用方法。
1.2 三酰甘油酯色谱分离与检测
TAG色谱分离方法主要有反相色谱 [7-8]、银离子色谱 [9]、手性色谱 [10]、二维色谱联用 [11]。反相液相色谱是由非极性固定相和极性流动相所组成的液相色谱体系,按照等效碳原子数目的大小将TAG从色谱柱上依次洗脱下来而得到分离。Lisa等 [12]比较了C 18与C 30两种不同固定相的反相色谱柱对黑加仑油中TAG的分离能力,结果显示虽然C 18分离能力较C 30低,但是大大缩短了分析时间(C 18需分析10 min,C 30为90 min),ECN同为36的LnLnLn(Ln,linolenic acid,亚麻酸)与LnLSt(L,linoleic acid,亚油酸;St,stearidonic acid,十八碳四烯酸)在两种反相色谱中都没有分离,因此反相色谱的缺点是等效碳原子数相同的TAG并不能得到很好地分离。反相色谱的优点是前处理简单,对ECN不同的TAG分离能力较强,饱和的TAG如SSS(S,stearic acid,硬脂酸)不需要衍生化处理也有良好的信号 [13],是目前最常用的方法之一。银离子色谱柱主要有商品化的银离子柱 [14]和在阳离子交换色谱柱上固载银离子 [15]的混合色谱柱2 种,适用于不饱和酯异构体的分离,是基于不饱和差异、双键位置不同而分离,能很好地解除基质效应。Lisa等 [16]采用银离子色谱分析动物油脂中的TAG,能将总双键数为2或1的TAG位置异构体如SOP/SPO(O,oleic acid,油酸;P,palmitic acid,棕榈酸)和SOO/OSO很好地分离,但是无法分离开饱和TAG。因此银离子色谱优点是能对部分位置异构体进行分离,特别在一元和二元饱和酯单体的分离起到了很好的效果,缺点是不适合分析饱和TAG。手性色谱是通过手性固定相,引入手性环境使目标分子对映异构体间呈现物理特征差异,从而达分离目的,能对互为对映体的甘油酯分离 [17]。Rezanka等 [18]采用手性色谱将酵母菌中TAG位置异构体组合LLPo/PoLL/LPoL(Po,palmitoleic acid,棕榈烯酸)得到了很好的分离,由于三酰甘油酯的多样性,手性色谱柱并不适合所有的异构体,如POP与OPP两者无法分离。因此单种性质的色谱柱并不能完全满足分离要求,二维色谱联用能达到更好的效果。
质谱检测器 [19-21]灵敏度高、检测限低,利用碎片离子的特征即可进行分子结构分析,是最适合分析TAG的检测器。不同的质谱仪器对碎片强度比值的影响不大,这一结论得到Holcapek等 [22]的验证:采用5 种不同的质谱仪对比分析TAG异构体,仪器对碎片强度比值的影响要远小于化合物本身双键位置及酰基链位置的影响。
TAG是食用植物油脂的主要成分,可以成功应用于食用油的鉴别 [23-24]。TAG的高通量质谱数据给植物油保真检测带来了巨大阻碍,无法直接通过图谱区分不同的油脂,而化学计量学可以分析TAG的指纹图谱揭示油脂中隐含的特有性质,对不同油脂进行识别。化学计量学结合三酰甘油酯在食用油保真检测技术具体的步骤是:1)油样的收集和三酰甘油酯的测定。2)使用化学计量学以油样中三酰甘油酯数据和油样品种建立模型,模型的样本一般是随机抽取大部分样品,其中预留的部分对构建的模型进行验证。Brandao等 [25]收集了大豆油、玉米油、棉籽油、棕榈仁油、巴西棕榈油、S1800和S500生物柴油,用异丙醇-正己烷(5:4,V/V)提取TAG,反相色谱-紫外检测器分析油样中的TAG,分析结果显示生物柴油中并不含TAG,而掺入的不同品种的植物油TAG会有所不同,因此依据TAG数据结合多变量分析建立了生物柴油中掺食用油的鉴别技术:第1种方法在生物柴油中分别掺入不同体积比的5 种食用油,使用PCA(principal component analysis,主成分分析)和K-最邻近法分析TAG数据(9 个峰的面积为变量)建立的模型能区分掺有不同类型植物油的生物柴油;第2种方法是使用偏最小二乘回归(partial least squares regression,PLS)确定掺伪生物柴油的掺伪量,首先以TAG总峰面积与掺伪量(体积分数0%~5%)建立5 种单一掺伪油的回归方程,再配制不同掺伪量来验证曲线的可行性,用于单一掺伪油的定量分析,并可以计算出最低检出限;然后采用偏最小二乘回归法建立多元掺伪油中多变量与掺伪量的关系,交叉验证法用于确定因变量,成功预测掺伪油中不同油脂的掺入量。该方法的优点是不仅能识别生物柴油中掺有哪种植物油,而且可以对掺伪进行定量分析,缺点是收集样本较小,且对TAG没有进行准确的定性分析。目前文献报道中应用于油脂检测的化学计量学方法主要有主成分分析法,偏最小二乘法、聚类分析(clustering analysis,CA)、判别分析(discriminant analysis,DA)等。
2.1 主成分分析
主成分分析是化学计量学中的一种数据挖掘技术,在保存主要信息的前提下选择最少的新变量来代替旧变量,解决了多变量分析的困难。1901年Pearson对非随机变量引入主成分分析,1933年Hotelling在随机向量的情形得到应用,它有严格的数学理论基础 [26]。主成分分析的主要目的是将相关性高的多变量转化成独立的为数不多的变量。通常是选出能解释样本大部分变异的几个新变量作为主成分,用于描述样本的综合性指标。由此可见,主成分分析实际上是运用了降维的思想,原始变量的重要性给出对应的载荷图,样品分布通常采用二维或三维投影图表示。
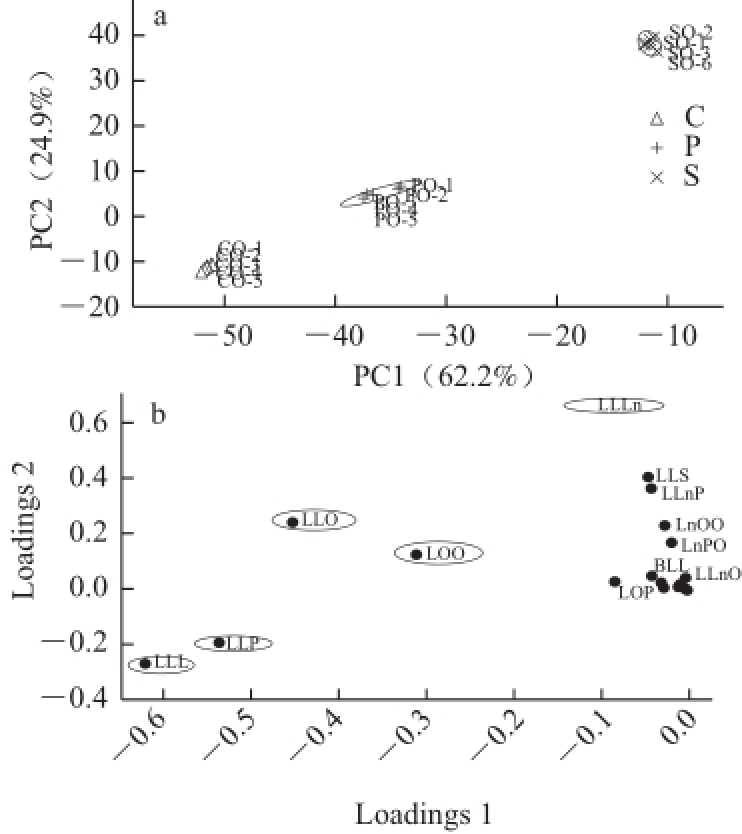
图2 基于TAG的植物油样本主成分分析得分投影图(a)和载荷图(bb)
Fig.2 PCA score (a) and loading plot (b) of vegetable oil samplers base on TAG
图2 是Wei Fang等 [27]对花生油(P)、大豆油(S)、玉米油(C)基于TAG得到的主成分得分投影图和载荷图,二维图使全局信息的可视化且清晰简便,相同品种在空间上聚在相近的位置,不同种类的样品相互远离。另外根据载荷图可以解释原始变量对于主成分的贡献以及对及样本聚类的影响,离中心坐标(0,0)越远代表其贡献值越大,从图2b可以明显看出LLLn、LLO、LLP、LOO、LLL这5 种TAG的贡献值显著。Lisa等 [28]利用反相液相色谱-离子阱质谱联用仪从60 种不同油脂中分离鉴别到355 种TAG,基于TAG数据结合主成分分析建立判别模型,掺有不同质量分数水平葵花油的橄榄油与真实的橄榄油得到很好的识别,识别程度可达掺有1%葵花油油的橄榄油。Cerretani等 [29]对来自7 个不同地区的12 个初榨橄榄油样本的一些定性参数 (游离酸度、过氧化值和紫外分光光度指数)、主要成分(脂肪酸和TAG)、微量组分(叶绿素、类胡萝卜素、生育酚和酚类化合物)进行了评价,主成分分析结果显示TAG是识别不同地区橄榄油最有效的组分。Park等 [30]采用高温气相色谱得到的TAG指纹图谱结合主成分分析用于橄榄油掺入大豆油的研究,对POP、OOP、OOO 3 种TAG进行了定量分析,其中OOO/ OOP值是识别橄榄油中掺入大豆油非常重要的因素,能够检测出掺有不多于5%含量大豆油的橄榄油。
大多数研究者使用主成分分析作为一种分类方法,而不是作为一个探索性的方法。在一般情况下,使用的样本数量太小,此外,模型的建立并没有经过验证分析,不能确保结果的准确性。何勇等 [31]通过近红外光谱技术结合主成分分析得到与苹果品种密切相关的特征波段,并且用特征波段550~565 nm和650~690 nm建立人工神经网络模型,模型样本量为随机抽出3 个不同苹果品种各25 个共75 个,品种识别率达到100%。因此主成分分析适合于对原始数据进行预处理,找出主要的相关变量,再结合其他模式识别技术对品种鉴别与分类是非常有效的,主成分分析作为一个独立方法的应用已越来越少,结合其他化学计量学成为发展趋势。
2.2 偏最小二乘法
Wold作为PLS的创始人,在上世纪70年代创建了非线性迭代偏最小二乘算法,Wold和Albano等在1983年提出了偏最小二乘回归的概念,用来解决计量化学中多因变量与多自变量问题 [26]。现已成为化学计量学中最常用的数据分析方法,在化学测量以及食品检测中得到广泛应用。偏最小二乘法是比较完善的多元分析方法,在建模过程中集中了主成分分析,相关性分析和线性回归分析方法的特点,提供更丰富、深入的信息,并可以通过交叉有效性检验来确定模型的可靠性。偏最小二乘法与主成分分析的不同之点在于分解量测矩阵的同时对响应矩阵也进行正交分解。在植物油识别分析中的应用主要分为两类:一类是测定待测油样中的特征成分的含量来判定是否掺假,Wang Li等 [32]建立了山茶油掺有大豆油含量的偏最小二乘法模型,结果表明所建立模型的相关系数为0.994,预测集的均方根误差为0.667,交叉验证误差为0.81,表明所建立的方法能够很好地识别掺假的山茶油。因此偏最小二乘法在多元混合油的识别技术中有很好的应用前景,Ruiz-Samblas等 [33]以最小标准误和留一法交叉验证为基础建立的偏最小二乘回归模型来预测掺杂橄榄油的百分含量,建立的5 种二元混合油模型的相关系数在0.95~0.99之间。另一类是偏最小二乘法结合判别分析方法(PLS-DA)对不同的油样进行识别。基于TAG色谱-质谱指纹图谱结合偏最小二乘-判别分析对植物油识别技术得了广泛的应用,PLS-DA模型 [34]成功识别橄榄油等级、橄榄油中掺入其他植物油、预测油脂的地理来源,为检测模型的识别能力,进行交叉验证分析。基于甘油酯的偏最小二乘回归在建模的同时实现了数据结构的简化,因此,可以在二维或三维图上对多维数据的特性进行观察,这使得偏最小二乘回归分析的图形功能十分强大。同时可以对所建立的回归模型给予许多更详细深入的实际解释。
2.3 聚类分析
聚类分析是按“物以类聚”的原则,基于相似性或差异性指标,定量地分析样本间的亲疏关系,并对样本进行聚类,是一种非参数统计模式识别,也是食品类别分析中应用较广的模式识别分类方法之一。聚类分析包括系统聚类方法、k-均值聚类法、模糊k-均值聚类方法。这里介绍系统聚类方法,原理是:先将所有样本各自看成一类,选择距离最小的两个并成一个新类,计算两者距离,再重复上述操作,每次减少一类,直至所有的样本都成为一类为止。距离的算法有绝对值距离、欧氏距离、明科夫斯基距离、切比雪夫距离,选择不同的距离,聚类结果会有所差异。在地理分区和分类研究中,往往采用几种距离进行计算对比,选择一种较为合适的距离进行聚类。有研究者 [35-36]基于植物甾醇、酚类物质、脂肪酸、二酰甘油酯、TAG等特征组分浓度基础上,用CA分析,结果显示地理来源相同的橄榄油聚集在一起,不同来源的距离较远,因此可以用于油脂地理分区的研究,距离的算法都是采用欧氏距离。还有使用脂肪酸、甾醇、TAG浓度 [37],通过欧氏距离的CA建立橄榄油品种的系统树状图,能将不同品种的油脂分开。因此,聚类分析在油脂品种和地理来源预测中有很好的应用前景。聚类分析的优点是可以在没有训练集的情况下建立模型直接应用,是一种无监督的模式识别,但是选择合适的算法描绘树状分支图是非常重要的,对于分成多少类,存在的主观性比较强。
2.4 判别分析
判别分析基本思路是采用已知类别的样本建立判别模型和判别据点,然后对未知样本进行识别分析。为检测模型的判别能力,还常用识别率与预测率来分析,识别率是训练集的正确判别率,预测率是测试集的正确判别率,预测率更为重要。判别分析有距离判别分析法、Fisher判别分析法、Beayes判别分析法、逐步判别分析法、线性判别函数法、K-邻域判别法、势函数判别法、人工神经网络等。这里主要介绍线性判别函数法(linear discriminant function,LDA),LDA借用了方差分析和主成分分析的思想,最大化组间方差和最小化组内方差,利用主成分分析对原始变量做线性变换,寻找能将不同类别样品最大分离的几个基于原始变量线性组合的判别函数,建立判别模型,是油脂分类中常用的方法。Jakab等 [38]依据TAG色谱-质谱数据建立了3 种LDA的二维模型,其中最好的模型可以将13 种植物油分类,正确率高达97.6%。LDA在植物油鉴别技术中的应用包括了植物油的分类 [39-40]、橄榄油的来源预测 [41-42]、低价油脂掺入橄榄油的识别 [43]、品种鉴别 [42]。Barreira等 [44]还通过脂肪酸、TAG、酚类化合物的指纹图谱建立LDA模型来预测板栗的品种。LDA是将高维模式的样本投影到最佳鉴别矢量空间,以达到抽取分类信息和压缩特征空间维数的效果,获得空间中最佳的可分离性,因此它是一种有效的特征抽取方法。判别分析是有监督的模式识别,判别函数的选择非常关键,函数个数取决于判别效果,2~3 个为最佳选择,便于肉眼观察。
近年来食用油脂安全受到广大研究者的关注,三酰甘油酯和化学计量学在鉴别食用油中取得了一定的进展,能成功鉴别不同类型、品种、地域以及掺假的油脂,鉴别的依据是三酰甘油酯类别与相对含量的差异,该方法准确性高,但是也存在一定的缺点,三酰甘油酯鉴定技术尚不成熟,尤其是位置异构体的分离与鉴别,此外,还没有建立分析三酰甘油酯的标准方法。因此,完善三酰甘油酯结构的鉴定是未来研究的一个重要方向。
参考文献:
[1] GB 23347—2009 橄榄油、油橄榄果渣油[S].
[2] HOLCAPEKM, JANDERA P, FISCHER J, et al. Analytical monitoring of the production of biodiesel by high-performance liquid chromatography[J]. Journal of Chromatography A, 1999, 858(1): 13-31.
[3] 杨芹, 石先哲, 单圆鸿, 等. 银离子高效液相色谱-质谱法分析血清中甘油三酯类化合物的组成[J]. 色谱, 2006, 30(9): 876-882.
[4] FOLCH J M, LEES G H, STANLEY S. A simple method for the isolation and purification of total lipids from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1): 497-509.
[5] BLIGH E G, DYER W. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology,1959, 37(8): 911-917.
[6] HARA A, RADIN N S. Lipid extraction of tissues with a low-toxicity solvent[J]. Analytical Biochemistry, 1978, 90(1): 420-426.
[7] 张东, 龙伶俐, 薛雅琳. 液质联用分析常见植物油甘油三酯[J]. 粮油食品科技, 2012, 20(6): 33-37.
[8] HERRER C L, RAMALEY L, POTVIN M A, et al. A method for determining regioisomer abundances of polyunsaturated triacylglycerols in omega-3 enriched fish oils using reversed-phase liquid chromatography and triple-stage mass spectrometry[J]. Food Chemistry, 2013, 139(1/4): 655-662.
[9] CVACKA J, HOVORKA O, JIROS P, et al. Analysis of triacylglycerols in fat body of bumblebees by chromatographic methods[J]. Journal of Chromatography A, 2006, 1101(1/2): 226-237.
[10] IWASAKI Y, YASUI M, ISHIKAWA T, et al. Optical resolution of asymmetric triacylglycerols by chiral-phase high-performance liquid chromatography[J]. Journal of Chromatography A, 2001, 905(1/2): 111-118.
[11] DUGO P, KUMM T, CRUPI M L, et al. Comprehensive twodimensional liquid chromatography combined with mass spectrometric detection in the analyses of triacylglycerols in natural lipidic matrixes[J]. Journal of Chromatography A, 2006, 1112(1/2): 269-275.
[12] LISA M, HOLCAPEK M, SOVOVA H. Comparison of various types of stationary phases in non-aqueous reversed-phase high-performance liquid chromatography-mass spectrometry of glycerolipids in blackcurrant oil and its enzymatic hydrolysis mixture[J]. Journal of Chromatography A, 2009, 1216(47): 8371-8377.
[13] KUMAR G, KUMAR D. Monitoring of base catalyzed ethanolysis of Jatropha curcas oil by reversed phase high performance liquid chromatography assisted by ultrasonication[J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 962-967.
[14] VRKOSLAV V, URBANOVA K, HAKOVA M, et al. Analysis of wax esters by silver-ion high-performance liquid chromatographytandem mass spectrometry[J]. Journal of Chromatography A, 2013,1302(32): 105-115.
[15] ACHEAMPONG A, LEVEQUE N, TCHAPLA A, et al. Simple complementary liquid chromatography and mass spectrometry approaches for the characterization of triacylglycerols in Pinus koraiensis seed oil[J]. Journal of Chromatography A, 2011, 1218(31): 5087-5100.
[16] LISA M, NETUSILOVA K, FRANEK L, et al. Characterization of fatty acid and triacylglycerol composition in animal fats using silver-ion and non-aqueous reversed-phase high-performance liquid chromatography/mass spectrometry and gas chromatography/flame ionization detection[J]. Journal of Chromatography A, 2011, 1218(42): 7499-7510.
[17] LISA M, HOLCAPEK M. Characterization of triacylglycerol enantiomers using chiral HPLC/APCI-MS and synthesis of enantiomeric triacylglycerols[J]. Analytical Chemistry, 2013, 85(3): 1852-1860.
[18] REZANKA T, KOLOUCHOVA I, CEJKOVA A, et al. Identification of regioisomers and enantiomers of triacylglycerols in different yeasts using reversed- and chiral-phase LC-MS[J]. Journal of Separation Science, 2013, 36(20): 3310-3320.
[19] ZEB A. Triacylglycerols composition, oxidation and oxidation compounds in camellia oil using liquid chromatography-mass spectrometry[J]. Chemistry and Physics of Lipids, 2012, 165(5): 608-614.
[20] 刘书成, 章超桦, 洪鹏志, 等. 液质联用技术在油脂分析中应用[J].粮食与油脂, 2006(9): 10-13.
[21] 胡珺, 魏芳, 董绪燕. 食用油甘油三酯质谱分析方法的研究进展[J].分析检测学报, 31(6): 749-756.
[22] HOLCAPEK M, DVORAKOVA H, LISA M, et al. Regioisomeric analysis of triacylglycerols using silver-ion liquid chromatographyatmospheric pressure chemical ionization mass spectrometry: comparison of five different mass analyzers[J]. Journal of Chromatography A, 2010, 1217(52): 8186-8194.
[23] 范璐, 周亚利, 霍权恭, 等. 甘三酯-主成分分析识别7种植物油脂的研究[J]. 河南工业大学学报, 2014, 35(1): 1-5.
[24] 朱桃花. 甘油三酯分析结合化学计量学识别5种植物油脂[D]. 郑州:河南工业大学, 2011.
[25] BRANDAO L F, BRAGA J W, SUAREZ P A. Determination of vegetable oils and fats adulterants in diesel oil by high performance liquid chromatography and multivariate methods[J]. Journal of Chromatography A, 2012, 1225(7): 150-156.
[26] 司守奎, 孙玺. 数学建模算法与应用[M]. 北京: 国防工业出版社,2011: 460-542.
[27] WEI Fang, JI Shuxian, HU Na, et al. Online profiling of triacylglycerols in plant oils by two-dimensional liquid chromatography using a single column coupled with atmospheric pressure chemical ionization mass spectrometry[J]. Journal of Chromatography A, 2013,1312(42): 69-79.
[28] LISA M, HOLCAPEK M, BOHAC M. Statistical evaluation of triacylglycerol composition in plant oils based on high-performance liquid chromatography-atmospheric pressure chemical ionization mass spectrometry data[J]. Journal of Agricultural and Food Chemistry,2009, 57(15): 6888-6898.
[29] CERRETANI L, BENDINI A, CARO A D, et al. Preliminary characterisation of virgin olive oils obtained from different cultivars in Sardinia[J]. European Food Research and Technology, 2006, 222(3/4): 354-361.
[30] PARK G R, LEE D S. Detection of adulteration in olive oils using triacylglycerols compositions by high temperature gas chromatography[J]. Bulletin of the Korean Chemical Society, 2003,24(4): 527-529.
[31] 何勇, 李晓丽, 邵咏妮. 基于主成分分析和神经网络的近红外光谱苹果品种鉴别方法研究[J]. 光谱学与光谱分析, 2006, 26(5): 850-852.
[32] WANG Li, LEE F S C, WANG Xiaoru, et al. Feasibility study of quantifying and discriminating soybean oil adulteration in camellia oils by attenuated total reflectance MIR and fiber optic diffuse reflectance NIR[J]. Food Chemistry, 2006, 95(3): 529-536.
[33] RUIZ-SAMBLAS C, MARINI F, CUADROS-RODRIGUEZ L, et al. Quantification of blending of olive oils and edible vegetable oils by triacylglycerol fingerprint gas chromatography and chemometric tools[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2012, 910(22): 71-78.
[34] RUIZ-SAMBLAS C, CUADROS-RODRIGUEZ L, GONZALEACASADO A, et al. Multivariate analysis of HT/GC-(IT)MS chromatographic profiles of triacylglycerol for classification of olive oil varieties[J]. Analytical and Bioanalytical Chemistry, 2011, 399(6): 2093-2102.
[35] OUNI Y, FLAMINI G, YOUSSEF N B, et al. Sterolic composition and triacylglycerols of Oueslati virgin olive oil: comparison among different geographic areas[J]. International Journal of Food Science & Technology, 2011, 46: 1747-1751.
[36] MANAI-DJEBALI H, KRICHENE D, OUNI Y, et al. Chemical profiles of five minor olive oil varieties grown in central Tunisia[J]. Journal of Food Composition and Analysis, 2012, 27(2): 109-119.[37] BRESCIAA M A, ALVITIB G, LIUZZIB V, et al. Chemometric classi☒cation of olive cultivars based on compositional data of oils[J]. American Oil Chemists’ Society, 2003, 80(10): 945-950.
[38] JAKAB A, HEBERGER K, FORGACS E. Comparative analysis of different plant oils by high-performance liquid chromatographyatmospheric pressure chemical ionization mass spectrometry[J]. Journal of Chromatography A, 2002, 976(1/2): 255-264.
[39] LERMA-GARCIA M J, LUSARDI R, CHIAVARO E, et al. Use of triacylglycerol profiles established by high performance liquid chromatography with ultraviolet-visible detection to predict the botanical origin of vegetable oils[J]. Journal of Chromatography A,2011, 1218(42): 7521-7527.
[40] CONCHA-HERRERA V, LERMA-GARCIA M J, HERREROMARTINEZ J M, et al. Classification of vegetable oils according to their botanical origin using amino acid profiles established by high performance liquid chromatography with UV-vis detection: a first approach[J]. Food Chemistry, 2010, 120(1): 149-154.
[41] NAGY K, BONGIORNO D, AVELLONE G, et al. High performance liquid chromatography-mass spectrometry based chemometric characterization of olive oils[J]. Journal of Chromatography A, 2005, 1078(1/2): 90-96.
[42] LERMA-GARCIA M J, SIMO-ALFONSO E F, MENDEZ A, et al. Classification of extra virgin olive oils according to their genetic variety using linear discriminant analysis of sterol profiles established by ultra-performance liquid chromatography with mass spectrometry detection[J]. Food Research International, 2011, 44(1): 103-110.
[43] LERMA-GARCIA M J, RAMIS-RAMOS G, HEERREROMARTINEZ J M, et al. Authentication of extra virgin olive oils by Fourier-transform infrared spectroscopy[J]. Food Chemistry, 2010,118(1): 78-83.
[44] BARREIRA J C, CASAL S, FERRERIRA I C, et al. Chemical characterization of chestnut cultivars from three consecutive years: chemometrics and contribution for authentication[J]. Food and Chemical Toxicology, 2012, 50(7): 2311-2317.
Review on Chemometrics Methods and Triacylglycerols for Authentication of Edible Oils
LIU Youqian
1,2, LIU Xia
1,*, LI Peiwu
2,*, WANG Xiupin
2
(1. Hunan Province Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology, Hunan Agricultural University, Chang sha 410128, China; 2. Quality Inspection and Test Center for Oilseeds Products, Ministry of Agriculture, Oil Crops Research Insti tute, Chinese Academy of Agricultural Sciences, Wuhan 430062, China)
Abstract:The detection technologies for authentication of edible vegetable oils provide an important means for crackdown against fake or adulterated vegetable oils and consequently ensuring people’s health. Triacylglycerols (TAGs) are the main components of vegetable oils, accounting for more than 90% of the total oil composition. Nowadays, the methods used for TAGs detection are mainly based on the evaluation of their acyl chain structure, during which the methyl esterification of fatty acids is performed. However, such methods do not provide information about the precise structures and contents of TAGs. T his article has reviewed the latest studies that have been conducted to develop detection technologies for authenticating edible vegetable oils by TAGs determination and chemometrics analysis of TAGs fingerprints, aiming to provide technical support for ensuring the safety of edible vegetable oils.
Key words:edible vegetable oil; triacylglycerols; chemometrics
中图分类号:S565.9
文献标志码:A
文章编号:1002-6630(2015)03-0234-06
doi:10.7506/spkx1002-6630-201503045
收稿日期:2014-04-23
基金项目:国家现代农业(油菜)产业技术体系建设专项(CARS-13);“十二五”国家科技支撑计划项目(2012BAK08B03);农业部948重点项目(2011-G5;2010-G1)
作者简介:刘优钱(1988—),女,硕士研究生,主要从事食品安全与检测研究。E-mail:liuyouquancz@126.com
*通信作者:刘霞(1976—),女,副教授,博士,主要从事食品分析与生物技术研究。E-mail:liuxiaspr@gmail.com李培武(1961—),男,二级研究员,博士,主要从事农产品质量标准与检测技术研究。E-mail:peiwuli@oilcrops.cn