
图1 主题中包含“Organogels”在Web of Science检索的每年文章数
Fig.1 The annual numbers of articles with the subject including“organogels” on Web of Science
钟金锋,覃小丽*,刘 雄
(西南大学食品科学学院,重庆 400715)
摘 要:本文系统地综述凝胶油的定义、形成和结构以及凝胶油体系中凝胶因子种类、凝胶油研究技术、凝胶油对血浆中游离脂肪酸和甘油三酯影响的研究进展。简要阐述凝胶油的主要优势及其在食品行业的应用。在此基础上,提出未来凝胶油研究中应注意的有关问题。
关键词:凝胶油;凝胶因子;自组装;植物油
随着人们饮食结构的改变,膨 化类、焙烤类、涂抹类等食品所占比例越来越大,我国已成为世界上最大的食品专用油脂(如焙烤专用油、冰激凌 专用油脂)消费国。目前,国内市场上大多数以氢化油为主要成分的人造奶油或涂抹脂产品(涂抹奶油、威化饼干和蛋黄派等)等食品中反式脂肪酸的质量分数(5%~11%)严重超标 [1]。由此可见,我国食品专用油脂的反式脂肪酸问题较为严重。同时,此类产品还含有较多的饱和脂肪酸。研究表明,人们通过饮食过 多摄入反式脂肪酸和 饱和脂肪酸对人体健康产生不利的影 响,如增 加糖尿病、肥胖和心血管 疾病等代谢综合征的风险 [2-3],因此, 联合国粮食与农业组织和世界卫生组织提出 每日摄入的食品中反式脂肪酸和饱和脂肪酸能量应分别低于总能量的1%和10% [4]。食品专用油脂不仅赋予食品独特的风味、良好的口感和造型,而且在食品加工中具有特殊功能特性,例如在焙烤食品中具有涂膜、润滑、起酥等特性。为了满足消费者对健康及美味食品的需求,降低或消除膳食中反式脂肪酸和饱和脂肪酸且不能改变其特殊质地是广大研究者和食品生产商面临的大问题与挑战。因此,积极研发低/零反式脂肪酸和低饱和脂肪酸食品专用油脂具有重要现实意义。近几年来,植物油的凝胶固态化及其技术成为国外研究热点之一。添加小分子有机凝胶因子到植物油中并在一定的加工条件(如加热、冷却)下可使植物油形成类似凝胶状物,这种凝胶状油称为凝胶油。凝胶油具有半固态油脂黏弹性、低反式脂肪酸和饱和脂肪酸等优点,其可广泛应用于食品、医药、日化用品等领域 [5]。近年来,国外对凝胶油的研究较多,而国内的研究少见报道 [6]。本文主要综合分析国外有关文献,对国外凝胶油的研究进展作简要综述。
凝胶油(oleogels或者edible oil organogels)是一种热可逆的黏弹性液体状或固体状的脂类混合物,它由亲脂性液体(一般为植物油)与少量(<10%)的小分子有机凝胶因子组成。这些有机凝胶因子可以通过自组装或者结晶的方式捕集液体油形成多种形态(如带状、纤维状)的结构,继而形成三维网络结构,阻止了亲脂性液体的流动,从而使整个体系凝胶化。凝胶油是一种主要有机凝胶(organogels)。自2005年以来,有机凝胶的研究报道有了较大幅度增加(图1),已成为化学和医学领域的研究热点,并有数篇综述文章发表 [5,7-8]。2011年,Marangoni等 [9]合著的专著Edible Oleogels: Structure and Health Implications问世,标志着凝胶油在食品和医学领域的发展。

图1 主题中包含“Organogels”在Web of Science检索的每年文章数
Fig.1 The annual numbers of articles with the subject including“organogels” on Web of Science
大多数有机凝胶(如凝胶油)为二元体系,其制备方法是将少量的有机凝胶因子在溶剂(如植物油)中加热溶解并搅拌一定时间,再冷却至室温或室温以下。氢键力、静电力等非共价键的弱相互作用是有机凝胶因子使溶剂(植物油)凝胶化的驱动力。在体系温度降低过程中,凝胶因子分子通过这些弱相互作用自组装或一定程度聚集产生晶体的方式形成一维的线状、带状或纤维状等聚集体,继而这些聚集体通过相互缠绕形成一个三维的网络结构,阻止了溶剂(油脂)分子的流动,从而使整个体系呈凝胶化状态(图2)。在工业化生产有机凝胶中,在冷却过程中有机凝胶因子的结晶是在非等温条件下进行。有机凝胶因子的结晶行为和结构对热和传质条件是非常敏感的,其成核行为尤其重要,它影响晶体结构特征(如晶粒的数目、大小和形态学、空间分布),从而影响体系机械强度和溶剂(油脂)结合能力 [10]。凝胶油的性能(如硬度)取决于有机凝胶因子种类及浓度、制备过程、冷却速度、保存时间和保存温度等多种因素。凝胶油应满足两个大方面的要求:1)在流变学上,在一定条件下,当应力解除后,凝胶油体系可以恢复原来的形状;2)在结构上,凝胶油体系表现类似于固体,但在显微镜下依然是绝大部分由液体组成。
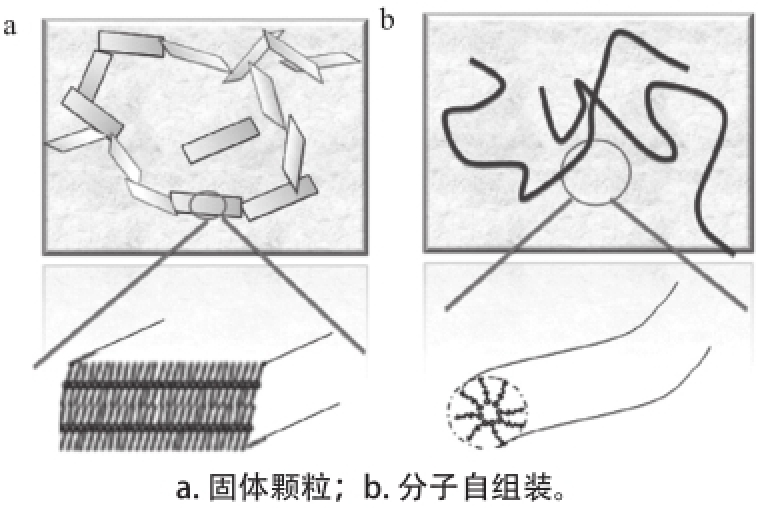
图2 凝胶因子的网络结构
[88]
Fig.2 Network structures of organogelators
[8]
3.1 凝胶因子的种类
由于小分子易于聚集而自发地组装,所以目前有机凝胶因子的研究主要限于小分子有机化合物。有机凝胶因子(organogelators)是一类具有两亲性的低分子质量分子(<3 kD),通过分子间氢键力、范德华力等非共价键的相互作用在合适的溶剂中自发地聚集,组装成有序的线状、片状或纤维等形貌,接着这些聚集体通过相互缠结进一步形 成三维网络结构,使整个体系凝胶化。凝胶因子的凝胶能力被认为是凝胶因子与溶剂的结晶化与溶解的平衡。一种凝胶剂分子在溶剂中必须是相对不溶的,以便它能结晶或自组装而形成中尺度结构。一般而言,大多数凝胶因子形成不对称中尺度结构。如果凝胶因子不溶于一种给定的溶剂,则不能与该溶剂发生相互作用而直接形成沉淀物,而不是凝胶。反之,若凝胶因子易溶于相应的溶剂,然后溶液被代替形成凝胶。每种凝胶因子均有使相应溶剂凝胶化的最低浓度,也称临界凝胶质量分数。临界凝胶质量分数随 着凝胶因子种类和所用溶剂的不同而改变。临界凝胶因子越低说明该凝胶因子形成凝胶能力越强,大多数的凝胶因子的最小质量分数较低(<2%)。
凝胶因子作为凝胶油中关键组成部分,除了油脂本身脂肪酸组成之外,其结构直接影响凝胶油的性能。凝胶因子通常是被偶然、意外发现或由已知凝胶因子衍生得到。基于目前对凝胶因子在溶剂中的凝胶机理尚未完全清楚,对于设计新型凝胶因子分子还存在一定难度。因此,凝胶油商业化应用目前面临的关键挑战是新的有机凝胶因子的发现,特别是食品级的有机凝胶因子。据文献报道,用于制备凝胶油的凝胶因子主要有:长碳链饱和脂肪酸、饱和脂肪醇以及它们的混合物 [11]、羟基化脂肪酸 [12]、卵磷脂和糖醇酯(三硬脂酸山梨糖醇酯)的混合物 [13]、卵磷脂与类胡萝卜素的混合物 [14]、植物化学成分(甾醇和谷维素) [15]、生物蜡和蜡酯 [16]、单甘酯 [17],以及高分子质量的乙基纤维素 [18]。下面对近年文献常见的有机凝胶剂进行详细介绍。
3.1.1 羟基化脂肪酸
羟基化脂肪酸是目前最有效的有机凝胶因子之一。12-羟基硬脂酸和12-羟基蓖油酸是常见的羟基化脂肪酸凝胶因子。12-羟基硬脂酸可以从完全氢化蓖麻油中获得,而12-羟基蓖油酸可以从部分氢化蓖麻油中分离出来。早在1946年,12-羟基硬脂酸的锂盐就开始应用于润滑油工业 [19]。从某种意义上说,凝胶因子的研究也由此引发。12-羟基硬脂酸的成晶核过程需要高度特异性相互作用以诱导其一维结构生长,这种一维结构生长能促使“晶体状”纤维形成 [10];12-羟基硬脂酸分子之间通过非共价键(如氢键力、范德华力、π-π堆砌)相互作用聚合形成纤维状初级结构,并进一步形成三维网络结构,限制溶剂分子的流动而最终形成凝胶。由于12-羟基脂肪酸在油相中形成细小而长的纤维状晶体,在大部分食品体系需要剪切或搅拌的条件下,其形成的纤维状网络容易被破坏且不可恢复,从而不能保持其凝胶能力最终导致液体油的溢流损失 [20]。此外,12-羟基硬脂酸是一种刺激物,具有缓泻作用,因此不能作为食品级添加剂。然而,由于其成本低和能有效率地将溶剂分子凝胶化,12-羟基硬脂酸是研究凝胶油的宏观性质的理想化合物。Rogers等 [10,12]研究了12-羟基硬脂酸在植物油中非等温成核和结晶行为及其自组装网络的晶体稳定性,为其他凝胶因子在凝胶油制备过程中各因素的动态变化对凝胶油宏观性质的影响等研究提供了有益参考和指导。
3.1.2 植物甾醇与甾醇酯混合物
植物甾醇和甾醇酯天然存在于米糠油和多种植物油中。研究 [21]证实,植物甾醇(酯)能降低血清低密度脂蛋白水平,从而减少心血管疾病的发生,已被作为营 养剂添加到某些脂肪产品中,例如添加到人造黄油和植物油中。植物甾醇(酯)作为食品级凝胶剂,添加的质量分数占植物油的比例<10%。需要注意的是,单独使用植物甾醇或甾醇酯并不能使油脂凝胶化,并且不是所有甾醇(酯)均能使植物油形成凝胶。研究表明,环状结构C3位上含有羟基和B环有/无双键的甾醇(如胆固醇)与一定比例的γ-谷维素混合能使植物油形成透明而坚固的凝胶,而环状结构中无羟基或含有共轭双键的甾醇(如5α-胆甾烷和麦角固醇)与γ-谷维素混合则没有凝胶能力;此外,D环中C17位连接的烷基对植物甾醇(酯)的凝胶能力没有明显影响 [15]。与其他凝胶剂不同的是,γ-谷维素和β-谷甾醇在冷却过程中不能立即使植物油凝胶化,但通过机械搅 拌(如剪切)可以促进凝胶的形成。Bot等 [22]以γ-谷维素和β-谷甾醇的混合物为凝胶剂制得葵花籽油凝胶,并采用小角X射线散射研究了其中微观结构,结果表明β-谷甾醇自组装形成直径约为7.2 nm的纳米级中空管,这些小管的聚集和相互作用形成的空间填充网络使植物油固定在其中;当γ-谷维素的比例增加时,中空管状结构聚集减少,形成的油凝胶更透明。在分子水平,γ-谷维素和β-谷甾醇的甾醇单元分别位于结构的一端,而γ-谷维素的阿魏酸位于结构的伸出部位,这两种分子间的羟基通过氢键作用形成轻微的楔形结构为弯曲的超分子结构留下空间,这些超分子结构可形成薄纤维状结构,从而观察到透明的油凝胶 [23]。虽然植物甾醇既具有降低胆固醇等生理功效又是凝胶剂成分之一,但其应用在食品体系中将受到一定限制。例如,在含有水分的食品(如肉糜制品)中,γ-谷维 素和β-谷甾醇的凝胶能力严重受到水分的影响 [24],从而影响凝胶能力,因此这些植物甾醇更适合应用于非常单一的体系而不是复杂食品体系。
3.1.3 生物蜡
生物蜡广泛存在于自然界一切有生命的动植物(如鲸蜡、蜂蜡、棕榈蜡、亚麻蜡)中,在食品、化妆品和制药工业有着广泛的应用前景。植物蜡包含长链脂肪酸和长链脂肪族醇的酯,是容易大规模获取的一种生物蜡。棕榈蜡和小烛 树蜡是常见的食品添加剂,也常用于化妆品行业,但其作为凝胶剂的研究仍处于起步阶段。2007年,Toro-Vazquez等 [16]首次报道小烛树蜡作为凝胶剂能使植物油凝胶化,并考察了时间-温度条件对形成油凝胶的影响;结果表明含有3%小烛树蜡的凝胶油在室温下放置3 个月内无相分离现象。小烛树蜡是由49%~50%的C29~C33烷类,20%~29%高分子质量的脂肪酸醇酯(C28~C34),12%~14%的醇类和甾醇和7%~9%的游离酸组成。Toro-Vazquez所在研究团队 [25]进一步比较研究分别以小烛树蜡和其中一种主要成分(正三十二烷)为凝胶剂制备凝胶油的热机械性能,结果表明两者均能使红花油凝胶化;小烛树蜡中其他组分对正三十二烷的结晶习性有着深远影响,进而影响凝胶的物理性质。此外,植物油中高熔点物质(如三棕榈酸甘油酯)与凝胶剂小烛树 蜡在冷却过程的共结晶可能是一种不错的选择以获得具有特定理化性质(如熔点、质地)的凝胶油 [26]。
米糠蜡是米糠毛油在精炼过程脱蜡步骤中分离出来的一种天然植物蜡。米糠蜡因其廉价在化妆品、医药、食品等行业具有潜在应用。米糠蜡是以偶数碳链脂肪酸(C16~C32)与脂肪醇(C24~C38)的酯化形式存在,熔点范围在78~81 ℃,因此容易在室温中结晶。Dassanayake等 [27]分别以米糠蜡和小烛树蜡制备凝胶油,并比较了两种凝胶油的物理性质;通过直接目测观察和黏度与温度之间关系发现米糠蜡使植物油凝胶化的速度最快,所得的油凝胶的硬度也较大。造成这两种凝胶油硬度差异的主要原因可能是米糠蜡在凝胶油中呈现针状晶体,粒径在20~50 μm,其能有效地将液体油包封在这些晶体矩阵中,而小烛树蜡的晶体非常细小(<10 μm)因而不能有效地将液体油封锁在其晶体网络中。
除了小烛树蜡、棕榈蜡、米糠蜡,从向日葵提取的向日葵蜡也能使植物油凝胶化。研究表明,小烛树蜡、棕榈蜡、米糠蜡和向日葵蜡使植物油凝胶化的临界质量分数分别为4%、2%、1%和1%,这意味着,在相同质量分数下向日葵的凝胶能力与米糠蜡的相当,优于小烛树蜡和棕榈蜡 [28]。一方面,从它们形成的晶体大小角度看,相比之下,向日葵蜡在凝胶油中形成的晶体粒径最大(>100 μm),允许每个晶体链连接成更多结晶区,使得凝胶网络得到增强。另一方面,生物蜡的纯度或其中非主要成分物质对蜡的晶体尺寸、形态以及油的凝胶化效果有一定影响。向日葵蜡含杂质少,纯度最高(>97%酯类),其次是米糠蜡(90%~97%酯类),然后是棕榈蜡(84%~85%酯类)和小烛树蜡(27%~35%酯类);生物蜡中的酯类含量是增强凝胶效果的主要贡献。
3.1.4 山梨糖酯和卵磷脂
Murdan等 [29]研究表明在凝胶化温度时,表面活性剂分子(单硬脂酸山梨醇酯,单软脂酸山梨醇酯)在植物油中发生自我 组装成囊泡,进一步冷却后囊泡转化成棒状细管,最终形成不透明的三维网络而坚固的凝胶油,所得的凝胶油的熔点约为40 ℃,是热可逆的。然而,山梨醇结构上的3 个羟基均被酯化成的三硬脂酸山梨醇酯并不能使植物油凝胶化。若在含有三硬脂酸山梨醇酯的植物油中添加一定比例的卵磷脂,卵磷脂可促使三硬脂酸山梨醇酯在植物油中形成细小的针状晶体,并影响三硬 脂酸山梨醇酯晶体形态 [30]。由于三硬脂酸山梨醇酯和卵磷脂使油凝固和融化的温度(约为15 ℃)远低于室温(25 ℃),因此,在一定程度上其在某些食品中的应用受到了限制。
3.1.5 脂肪酸和脂肪醇
脂肪酸和脂肪醇的熔点随着烷基碳链长度增加而增加。Gandolfo等 [11]考察一系列脂肪酸和脂肪醇(C16~C22)对植物油凝胶化的效果,结果显示了添加质量分数为2%的脂肪醇或脂肪酸均能使葵花籽油凝胶化,而且在相同质量浓度的凝胶剂(>C16)下,以脂肪醇为凝胶剂的凝胶油的硬度大于相同碳原子数的脂肪酸;基于此,5%的脂肪酸与脂肪醇混合物(7:3或3:7)也能使葵花籽油形成凝胶,研究发现在20 ℃时硬脂酸与十八醇的协同效应最为明显,分散的凝胶剂开始彼此相互作用,随着温度继续降低,晶体不断形成及凝胶体系的硬度也随之增加。虽然长碳链饱和脂肪酸和脂肪为凝胶剂可 制得凝胶油,但是过多摄入含有较多长碳链饱和脂肪酸的凝胶油对人们身体健康也会产生一定的负面影响。
3.1.6 乙基纤维素
乙基纤维素是纤维素链中部分羟基通过合适修饰手段被乙氧基取代的纤维素衍生物。乙基纤维素是易批量获得、应用最广泛的纤维素衍生物之一,例如在药剂中可用作薄膜包衣材料、片剂黏合剂等多种用途。以乙基纤维素为凝胶因子制备凝胶油时,为发挥其凝胶能力,需要将含有乙基纤维素的油脂加热到其玻璃化温度(约为130 ℃)以上,同时通常加入表面活性剂以辅助其溶解 [31];在随后的冷却过程,乙基纤维素分子间以范德华力和氢键等相互作用力形成聚合物网络,液体油因此被聚合物网络封在其中。然而,在油相加热溶解乙基纤维素 时,需要重视由加热温度及维持时间而引起的油的氧化、乙基纤维素、表面活性剂的降解问题。
乙基纤维素的类型(包括纤维素取代度、黏度和分子质量)对凝胶油的流体性质有显著影响。在添加相同质量浓度的乙基纤维素时,由黏度大的乙基纤维素(0.3 Pa·s)为凝胶因子制得的凝胶油的储能模量(弹性参数)是黏度小的乙基纤维素(0.01 Pa·s )制得的凝胶油的储能模量的2.5 倍 [32]。此外,用于辅助乙基纤维素溶解于油相的表面活性剂的种类也影响凝胶油的黏弹性。如前面提到的单硬脂酸山梨醇酯本身也是一种凝胶因子,因此在其他相同条件下含有乙基纤维素和单硬脂酸山梨醇酯的凝胶油具有较高的储能模量,是含有乙基纤维素和甘油单油酸酯的凝胶油的储能模量值的100 倍 [33];即使对于同种类的表面活性剂,其分子中疏水基团的饱和度也影响凝胶油的弹性,例如,以吐温-60和乙基纤维素制成的凝胶油比吐温-80和乙基纤维素制成的凝胶油的储能模量值大。
3.2 凝胶油对血浆中游离脂肪酸和甘油三酯的影响
与起酥油和人造奶油相比,凝胶油具有低饱和脂肪酸和低反式脂肪酸等突出优点。这种具有涂抹等性能的低反式脂肪酸和低饱和脂肪酸的凝胶化油脂应用到相关食品产品中能满足人们对更健康、更安全食品的需求。目前,关于凝胶油及含凝胶油相关食品对体内血脂参数的影响研究较少。Stortz等 [34]进行了一项临床实验,报道了以12-羟基硬脂酸为凝胶因子制得的凝胶油与奶油、人造奶油有相似的功能特性,可作为涂抹脂;并对比考察了凝胶化菜籽油、奶油、人造奶油和菜籽油对12 位健康的年轻人餐后血清中游离脂肪酸和甘油三酯的影响;结果表明,凝胶化菜籽油和天然菜籽油能显著降低血清中甘油三酯和游离脂肪酸含量。由此可见,凝胶油与固态脂肪表现出类似的机械性能,却给予不同样的餐后血脂响应。一项类似研究 [35]考察了O/W型乳剂(分散相由为以植物甾醇为凝胶剂的凝胶油组成)在体外模拟十二指肠环境中的消化情况,结果显示甘油三酯的脂肪分解减少;可能原因是油的凝胶化阻碍了甘油三酯扩散到脂滴表面,因而甘油三酯不受脂滴表面的脂肪酶所水解,从而脂质的消化受到影响。另一可能的原因是甘油三酯嵌入到由凝胶剂(β-甾醇)形成的管状网络中从而免受到脂肪酶的作用,因此 不会轻易发生水解。第三种可能性是肠腔内脂肪酶容易吸附到由植物甾醇凝胶分子形成的具有疏水性的管状网络上,导致脂肪酶的活性受到抑制而不能有效水解甘油三酯。目前仍没有进一步研究支持或确定甘油三酯水解减少的某一种可能 性,关于凝胶油对体内血脂等参数的作用机制的相关研究仍有待加强。
3.3 凝胶油的研究技术
3.3.1 力学性能
凝胶化植物油应 用到食品中应具有一定的力学性能,如硬度、黏弹性。凝胶的三级结构主要决定凝胶油的宏观性质,可用较精密的质构仪测定,并对凝胶油的物性概念做出数据化的表达,所得数据常用于评价不同结构凝胶因子之间的凝胶效果以及根据给定的凝胶的弹性和强度来评测其潜在的实际应用价值。Gandolfo等 [11]采用配备圆柱形探头的TA-XT2i质构仪测定一系列高级偶碳链脂肪醇( C 16~C22)和一系列偶碳链脂肪酸(C16~C22) 在不同质量分数(1.5%~11%)下制得植物油凝胶的硬度以及不同贮存温度对凝胶硬度的影响,通过硬度指标数据来确定每种凝胶因子的凝胶化的浓度和 以及评价相同浓度下不同凝胶因子的凝胶能力。Pernetti等 [13]考察了两种凝胶因子(卵磷脂和三硬脂酸山梨糖醇酯)的混合比例对凝胶化植物油硬度的影响,结果显示,凝胶的最大硬度与凝胶剂的添加量并不成正比,随着凝胶剂含量的继续增加,凝胶硬度反而降低,可能原因是过多的三硬脂酸山梨糖醇酯在植物油中溶解。然而,质构仪不适宜分析凝胶的微观结构,无法给出凝胶因子自组织(一级结构)方面的信息。
流变学特性也可用于评价凝胶油在贮存期间微结构的稳定性。研究流变学特性随着时间和温度的变化信息有助于鉴别凝胶网络结构(三级结构)的重结晶或重组现象。还可以通过相关变量(如弹性模量和黏性模量)与施加应力、温度、凝胶因子的浓度等作图,可以得到凝胶体系的一些特性 [36]。
3.3.2 热力学性质
凝胶油的热性能可提供温度稳定性和熔点的信息。流变学数据可以创建相图,它有助于理解所涉及过程中的动力和热力学性质,如在结晶或凝胶化开始的熔化焓和活化能。
凝胶达到一定硬度、强度所需要的固体含量是衡量凝胶剂的凝胶效果的一种指标,并能部分反映凝胶油的微观结构。热力学方法,主要是差示扫描量热法(differential scanning calorimetry,DSC)可以得到凝胶的相变温度和熔化焓,通常用于检测脂肪固体含量的手段。然而,DSC所得的凝胶油的熔化峰在一般情况下较宽,甚至会消失。由于所需凝胶油样品量少以及存在同质多晶现象,特别是在较低凝胶因子浓度的凝胶油情况下,因此,DSC不适宜测量其非常缓慢的过程。此外,核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)也是一种非常有用的技术以获得凝胶熔点的信息,如确定凝胶体系的相转变温度。值得注意的是,NMR检测的凝胶体系的微观结构变化,而前面提到的流变学技术检测的是三级结构的变化,所以由其测得的相转变温度与流变学方法测得的数值经常存在一定差异。
3.3.3 凝胶机理的阐释
油脂固体在分子水平上存在无定形,单晶或多晶的性质,这些性质可用偏振光显微镜检测。通过显微镜,可观察凝胶体系中晶体的形貌(形状、长度、分布),所得的晶体形貌信息可以提供分子的排序和晶体优先生长方向的信息。然而,晶体的形状不足以解释凝胶的质地,为了更好地了解在显微结构下观察到凝胶固体的性质,可以采用光谱技术观察凝胶体系中晶体晶型。同质而不同晶型的油脂赋予凝胶油不同的物理特性。虽然DSC、NMR和红外辐射光谱(infrared radiation spectroscopy,IR)可以用于识别晶体形态,但是仅限于已知的特定凝胶体系 [30]。X射线粉末衍射(X-ray powder diffraction,XRPD)是确定胶体系中晶体结构或形态的最合适的方法。当凝胶体系中含有多种凝胶因子时,X射线衍射(XRD)数据可解释混合晶体是否是产生协同作用 [37]或单一凝胶因子的晶体颗粒 [13]。另外,通过比较凝胶与各种晶体的XRPD图谱也可以反映凝胶中分子的堆积方式。XRD也可检测晶体颗粒的分子堆积方式,但要求晶体结构为单晶。
通过上述各种技术手段的结果可以获得凝胶体系中分子一级结构的信息,对凝胶结构的原子级别的解析存在一定困难性,因为凝胶油本身存在固有的无序性。但仍然可以综合这些技术手段的结果通过建立数学模型的方法模拟得到凝胶中凝胶因子的分子自组装的聚集模型。
3.4 凝胶油在食品行业中的应用
近年来,凝胶油的研究受到了广泛关注,其应用于食品、医药和化妆品等工业价值来源归结于以下主要的优势:1)油的凝胶化可限制油相的流动和迁移;2)因饱和脂肪和反式脂肪酸含量较低且具有一定的塑性,凝胶油可替代人造奶油、起酥油和涂抹脂;3)以油相为溶剂,可包载营养素、药物,并控制营养药物释放速率能力;4)由于低分子质量有机凝胶因子具有双亲性,可在油相中同时固定少量的水分子从而增强凝胶化乳液的稳定性。下面就凝胶油在食品领域的应用作简单介绍。
3.4.1 用于生产人造奶油和起酥油
Stortz等 [34]以复合凝胶剂(2%单硬脂酸山梨醇酯和6%乙基纤维素)与菜籽油或高油酸葵花籽油在140 ℃加热混合均匀,然后冷却到60 ℃后与氢化棕榈油质量比例混合(3:2),最终得到新型人造奶油,结果表明,新型人造奶油 的 漏油率低于以液体油制得的传统奶油;此外,Stortz等还添加质量分数为3%或5%的乙基纤维素制得的凝胶油作为新型起酥油应用于饼干制作,结果表明凝胶油在饼干产品中的漏出率较低,同时饼干中饱和脂肪酸含量低。由此推测,凝胶油是一种有效地减缓或阻止油脂迁移的奶油类产品,有利于延长产品货架期,同时改善了油脂脂肪酸组成。另一研究者 [38]调查了以单甘酯、甘油二酯和聚山梨醇酯-80为乳化剂,由10%米糠蜡和90%高油酸葵花籽油构成的凝胶油代替固体脂肪应用于冰淇淋制作,采用低温扫描式电子显微镜法、差示扫描量热法和透射电子显微镜法评测冰激淋的形成结构,结果显示,与液体油为脂肪来源的冰激淋样品相比,含有凝胶油的冰激淋具有良好的口感和形状,但在熔化过程中该凝胶油未能发展充分的结构以维持冰激淋的形状;另外,微观结构和超微结构研究表明该凝胶油在冰淇淋中能很好的乳化,诱导脂肪球网的形成,这表明进一步研究影响凝胶油结构的因素及优化其凝胶结构有望将米糠蜡凝胶油成功地应用到冰激淋产品中。
3.4.2 应用于糖果产品
在糖果产品中,脂肪迁移是经常发生的。例如,巧克力夹心糖果中夹心所用的油脂熔点较低,在不适宜的贮藏温度下,夹心中的油脂会迁移到整个糖果表面,使表面发花(fat bloom),从而影响了糖果的质感和质量 [39]。为了维持这种类型糖食品的存贮质量,防止油脂迁移是至关重要的。目前,虽然有许多方法被用来减缓糖果产品的油迁移,但有效的或实际的解决方案未见报道。防止糖果产品中油脂迁移的有效方法是对倾向于迁移的低熔点油进行凝胶化 [5,40]。虽然,目前关于凝胶油应用到巧克力糖果制品的研究报道几乎处于空白,但是从理论角度,通过固定液体油于凝胶网络中食品基质中油脂分子的移动和迁移将大大的降低,因油脂迁移而导致的糖果表面产生的表花的速度也将减缓。
3.4.3 应用于肉糜制品
肉糜制品中的油脂可以提供良好的质地和风味,肉糜制品通常含有40%以下的油脂。由于消费者对健康的产品需求不断增长,改变其脂肪酸组成的相关研究成为研究重点之一。凝胶化的植物油中保持所使用的植物油的脂肪酸组成,同时拥有一种固体状的结构,随着凝胶油的研究不断深入,将凝胶油应用到肉糜制品的制作中,既能维持肉糜制品中脂肪的功能性作用,又不增加其饱和脂肪酸含量。Zetzl等 [18]研究凝胶化菜籽油(乙基纤维素质量分数占10%)代替含有高含量饱和脂肪酸的动物脂肪应用到法兰克福香肠的可行性,结果显示,含凝胶油的法兰克福香肠的咀嚼性和硬度与含牛脂的法兰克福香肠对照品的没有显著差异。Wood [41]系统地研究了凝胶菜籽油(以乙基纤维素为凝胶剂和单硬脂酸山梨糖酯为塑化剂)作为牛肉法兰克福香肠和猪肉早餐香肠的脂肪来源,结果显示,含有凝胶油的香肠的黏结性、咀嚼性、黏性值与含油脂香肠的相似(P<0.05)。
3.4.4 应用于酱制品
花生酱富含蛋白质、脂肪、纤维素等各种营养成分,是深受广大消费者喜爱的营养食品。然而,花生酱在存放期 间极容易出现表面析出油层,底层结块显现(即油酱分离),从而严重影响了花生酱的产品质量和贮藏性。这成为我国花生酱生产一直滞后的主要技术问题之一。国内对花生酱的稳定性的研究中,主要是通过合适的生产工艺和合适的稳定剂来提高花生酱在贮存过程中稳定性 [42-43]。然而,花生酱配方中常含有一定比例的人造奶油。理论上,用凝胶植物油部分替代人造奶油,花生酱的稳定性得到提高,同时减少了人们对其中饱和脂肪酸和反式脂肪酸的摄入。早在1972年,Elliger等 [44]将添加12-羟基硬脂酸到花生酱中,结果表明12-羟基硬脂酸能使酱中的花生油增稠和凝胶化,凝胶油的添加有效降低了花生酱的油移动食品基质的分层。
目前,油脂中反式脂肪酸和饱和脂肪酸已经得到了世界各国普遍的关注。过多摄入含反式脂肪酸和不饱和脂肪酸的食品对人体健康不利。众多研究报道关于饮食中反式脂肪酸与疾病关系的问题促使科学家和生产商开始努力降低食物中反式脂肪酸含量,竞相开发低反式脂肪酸或零反式脂肪酸起酥油人造奶油等塑性脂肪。凝胶油是一种新型的塑性脂肪,在食品和医药等行业展现了潜在的应用前景和潜力。随着日后研究的不断深入其必将被更为广泛地应用于食品、日化品和医药等领域。然而,更多的研究工作将需要开发这项技术转化为可销售的消费产品。首先,既实用而经济的食品级有机凝胶剂的不断发现。目前,可用于食品体系中的有机凝胶剂是γ-谷维素与β-谷甾醇的混合物 [15],但其对复杂食品体系又非常敏感而影响其凝胶能力。寻找合适的凝胶剂是获得特定功能化凝胶油理化性质的关键。由于凝胶因子在溶剂中键合相互作用和网络结构形成和的复杂性,有机凝胶因子的设计或预测油一定难度。随着有机凝胶网络的形成和结构的基础研究不断深入和对这些复杂体系的逐步理解,应用于植物油的凝胶因子可能被不断发现。在凝胶油体系中,生物蜡,糖酯和脂肪酸中脂肪酸残基常常是高级脂肪酸残基,它们不能提供额外的营养价值。2013年,Jadhav等 [45]采用较低质量浓度(<3 g/100 mL)的新型的低热量糖醇酯类凝胶剂(二辛酸甘露醇酯和二辛酸山梨糖醇酯)使多种植物油(菜籽油、大豆油和葡萄籽油)凝胶化,结果显示合成的糖醇酯具有较高的细胞活性(50 μg/mL),它们在植物油中能形成纳米级多层结构进而形成连续网络结构。该研究为开发功能和健康化凝胶剂提供了有益参考。因此,不断发现无毒、有效和健康营养化的食用级凝胶剂是今后研究的重点。今后凝胶油在食品和医药等领域的应用前景更加广阔。
其次,目前主要考察的是凝胶因子在简单体系(植物油)中的凝胶能力,这些研究结果未能充分确定凝胶油成功地应用在食品体系。需综合运用各种分析技术进一步探索、监测凝胶油在不同的复杂食品系统的流动和迁移情况以及优化凝胶因子在复杂体系中的网络结构,这为凝胶油广泛应用于复杂的食品体系提供更详实参考和实践支持。另外,初步的研究表明,与人造奶油等塑性脂肪相比,凝胶油可能会降低患心血管疾病的一些的风险,但这种潜在的健康益处必须通过更详细地研究才得出结论。例如,进行长期的饮食干预实验,在几个月的时间内监测一定数量参与者的心血管疾病风险的指标。
参考文献:
[1] 傅红赵, 杨琳, 李珍, 等. 中国市售食品中反式脂肪酸含量的现状研究[J]. 中国食品学报, 2010, 10(4): 48-54.
[2] MOZAFFARIAN D, KATAN M B, ALBERTO A, et al. Trans fatty acids and cardiovascular disease[J]. New England Journal of Medicine,2006, 354(15): 1601-1613.
[3] MENSINK R P, KATAN M B. Effect of dietary trans fatty acids on high-density and low-density lipoprotein cholesterol levels in healthy subjects[J]. New England Journal of Medicine, 1990, 323(7): 439-445.
[4] NISHIDA C, UAUY R, KUMANYIKA S, et al. The joint WHO/FAO Expert Consultation on diet, nutrition and the prevention of chronic diseases: process, product and policy implications[J]. Public Health Nutrition, 2004, 7(1A): 245-250.
[5] HUGHES N E, MARANGONI A G, WRIGHT A J, et al. Potential food applications of edible oil organogels[J]. Trends in Food Science & Technology, 2009, 20(10): 470-480.
[6] 朱小勇, 孟宗, 李进伟, 等. 凝胶剂种类对凝胶油物性及结晶形态的影响[J]. 中国粮油学报, 2013, 28(10): 37-44.
[7] VINTILOIU A, LEROUX J C. Organogels and their use in drug delivery: a review[J]. Journal of Controlled Release, 2008, 125(3): 179-192.
[8] DASSANAYAKE L S K, KODALI D R, UENO S. Formation of oleogels based on edible lipid materials[J]. Current Opinion in Colloid & Interface Science, 2011, 16(5): 432-439.
[9] MARANGONI A G, GARTI G N. Edible oleogels: structure and health implications[M]. Champaign, IL: AOCS Press, 2011.
[10] ROGERS M A, MARANGONI A G. Non-isothermal nucleation and crystallization of 12-hydroxystearic acid in vegetable oils[J]. Crystal Growth & Design, 2008, 8(12): 4596-4601.
[11] GANDOLFO F G, BOT A, FL☒TER E. Structuring of edible oils by long-chain FA, fatty alcohols, and their mixtures[J]. Journal of the American Oil Chemists’ Society, 2004, 81(1): 1-6.
[12] ROGERS M A, WRIGHT A J, MARANGONI A G. Crystalline stability of self-assembled fibrillar networks of 12-hydroxystearic acid in edible oils[J]. Food Research International, 2008, 41(10): 1026-1034.
[13] PERNETTI M, VANMALSSEN K, KALNIN D, et al. Structuring edible oil with lecithin and sorbitan tri-stearate[J]. Food Hydrocolloid,2007, 21(5): 855-861.
[14] NIKIFORIDIS C V, SCHOLTEN E. Self-assemblies of lecithin and α-tocopherol as gelators of lipid material[J]. RSC Advances, 2014,4(5): 2466-2473.
[15] BOT A, AGTEROF W G M. Structuring of edible oils by mixtures of γ-oryzanol with β-sitosterol or related phytosterols[J]. Journal of the American Oil Chemists’ Society, 2006, 83(6): 513-521.
[16] TORO-VAZQUEZ J F, MORALES-RUEDA J A, DIBILDOXALVARADO E, et al. Thermal and textural properties of organogels developed by candelilla wax in safflower oil[J]. Journal of the American Oil Chemists’ Society, 2007, 84(11): 989-1000.
[17] MENG Zong, YANG Lijun, GENG Wenxin, et al. Kinetic study on the isothermal and nonisothermal crystallization of monoglyceride organogels[J]. The Scientific World Journal, 2014, http://dx.doi. org/10.1155/2014/149753.
[18] ZETZL A K, MARANGONI A G, BARBUT S. Mechanical properties of ethylcellulose oleogels and their potential for saturated fat reduction in frankfurters[J]. Food & Function, 2012, 3(3): 327-337.
[19] FRASER H M. Production of lubricants: America, US2397956[P]. 1946-04-09.
[20] ZETZL A K. Structured emulsions and edible oleogels as solutions to trans fat[D]. Guelph: University of Guelph, 2013.
[21] KATAN M B, GRUNDY S M, JONES P, et al. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol[C]// Mayo Clinic Proceedings. Amsterdam, Netherlands: Elsevier, 2003,78(8): 965-978.
[22] BOT A, den ADEL R, ROIJERS E C. Fibrils of γ-oryzanol + β-sitosterol in edible oil organogels[J]. Journal of the American Oil Chemists’ Society, 2008, 85(12): 1127-1134.
[23] BOT A, VELDHUIZEN Y S J, den ADEL R, et al. Non-TAG structuring of edible oils and emulsions[J]. Food Hydrocolloid, 2009,23(4): 1184-1189.
[24] BOT A, FL☒TER E. Edible oil oleogels based on self-assembled,β-sitosterol and γ-oryzanol tubules[M]//MARANGONI A G, GARTI N. Edible oleogels: structure and health implications. Urbana: AOCS Press, 2011: 49-80.
[25] MORALES-RUEDA J A, DIBILDOX-ALVARADO E, CHARALONSO M A, et al. Thermo-mechanical properties of candelilla wax and dotriacontane organogels in safflower oil[J]. European Journal of Lipid Science and Technology, 2009, 111(2): 207-215.
[26] TORO-VAZQUEZ J F, ALONZO-MACIAS M, DIBILDOXALVARADO E, et al. The effect of tripalmitin crystallization on the thermomechanical properties of candelilla wax organogels[J]. Food Biophysics, 2009, 4(3): 199-212.
[27] DASSANAYAKE L S K, KODALI D R, UENO S, et al. Physical properties of rice bran wax in bulk and organogels[J]. Journal of the American Oil Chemists’ Society, 2009, 86(12): 1163-1173.
[28] BLAKE A I, CO E D, MARANGONI A G. Structure and physical properties of plant wax crystal networks and their relationship to oil binding capacity[J]. Journal of the American Oil Chemists’ Society,2014, doi:10.1007/s11746-014-2435-0.
[29] MURDAN S, GREGORIADIS G, FLORENCE A T. Novel sorbitan monostearate organogels[J]. Journal of Pharmaceutical Sciences, 1999,88(6): 608-614.
[30] PERNETTI M, van MALSSEN K F, FL☒TER E, et al. Structuring of edible oils by alternatives to crystalline fat[J]. Current Opinion in Colloid & Interface Science, 2007, 12(4): 221-231.
[31] GRAVELLE A J, BARBUT S, MARANGONI A G. Ethylcellulose oleogels: manufacturing considerations and effects of oil oxidation [J]. Food Research International, 2012, 48(2): 578-583.
[32] CO E D, MARANGONI A G. Organogels: an alternative edible oilstructuring method[J]. Journal of the American Oil Chemists’ Society,2012, 89(5): 749-780.
[33] DEY T, KIM D A, MARANGONI A G. Ethylcellulose oleogels[M]// MARANGONI A G, GARTI N. Edible oleogels: structure and health implications. Urbana: AOCS Press, 2011: 295-311.
[34] STORTZ T A, ZETZL A K, BARBUT S, et al. Edible oleogels in food products to help maximize health benefits and improve nutritional profiles[J]. Lipid Technology, 2012, 24(7): 151-154.
[35] DUFFY N, BLONK H C G, BEINDORFF C M, et al. Organogelbased emulsion systems, micro-structural features and impact on in vitro digestion[J]. Journal of the American Oil Chemists’ Society,2009, 86(8): 733-741.
[36] MORALES-RUEDA J A, DIBILDOX-ALVARADO E, CHAR☒-ALONSO M A, et al. Rheological properties of candelilla wax and dotriacontane organogels measured with a true-gap system[J]. Journal of the American Oil Chemists’ Society, 2009, 86(8): 765-772.
[37] SCHAINK H M, van MALSSEN K F, MORGADO-ALVES S, et al. Crystal network for edible oil organogels: possibilities and limitations of the fatty acid and fatty alcohol systems[J]. Food Research International, 2007, 40(9): 1185-1193.
[38] ZULIM BOTEGA D C, MARANGONI A G, SMITH A K, et al. The potential application of rice bran wax oleogel to replace solid fat and enhance unsaturated fat content in ice cream[J]. Journal of Food Science, 2013, 78(9): C1334-C1339.
[39] GHOSH V, ZIEGLER G R, ANANTHESWARAN R C. Fat,moisture, and ethanol migration through chocolates and confectionary coatings[J]. Critical Reviews in Food Science and Nutrition, 2002,42(6): 583-626.
[40] LEE W L, MCCARTHY M J, MCCARTHY K L. Oil migration in 2-component confectionery systems[J]. Journal of Food Science, 2010, 75(1): E83-E39.
[41] WOOD J M. Reduction of saturated fat in finely comminuted and ground meat products by use of canola oil organogels and the effect on organoleptic qualities, texture and microstructure[D]. Guelph: University of Guelph, 2013.
[42] 周立新, 黄凤洪. 影响花生酱稳定性的关键[J]. 食品科学, 1999,20(1): 64.
[43] 魏振枢, 周晓莉, 杨航. 奶油花生酱生产新工艺的研究[J]. 中州大学学报, 1998(2): 70-72.
[44] ELLIGER C A, GUADAGNI D G, DUNLAP C E. Thickening action of hydroxystearates in peanut butter[J]. Journal of the American Oil Chemists’ Society, 1972, 49(9): 536-537.
[45] JADHAV S R, HWANG H, HUANG Q, et al. Medium-chain sugar amphiphiles: a new family of healthy vegetable oil structuring agents[J]. Journal of Agricultural and Food Chemistry, 2013, 61(49): 12005-12011.
Advances in Oleogels and Their Applications in Food Industry
ZHONG Jinfeng, QIN Xiaoli*, LIU Xiong
(College of Food Science, Southwest University, Chongqing 400715, China)
Abstract:This review article is focused on the discussions of the definition, formation, structure of oleogels and their effects of oleogels on the levels of free fatty acids and triacylglycerol in blood serum and research techniques, the types of o rganogelators present in oleogel systems, and the techniques for oleogel research. The potential functionalities of oleogels in food products and their uses in the food industry are summarized. Base d on these, some suggestions for future studies in this field are also given.
Key words:oleogels; organogelator; self-as sembly; vegetable oil
中图分类号:TS221
文献标志码:A
文章编号:1002-6630(2015)03-0272-08
doi:10.7506/spkx1002-6 630-201503051
收稿日期:2014-02-16
基金项目:中央高校基本科研业务费专项资金项目(SWU112042;SWU113036;XDJK2013B034;XDJK2014B019);中国博士后科学基金项目(2013M531927);重庆市基础与前沿研究计划项目(cstc2013jcyjA80024)
作者简介:钟金锋(1984—),男,讲师,博士,主要从事食品营养化学、碳水化合物改性及其过程的优化控制研究。E-mail:zhongjf66@163.com
*通信作者:覃小丽(1984—),女,讲师,博士,主要从事油脂化学方面研究。E-mail:qinxiaoli66@163.com