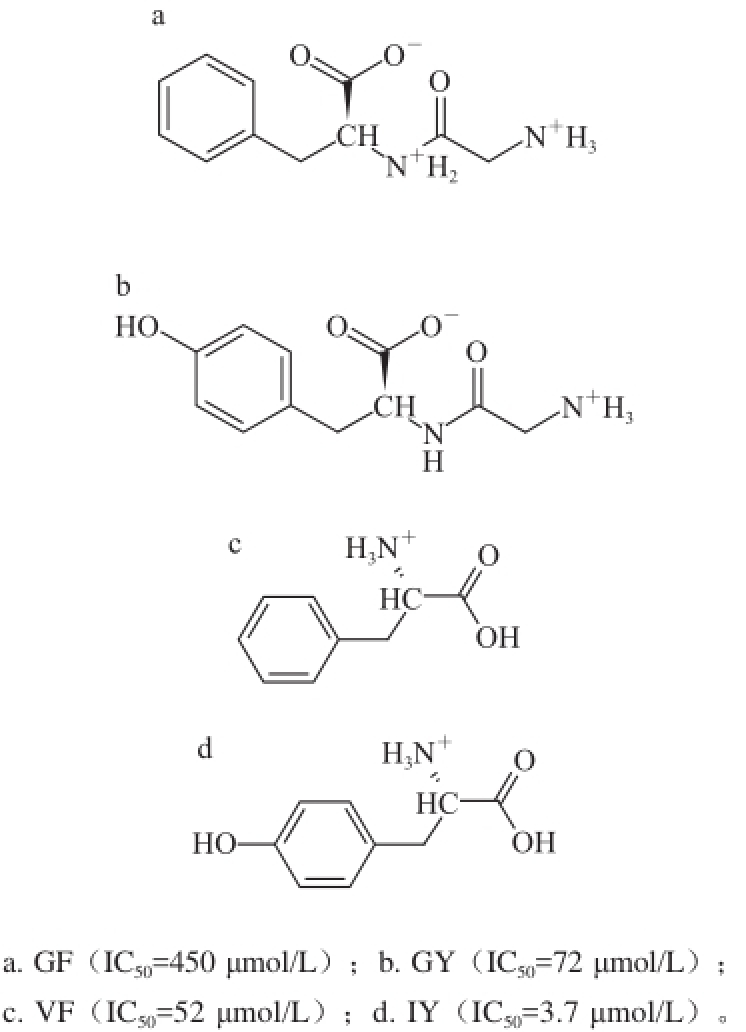
图1 ACE抑制肽的分子结构
Fig.1Chemical structures of ACE inhibitory peptides
管 骁 1,刘 静 2,*,苏淅娜 1,韩 飞 3,王文高 4,5,申瑞玲 6,李景军 7,廖丽丽 8
(1.上海理工大学医疗器械与食品学院,上海200093;2.上海海事大学信息工程学院,上海200135;3.国家粮食局科学研究院,北京100037;4.上海良友(集团)有限公司,上海200333;5.上海市粮食科学研究所,上海200333;6.郑州轻工业学院食品与生物工程学院,河南郑州450002;7.江苏长寿集团股份有限公司,江苏如皋226500;8.桂林西麦食品集团,广西桂林541004)
摘要:食源性血管紧张素转化酶(angiotensin Ⅰ-converting enzyme,ACE)抑制肽可有效抑制生物体内ACE活性,进而起到降压 疗效,且作用温和,无副作用,是高血 压治疗的理想药物,但其分子作用机制一直未有明确解释。本实验选取4 个代表性食源ACE抑制二肽(Gly—Phe、Gly—Tyr、Val—Phe、Ile—Tyr)为研究对象,采用柔性分子对接的方法研究它们与ACE的相互作用模型与分子机理。分子对接结果表明:氢键、亲水、疏水、静电等作用力同时对二肽与ACE的结合有贡献,但以氢键作用为主;ACE分子中Ala354、Glu384、Arg522等氨基酸残基为二肽与其结合的重要活性位点;ACE抑制二肽中氮端氨基对其抑制活性影响显著。通过以上分子机理研究可为指导开发强活性ACE抑制肽提供理论指导。
关键词:血管紧张素转化酶;抑制二肽;分子对接;分子机理
血管紧张素转换酶(angiotensin Ⅰ-converting enzyme,ACE,EC3.4.15.1)是一种含锌的二羧肽酶 [1],广泛分布于生物体内各组织中,尤其以肺、脑、肾等器官中含量丰富。ACE作为人体及哺乳类动物血压调节的关键限速酶,已被视作开发心血管类疾病防治药物的重要靶标 [2]。
ACE抑制肽通常是一类具有抑制ACE活性的小肽物质,往往与ACE通过不同方式结合后,抑制了ACE催化无活性的血管紧张素Ⅰ水解为血管紧张素Ⅱ(一种血管收缩剂)的作用,进而起 到降低血压的目的。此外,ACE抑制肽对正常血压者无降压效果,安全性高、毒副作用小、容易吸收,可长期服用,作为降压药物或保健食品有着良好的应用前景 [3]。目前普遍认为,单胃哺乳动物从胃肠道吸收二肽或三肽是一种重要的生理现象,而且在血液循环中相当数量的氨基酸也是以小肽形式存在的 [4],故二肽和三肽备受研究者们的关注。
尽管ACE抑制肽的研究已经开展了近50 年,大量的ACE抑制肽被陆续报道。尽管部分学者对ACE抑制肽的定量构效关系与分子对接进行了初步研究 [5-11],但仍未能对其分子作用机制进行系统阐述。目前ACE抑制肽的作用机理讨论大多仍局限于对已知序列的活性肽进行定性分析。20世纪80年代以来,分子对接技术在新药研发领域开始得到应用,并逐渐发展成为药物设计的一种强有力工具 [12-15]。近年来,关于ACE抑制肽的分子对接研究已逐步有所涉及,为从分子水平解释ACE抑制肽与ACE相互作用提供了理论依据。
本实验在上述研究基础上,选择了4 个已报道的有代表性的ACE抑制二肽GF、GY、VF、IY [16-17]作为对接对象,通过对ACE与配体对接结果的分析,探讨两者间的作用机理,为进一步研发设计新型降血压药提供理论参考。
1.1 仪器与设备
计算机工作站HP Z620 美国惠普公司;Accelrys Discovery Studio 2.5分子模拟软件 美国Accelrys公司。
1.2 方法
1.2.1 受体蛋白准备
从Protein Data Bank数据库(www.rcsb.org)中下载ACE的X衍射三维结构数据(PDB code:1086),并用Discovery Studio2.5 [12,18-20,21](DS 2.5,Accelrys公司)软件处理该蛋白质。去除所有的水分子,保留ACE中的Zn 2+和Cl -并优化蛋白质的结构,去除蛋白多构象,补充完整的氨基酸残基,为蛋白加氢等。
1.2.2 小分子准备
本研究选择4 个食源性ACE抑制二肽GF(Gly—Phe)、GY(Gly—Tyr)、VF(Val—Phe)、IY(Ile—Tyr)为研究对象,利用Argus lab软件(Pacifi c Northwest National Laboratory, Mark Thompson)构造出GF、GY、VF、IY的结构式(图1),加氢后纠正其结构并用DS 2.5中的CHARMm工具进行能量优化,所有结构利用DS 2.5中的“Prepare Ligands”程序产生多构象,最终得到的结构保存为sd格式,用于进行下步的分子对接。

图1 ACE抑制肽的分子结构
Fig.1Chemical structures of ACE inhibitory peptides
1.2.3 分子对接
所有计算工作均在HP Z620计算机工作站上完成。通过分子模拟软件Accelrys Discovery Studio 2.5建立ACE与底物及抑制多肽的分子对接模型,并在CHARMm [22]立场下完成。本实验中所用ACE结构来自PDB code 1086,以复合物的活性位点为参考,研究ACE抑制肽与ACE间的相互作用。
依据DS对接程序,将ACE定义为受体,二肽设置为配体,对接运行参数为:Radius8 Å,X:40.492、Y:38.898、Z:46.267,用Flexible Docking工具将4 个配体GF、GY、VF、IY对接到受体中。综合考虑LibDockScore的高低、配体-受体复合物的CDocker Energy、CDocker Interaction Energy、软件中打分函数(Ligscore 1、Ligscore 2、PLP1、PLP2、Jain、PMF、PMFO4)打分值的高低及氢键作用选取最优、最稳定的对接构象。
2.1 活性位点
活性位点的设置是分子对接中的关键一步,一般采用3 种方法获得:1)参考相关文献;2)利用软件中的相关程序;3)基于所用复合物的结构信息。本实验综合以上三方面的信息,即以相关报道为依据,运用DS中的活性位点工具,结合PDB数据库中获得的ACE-lisinopril复合物的结构信息,最终确定ACE的活性位点信息 [22]。该活性口袋共包含16 个氨基酸残基:His353、Ala354、Ser355、Ala356、Val380、His383、Glu384、His387、Glu411、Lys511、Phe512、His513、Val518、Tyr520、Arg522、Tyr523。
2.2 GF与ACE的相互作用分析
根据对接步骤,设置相关参数,最终得到21 个较好的GF与ACE的对接构象。对接完成后,用DS中的相关功能分析GF和ACE的对接结果,综合考虑打分值、能量值及氢键等,最终获得一个最佳对接构象(图2a、2b),其结合能为-236.44 kJ/mol。此时,GF呈现一种展开的构象被埋藏在ACE的疏水性活性裂缝中,并与ACE之间形成4 个氢键(图2)。最佳结合构象的氢键参数如表1所示。
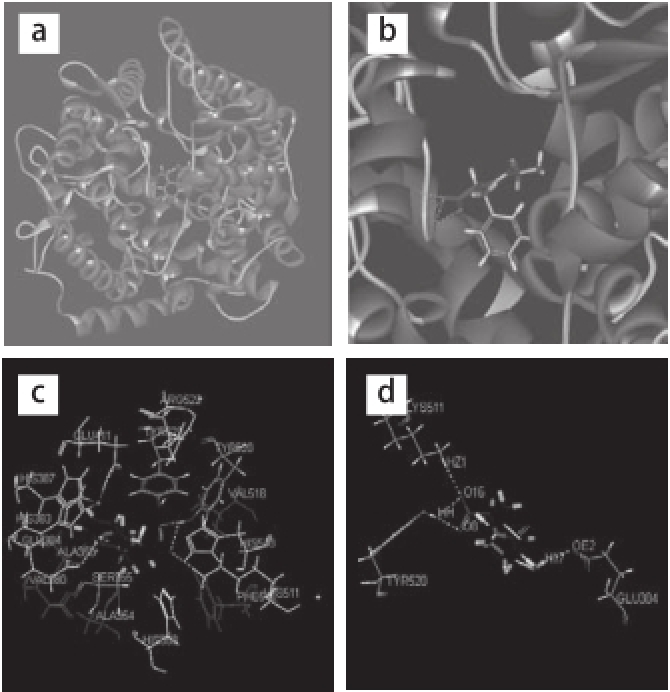
图2GF与ACE的相互作用
Fig.2Interaction of GF with ACE
a.GF与ACE相互作用整体图;b.GF与ACE相互作用局部图;c.GF与ACE活性位点残基的亲水疏水图;d.GF与ACE间的氢键信息图。图中线状模式表示ACE活性位点的氨基酸残基,棒状模式表示ACE抑制肽,虚线为氢键;c图中小球为Zn 2+,疏水氨基酸残基用深灰色表示,亲水氨基酸残基用白色表示,其他氨基酸残基为浅灰色。下同。
表1 GF与ACE形成的最佳结合构象的氢键信息
Table 1 Hydrogen bonds observed between ACE and the best GF pose

GFd(X…Y)(XHY)Glu384∶OE2…GF∶H172.19122.4 Lys511∶HZ1…GF∶O162.13160.9 Tyr520∶HH…GF∶O82.04159.8 Tyr520∶HH…GF∶O162.24122.1
由表1可知,GF中甘氨酸的氨基与Glu384形成了一个氢键,键长为2.19,键角为122.4º;苯丙氨酸C端的羟基分别与Lys511和Tyr520(O16)形成氢键,前一个氢键的键长为2.13,键角为160.9º,后一个氢键的键长为2.24,键角为122.1º;苯丙氨酸C端的羰基与Tyr520(O8)形成一个氢键,键长为2.04,键角为159.8º。由以上信息可知,GF与Lys511、Tyr520(O8)形成的2 个氢键相对较强,与Glu384、Tyr520(O16)形成的氢键相对较弱。其中,Tyr520参与了2 个氢键的形成,在两者的相互作用中贡献较大。同时,GF的碳端羟基(O16)分别参与形成了两个氢键。GF与ACE间形成氢键的详细信息见图2d。
图2c所示为GF周围亲水氨基酸及疏水氨基酸分布,其中,产生亲水作用的氨基酸残基有8 个:His353、His383、Glu384、His387、Glu411、Lys511、His513、Arg522,产生疏水作用的氨基酸残基有5 个:Ala354、Ala356、Val380、Phe512、Val518。此外,Tyr523的芳香基为疏水基团也对结构稳定有所贡献。这些氨基酸残基参与了ACE与肽分子的相互作用,形成的作用力将二肽固定在ACE的活性中心,使得肽分子能与ACE以较高的亲和力结合。GF分子中含有的亲水性基团(—COOH、—NH 3、—CO—NH—)参与了分子间亲水作用的形成,与ACE活性位点的亲水氨基酸残基形成了较强的亲水作用;而苯环等疏水基团则与活性位点的疏水氨基酸残基形成了疏水作用,对复合物的稳定起到一定作用。与ACE氨基酸残基间氢键、亲水、疏水、静电作用(表6)的存在使得最佳结合构象得以稳定。
2.3 GY和ACE的相互作用分析
采用相同方法将GY对接到ACE中,最终得到28 个较好的对接构象。其中,最佳结合构象的结合能为-262.92 kJ/mol,最佳构象见图3a、3b。由图中可以清晰看出,GY结合于ACE活性空腔内,并与之形成2 个氢键以维持复合物的稳定。DS2.5软件可分析ACE活性位点与最佳构象的氢键、亲水、疏水和静电作用(表6)。最佳构象的氢键参数如表2所示。

图3GY与ACE间的相互作用
Fig.3Interaction of GY with ACE
a. GY与ACE相互作用整体图;b.GY与ACE相互作用局部图;c. GY与ACE活性位点残基的亲水疏水图;d. GY与ACE间的氢键信息图。
表2GY与ACE形成的最佳结合构象的氢键信息
Table 2 Hydrogen bonds observed between ACE and the best GY pose

GYd(X…Y)(XHY)Glu384∶OE2…GY∶H292.08144.5 Tyr520∶HH…GY∶O102.43149.5
如表2所示,Glu384与GY中酪氨酸的羰基形成氢键,键长为2.08,键角为144.5º,Tyr520与GY中甘氨酸的氨基形成氢键,键长为2.43,键角为149.5º,两个氢键均为强氢键,在两者的相互作用中贡献较大,故Glu384和Tyr520为关键氨基酸,GY的氮端氨基和碳端羰基为关键基团。GY与ACE间形成氢键的详细信息见图3d。
图3c所示为GY周围亲水氨基酸及疏水氨基酸分布,其中,His353、His383、Glu384、His387、Glu411、Lys511、His513、Arg522通过亲水作用影响两者的相互关系,Ala354、Ala356、Val380、Phe512、Val518通过疏水作用稳定复合物的构象。这些氨基酸与肽分子间的相互作用,形成的作用力将二肽固定在ACE的活性中心,使得肽分子能与ACE以较高的亲和力结合,从而使构象得以稳定。
2.4 VF和ACE的相互作用分析
将VF对接到ACE中,最终得到8 个较好的对接构象。DS分析出的最佳结合构象(图4a、4b)结合能为-274.32 kJ/mol,并与ACE之间形成4 个氢键(图4d)。最佳结合构象的氢键参数如表3所示。

图4VF与ACE的相互作用
Fig.4Interaction of VF with ACE
a. VF与ACE相互作用整体图;b. VF与ACE相互作用局部图;c. VF与ACE活性位点残基的亲水疏水图;d. VF与ACE间的氢键信息图。
表3VF与ACE形成的最佳结合构象的氢键信息
Table 3 Hydrogen bonds observed between ACE and the best VF pose

VFd(X…Y)(XHY)Ala354∶O…VF∶H212.3683.94 Ala354∶O…VF∶H222.1993.62 Ala354∶O…VF∶H232.4579.47 Glu384∶OE2…VF∶H221.87133.88
由表3可知,VF中缬氨酸的氨基与Ala354形成了3 个氢键,与Glu384形成了一个强氢键。其中Ala354参与了3 个氢键的形成,Glu384虽只形成一个氢键但为强氢键,Ala354及Glu384在两者的相互作用中贡献较大。同时,VF的氮端氨基分别参与形成了4 个氢键,故VF的氮端氨基为关键基团。VF与ACE间形成氢键的详细信息见图4d。
图4c所示为VF周围亲水氨基酸及疏水氨基酸分布,其中,His353、His383、Glu384、His387、Glu411、Lys511、His513、Arg522通过亲水作用影响两者的相互关系,Ala354、Ala356、Val380、Phe512、Val518通过疏水作用稳定复合物的构象。这些氨基酸残基参与了ACE与肽分子的相互作用,形成的作用力将二肽固定在ACE的活性中心,使得肽分子能与ACE以较高的亲和力结合。
2.5 IY和ACE的相互作用分析
采用相同方法将IY对接到ACE中,最终得到8 个较好的对接构象。其中,最佳结合构象的结合能为-359.99 kJ/mol,最佳构象见图5a。由图中可以清晰看出,IY结合于ACE活性空腔内,并与之形成3 个氢键以维持复合物的稳定。DS2.5软件分析ACE活性位点与最佳构象的氢键、亲水、疏水和静电作用(表6)。最佳构象的氢键参数如表4所示。
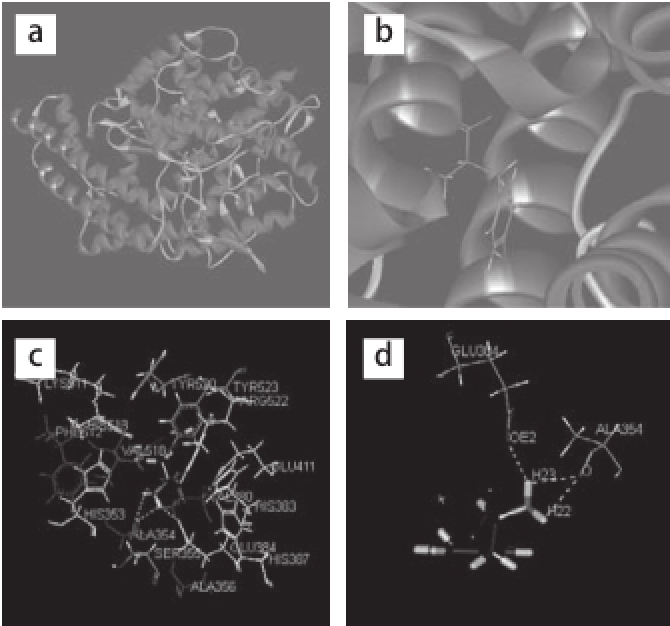
图5IY与ACE间的相互作用
Fig.5Interaction of IY with ACE
a.GY与ACE相互作用整体图;b.GY与ACE相互作用局部图;c.GY与ACE活性位点残基的亲水疏水图;d.GY与ACE间的氢键信息图。
表4 IY与ACE形成的最佳结合构象的氢键信息
Table 4 Hydrogen bonds observed between ACE and the best IY pose
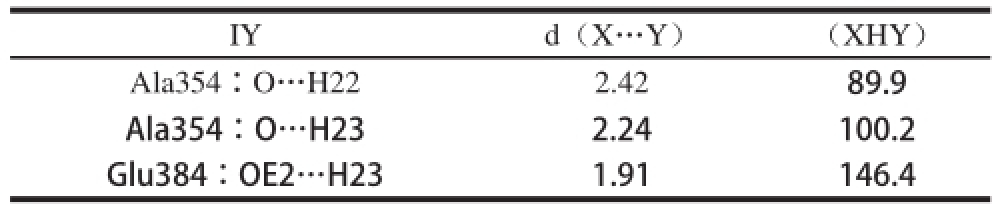
IYd(X…Y)(XHY)Ala354∶O…H222.4289.9 Ala354∶O…H232.24100.2 Glu384∶OE2…H231.91146.4
如表4所示,IY氮端氨基与Ala354形成两个氢键,同时与Glu384形成一个氢键,且为强氢键。ACE中Ala354与Glu384两个氨基酸残基在与肽的相互作用中贡献较大,故Ala354和Glu384为关键氨基酸残基,IY的氮端氨基参与了3 个氢键的形成,为关键基团。IY与ACE间形成氢键的详细信息见图5d。
图5c所示为IY周围亲水氨基酸及疏水氨基酸分布,其中,His353、His383、Glu384、His387、Glu411、Lys511、His513、Arg522通过亲水作用影响两者的结合,Ala354、Ala356、Val380、Phe512、Val518通过疏水作用稳定复合物的构象。这些氨基酸与肽分子间的相互作用,形成的作用力将二肽固定在ACE的活性中心,使得肽分子能与ACE以较高的亲和力结合,从而使构象得以稳定。
2.6 二肽与ACE之间氢键作用综合分析
氢键对分子间相互作用往往贡献较大 [23-25]。表5为GF、GY、VF、IY与ACE间氢键作用的综合分析表,由此表可知,Glu384均与GF、GY、VF、IY形成了氢键,故Glu384可认为是二肽和ACE间形成氢键的最关键氨基酸残基。同时,Ala354、Lys511、Tyr520也不同程度参与了氢键的形成,对与抑制肽的结合发挥了积极作用,但它们并非是必需的。
表5ACE抑制二肽与ACE间形成的氢键信息统计表
Table5Hydrogen bonds observed between the best bioactive peptide poses
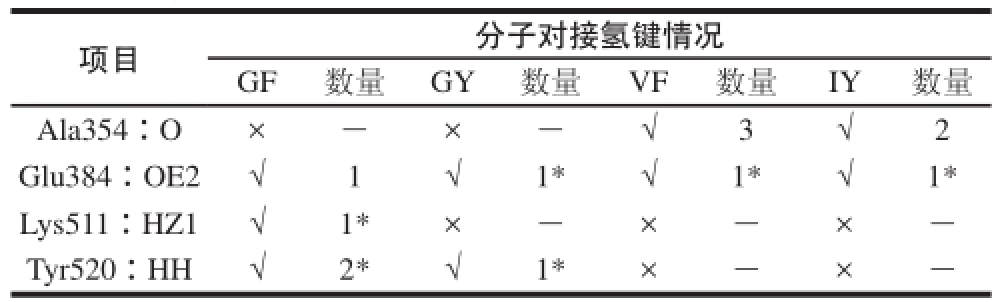
注:√. 存在氢键作用;×. 不存在氢键作用;数字代表形成的氢键个数;*. 氢键较强。
项目分子对接氢键情况GF 数量 GY 数量VF 数量 IY 数量Ala354∶O×-×-√3√2 Glu384∶OE2√1√1*√1*√1* Lys511∶HZ1√1*×-×-×-Tyr520∶HH√2*√1*×-×-
表6ACE抑制肽与ACE活性位点氨基酸残基间的相互作用能
Table 6 Electrostatic energy, van der Waals energy and total potential energyol) of the best poses obtained from docking results kJ/mol
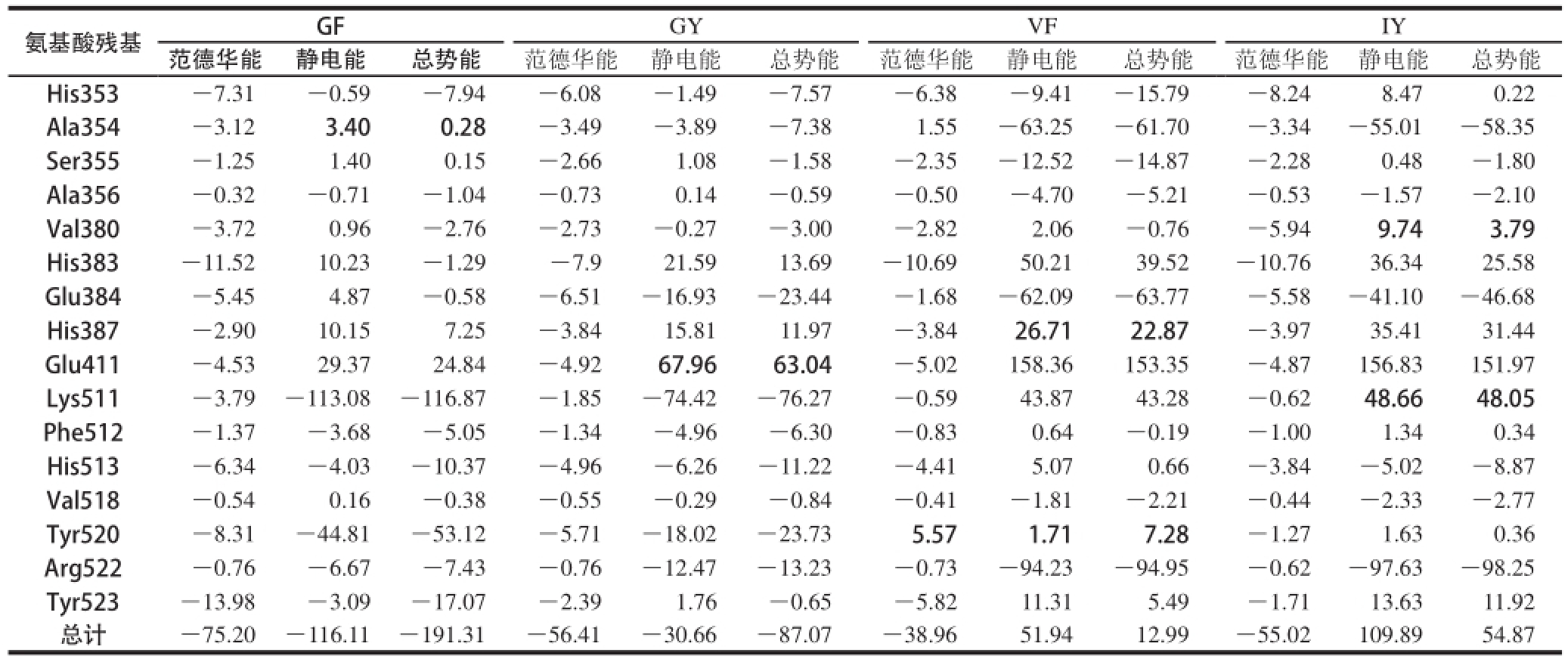
氨基酸残基GFGYVFIY范德华能静电能总势能范德华能静电能 总势能 范德华能静电能总势能范德华能静电能总势能His353-7.31-0.59-7.94-6.08-1.49-7.57-6.38-9.41-15.79-8.248.470.22 A la354-3.123.400.28-3.49-3.89-7.381.55-63.25-61.70-3.34-55.01-58.35 Ser355-1.251.400.15-2.661.08-1.58-2.35-12.52-14.87-2.280.48-1.80 Ala356-0.32-0.71-1.04-0.730.14-0.59-0.50-4.70-5.21-0.53-1.57-2.10 Val380-3.720.96-2.76-2.73-0.27-3.00-2.822.06-0.76-5.949.743.79 His383-11.5210.23-1.29-7.921.5913.69-10.6950.2139.52-10.7636.3425.58 Glu384-5.454.87-0.58-6.51-16.93-23.44-1.68-62.09-63.77-5.58-41.10-46.68 His387-2.9010.157.25-3.8415.8111.97-3.8426.7122.87-3.9735.4131.44 Glu411-4.5329.3724.84-4.9267.9663.04-5.02158.36153.35-4.87156.83151.97 Lys511-3.79-113.08-116.87-1.85-74.42-76.27-0.5943.8743.28-0.6248.6648.05 Phe512-1.37-3.68-5.05-1.34-4.96-6.30-0.830.64-0.19-1.001.340.34 His513-6.34-4.03-10.37-4.96-6.26-11.22-4.415.070.66-3.84-5.02-8.87 Val518-0.540.16-0.38-0.55-0.29-0.84-0.41-1.81-2.21-0.44-2.33-2.77 Tyr520-8.31-44.81-53.12-5.71-18.02-23.735.571.717.28-1.271.630.36 Arg522-0.76-6.67-7.43-0.76-12.47-13.23-0.73-94.23-94.95-0.62-97.63-98.25 Tyr523-13.98-3.09-17.07-2.391.76-0.65-5.8211.315.49-1.7113.6311.92总计-75.20-116.11-191.31-56.41-30.66-87.07-38.9651.9412.99-55.02109.8954.87
2.7 二肽与ACE重要氨基酸残基之间的作用能分析
表6为GF、GY、VF、IY分别与ACE活性位点的氨基酸残基间的相互作用能,包括范德华能和静电能。相互作用能越大,表明结合物就越稳定。在GF与ACE的相互作用中,静电力(-116.11 kJ/mol)比范德华力(-75.20 kJ/mol)所起的作用大,His353(-7.94 kJ/mol)、Lys511(-116.87 kJ/mol)、His513(-10.37 kJ/mol)、Tyr520(-53.12 kJ/mol)、Arg522(-7.43 kJ/mol)、Tyr523(-17.07 kJ/mol)为两者相互作用中的关键氨基酸残基,尤其Lys511、Tyr520、Tyr523对复合物的稳定性贡献最大;而在GY与ACE的相互作用中,范德华力(-56.41 kJ/mol)的作用胜于静电力(-30.66 kJ/mol),其中,His353(-7.57 kJ/mol)、Ala354(-7.38 kJ/mol)、Glu384(-23.44 kJ/mol)、Lys511(-76.27 kJ/mol)、His513(-11.22 kJ/mol)、Tyr520(-23.73 kJ/mol)、Arg522(-13.23 kJ/mol)对复合物的稳定性影响较大,特别是Glu384、Lys511、Tyr520对复合物的稳定贡献最大;在VF与ACE的相互作用中,静电力(51.94 kJ/mol)比范德华力(-38.96 kJ/mol)所起的作用大,His353(-15.79 kJ/mol)、Ala354(-61.70 kJ/mol)、Ser355(-14.87 kJ/mol)、Glu384(-63.77 kJ/mol)、Arg522(-94.95 kJ/mol)为两者相互作用的关键氨基酸残基,尤其Ala354、Glu384、Arg522为两者作用的关键氨基酸残基。在IY与ACE的相互作用中,静电力(109.89 kJ/mol)比范德华力(-55.02 kJ/mol)所起的作用大,Ala354(-58.35 kJ/mol)、Glu384(-46.68 kJ/mol)、Arg522(-98.25 kJ/mol)为两者相互作用的关键氨基酸残基。
综合GF、GY、VF、IY与ACE的对接结果可知,4 个二肽均与Ala354、Glu384、Arg522存在相互作用,尤其是Glu384同时参与了GF、GY、VF、IY与ACE的氢键形成,可见,Ala354、Glu384、Arg522是ACE活性位点中起重要作用的残基,对二肽和ACE的结构稳定性有重要影响。GF、GY、VF、IY均为二肽,长度相等且抑制类型相同,这解释了GF、GY、VF、IY与ACE的结合表现出相似的分子作用机制 [22]。此外,二肽分子中参与氢键形成的多为氮端氨基,这些基团在配体与受体的结合中起着重要作用。从另一方面看,GF、GY和VF三者与ACE的结合方式尽管较为相似,然而GF的活性远远小于GY与VF(IC 50值反映),究其原因,可能在于GY和VF与ACE中Glu384之间均形成了强氢键,而GF与其形成的氢键为弱氢键,该氢键作用对ACE抑制活性具有重要影响。这一点从IY与ACE的对接信息上进一步得到验证,IY具有4 个二肽中最强的抑制活性,同样IY与Glu384之间形成了强氢键,有利于其抑制活性的发挥。
表7ACE抑制肽与ACE形成的最佳构象的结合能
Table7Binding energy of the best poses obtained from docking results wite ACE
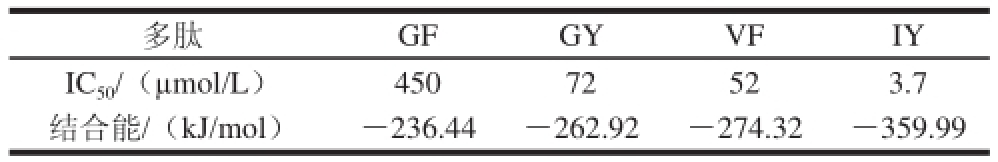
多肽GFGYVFIY IC 50/(μmol/L)450 72523.7结合能/(kJ/mol)-236.44-262.92-274.32-359.99
结合能是表征众多配体与大分子结合稳定性的一个重要参数。如表7所示,GF与ACE之间的结合能为-236.44 kJ/mol,GY与ACE之间的结合能为-262.92 kJ/mol,VF与ACE之间的结合能为-274.32 kJ/mol,IY与ACE之间的结合能为-359.99 kJ/mol。GF、GY、VF、IY的结合能依次增大,表明它们与ACE的结合能力逐渐增强,这刚好与它们的IC 50值依次减小(活性增强)的实验结果一致。由此可知,抑制效果好的二肽,与ACE的结合力较强,即对ACE的活性影响较大,这是与理论相吻合的实践结果。
本实验将4 个代表性ACE抑制二肽(GF、GY、VF、VY)与ACE进行分子对接研究,通过对对接结果的分析,得出对ACE活性起重要作用的残基:Ala354、Glu384、Arg522及二肽中重要的基团:氮端氨基。同时指出,4 个二肽与ACE的结合表现出相似的分子作用机制,且4 个二肽的结合能的变化与其IC 50值的变化相一致。以上结论可部分揭示ACE抑制肽的作用机制,给出ACE抑制二肽与ACE关键氨基酸残基相互作用的直接证据,可为降压新药的设计与研发提供一定的借鉴及理论指导。
参考文献:
[1] ROKS A J M, BUIKEMA H, PINTO Y M, et al. The renin-angiotensin system and vaseular function. The role of antiotensinⅡ, angiotensinconverting enzyme, and alternative conversion of angiotensinⅠ[J]. Heart Vessels, 1997, Suppl 12: 119-124.
[2] STURROCK E, NATESH R, ROOYEN J, et al. Whats new in the reninangiotensin system:structure of angiotensinⅠ-converting enzyme[J]. Cellular and Molecular Life Sciences, 2004, 61(21): 2677-2686.
[3] 孙勤, 陈季旺, 夏文水, 等. 食品蛋白源ACE抑制肽的生理和生化性质[J]. 武汉工业学院学报, 2009, 28(1): 27-31.
[4] 王志超, 安玉会. 生物活性肽的研究进展[J]. 河南医学研究, 2004, 13(4): 353-356.
[5] LI Guanhong, LE Guowei, SHI Yonghui, et al. AngiotensinⅠ-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J]. Nutrition Research, 2004, 24: 469-486.
[6] KUBA M, TANAKA K, TAWATA S, et al. AngiotensinⅠ-converting enzyme inhibitory peptides isolated from tofuyo fermented soybean food[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(6): 1278-1283.
[7] WU Jianping, ALUKO R E, NAKAI S. Structural requirements of angiotensinⅠ-converting enzyme inhibitory peptides: quantitative structure-activity relationship study of di- and tripeptides[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 732-738.
[8] WU Jianping, ALUKO R E, NAKAI S. Structural requirements of angiotensinⅠ-converting enzyme inhibitory peptides: quantitative structure-activity relationship modeling of peptides containing 4-10 amino acid residues[J]. Qsar and Combinatorial Science, 2006, 25(10): 873-880.
[9] 刘静, 彭剑秋, 管骁. 基于MLR的ACE抑制肽定量构效关系建模研究[J]. 分析科学学报, 2012, 28(1): 16-22.
[10] 刘静, 管骁, 彭剑秋. 神经网络在ACE抑制肽QSAR中的应用研究[J].分析测试学报, 2012, 31(10): 1260-1265.
[11] 刘静, 管骁, 彭剑秋. 基于氨基酸描述符SVHEHS的ACE抑制肽QSAR研究[J]. 化学学报, 2012, 70(1): 83-91.
[12] PAN Daodong, GUO Huiqing, ZHAO Bo, et al. Studies on purifi cation and the molecular mechanism of a novel ACE inhibotory peptide from whey protein hydrolysate[J]. Food Chemistry, 2012, 130(1): 121-126.
[13] ABAGYAN R, TOTROV M. High-throughput docking for lead generation[J]. Current Opinion in Chemical Biology, 2001, 5(4): 375-382. [14] KROEMER R T. Structure-based drug design: docking and scoring[J]. Current Protein and Peptide Science, 2007, 8(4): 312-328.
[15] GSEHWEND D A, GOOD A C, KUNTZ I D. Molecular docking towards drug discovery[J]. Journal of Molecular Recognition, 1996, 9(2): 175-186.
[16] 王伟, 沈生荣, 冯风琴, 等. 基于药效团的血管紧张素转化酶抑制肽的结构优化[J]. 中国科学B辑: 化学, 2008, 38(4): 357-364.
[17]FUJITA H, YOKOYAMA K, YOSHIKAWA M. Classification and antihypertensive activity of angiotensinⅠ-converting enzyme inhibitory peptides derived from the edible mushroom Tricholoma giganteum[J]. Peptides, 2004, 25: 621-627.
[18] ANTONELLA P, SUSAN C, GIOVANNI C, et al. Molecular modeling of mirarulin: structural analyses and functional hypotheses[J]. Biochemical and Biophysical Research Communications, 2008, 367(1): 26-32.
[19] KIM D, PARK J, KIM J, et al. Flavonoids as mushroom tyrosinase tyrosinase inhibitors: a fluorescence quenching study[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 935-941.
[20] KIM M R, YUKIO K, KIM K M, et al. Tastes and structures of bitter peptide, asparagine-alanine-leucine-proline-glutamate, and its synthetic analogues[J]. Journal of Agricultural and Food Chem istry, 2008, 56(21): 5852-5858.
[21] KANG N J, LEE K W, KIM B H, et al. Coffee phen olic phytochemicals suppress colon cancer metastasis by targeting MEK and TOPK[J]. Carcinogenesis, 2011, 32( 6): 921-928.
[22] PAN Daodong, GUO Huiqing, ZHAO Bo, et al. The molecular mechanisms of interactions between bioactive peptides and angiotensin-converting enzyme[J]. Bioorganic and Medicinal Chemi stry Letters, 2011, 21(13): 3898-3904.
[23] 郁彩虹, 张耀东, 高裙裙, 等. 分子对接和荧光光谱法研究槲皮素与β-葡萄糖苷酶的相互作用[J]. 光谱学与光谱分析, 2011, 31(8): 2151-2155.
[24] 徐倩, 邓丹丹, 曹志娟, 等. 荧光法和分子对接研究4种黄酮与血清白蛋白的相互作用[J]. 分析化学研究学报, 2010, 38(4): 483-487.
[25] 杨旭曙, 王晓栋, 季力, 等. 分子对接结合比较分子相似性指数分析用于雌激素类化合物活性预测和分子机理研究[J]. 科学通报, 2008, 53(22): 2735-2741.
Flexible Molecular Docking of Interaction between AngiotensinⅠ-Converting Enzyme(ACE) Inhibitory Dipeptides and ACE
GUAN Xiao
1,LIU Jing
2,*,SU Xina
1,HAN Fei
3,WANG Wengao
4,5,SHEN Ruiling
6,LI Jingjun
7,LIAO Lili
8
(1.School of Medical Instrument and Food Engineering,University of Shanghai for Science and Technology,Shanghai200093,China;2.College of Information Engineering,Shanghai Maritime University,Shanghai200135,China;3.Academy of State Administration of Grain,Beijing100037,China;4.Shanghai Liangyou(Group)Co.Ltd.,Shanghai200333,China;5.Shanghai Grain Science Research Institute,Shanghai200333,China;6.School of Food and Bioengineering,Zhengzhou University of Light Industry,Zhengzhou450002,China;7.Jiangsu Changshou(Group)Co.Ltd.,Rugao226500,China;8.Guilin Ximai Food Company,Guilin541004,China)
Abstract:AngiotensinⅠ-converting enzyme (ACE) inhibitory peptides are ideal anti-hypertension drugs because they can inhibit ACE activity in vivo effectively, and have strong blood-reducing activity without side effects. However, their molecular mechanism remains unclear so far. In this paper, four typical ACE inhibitory dipeptides including GF (Gly-Phe), GY (Gly-Tyr), VF (Val-Phe) and IY (Ile-Tyr) were chosen as re search targets, and their action modes and molecular mechanisms on ACE were studied in detail by flexible molecular docking method. The results showed that hydrogen bond, hydrophobic, hydrophilic and electrostatic interactions existed between peptides and ACE, in which hydrogen bond interaction plays the dominant role. Moreover, Ala354, Glu384 and Arg522 in ACE were especially important binding site with active peptides, and N-terminal amino groups were the key groups in dipeptides. This information will be helpful for the molecule design of new ACE inhibitory peptides with strong activity.
Key words:angiotensin Ⅰ-converting enzyme; inhibitory dipeptides; molecular docking; molecular mechanism
中图分类号:TS201.25
文献标志码:A
文章编号:1002-6630(2015)05-0001-06
doi:10.7506/spkx1002-6630-201505001
收稿日期:2014-05-30
基金项目:国家自然科学基金青年科学基金项目(31101348);上海市自然科学基金项目(14ZR1419200)
作者简介:管骁(1979—),男,副教授,博士,研究方向为食品功能因子开发。E-mail:gnxo@163.com
*通信作者:刘静(1979—),女,副教授,博士,研究方向为生物信息学。E-mail:Jingliu@shmtu.edu.cn