李志平 1,张弛 2,周维清 2,纪启芳 2,孔小卫 2,李玉成 1,*
(1.安徽大学资源与环境工程学院,安徽合肥230601;2.安徽大学生命科学学院,安徽合肥230601)
摘要:目的:以从巢湖蓝藻中分离纯化的一种多糖(acidic polysaccharide from Cyanobacteria of Chaohu,CHAP)为研究对象,对其纯度、分子质量、光谱特征、单糖组成、抗氧化作用进行研究,旨在为水华蓝藻资源进行综合开发利用提供有价值的参考。方法:采用60℃的热水抽提蓝藻,采用硫酸铵去除其中蛋白质,粗多糖经DEAE-52阴离子交换层析柱分离并用Sephadex G-150进行纯化得到纯化多糖CHAP。结果:CHAP中多糖和蛋白质含量分别为91.49%和0.18%,紫外-可见光谱表明CHAP不含核酸,高效液相色谱(high performance liquid chromatography,HPLC)测定CHAP的分子质量为2.209×10 5D,离子色谱(ion chromatography,IC)表明CHAP由6.36%的阿拉伯糖、35.47%的葡萄糖、5.03%的木糖、17.09%的半乳糖、27.36%的甘露糖及一种未知单糖构成。红外光谱表明CHAP是具有α-D-半乳吡喃糖的特征吸收峰的吡喃糖,CHAP的抗氧化作用表明:CHAP对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧阴离子自由基(O 2 -·)有较强的清除能力,其IC 50分别为276μg/mL和186.05μg/mL。CHAP对羟自由基(·OH)的清除能力较弱,清除率不到10%。
关键词:巢湖蓝藻;酸性多糖;理化性质;抗氧化作用
由于巢湖的富营养化,巢湖每年都会发生严重的蓝藻水华,微囊藻是形成巢湖蓝藻水华的主要种类之一 [1]。目前,直接打捞蓝藻仍是湖泊富营养化治理的长期基本措施 [2]。但是打捞上来的蓝藻由于含有藻毒素不能被家禽、家畜直接利用而被随意堆放在岸边,此法不但直接占用大量的土地,而且藻体在死亡衰败过程中产生的有害物质往往会对周边的环境造成污染 [3]。
近年来,蓝藻资源化成为了研究热点之一,许玲等 [4]系统介绍了蓝藻在能源化利用、提取天然色素、提取藻胆蛋白、提取多糖、生物固氮及其他方面的利用情况,为蓝藻的综合利用提供了有价值的参考。蓝藻体内、细胞壁以及由鞘、荚膜、黏质构成的细胞外层都含有丰富的多糖组成 [5],大量研究表明:多糖是一类具有生理生化活性的大分子物质,而且具有抗肿瘤、抗炎症、提高机体免疫力和降低血糖等生物活性 [6]。任欣欣等 [7]研究发现:蓝藻胞外多糖是一种酸性杂多糖,超过75%的多糖由6种以上单糖组成。胞外多糖具有一系列重要的生理生化功能,而且在生态学和工业上具有广阔的应用前景。王习达等 [8]用热水浸提法提取、DEAE-52纤维素柱分离纯化得到铜绿微囊藻酸性多糖,研究表明铜绿微囊藻酸性多糖是一种新型的α-型吡喃糖,平均分子质量为2.0028×10 5D,由鼠李糖、木糖、阿拉伯糖、半乳糖和半乳糖醛酸组成。梅秋红等 [9]采用pH8.0、80℃的热水抽提铜绿微囊藻,得到两种胞外多糖,两种胞外多糖的单糖组成一致,但分子质量不同。这些研究取得了较高的水平,也为当前的研究提供了很好的基础,但他们往往以实验室培养的蓝藻为研究对象,对野外采集的蓝藻的直接研究较少,在理化性质以及活性方面的研究也不足。本实验以巢湖蓝藻为直接提取原料,并对蓝藻酸性多糖(acidic polysaccharide from Cyanobacteria of Chaohu,CHAP)进行分离纯化,研究其理化性质,探讨其体外抗氧化能力,旨在充分利用巢湖蓝藻这一大量生物资源,为下一步蓝藻多糖在生物活性和药理药效等方面的应用奠定基础。
1.1 材料与试剂
2013年7月20日巢湖西半湖塘西河口采集蓝藻,经镜检98%以上为蓝藻门的微囊藻属,经测定藻浆的含水率为95.85%。
标准单糖葡萄糖(D-glucose,Glc)、半乳糖(D-galactose,Gal)、阿拉伯糖(L-arabinose,Ara)、鼠李糖(L-rhamnose,Rha)、甘露糖(D-mannose,Man)、木糖(D-xylose,Xyl)、标准葡聚糖T-10、T-40、T-70、T-100、T-500、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、Tris美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DEAE-52阴离子交换层析柱英国Whatman公司;UV-2100分光光度计瑞典Pharmacia Biotech公司;4100型紫外-可见光-近红外分光光度计日本日立公司;红外光谱分析仪美国Sigma公司;Waters515高效液相色谱仪美国Waters公司;ICS-3000型色谱仪美国戴安公司。
1.3 方法
1.3.1 多糖提取与纯化
粗多糖的提取:称取一定量藻浆,反复冻融3次后按1∶30料液比加入蒸馏水混匀,60℃水浴4h,离心取上清液,旋转浓缩至原体积的1/10,加5倍体积无水乙醇静置过夜,离心、收集沉淀,加一定量蒸馏水溶解,加固体硫酸铵直至不再溶解为止,离心取上清液,再用透析袋自来水流水透析3d,蒸馏水透析1d,浓缩、冷冻干燥得粗多糖。
蓝藻酸性多糖的分离:取一定量粗多糖,溶于适当蒸馏水中。过DEAE-52阴离子交换层析柱,先用蒸馏水洗脱(流速:1.5mL/min,6mL/管),苯酚-硫酸法检测直至无糖检测出来为止。然后用1mol/L的NaCl溶液洗脱(流速:1.5mL/min,6mL/管),苯酚-硫酸法检测直至无糖出来为止。收集合并主峰,盐洗部分自来水流水和蒸馏水各透析1d,旋转浓缩、冷冻干燥得酸性蓝藻多糖。
蓝藻酸性多糖的纯化:取20mg酸性蓝藻多糖溶于2mL去离子水中,Sephadex G-150层析,以蒸馏水洗脱,流速0.5mL/min,每管2mL。苯酚-硫酸法 [10]跟踪测定多糖并绘制洗脱曲线。收集主峰、冷冻干燥得到蓝藻多糖CHAP。
1.3.2 CHAP基本理化性质测定
检验CHAP在水、乙醇、氯仿等溶剂中的溶解度,并进行斐林试剂反应、硫酸-咔唑反应、碘-碘化钾反应。
1.3.3 CHAP糖含量和蛋白质含量的测定
分别采用苯酚-硫酸法 [10]和考马斯亮蓝法 [11]测定糖含量和蛋白质含量。
1.3.4 CHAP紫外-可见光谱分析
将CHAP用蒸馏水配制成质量浓度为1mg/mL的多糖溶液,用去离子水为空白对照调零,在190~900nm波长范围内进行扫描。取配制好的多糖溶液与质量分数为6%的苯酚溶液、浓硫酸以1∶2∶5的体积比显色,混匀静置10min后在400~900nm波长范围内进行扫描。
1.3.5 CHAP红外光谱分析
取少量干燥的CHAP与KBr充分研磨制片,然后在4000~500cm -1范围内扫描,测定其红外吸收。
1.3.6 CHAP分子质量测定 [12]
分别称取10mg的CHAP及多糖标准品Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-100、Dextran T-500、Dextran T-2000分别溶于2mL蒸馏水中,过0.22μm的水膜。分析仪器为高效液相色谱(high performance liquid chromatography,HPLC)仪,检测器为蒸发光散射检测器,分析柱为TSK-GELG4000PWX,柱温37℃,流动相为乙腈-水(4∶1,V/V),流动相速率为1.0mL/min,上样量为10μL。分别记录各自的色谱图,用分析软件以标准多糖分子质量的对数值(lgM W)对保留时间t R进行回归处理,得到回归方程lgM w= 17.928-1.8712t(R 2=0.9932),按照回归方程求出CHAP分子质量。
1.3.7 CHAP单糖组成分析
多糖的水解:精密称取CHAP样品25.0mg于安瓿瓶中,加入4mol/L三氟乙酸(trifluoroacetic acid,TFA)溶液3mL,充N 2后封口,置于110℃烘箱中加热水解8h,取出70℃旋转浓缩至干,得多糖水解物。取水解物配制成20mg/L的蓝藻水解单糖溶液。
CHAP的离子色谱分析 [13]:分别用去离子水稀释成质量浓度为1.0mg/L的鼠李糖、木糖、阿拉伯糖、半乳糖、葡萄糖和甘露糖标准溶液,然后再配制质量浓度均为1.0mg/L的上述6种糖的混标溶液。仪器参数:分析仪器为ICS-3000型色谱仪,检测器为电化学检测器ED50(Au为工作电极,Ag/AgCl为参比电极),扫描电位为 脉冲安培电位波形,分析柱为CarboPac PA200(3mm×250mm)。流动相为2.5mmol/L的NaOH,流速为0.3mL/min,柱温为30℃,进样量为20μL。
1.3.8 CHAP体外抗氧化研究
1.3.8.1 对DPPH自由基的清除作用测定
DPPH乙醇溶液呈紫色,在517nm波长处有强烈吸收。加入抗氧化剂后,颜色变浅,溶液吸光度下降,以在517nm波长处吸光度的下降值表示抗氧化剂对DPPH自由基的清除能力 [14-15]。
参考Shimada等 [16]的方法,略作改动。准确称取0.002g DPPH溶于无水乙醇,50mL棕色容量瓶定容。取11支具塞试管(10mL),样品组试管加入2mL DPPH和2mL一定质量浓度(0.1、0.2、0.3、0.4、0.5mg/mL)的多糖溶液,混合均匀后,黑暗中反应30min,于517nm波长处测定吸光度。实验结果重复3次。同时测定抗坏血酸清除DPPH自由基能力,DPPH自由基清除率计算公式如下。
式中:A 1为2mL不同质量浓度多糖溶液+ 2mL DPPH溶液即样品组吸光度;A 2为2mL不同质量浓度多糖溶液+2mL无水乙醇即样品组本身吸光度;A 0为2mL去离子水+2mL DPPH溶液即空白组吸光度。
1.3.8.2 对羟自由基(·OH)的清除作用测定
利用Fenton反应法产生·OH。·OH氧化水杨酸产生有色物质,该产物在510nm波长处有最大吸光度,吸光度大小与·OH呈正比。在体系中加入含羟基的受试物,受试物上的羟基与Fe 2+络合,从而阻断·OH的生成途径 [17]。
参考张云侠 [12]的方法并略作修改。取11支10mL具塞试管,各加9mmol/L的FeS0 4溶液1mL,9mmol/L水杨酸-乙醇溶液2mL,样品组加入一定质量浓度(0.1、0.2、0.3、0.4、0.5mg/mL)的多糖溶液2mL,然后加入8.8mmol/L的H 2O 2溶液2mL启动反应,室温下反应1h,在510nm波长出测定吸光度,记录数据,实验重复3次。同时测定抗坏血酸清除·OH能力。·OH清除率计算公式如下:式中:A 1为1mL FeSO 4溶液+2mL水杨酸-乙醇溶液+ 2mL不同质量浓度多糖溶液+2mL H 2O 2溶液即样品组吸光度;A 2为1mL FeSO 4溶液+2mL水杨酸-乙醇溶液+ 2mL不同质量浓度多糖溶液+2mL H 2O即样品组本身吸光度;A 0为1mL FeSO 4溶液+2mL水杨酸-乙醇溶液+ 2mL H 2O+2mL H 2O 2即空白对照吸光度。
1.3.8.3 对超氧阴离子自由基(
 )的清除作用测定邻苯三酚在弱碱性条件下会发生自氧化产生
)的清除作用测定邻苯三酚在弱碱性条件下会发生自氧化产生
 ,
,
O
2
-·加速邻苯三酚的自养化速率并生成有色中间产物,该产物在320nm波长处有强烈的光吸收。如加入
 产生抑制剂,便能抑制O
2
-·和有色物质的产生,通过测定吸光度的差异就可判断出抑制剂的抑制效果
[18]。
产生抑制剂,便能抑制O
2
-·和有色物质的产生,通过测定吸光度的差异就可判断出抑制剂的抑制效果
[18]。
参考张云侠
[12]的方法,并略作修改。取l0mL具塞试管11支,加入5mL浓度为0.05mol/L、pH8.2的Tris-HCl缓冲液于试管中,加入1mL一定质量浓度(0.1、0.2、0.3、0.4、0.5mg/mL)的多糖溶液,25℃反应20min后,加入3mmol/L的邻苯三酚0.4mL,混合均匀,25℃准确反应4min后,立即用0.5mL的浓盐酸终止反应。终止反应后在320nm波长处测定吸光度,记录数据,实验结果重复3次,同时测定抗坏血酸清除
 能力。
能力。
 清除率计算公式如下。
清除率计算公式如下。
式中:A 1为5mL的Tris-HCl缓冲液+1mL不同质量浓度多糖溶液+0.4mL邻苯三酚溶液+0.5mL浓盐酸即样品组吸光度;A 2为5mL的Tris-HCl缓冲液+1mL不同质量浓度多糖溶液+0.4mL超纯水+0.5mL浓盐酸即样品组本身吸光度;A 0为5mL的Tris-HCl缓冲液+1mL超纯水+0.4mL邻苯三酚溶液+0.5mL浓盐酸即空白对照吸光度。
2.1 多糖的提取与纯化
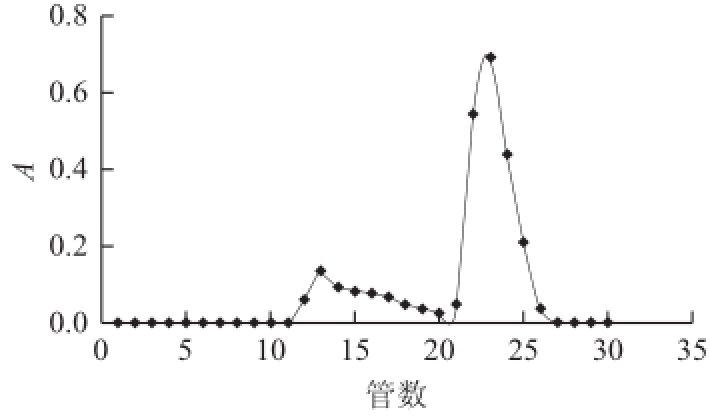
图1 巢湖蓝藻酸性多糖在Sephadex G-150柱上的洗脱曲线
Fig.1Elution curve of acidic polysaccharide extracted from Cyanobacteria on Sephadex G-150column
由图1可知,酸性多糖经Sephadex G-150层析,可以较好地分离两种多糖,收集后面主峰得到纯化多糖(CHAP)。
2.2 CHAP理化性质
实验得到的CHAP为浅棕色疏松絮状物,易溶于水,不溶于高浓度乙醇及氯仿等有机试剂。碘-碘化钾反应呈阴性,说明CHAP不是淀粉类多糖。CHAP与斐林试剂和三氯化铁反应为阴性,说明CHAP不含单糖和多酚类物质。硫酸-咔唑反应呈阳性,说明CHAP含有糖醛酸。
2.3 CHAP糖含量和蛋白质含量分析
经测定CHAP中糖与蛋白质含量分别为91.49%和0.18%。
2.4 CHAP紫外-可见光谱分析
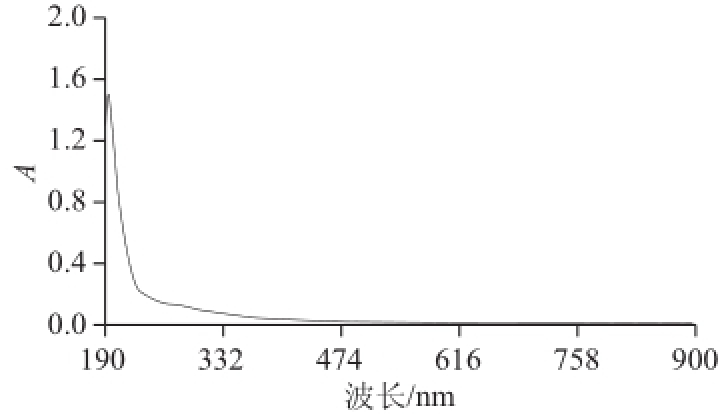
图2CHAP紫外-可见光图谱
Fig.2Ultraviolet spectrum of CHAP in the wavelength rang of190-900nm
蛋白质产生紫外吸收光谱的主要原因是色氨酸(Trp)和酪氨酸(Tyr)残基的侧链基团对光的吸收,其次是苯丙氨酸(Phe)、组氨酸(His)、半胱氨酸(Cys)残基的侧链基团对光的吸收。Trp和Tyr在280nm波长附近有吸收峰,Phe在257nm波长附近有吸收峰 [19]。由图2可知,CHAP在250~280nm波长范围无吸收峰,说明CHAP残留的蛋白质中不含上述氨基酸,同时也说明CHAP不含核酸。由图3可知,CHAP经苯酚-硫酸显色反应后,在490nm波长处有多糖的特征吸收峰。

图3CHAP经苯酚-硫酸法显色后紫外-可见光图谱
Fig.3UV-visible spectrum of CHAP reacted with phenol and sulfate in the wavelength range of400-900nm
2.5 CHAP红外光谱分析

图4CHAPP红外光谱
Fig.4IR spectrum of CHAP
由图4可知,CHAP在3000~2800cm -1、1400~1200cm -1两组范围内均有吸收峰,它们属于糖类的特殊吸收峰,前峰是糖类中—CH 2中C—H伸缩振动,后峰是C—H变角振动。在3392cm -1处有一宽峰,代表是多糖中分子间氢键O—H引起伸缩振动。1652cm -1处的吸收峰是羰基中的C=O伸缩振动引起的。1411cm -1处的吸收峰则是—COOH中C—O伸缩振动引起的。1035cm -1处的强吸收峰则是吡喃糖环的C—O—C振动引起。894cm -1处的特征峰代表了吡喃环的β端基差向异构的C—H变角振动。在815cm -1处的吸收峰是α-D-半乳吡喃糖的特征吸收峰 [20]。
2.6 CHAP的分子质量

图5CHAP的HPLC图HPLC
Fig.5HPLC of CHAP
由HPLC检测得到蓝藻多糖CHAP基本为单一对称峰(图5),说明CHAP纯度较高。根据CHAP的出峰时间,计算出CHAP的分子质量为2.209×10 5D。
2.7 CHAP单糖组成分析
离子色谱法是近年来发展起来的色谱分析方法,可通过将糖类物质在强碱性淋洗液中离子化后在阴离子交换柱上进行分离,然后通过金电极脉冲安培检测器进行检测,从而达到分析糖类物质的目的 [21-22],该法不需要预先衍生就能检测到几乎所有的单糖,且灵敏度高,分析速度快,稳定性较好。
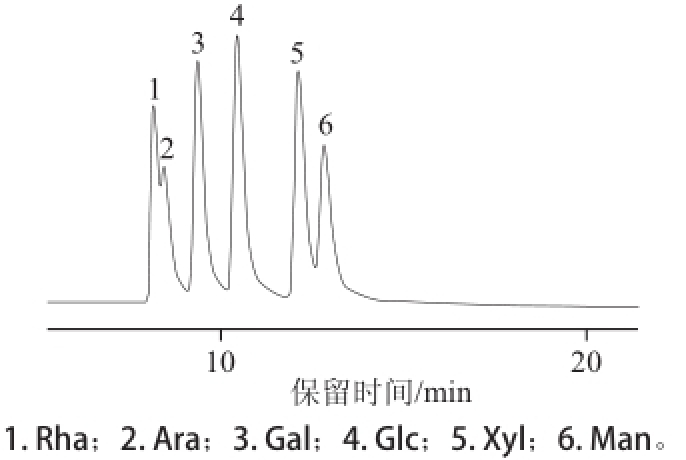
图6标准单糖离子色谱图
Fig.6Ion chromatogram of monosaccharide standards

图7CHAP水解样品离子色谱图
Fig.7Ion chromatogram of CHAP
图6 是标准单糖为L-鼠李糖、D-木糖、L-阿拉伯糖、D-甘露糖、D-葡萄糖、D-半乳糖的标准混合色谱图。由图7可知,CHAP的单糖组成是L-阿拉伯糖、D-半乳糖、D-葡萄糖、D-木糖、D-甘露糖,说明CHAP是一种杂多糖。经计算各单糖百分含量分别为6.36%、17.09%、35.47%、5.03%、27.36%。图7中位于半乳糖和葡萄糖之间的糖由于缺少标准品的对照,不能鉴定。
2.8 蓝藻多糖体外抗氧化研究
2.8.1 DPPH自由基清除能力
对DPPH自由基的清除能力可以用来衡量抗氧化剂的抗氧化活性,清除率越高,抗氧化能力越强。自由基清除剂对DPPH自由基的清除程度与其所接受的电子数成定量关系,也就是说和抗氧化剂的供氢能力有关 [23]。
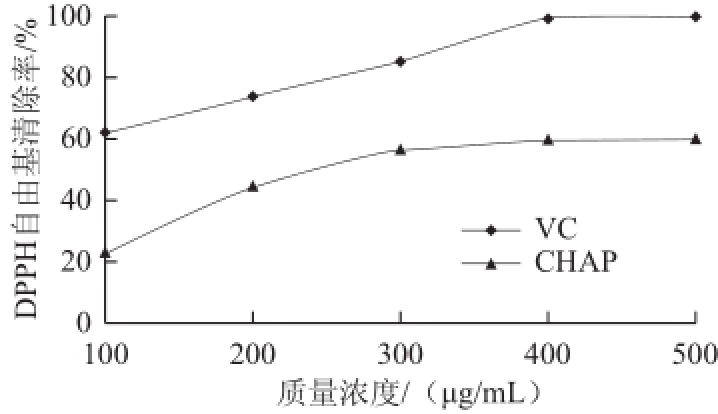
图8蓝藻多糖和VC对DPPH自由基清除作用的比较
Fig.8Comparison of DPPH free radical scavenging capacity between CHAP and vitamin C
由图8可知,VC对DPPH自由基有很强的清除作用,当其质量浓度达到400μg/mL时清除率就接近于100%。在实验质量浓度范围内,DPPH自由基清除能力随着CHAP质量浓度的增加而逐渐升高,但当其质量浓度达到400μg/mL后对DPPH自由基清除能力基本保持不变,最高为60.71%。通过实验数据求得蓝藻多糖对DPPH自由基清除IC 50为276μg/mL。VC和CHAP对DPPH自由基清除能力的差异可能与羟基的数目和活性相关 [24]。
2.8.2 ·OH清除能力
·OH是生物体内正常代谢产物,在正常情况下,机体处于动态平衡,一旦平衡被打破,就会对机体造成严重损害,从而引起一系列疾病 [25]。因此,以对·OH清除率为评价多糖的抗氧化能力具有重要的意义。VC为已知的·OH清除剂,因此以VC为对照品与CHAP进行比较,结果见图9。VC对·OH的清除能力随着其质量浓度的升高而升高,CHAP对·OH的清除能力较弱,随着其质量浓度的变化,清除率无显著变化,基本维持在7%左右。可能是由于CHAP上的羟基与Fe 2+络合能力较弱,相关的机理还需进一步研究。
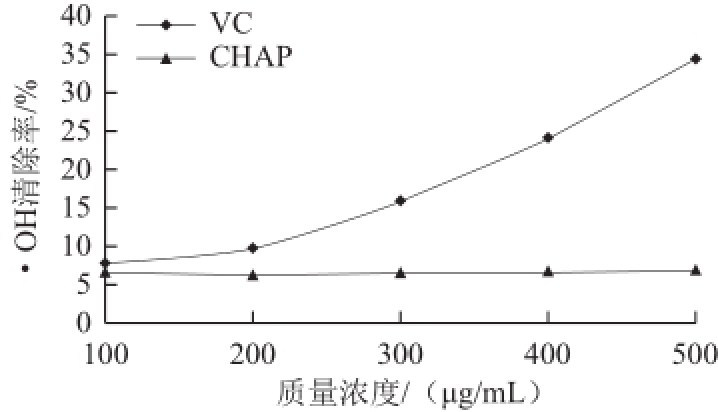
图9蓝藻多糖和VC对VC·OH清除作用的比较
Fig.9Comparison of hydroxyl free radical scavenging capacity between CHAP and vitamin C
2.8.3
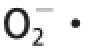 清除能力
清除能力
O
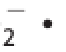 是生物体内主要的氧自由基,是其他活性氧的前体,对生物体内细胞、酶、DNA及不饱和脂肪酸等物质均能产生影响。生物体内部分氧化还原反应会产生
是生物体内主要的氧自由基,是其他活性氧的前体,对生物体内细胞、酶、DNA及不饱和脂肪酸等物质均能产生影响。生物体内部分氧化还原反应会产生
 它是活性氧的一种,是机体内寿命最长的自由基,通常作为自由基链式反应的引发剂,产生活性更强的氢离子自由基,进一步给机体造成危害
[26]。由图10可知,在实验质量浓度范围内,VC对
它是活性氧的一种,是机体内寿命最长的自由基,通常作为自由基链式反应的引发剂,产生活性更强的氢离子自由基,进一步给机体造成危害
[26]。由图10可知,在实验质量浓度范围内,VC对
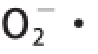 有较强的清除能力,当其质量浓度为300μg/mL时,清除率即达到94%以上,再增加其质量浓度其清除率无明显变化。CHAP对
有较强的清除能力,当其质量浓度为300μg/mL时,清除率即达到94%以上,再增加其质量浓度其清除率无明显变化。CHAP对
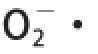 的清除能力随着其质量浓度的增加而升高,当CHAP的质量浓度达到500μg/mL时,
的清除能力随着其质量浓度的增加而升高,当CHAP的质量浓度达到500μg/mL时,
 清除率达到最大值74.74%,通过实验数据求得蓝藻多糖对
清除率达到最大值74.74%,通过实验数据求得蓝藻多糖对
 清除的IC
50为186.05μg/mL。
清除的IC
50为186.05μg/mL。
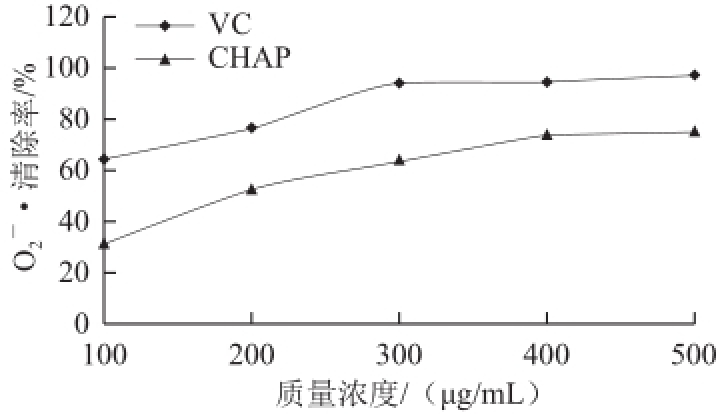
图1 0蓝藻多糖和VC对
 VC清除作用的比较
VC清除作用的比较
Fig.10Comparison of superoxide anion free radical scavenging capacity between CHAP and vitamin C
3
由于巢湖水体的富营养化没有根本的改善,每年夏秋季节由于巢湖的富营养化导致的水华爆发对巢湖周边的生态环境造成了严重的灾难。而打捞上来的大量蓝藻如何有效地利用和处理是目前亟需解决的问题。本实验以直接打捞的蓝藻为原材料,经过反复冻融去除细胞壁 [27],水浴法得到蓝藻多糖粗提物。多糖粗提物经过硫酸铵沉淀,在蛋白质沉淀的同时一部分溶解性小的多糖也沉淀下来 [28],这相对于经典的蛋白去除方法Sevag法有处理量大、操作简便、不产生有害物质等优点,而且多糖可以得到进一步纯化。粗多糖经过DEAE-52吸附NaCl洗脱得到酸性多糖,得到的酸性多糖再经过Sephadex G-150纯化得到相对均一性多糖CHAP。
从单糖组成上来看,CHAP是酸性杂多糖,这与滇池水华蓝藻酸性多糖 [29]、太湖水华蓝藻酸性多糖 [30]研究结论一致。这3种水华蓝藻多糖单糖组成中都含有阿拉伯糖、甘露糖、葡萄糖,但单糖组成种类不完全一样,可能是由于各自不同的环境条件和提取条件导致的。这3种水华蓝藻多糖与从实验室培养的蓝藻中提取的酸性多糖 [8-9,31]在单糖组成上也不同,而且前者的单糖组成种类明显多于后者。从分子质量上来看,CHAP的分子质量(2.209×10 5D)与铜绿微囊藻的胞内多糖分子质量 [31](2.0025×10 5D)接近,可能是由于胞外多糖的分子质量(7.0012×10 4D)相对较小,在硫酸铵沉淀环节与蛋白质一起被沉淀下来。初步抗氧化研究表明CHAP对
DPPH自由基和
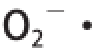 有较强的清除能力,但对·OH的清除能力较弱,这对CHAP在后续的更为全面、系统的体外和体内抗氧化实验奠定了坚实的基础。
有较强的清除能力,但对·OH的清除能力较弱,这对CHAP在后续的更为全面、系统的体外和体内抗氧化实验奠定了坚实的基础。
参考文献:
[1]雷腊梅,宋丽荣.微囊藻及其毒素分子生物学研究进展[J].自然科学进展,2002,12(4):350-355.
[2]王惠,朱喜.太湖蓝藻打捞和资源化利用的实践与思考[J].江苏水利,2009(7):35-37.
[3]李永慧,李玉成,王宁,等.巢湖蓝藻死亡衰败过程中典型有害成分形成及控制对策[J].湖泊科学,2012,24(4):513-518.
[4]许玲,张无敌,尹芳,等.蓝藻综合利用研究现状[J].现代农业科技,2010(8):283-284.
[5]黄泽波,刘永定.蓝细菌多糖及其应用研究概况[J].生物技术通报,1997(4):26-32.
[6]徐翠莲,杜林洳,樊素芳,等.多糖的提取、分离纯化及分析鉴定方法研究[J].河南科学,2009,27(12):1524-1529.
[7]任欣欣,姜昊,冷欣,等.蓝藻胞外多糖的生态学意义及其工业应用[J].生态学杂志,2013,32(3):762-771.
[8]王习达,吴国荣,陈景耀,等.铜绿微囊藻酸性多糖的分离、纯化与结构研究[J].中草药,2003,26(3):865-867.
[9]梅秋红,缪月秋,张成武,等.铜绿微囊藻(Microcystic aeruginosa var.major)胞外酸性多糖的分离、纯化及其理化特性[J].湖泊科学,2005,17(4):322-326.
[10]许文涛,张方方,罗云波,等.荞麦水溶性多糖的分离纯化及其分子量的测定[J].食品科学,2009,30(13):22-24.
[11]秦卫东,马利华,陈学红,等.生姜多糖的提取及脱蛋白研究[J].食品科学,2008,29(4):218-220.
[12]张云侠.平菇多糖的提取、鉴定及其抗氧化活性研究[D].合肥:安徽大学,2012:22-43.
[13]王雪梅,汪莹莹,吴迷迷,等.黄蜀葵多糖的分子质量测定及单糖组成分析[J].安徽大学学报:自然科学版,2011,35(3):82-87.
[14]LU Yinrong,YEAPFOO L.Antioxidant and radical scavenging activities of polyphenols from apple pomace[J].Food Chemistry,2000,68(1):81-85.
[15]EONG L P,SHUI G.An investigation of antioxidant capacity of fruits in Singapore markets[J].Food Chemistry,2002,76(1):69-75.
[16]SHIMADA K,FUJIKAWA K,YAHARA K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40(6):945-948.
[17]周林珠,杨祥良,周井炎,等.多糖抗氧化作用研究进展[J].中国生化药物杂志,2002,23(4):210-212.
[18]文镜,贺素华,杨育颖,等.保健食品清除自由基作用的体外测定方法和原理[J].食品科学,2004,25(11):190-195.
[19]吴丹,徐桂英.光谱法研究蛋白质与表面活性剂的相互作用[J].物理化学学报,2006,22(2):254-260.
[20]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:243-248.
[21]牟世芬,李宗利.阴离子交换分离-脉冲安培检测分析糖类化合物的进展[J].色谱,1995,13(5):320-324.
[22]MARIA P C,ALESSIO C.Iron chromatography characterization of polysaccharides in ancientwall paintings[J].Chromatogra,2002,968(1):79-88.
[23]RICE-TVANTS C,MILLER N J,PAGANGA G.Antioxidant properties of phenolic compounds[J].Trends in Plant Science,1997,2(4):152-159.
[24]黄进,杨国宇,李宏基,等.抗氧化剂作用机制研究进展[J].自然杂志,2004,26(2):74-78.
[25]冉靓,杨小生,王伯初,等.抗氧化多糖的研究进展[J].时珍国医国药,2006,17(4):494-496.
[26]张唐伟,杨乐,柳青海,等.地木耳多糖的抗氧化性与抑菌作用[J].食品与生物技术学报,2011,30(6):868-873.
[27]陈伟平,陈必链,张艳燕.三种微藻细胞破碎方法的比较[J].生物技术,2008,18(1):55-58.
[28]方积年,丁侃.天药物-多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-346.
[29]耿兰芳,李朋富,宋立荣,等.滇池微囊藻水华多糖的提取和化学特征[J].湖泊科学,2007,19(6):637-642.
[30]印小燕.太湖水华蓝藻中水溶性多糖的分离纯化[D].无锡:江南大学,2011:11-15.
[31]梅秋红,张玲,王习达,等.铜绿微囊藻(Microcystic aeruginosa)胞内酸性多糖和胞外酸性多糖理化性质的比较研究[J].食品科学,2007,28(6):180-184.
Physico-chemical Characteristics and Antioxidant Activity of Acidic Polysaccharide Extracted from Cyanobacteria from Chaohu Lake
LI Zhiping
1,ZHANG Chi
2,ZHOU Weiqing
2,JI Qifang
2,KONG Xiaowei
2,LI Yucheng
1,*
(1.College of Resources and Environmental Engineering,Anhui University,Hefei230601,China;2.College of Life Science,Anhui University,Hefei230601,China)
Abstract:Objective:To the study physico-chemical characteristics and antioxidant activities of acidic polysaccharide extracted from Cyanobacteria from the Chaohu Lake.Methods:Acidic polysaccharide was extracted by hot water(60℃)from Cyanobacteria.After deproteinization by ammonium sulfate method,the neutral and acidic polysaccharides were pooled from the elutes of DEAE-52gel column.Then,the acidic polysaccharides were further loaded onto Sephadex G-150column and a purified acidic polysaccharide,CHAP,was obtained.HPLC,UV,IR,and IC were used for the analysis of CHAP for purity,molecular weight,monosaccharide composition,spectroscopic characteristics and antioxidant activity.Results:The CHAP obtained contained91.49%polysaccharides and0.18%proteins without the presence of nucleic acids.The mean molecular weight of CHAP was2.209×10 5D.The monosaccharide composition of CHAP included L-arabinose(6.36%),glucose(35.47%),D (+)xylose(5.03%),D-mannose(27.36%),D-galactose(17.09%),and unknown monosaccharides.Infrared spectrum showed that CHAP was mainly composed of pyranose-polysaccharides and had a characteristic absorption peak ofα-D-galactopyranosyl.The results of antioxidant activity indicated that CHAP had a strong ability to scavenge both superoxide anion free radicals and DPPH free radicals,with IC 50values of186.05and276μg/mL,respectively.However,almost no scavenging effect against hydroxyl free radical was observed.
Key words:Cyanobacteria from the Chaohu Lake;acidic polysaccharide;physico-chemical characteristics;antioxidant activity
中图分类号:TS244.5
文献标志码:A
文章编号:1002-6630(2015)05-0007-06
doi:10.7506/spkx1002-6630-201505002
收稿日期:2014-04-26
基金项目:国家自然科学基金青年科学基金项目(40972092;41172121);巢湖入湖重污染河道污染消减关键技术与示范工程项目(2012ZX07103-004)
作者简介:李志平(1987—),男,硕士研究生,研究方向为水污染控制。E-mail:li_zhi_ping@yeah.net
*通信作者:李玉成(1963—),男,教授,博士,研究方向为生物地球化学。E-mail:li-yucheng@163.com