刘小玲 1,2,何 虹 1,2,姜元欣 1,江虹锐 1,2,李全阳 1,2
(1.广西大学轻工与食品工程学院,广西南宁530004;
2.广西高校特色农产品精深加工与安全控制重点实验室,广西南宁530004)
摘要:研究过氧化氢溶液体系中罗非鱼皮胶原纤维热降解过程,反应体系中降解产物的氨基酸组成、分子质量和性质的变化。结果表明:反应1 h内,释放到溶液的胶原蛋白降解产物极少,不足以测试样品的凝胶强度和黏度。反应1~3 h,反应体系中溶液的表观黏度增加,反应液冷却后可凝结成凝胶,凝胶强度随时间的延长逐渐增大,说明释放到水溶液中胶原分子数量增加,溶质质量浓度提高。反应3~5 h后,反应液表观黏度随时间下降,反应液中溶质质量浓度提高,凝胶的凝胶强度下降,说明这个阶段以原胶原分子肽链的裂解为主体,导致胶原蛋白进一步水解断裂。电泳结果显示,反应4 h的样品,分子质量在130 kD以下的条带比例增加,说明样品中α链断裂片段增加。氨基酸组成分析显示,降解产物与鱼皮氨基酸组成略有差异,但不同反应时间点,明胶产物的氨基酸均没有显著变化,说明过氧化氢协同热效应,主要是通过水解肽键的方式实现胶原纤维向可溶态明胶的转变。
关键词:罗非鱼;胶原纤维;过氧化氢;降解
明胶是一种重要的天然高分子物质,是Ⅰ型胶原热降解的衍生物,具有水溶性、黏性、胶凝性、表面活性等,是食品工业中一种重要的配料,可作为胶凝剂、稳定剂、黏合剂、黏结剂、发泡剂、增稠剂、乳化剂、澄清剂等使用 [1-2]。Ⅰ型胶原主要以胶原纤维的高聚态结构存在于动物的皮肤、骨骼、韧带、肌腱组织中。胶原纤维向明胶的热降解转化过程涉及到了聚集态结构的破坏、多种键合方式的解离、共价键的断裂和热变性等步骤。为了提高明胶的生产效率,很多研究工作持续展开。Eastman Kodak公司的Kenyon [3]论述碱提取法,他们将原料采用氨或脂肪胺进行预处理,在50~65℃提胶,提取液pH值调到9~10,在胶液真空浓缩时,胺快速挥发达到去除的目的。Alexandrescu等 [4]采用不同消化剂来加速胶原的水解,在有氯化钙、尿素或醋酸铵存在下提取明胶,整个提取过程需16~20h,明胶得率提高。用γ射线轰击胶原原料,可以明显改善明胶的物理化学性质 [5]。Franklin等 [6]提出了连续法逆流提取明胶装置,使提取效率提高。Hill等 [7]改进提取装置,在提取时注入蒸汽来加热逆流提取液,使之转变为明胶,该方法由于热传递,缩短了提胶时间。Coudun [8]提出的方法是将预处过的原料加压挤压,挤出的黏液经适当加热得到明胶。
过氧化氢通常用作漂白剂和杀菌剂,在明胶生产的后续工段使用 [9],但也有在制胶其他环节上的研究。Aewsiri等 [10]用2、5 g/100 mL过氧化氢漂白墨鱼皮24、48 h,用5%过氧化氢漂白48 h,在60 ℃熬胶12 h,得到背部和腹部处的最大产率分别为49.65%和72.88%。不仅改善了明胶的颜色而且能够增加凝冻强度、乳化和发泡性质。Gallo等 [11]发现以1.7 mol/L过氧化氢处理活的鲤鱼浮鳔,0 ℃时对胶原没有影响,但37 ℃时胶原完全溶解。Dey等 [12]研究过氧化氢对明胶的影响,胶原用高浓度的过氧化氢处理5 d,胶原完全溶解。
在热提取环节中添加适量的过氧化氢有助于提高胶原的降解速率、缩短明胶提取时间和提高明胶产率。罗非鱼皮为原料提取鱼皮明胶的最佳提取条件为过氧化氢0.07 mmol/g,53 ℃提取4.6 h,此条件下明胶提取率达到87.71%,黏度为8.9 mPa·s。而再延长时间,尽管提取率还可进一步提高,但明胶的黏度和凝胶性下降,显示胶原蛋白的肽键水解加剧 [13]。
为了解过氧化氢协同热效应对胶原纤维向明胶转变的进程,本实验分析不同反应时间点溶解到反应液中的鱼皮明胶的组成、结构及其性质,旨在为准确控制过氧化氢法生产高质量明胶提供依据。
1.1 材料与试剂
罗非鱼鱼皮由百洋水产集团股份有限公司提供。
次高分子质量标准蛋白(43~200 kD)、考马斯亮蓝R-250华美生物工程有限公司;L-羟赖氨酸美国Sigma公司;L-羟脯氨酸上海生化试剂公司;丙烯酰胺、N,N’-甲叉双丙烯酰胺北京索莱宝科技有限公司。
1.2 仪器与设备
TA-XT plus物性测试仪英国Stable Micro System公司;FTIR-8400S傅里叶变换红外光谱仪美国惠普公司;S-570扫描电子显微镜日本日立公司;4153B172X射线衍射仪日本理学公司;奥氏黏度计浙江台州市椒江玻璃仪器厂;DYCZ-23A型电泳仪北京六一仪器厂;Agilent1100液相色谱仪美国安捷伦公司。
1.3 方法
1.3.1 过氧化氢诱导的鱼皮胶原纤维降解反应
罗非鱼皮经饱和石灰水浸灰6d后取出,用流动水清洗,最后用盐酸中和至中性。取10kg鱼皮以完整自然的状态置于含有过氧化氢0.07mmol/g的水溶液中(料液比1∶6(m/V)),于53℃恒温搅拌提取明胶,期间每隔一段时间从反应体系中吸取反应液200~1000mL(根据反应体系中明胶的含量确定),经4000r/min离心10min,一部分澄清液用于直接测定反应液凝胶强度。剩余澄清液浓缩、干燥后制得待测产物样品,用于测定反应产物的黏度、氨基酸组成、分子质量。
1.3.2 降解产物表观黏度测定
准确称取反应时间点待测样品,配成质量浓度为6.67g/100mL的明胶溶液,准确量取10mL反应液加入奥氏黏度计内,于60℃水浴平衡10min后,测定溶液流经毛细管的时间,通过下式计算反应液的表观黏度。
式中:η为反应溶液的表观黏度/(mPa·s);η 0为纯水在标准大气压下的黏度/(mPa·s);ρ为反应溶液的质量浓度/(g/mL);ρ 0为纯水在标准大气压下的质量浓度/(g/mL);t为反应溶液流经奥氏黏度计的时间/s;t 0为纯水流经奥氏黏度计的时间/s。
1.3.3 降解产物的凝胶强度测定
移取不同反应时间点离心后的反应液,准确量取150mL反应液注入至直径为80mm的烧杯中,在4℃条件下凝冻18h备用。取出在20℃室温内快速采用TA-XT plus物性测试仪测定产物的凝胶强度。测试条件:采用NO-P/0.5探头,下压速率1mm/s,下压高度4mm。凝胶强度表示为凝胶被压缩变形所需的最大应力(g)。
1.3.4 降解产物的氨基酸组成测定
准确称取一定质量的干燥的反应产物置于水解管底部,加入8mL6mol/L的HCl,真空封口,于(110±1)℃条件下水解22~24h。水解物经定容、过滤、离心后,取清液置于样品瓶中用氨基酸自动分析仪上机测定。空白对照为未经热提取的鱼皮干燥物。
1.3.5 降解产物的分子质量及分子质量分布测定
降解产物样品的分子质量分布采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate polyacrylamide gel electrophoresis,SDS-PAGE)测定。以次高分子质量标准蛋白作为参比。选择8%分离胶,4%浓缩胶,胶厚为1.5mm。80V恒压电泳至溴酚蓝标志到达浓缩胶和分离胶交界处并成一条直线时,再将电压调至120V进行电泳,直至溴酚蓝标志到达凝胶前沿后停止电泳。分别用三氯乙酸固定、考马斯亮蓝R-250染色、冰醋酸脱色。电泳凝胶胶片置于凝胶成像系统下,拍照得电泳图谱。
1.4 数据处理
采用Excel2007和SPSS17.0进行数据处理和单因素方差分析(P<0.05)。表观黏度和凝胶强度每个样品分别测试3个平行样,结果以平均值表示。
2.1 降解产物的表观黏度变化
明胶黏度取决于明胶大分子链的旋转半径的大小,也与大分子的质量浓度成正比。不同反应时间的明胶表观黏度结果如图1所示。
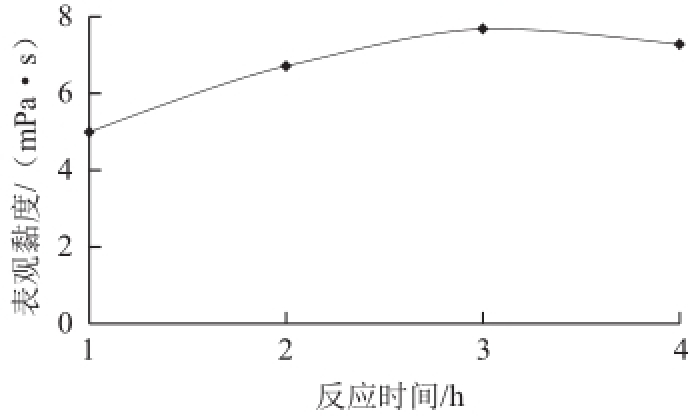
图1 不同反应时间的明胶表观黏度
Fig.1Viscosity of gelatin at different reaction times
由图1可知,反应前1h,由于溶液中获得的降解产物样品量极少,无法满足表观黏度的测试要求。在相同质量浓度(6.67g/100mL)下,随着反应时间的延长,明胶的黏度先增加后减小。3h达到黏度最大值,4h的样品黏度开始下降。说明3h之后,释放到水中的胶原蛋白开始进一步降解成小分子,分子质量的降低导致明胶溶液黏度下降。
2.2 降解产物的凝胶强度变化
待测物的凝胶强度取决于明胶的质量浓度,也与明胶的分子大小相关。在一定范围内,相同质量浓度的凝胶随明胶分子质量增大而加强;而相同分子质量的明胶则随其质量浓度的提高,凝胶强度增强。反应体系中的凝胶强度变化如图2所示。

图2不同反应时间降解产物明胶的凝胶强度
Fig.2Change in gel strength of gelatin at different reaction times
由图2可知,随着反应时间的延长,降解产物明胶的凝胶强度增大,反应3h后明胶凝胶强度增加程度有所缓和。反应过程中,鱼皮胶原纤维解体,部分原胶原分子不断释放到水中,使得反应液中溶质质量浓度提高,溶于水的胶原片段或原胶原分子即为明胶。与此同时,水中的原胶原分子在热和过氧化氢的协同作用下,溶于水的原胶原或其β、γ、α链还可进一步水解,生成胨、肽和氨基酸 [14]。因此,与3h样品相比,反应4h样品尽管溶质的质量浓度更高,但因分子质量的下降导致其凝胶强度上升减缓。说明反应2~3h,罗非鱼粗纤维大部分已经溶化,反应3h后,胶原蛋白的次级水解显著,为了获得较好的明胶质量及产率的平衡,反应控制在3~4h较为适宜。
2.3 降解产物的氨基酸组成变化
表1 不同反应时间罗非鱼皮胶原降解产物氨基酸组成变化
Table 1 Amino acid composition of degraded tilapia collagen fibers at different reaction times

注:*.天冬氨酸包括天冬氨酸和天冬酰氨;**.谷氨酸包括谷氨酸和谷胺酰氨。
个/1000个氨基酸残基氨基酸名称反应时间/h 01234天冬氨酸*4146454745谷氨酸**7477757876丝氨酸3633323332组氨酸66566甘氨酸356341333332334苏氨酸2526252625精氨酸5655545554丙氨酸128131127131128酪氨酸32222胱氨酸00000缬氨酸2020192020蛋氨酸108999羟赖氨酸64454苯丙氨酸1416151515异亮氨酸1010101010亮氨酸2523232424赖氨酸2827272827羟脯氨酸3266636458脯氨酸130109132115131
由表1可知,反应后得到的降解产物(1~4h)与未水解前鱼皮纤维(0h)的氨基酸组成略有一定差别。鱼皮纤维的氨基酸组成中甘氨酸超过总氨基酸物质的量的1/3(356个/1000个氨基酸残基)。丝氨酸、精氨酸、蛋氨酸、亮氨酸未水解的数量比反应后的降解产物多,而羟脯氨酸未水解数量低于反应后的降解产物。Ⅰ型胶原具有典型(Gly-X-Y) n的氨基酸组成特征,其中羟脯氨酸是胶原的特有氨基酸,在胶原蛋白中的含量相对比较稳定。由此可见,鱼皮纤维的氨基酸组成中显示其含有部分非胶原的蛋白质组分,说明鱼皮在前处理中并未能将非胶原杂蛋白去除净。
不同反应时间下罗非鱼皮胶原降解产物的氨基酸组成非常接近,某些氨基酸含量存在微小差异。不同时间的降解产物与符合胶原蛋白的氨基酸组成特征:甘氨酸约占总氨基酸物质的量的33%,蛋氨酸、组氨酸和酪氨酸含量少,胱氨酸都没有被检测出,亚氨基酸(脯氨酸和羟脯氨酸)约为190个/1000个氨基酸残基,约占总氨基酸物质的量的1/5,羟脯氨酸和羟赖氨酸,两者分别占总氨基酸残基比例约为60、4个/1000个氨基酸残基。相比较浸灰后鱼皮纤维的氨基酸组成,甘氨酸残基所占比例略有下降,羟脯氨酸残基所占比例却增加1倍。羟脯氨酸是胶原蛋白的特征性氨基酸。
与冷水鱼明胶相比较 [15],罗非鱼皮明胶在氨基酸组成上比较类似,但是丝氨酸、羟赖氨酸残基比例有所降低,而罗非鱼皮明胶的羟脯氨酸比商业冷水鱼明胶残基占总氨基酸比例有所增加,比猪皮明胶有所降低。因为羟基的氢键作用,羟脯氨酸被认为在胶原三股螺旋的稳定性中起着关键作用 [16],羟脯氨酸占氨基酸比例越高,明胶的凝胶强度越大。由表1可知,随着反应时间的延长,所得明胶的羟脯氨酸残基所占总氨基酸物质的量逐渐降低,特别是反应4h,羟脯氨酸所占比例降低速率更快了。故在制备鱼皮明胶的过程中,应权衡提取率的同时控制反应时间的长短,防止明胶凝胶强度下降,质量等级降低。
由氨基酸数据变化可知,同种原料在其他条件相同的情况下,反应不同时间得到的明胶的氨基酸组成除羟脯氨酸逐渐减少外,其他氨基酸没有发生太大变化。所以过氧化氢制备鱼皮明胶工艺中,明胶的氨基酸组成比较稳定。综合其他检测指标可知,鱼皮纤维反应3h左右能够得到理想的产率,而继续加热反应会导致次级水解产生对指标明胶不利的影响。
2.4 降解产物的分子质量及分子质量分布
不同反应时间得到的降解产物配制成5mg/mL的明胶溶液,上样量为10μL,电泳测定其蛋白质分子质量分布,结果如图3所示。

图3不同反应时间下明胶分子质量分布
Fig.3SDS-PAGE patterns of fish skin gelatins at different reaction times
胶原的降解组成存在有3种组分:γ组分分子质量在240~370kD,β组分分子质量为160~250kD,α组分分子质量为80~125kD [10]。由图3可知,反应产物在130kD附近有集中的2条染色带,在200kD以上分子质量也有较为明显的2条带,其他部分还有分散的染色区域。说明降解产物以α组分和β组分为主,同时也存在不同水解程度的分子片段。随着降解时间的延长,反应4h时,电泳谱带下移,分子质量在66.2kD以下的小分子显现,分子质量分布分散,说明胶原纤维降解加剧,有小分子质量的胶原肽降解片段产生。在反应4h内,γ、β、α 1链的谱带强度随反应时间增加没有显著差异,与Kittiphattanabawon等 [17]研究不同温度、时间下点纹斑竹鲨和黑鳍鲨皮的明胶的分子质量谱带相比,其谱带分布更集中在较大分子质量位置。与Duan等 [18]研究的在60℃提取的鲤鱼皮明胶分子质量分布类似。说明制备罗非鱼皮明胶时的反应条件温和,分子质量降解较为缓和。明胶组分分布与明胶凝胶强度之间存在着明显的相关性,α组分含量高,其凝胶强度也高,α组分含量少,其凝胶强度也低 [19]。反应4h的明胶含有较多α链断裂片段,使得其中小分子质量组分增加,故明胶的凝胶强度较之前有所降低。罗非鱼皮胶原纤维制备明胶的反应过程中,在获得高产率的提取时间下,分子质量分布说明了纤维降解维持在一个集中的范围而不分散,不至于使产品明胶的黏度和胶冻强度恶化。
制备明胶过程中,原胶原从胶原纤维束和微纤维中解离,释放到溶剂中,使溶剂中大分子溶质的质量数增加,反应溶液具备胶凝性,且凝胶强度随反应时间延长而增大。反应产物的表观黏度在前期随反应时间延长而增加,3h达到最大值。随着反应时间的延长,释放到溶剂中的原胶原大分子发生肽键水解或共价键断裂,使原胶原分子肽链降解为更小片段,从而因溶质的分子质量减小导致相同质量浓度下反应产物明胶的黏度降低。明胶制备过程中产物的氨基酸组成与鱼皮均没有显著变化,说明过氧化氢协同热效应,通过水解肽键的方式,实现胶原纤维向可溶态明胶的转变。电泳图谱亦显示,反应4h的样品,130kD以下的分子质量组分增加。结合制备明胶过程中底物的变化规律,说明为了获得高质量的明胶,胶原的热降解应控制在原胶原充分解离,但还未发生肽键水解的阶段终止反应,此时得到的产物的分子质量较大,产品黏度和凝胶强度较高。
参考文献:
[1]彭必先,陈丽娟.从胶原到明胶[J].明胶科学与技术,1994,14(1):1-14.
[2]LIU Haiying,LI Ding,GUO Shidong.Extraction and properties of gelatin from channel cat☒sh(Ietalurus punetaus)skin[J].LWT-Food Science and Technology,2008,41(3):414-419.
[3]KENYON J,SILBERSTEIN V.Production of gelatin or glue from hides and other collagen or ossein-containing materials:US,2453630[P].1983-05-05.
[4]ALEXANDRESCU G,SUAZER A.Die verwendung hydrotropaktiver stoffe in der leimund gelatinfabrikation[J].Review Chemistry(Buearesti),1966,7:360-367.
[5]The General Foods Company.Method of recovering gelatin:UK,866622[P].1998-11-03.
[6]FRANKLIN K,GARONO L E,STEIGMANN A E.Process for extracting gelatin and glue:US,2743265A[P].1956-04-24.
[7]HILL J E,HILL N C.Improved method for extracting glue and gelatin from hide and bones:US,2517487[P].1993-05-11.
[8]COUDUN C.Manufacture of glue and gelatin:French,992174[P].1999-02-17.
[9]沃德A G,考茨A.明胶的科学与工艺学[M].北京:中国轻工业出版社,1982:181-186.
[10]AEWSIRI T,BENJAKUL S,VISESSANGUAN W.Functional properties of gelatin from cuttlefish(Sepia pharaonis)skin as affected by bleaching using hydrogen peroxide[J].Food Chemistry,2009,115:243-249.
[11]GALLO P,SEIETF P M,MEILMAN E.Recent advances in gelatin and glue research[M].London:Pergamon Press,1958:378-382.
[12]DEY C L,MIEHELE S C.Gelatin handbook[J].Journal of American Leather Chemistrys Association,1965,60:665-674.
[13]何虹,刘小玲,姜元欣,等.罗非鱼皮明胶的过氧化氢法提取工艺[J]. 食品与发酵工业,2012,38(5):218-222.
[14]章爱娣,劳国强.明胶生产工艺及设备[M].北京:中国轻工业出版社,1996:24-53.
[15]EYSTURSKAR☒J,HAUG I J,ELHARFAOUI N,et al.Structural and mechanical properties of☒sh gelatin as a function of extraction conditions[J].Food Hydrocolloids,2009,23:1702-1711.
[16]BURJANDZE T V.Hydroxy-proline content and location in relation to collagen thermal stability[J].Biopolymers,1979,18:931-936.
[17]KITTIPHATTANABAWON P,BENJAKUL S,VISESSANGUAN W,et al.Comparative study on characteristics of gelatin from the skins of brownbanded bamboo shark and blacktip shark as affected by extraction conditions[J].Food Hydrocolloids,2010,24:164-171.
[18]DUAN Rui,ZHANG Junjie,XING Fangfang,et al.Study on the properties of gelatins from skin of carp(Cyprinus carpio)caught in winter and summer season[J].Food Hydrocolloids,2011,25(3):368-373.
[19]黄惠君,程晋生.胶原与明胶分子的化学基础和明胶的凝胶化[J].明胶科学与技术,2005,25(2):82-86.
Hydrogen Peroxide-Induced Degradation of TypeⅠCollagen Fibers of Tilapia Skin(Ⅱ):Changes in Composition and Properties of Degraded Products
LIU Xiaoling
1,2,HE Hong
1,2,JIANG Yuanxin
1,JIANG Hongrui
1,2,LI Quanyang
1,2
(1.Institute of Light Industry and Food Engineering,Guangxi University,Nanning530004,China;2.Guangxi Universities Key Laboratory of Local Farming Products Processing and Food Safety Control,Nanning530004,China)
Abstract:The amino acid composition,molecular weights and properties of degraded collagen fibers of tilapia skin induced by heat and hydrogen peroxide were studied.Experimental results showed that collagen fibers degradation could be divided into three stages.At the first stage,collagen fibers contracted when heated and no significant change was observed in the reaction solution.At the second stage,collagen fibers and microfibers were disrupted and procollagen was released into the solution,leading to an increase in the apparent viscosity of the reaction solution and the occurrence of gelation when cooled,with a time-dependent increase in gel strength.At the third stage,the peptide bonds of procollagen were broken,releasing smaller peptide chains after3h and causing a decrease in apparent viscosity and gel strength.The amino acid composition of the degraded products was slightly different from that of the original collagen fibers and there was no significant change during different reaction periods.It was proved that collagen fibers can be transformed into gelatin by hydrolysis of peptide bonds or crosslinking oxidation when heated in combination with hydrogen peroxide treatment.
Key words:tilapia;collagen fibre;hydrogen peroxide;degradation
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2015)05-0013-05
doi:10.7506/spkx1002-6630-201505003
收稿日期:2013-09-26
基金项目:国家自然科学基金地区科学基金项目(31060234);广西科技攻关计划项目(桂科重14121004-3);广西自然科学基金项目(2011GXNSFC018010);茂名科技计划项目(2012A01005)
作者简介:刘小玲(1972—),女,教授,博士,研究方向为生物大分子结构与性质。E-mail:13877173857@163.com