盐法提取豌豆分离蛋白凝胶特性及影响因素
单宏
(黑龙江省农业科学院农产品质量安全研究所,黑龙江哈尔滨150086)
摘要:采用一种低变性的提取方法——盐法提取豌豆分离蛋白并使用流变仪测定其流变特性,结果表明:盐法豌豆分离蛋白最低凝胶形成质量浓度是5.5g/100mL,豌豆分离蛋白凝胶点与蛋白质量浓度无相关性。豌豆分离蛋白凝胶点随加热速率增加呈上升趋势。较高的加热和冷却速率能够增加反应终点储能模量(G')和耗能模量(G”)值,因而降低凝胶强度。盐法豌豆分离蛋白凝胶韧性随蛋白质量浓度的增加而增大,且蛋白质量浓度与G'、G”值之间存在乘幂规律。tanδ值随蛋白质量浓度升高而降低,当蛋白质量浓度高于5g/100mL时,弱凝胶开始形成;当蛋白质量浓度高于7g/100mL时,tanδ值几乎保持恒定,表明凝胶弹性在此范围内基本恒定。比较盐法和商业豌豆分离蛋白凝胶性质后发现:盐法豌豆分离蛋白具有更好的凝胶性。
关键词:豌豆分离蛋白;盐法提取;凝胶;凝胶点;最低凝胶质量浓度;加热冷却速率;盐浓度
传统上豌豆一直作为蔬菜食用,近年来豌豆深加工有了一定发展,人们期待用豌豆分离蛋白(pea protein isolate,PPI)替代大豆蛋白用于肉制品乳化,然而与大豆蛋白相比,豌豆分离蛋白只能形成弱凝胶
[1],使其作为大豆蛋白替代品受到一定限制。目前对豌豆分离蛋白的凝胶性质研究较少,因此深入开展豌豆分离蛋白凝胶特性研究,进而开发可替代大豆分离蛋白(soy protein isolate,SPI)的豌豆分离蛋白,可为豌豆深加工探索新的出路,提升我国豌豆生产加工企业的经济效益。
许多植物蛋白都是球蛋白
[2],蛋白凝胶的形成是由无定形溶液转化为三维弹性网状结构的过程
[1]。球蛋白要形成交联成网状的凝胶,就必须要打开其球状结构。因而可以预期任何能够打开球蛋白结构,使包埋在其中的活性基团暴露的处理都可以改善植物蛋白的交联能力
[2]。加热处理可使豌豆分离蛋白产生部分变性,打开其球状结构,促进蛋白产生交联,形成三维结构的凝胶
[1]。
小张力振荡动态测试(small strain oscillatory dynamic testing)因其对样品物理结构和化学组分的变化特别敏感而在评估凝胶性质和凝胶强度方面有较大的应用价值
[3],近年来在对食品凝胶体系评价中应用逐渐增多。该方法测试过程中温度变化梯度很小,通过对温度的扫描可以记录下与流变性质相关的从液体到胶体的能量转化过程细节。可将动态流变测试或小张力凝胶强度测试用于研究热诱导的植物蛋白凝胶形成过程,这种方法适于测量与凝胶形成现象相关的细微变化
[4]。采用小张力振荡动态测试原理的流变仪可测试热诱导的豌豆分离蛋白凝胶体系并获得较好的结果。
储能模量(G')是对正弦剪切变形的每一循环能量恢复的测量,其增量代表了与弹性凝胶结构相关的样品的硬度
[5]。G'的变化可以用于监测豌豆分离蛋白的凝胶过程。高储能模量(G')值表示凝胶体系中较强的分子间网络结构及增强的蛋白-蛋白和蛋白-多聚物分子之间的相互作用,而较低的tanδ(G”/G')值表示弹性更强的网络结构
[6]。加热会引起蛋白质悬浊液产生由溶胶到凝胶的转化,这是随着储能模量G'值的快速增大并最终与耗能模量值(G”)形成交叉,交叉点为G'值开始大于G”时,这个点的温度即为凝胶的起始点,即文献[7-10]中最常提到的G'-G”交叉点。
本实验研究了盐法提取豌豆分离蛋白热诱导凝胶性质以及加热和冷却速率、盐浓度和蛋白质量浓度对凝胶性的影响,并与商品豌豆分离蛋白和商品大豆分离蛋白进行比较,旨在探索盐法豌豆分离蛋白应用于乳化肉制品的可行性。
1 材料与方法
1.1 材料与试剂
商业豌豆粉(蛋白质含量大于25%)大连嘉昱食品有限公司。
豌豆分离蛋白(蛋白质含量为大于82%)烟台东方蛋白科技有限公司;PRO-FAM974商业大豆分离蛋白(蛋白质含量为90%)美国Archer Daniels Midland(ADM)公司。
1.2 仪器与设备
TA2000流变仪美国TA公司;Vortex Genie Mixer振荡混合器美国Scientific Industries公司;AXGL10M高速大容量冷冻离心机上海赵迪实验室离心机公司;K2300自动凯氏定氮仪瑞典FOSS公司。
1.3 方法
1.3.1 盐法豌豆分离蛋白提取程序
盐法豌豆分离蛋白提取步骤为:
200g豌豆粉+800mL0.3mol/L NaCl→搅拌60min→离心(5000r/min,20min)→收集上清液→上清液与蒸馏水按1∶2混合→在5℃冰箱中静置2h→离心(2000r/min,15min)→收集沉淀→与少量蒸馏水混合搅拌→在透析袋中进行离子交换,在5℃冰箱中放置72h,每24h换一次蒸馏水→冷冻干燥
1.3.2 蛋白质含量测定
采用凯氏定氮法,转换系数为5.7
[11]。
1.3.3 样品制备
按照实验设计,将盐法豌豆分离蛋白、商品豌豆分离蛋白、商品大豆分离蛋白与不同浓度的NaCl溶液混合以获得需要的蛋白质含量和盐浓度。为获得均匀分散的悬浊液,样品用振荡混合器振荡1min以保证分离蛋白完全分散,悬浊液的pH值为自然值6.2~6.3,待测。
1.3.4 最低凝胶质量浓度测定
最低凝胶质量浓度测定采用O’Kane等
[12]的方法并略加修改。分别配制5mL4~18g/100mL的盐法豌豆分离蛋白悬浊液及8~20g/100mL的商品豌豆分离蛋白悬浊液。所有样品均在95℃水浴锅中加热10min(在密封的试管中以防止水分蒸发)。将样品在室温下冷却1h,在4℃存放过夜。第2天将试管倒置,24h后未流下液体的视为产生凝胶,从而确定最低凝胶质量浓度。
1.3.5 流变学特性测定
取约1mL豌豆分离蛋白悬浊液置于流变仪的工作台上(为避免测定期间样品水分蒸发,可加入适量矿物油到上平板的凹槽中,然后覆盖特殊金属盖以防止加热期间样品蒸干)。设定间隙高度为1.00mm。在加热和冷却速率实验中,采取4个不同的加热和冷却速率:4、2、1、0.5℃/min,且每个测试加热和冷却速率保持相同。样品首先在25℃平衡2min,然后在25~95℃温度范围内,以4、2、1、0.5℃/min的速率加热至95℃,然后冷却至25℃,最后在25℃进行频率扫描。频率扫描范围为0.01~10Hz。实验采用2次重复。除特别注明,所有处理均为蛋白质质量浓度14.5g/100mL,NaCl浓度0.3mol/L,加热和冷却速率均为2℃/min。
1.3.6 凝胶点测定
采用G'和G”交叉点温度为豌豆分离蛋白的凝胶点。
1.4 统计分析
所有数据均进行显著性分析,采用Graph Pad In Stat3.06进行Tukey’s检验,最低显著水平设为0.05。
2 结果与分析
2.1 最低凝胶质量浓度
Clark等
[13]根据网络结构形成前和形成过程中大分子聚合水平将多聚物凝胶区分为:1)由无序多聚物形成的凝胶,如卡拉胶、果胶、淀粉等;2)蛋白质凝聚,如热变性球蛋白和由酶或化学反应引起的凝胶,凝胶网络结构包括高密度和不灵活的粒子之间的特定作用。食品中常用于球蛋白凝胶的方法是加热变性,可以导致蛋白质四级、三级和二级结构的变化。它使一个球蛋白分子变性,二个以上凝聚,更多的则会形成一个胶体网络结构
[13]。由球蛋白制备凝胶需要其蛋白质量浓度比果胶或成胶碳水化合物浓度高出一个数量级
[14]。因此,较高的质量浓度是豌豆分离蛋白形成凝胶的一个必要条件。
与盐法相比,碱溶酸沉法提取的豌豆分离蛋白会产生严重的变性,导致其凝胶能力下降。当豌豆分离蛋白质量浓度为14.5g/100mL时,与商品豌豆分离蛋白(碱溶酸沉法提取)相比,盐法蛋白凝胶有着较高的G'和较低的tanδ值,可形成良好的凝胶,而商品豌豆分离蛋白只能形成极弱的凝胶,这是一种类似酱类的形态,弹性很差。
本实验制备的盐法豌豆分离蛋白质含量为81.91g/100g,最低凝胶质量浓度为5.5g/100mL,而商品豌豆分离蛋白的最低凝胶质量浓度为14.5g/100mL。与O’Kane等
[12]报道的含有20~28g/100g豆球蛋白和61~67g/100g豌豆球蛋白的豌豆分离蛋白的热诱导凝胶在中性条件下(pH7.1)的最低凝胶质量浓度(16g/100mL)十分接近。由于O’Kane等
[12]提取豌豆分离蛋白的方法是等电点沉淀法,与商业豌豆分离蛋白提取方法相同,该法会导致严重的蛋白变性而降低其功能性。
2.2 凝胶点
凝胶点是凝胶开始形成的初始点,以G'-G”交叉点作为凝胶点已获得广泛认可。Shimada等
[15]依据凝聚点与蛋白质量浓度的相关性将蛋白划分为凝聚型蛋白(与蛋白质量浓度相关)和凝胶型蛋白(与蛋白质量浓度不相关)两类。因此凝胶型蛋白具有恒定的凝胶点。由表1可知,不同质量浓度豌豆分离蛋白凝胶点在83~86℃之间波动,显示凝胶点与蛋白质量浓度不相关,推断豌豆分离蛋白是凝胶型蛋白。由表2可知,随加热速率的提高,凝胶点亦有升高的趋势。然而,在较高的加热速率(2~4℃/min)时,规律不明显。可见,在较低的加热速率时,凝胶点与加热速率相关;而在较高的加热速率时,凝胶点与加热速率无关。
表1 盐法提取豌豆分离蛋白质量浓度对凝胶点的影响
Table1Influence of protein concentration on gelling point
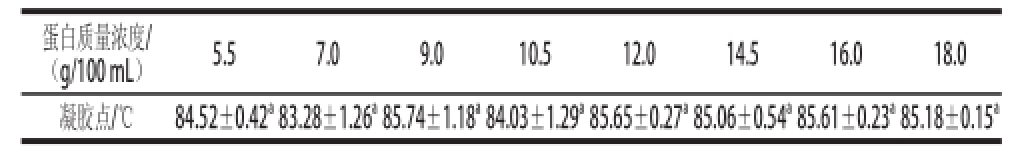
注:同行小写字母不同表示差异显著(P<0.05)。表2同。
蛋白质量浓度/(g/100mL)5.57.09.010.512.014.516.018.0凝胶点/℃84.52±0.42
a83.28±1.26
a85.74±1.18
a84.03±1.29
a85.65±0.27
a85.06±0.54
a85.61±0.23
a85.18±0.15
a
表2加热和冷却速率对凝胶点的影响
Table2Influence of heating and cooling rate on gelling point
Table2Influence of heating and cooling rate on gelling point

加热速率/(℃/min)0.51234凝胶点/℃61.34±1.76
a68.38±1.95
b85.22±0.48
c83.54±0.33
c84.68±1.76
c
2.3 加热速率和冷却速率对凝胶G'的影响
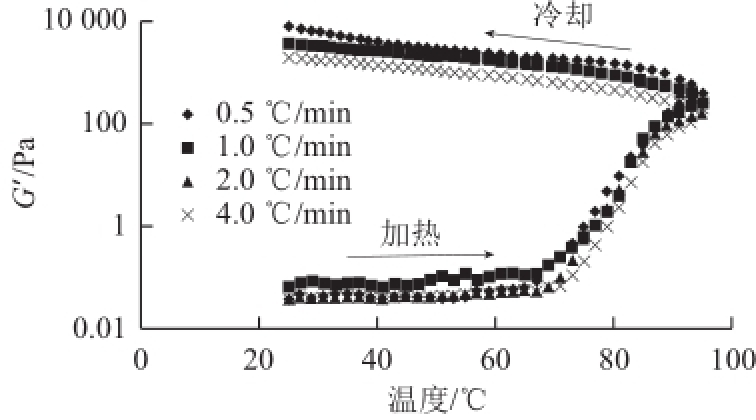
图1 加热和冷却速率对储能模量G'的影响
Fig.1Impact of heating and cooling rate on the development of storage modulus G'
由图1可知,当以最大速率(4℃/min)加热和冷却时,测得的G'值小于较慢加热和冷却速率(0.5、1、
2℃/min)条件下测得的数值。说明在较高的加热和冷却速率下形成的凝胶需要较高的温度才能达到与在较低的加热和冷却速率下形成的凝胶相同的弹性。此外,
0.5 ℃/min的G'值最大,这是因为较慢的加热和冷却速率可使蛋白分子有充足的时间重新排列成某种合理的顺序因而增强了凝胶的韧性
[16-18]。
2.4 蛋白质量浓度对凝胶G'和G”的影响

图2热致变豌豆分离蛋白凝胶网络的蛋白质量浓度与
G'和G”之间的关系
Fig.2Relationship between pea protein concentration and either G' 'or G”values for heat-induced networks
由图2可知,随着蛋白质质量浓度的增加,G'和G”值均增大。这很可能是因为随蛋白质质量浓度的增加,豌豆分离蛋白交联的机率亦增加,从而生成较强的凝胶。
以豌豆分离蛋白质量浓度(ρ)为横坐标,G'、G”为纵坐标,对图2中曲线进行拟合得到方程:G'=0.0002ρ
6.2(R
2=0.97);G”=0.0006ρ
5.0(R
2=0.97)。在早期研究中,研究者发现增加蛋白质量浓度可增大G'和G”值
[19-20],G'与蛋白质量浓度和G”与蛋白质量浓度之间存在一个乘幂规律。Arntfield等
[19]用类似的方法描述豌豆球蛋白的G'和其质量浓度之间关系,并获得类似的乘幂规律。

图3蛋白质量浓度对热致变凝胶网络tantanδ的影响
Fig.3Effect of protein concentration on tanδfor heat-induced gel networks
凝胶过程也可以用测定振荡期间应力——应变相角变化的方式进行监测,由G”/G'比率获得的tanδ值可传递溶胶——凝胶的转变信息。本研究中这一转化过程发生在加热阶段。在加热期间tanδ值越低表示凝胶的弹性越好。从实验数据推断豌豆分离蛋白网络结构的形成在83℃以上开始(表1),形成了凝胶理想的机械性能。在较低振荡频率时固体胶的tanδ值大约为0.01,弱凝胶的tanδ值约为0.1
[21]。理论上认为,如果δ =0°,这种物质就是理想的完全弹性凝胶,而δ=90°时,这种物质则是理想液体。
当受热变性时,暴露在蛋白质分子表面的疏水性残基会显著增加。二硫键很可能会在蛋白质聚合的第一步形成。加热导致分子间硫氢基——二硫化物的交换,使蛋白质分子产生聚合
[22]。显著降低的tanδ值表示弹性的增强。由图3可知,当豌豆分离蛋白含量从4%升高到7%时,tanδ值迅速从0.98下降到0.17,然后在0.16~0.17之间波动,这表明当豌豆分离蛋白质量浓度高于5g/100mL时,弱凝胶开始形成。当蛋白质量浓度高于7g/100mL时,tanδ值几乎保持恒定,表明凝胶弹性在此范围内基本恒定。
2.5 盐浓度对盐法提取豌豆分离蛋白凝胶特性的影响
由图4可知,在盐浓度为0mol/L时,G'值非常小,仅有0.35Pa,而tanδ值高达0.86,这表明与高盐浓度(0.3~1.0mol/L)相比,形成的凝胶较弱。盐浓度为0.1mol/L时,G'仅有0.61Pa,tanδ值却下降到很低的水平(0.13),说明已形成了凝胶,此时有大量水析出,说明该盐浓度条件下蛋白的持水力较差。观察发现在0.1mol/L盐浓度形成的凝胶其强度要比0.3mol/L以上盐浓度形成的凝胶高,这与Catsimpoolas等
[23]的研究报道相似。可能由于盐浓度的增大利于在蛋白分子表面电荷形成屏蔽效应,导致蛋白分子间排斥力削弱,产生与等电区域相同的情形,因而形成强度较高的凝胶。而进一步增加盐浓度会削弱缠绕成球状的蛋白分子结构的打开,从而妨碍凝胶的形成
[24]。

图4NaCl浓度对豌豆分离蛋白凝胶性的影响
Fig.4Effect of NaCl concentration on gelation properties of PPIs
由图4可知,G'曲线上有2个峰值,一个在盐浓度为0.4mol/L处,另一个在0.7mol/L处,表明在这两个盐浓度条件下,蛋白之间相互作用较强,形成了强度较高的凝胶。这可能是由于在这两个盐浓度条件下蛋白质分子之间具有较好的静电平衡,从而形成较强的凝胶
[25]。

图5凝胶点与NaCl浓度的关系
Fig.5Relationship between gelling point and NaCl concentration
另外,盐浓度对凝胶点也有较大影响,如图5所示,随着NaCl浓度的增加,凝胶点呈升高趋势。这可能是由于在较低的盐浓度区间蛋白分子表面电荷形成屏蔽效应,导致蛋白分子间排斥力减弱
[23],因而能够在较低温度下开始形成凝胶;而随着盐浓度的增加,球状蛋白质分子结构的打开受到抑制
[24],导致凝胶形成变得困难,因而凝胶点温度提高。
2.6 盐法豌豆分离蛋白、商品豌豆分离蛋白和商品大豆蛋白凝胶性质比较
表3盐法豌豆分离蛋白、商品豌豆分离蛋白和商品大豆蛋白的凝胶性质比较
Table3Comparison of gelation properties of PPIs,PPIc,and SPIc

注:—.无凝胶点。同列小写字母不同表示差异显著(P<0.05)。
样品G'/PaG”/Pa tanδ 凝胶点/℃ 商品豌豆分离蛋白349.54±36.13
a253.56±0.74
a0.74±0.09
a87.91±0.52
a盐法豌豆分离蛋白3212.51±0.74
b532.68±4.75
b0.17±0.00
b85.21±0.63
a商品大豆蛋白889.57±44.63
c225.00±5.71
c0.25±0.01
b—
由表3可知,盐法豌豆分离蛋白的凝胶G'(3212.51Pa)远高于商品豌豆分离蛋白(349.54Pa)。这是因为商品豌豆分离蛋白采用等电点沉降法制得,豌豆分离蛋白因酸处理严重变性,导致凝胶性能显著降低。
3 结论
球蛋白,如豌豆分离蛋白,能够形成热诱导凝胶,豌豆分离蛋白需要一定程度的变性以打开其缠绕的肽链、暴露出相关基团、进行交联以产生形成凝胶的非共价键和二硫键。变性程度较低时,豌豆分离蛋白可形成较强的凝胶。影响豌豆热诱导凝胶性质的因素中盐浓度是最重要的。实验结果显示,最适盐浓度大约为0.4、0.7mol/L,过高和过低的盐浓度都会导致凝胶的弱化;较高的盐浓度导致较高的凝胶点;蛋白质量浓度越高,凝胶韧性越大,然而凝胶点与蛋白质量浓度无关。实验证实加热速率也会影响凝胶点,较高的加热速率使凝胶点升高;提高加热和冷却速率均会引起凝胶弹性的弱化。
盐法提取豌豆分离蛋白是一种温和的提取方法,可以极大减轻豌豆分离蛋白变性程度。用此方法提取的豌豆分离蛋白与等电点沉降法(商业方法)相比具有优良的凝胶能力。因此,盐法提取豌豆分离蛋白可作为功能性蛋白添加剂应用于乳化肉制品中,具有良好的开发前景。
参考文献:
[1]O’KANE F E,HAPPE R P,VEREIJKEN J M,et al.Characterization of pea vicillin.2.Consequences of compositional heterogeneity on heat-induced gelation behavior[J].Journal of Agricultural and Food Chemistry,2004,52(10):3149-3154.
[2]NIELSEN P M.Reactions and potential industrial applications of transglutaminase.Review of literature and patents[J].Food Biotechnology,1995,9(3):119-156.
[3]WESTPHALEN A D,BRIGGS J L,LONERGAN S M.Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J].Meat Science,2005,70(2):293-299.
[4]HAMANN D D.Methods for measuring rheological changes during thermally induced gelation of proteins[J].Food Technology,1987,41(3):100-108.
[5]EGELANDSDAL B,MARTINSEN B,AUTIO K.Rheological parameters as predictor of protein functionality:a model study using myofibrils of different fiber-type composition[J].Meat Science,1995,39(1):97-111.
[6]URUAKPA F O,ARNTFIELD S D.Impact of urea on the microstructure of commercial canola protein-carrageenan network network:a research note[J].International Journal of Biological Macromolecules,2006,38(2):115-119.
[7]IKEDA S,NISHINARI K.On solid-like rheological behaviors of globular protein solutions[J].Food Hydrocolloids,2001,15(4/6):401-406.
[8]STADING M,HERMANSSON A M.Viscoelastic behavior ofβ-lactoglobulin structures[J].Food Hydrocolloids,1990,4(2):121-135.
[9]ROSS-MURPHY S B.Rheological characterisation of gels[J].Journal of Texture Study,1995,26(4):391-400.
[10]YOON W B,KIM B Y,PARK J W.Rheological characteristics of fibrinogen-thrombin solution and its effects on surimi gels[J].Journal of Food Science,1999,64(2):291-294.
[11]AACC.Approved Methods of the American Association of Cereal Chemists[S].
[12]O’KANE F E,VEREIJKEN J M,GRUPPEN H,et al.Gelation behaviour of protein isolates extracted from5cultivars of Pisum sativum L.[J].Journal of Food Science,2005,70(2):C132-C137.
[13]CLARK A H,ROSS-MURPHY S B.Structure and mechanical properties of biopolymer gels[M]//CLARK A H,ROSS-MURPHY S B.Advances in polymer science.Berlin Heidelberg:Springer,1987:57-192.
[14]TOMBS M P.Gelation of globular proteins[J].Faraday Discussions of the Chemical Society,1974,57:158-164.
[15]SHIMADA K,MATSUSHITA S.Thermal coagulation of egg albumin[J].Journal of Agricultural and Food Chemistry,1980,28(2):409-412.
[16]ARNTFIELD S D, MURRAY E D.Heating rate affects thermal properties and network formation for vicilin and ovalbumin at various pH values[J].Journal of Food Science,1992,57(3):640-646.
[17]STADING M,LANGTON M,HERMANSSON A M.Microstructure and rheological behaviour of particulate beta-lactoglobulin gels[J].Food Hydrocolloids,1993,7(3):195-212.
[18]LI J,OULD ELEYA M M,GUNASEKARAN S.Gelation of whey protein and xanthan mixture:effect of heating rate on rheological properties[J].Food Hydrocolloids,2006,20(5):678-686.
[19]ARNTFIELD S D,MURRAY E D,ISMOND M A H.Dependence of thermal properties as well as network microstructure and rheology on protein concentration for ovalbumin and vicilin[J].Journal of Texture Studies,1990,21(2):191-212.
[20]van KLEEF F S M.Thermally induced protein gelation and rheological characterization of highly concentrated ovalbumin and soybean protein gels[J].Biopolymers,1986,25(1):31-59.
[21]ROSS-MURPHY S B.Rheological methods[M]//CHAN H W S.Biophysical methods in food researach.Oxford:Alden Press,1984:138-199.
[22]HERMANSSON A M.Aggregation and denaturation involved in gel formation[M]//POUR-EL A.Functionality and protein structure.Washington:American Chemical Society,1979:81-103.
[23]CATSIMPOOLAS N,MEYER E W.Gelation phenomena of soybean globulins.I.Protein protein interactions[J].Cereal Chemistry,1970,47:559-570.
[24]BOYE J I,ALLI I,ISMAIL A A,et al.Factors affecting molecular characteristics of whey protein gelation[J].International Dairy Journal,1995,5(4):337-353.
[25]RENKEMA J M S,LAKEMOND C M M,de JONGH H H J,et al.The effect of pH on heat denaturation and gel forming properties of soy proteins[J].Journal of Biotechnology,2000,79(3):223-230.
Gel-Forming Characteristics of Pea Protein Isolate and Their Affecting Factors
SHAN Hong(Safety and Quality Institute of Agricultural Products,Heilongjiang Academy of Agricultural Sciences,Harbin150086,China)
Abstract:A novel low-denaturation extraction method,salt method,was applied to extract pea protein isolate from commercial pea flour and the gelation characteristics of this protein isolate were determined by a rheometer.The minimum gelation concentration of salt extracted pea protein isolate(PPIs)was5.5g/100mL.No correlation was noted between the gelation point and concentration of PPIs,but the gelling point showed a tendency of increasing with heating rate.Meanwhile,higher heating and cooling rates resulted in decreased final G'(storage modulus)and G”(loss modulus),thus reducing the gel stiffness.Higher protein concentration induced greater gel stiffness,and higher G'and G”values.It was found that there were power law relationships between protein concentration and either G'or G”values.Tan delta value decreased with increasing protein concentration,and weak gel was formed when protein concentration was greater than5g/100mL;however,when protein concentration was greater than7g/100mL,tan delta kept almost constant,which indicated that gel elasticity was constant within this concentration range.When comparing gelation properties of PPIs to commercial pea protein isolate(PPIc),the gel stiffness of PPIs was much greater than that of PPIc.Therefore,PPIs may have greater market prospect than PPIc in emulsified meat products.
Key words:pea protein isolate;salt extraction;gelation;gelling point;minimum gelation mass concentration;heating and cooling rate;salt concentration
中图分类号:TS252.53
文献标志码:A
文章编号:1002-6630(2015)05-0072-05
doi:10.7506/spkx1002-6630-201505014
收稿日期:2014-05-11
作者简介:单宏(1971—),女,副研究员,硕士,研究方向为农产品功能性评价。E-mail:ningjing8139@sina.com






