延边泡菜品质评价以及耐盐酵母菌的筛选
乌日娜
1,2,孟令帅
1,王茜茜
1,于美玲
1,岳喜庆
1,武俊瑞
1,*
(1.沈阳农业大学食品学院,辽宁沈阳110866;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
摘要:从延边11个泡菜样品中分离出37株酵母菌,根据其子囊孢子、假菌丝和细胞形态等生理生化特征,可将其分为爱尼拉酵母属、拿逊酵母属和毕赤氏酵母属等9个属。再从中筛选出6株耐盐酵母菌。对6株耐盐酵母菌的26S rDNA D1/D2区域进行测序,通过序列分析和构建系统发育树,进行种属鉴定。结果表明:6株耐盐酵母菌分别来自两个属。LB1-3和YB1-3属于酿酒酵母属,LB1-3被鉴定为Kazachstania turicensis;YB1-3被鉴定为Kazachstania exigua。LD1-3、TB1-3、YL1-2和TL1-2属于酵母属,被鉴定均为赛瓦酵母(Saccharomyces servazzii)。
关键词:泡菜;酵母菌;26S rDNA;系统发育树;同源性分析
泡菜作为发酵食品之一,在我国已经有很长历史。由于其制作成本低,风味美,而且便于保藏,深受人们的喜爱。同时,泡菜中富含丰富的营养物质,包括维生素、钙和磷等无机物
[1]。泡菜是蔬菜类经自然发酵而得,是韩国和朝鲜族的一种传统食品。就数量而言,有上百种泡菜,包括白萝卜、辣白菜和大头菜等
[2],现已被世界各地广泛地用作配菜。泡菜的主要原料是大白菜,主要用于辣椒面食谱。它的制作方式是
[3]:先用盐水将白菜腌制,低温贮存几天,然后将辣椒、大蒜、生姜、鱼汁、青梅汁和蜂蜜等配料混匀后,均匀地涂抹于白菜的表面;再将一些切片水果,涂抹在白菜的表面,最后经乳酸菌等微生物发酵而成。延边朝鲜族当地人做泡菜,关键由三部分组成,那就是容器、盐水及调料
[4],其中最关键的就是容器。用来存放泡菜的容器是地窖,也就是他们俗称的地气。地气意指饮食五谷之气,俗话说“天气通于肺,地气通于嗌”,地窖对于泡菜来说无疑是最好的保藏容器。
20世纪初,人们已经开始研究发酵蔬菜中的微生物
[5],大家都知道乳酸菌对于泡菜的发酵起着重要的作用,同时,酵母菌作为泡菜中的重要发酵微生物之一,对蔬菜发酵的风味和质地以及发酵后的贮藏也有着重要影响
[6]。蔬菜发酵期间,酵母菌引发发酵生成乙醇,对腌制品后熟阶段发生醋化反应和生成芳香物质是很重要的
[7]。酵母菌在消耗可发酵糖方面起了关键作用,因为可发酵糖的存在,在发酵蔬菜贮藏时,会被有害菌如腐败菌利用,引起腌制品腐败。而对发酵蔬菜起主导作用的乳酸菌一旦完成发酵后,会受到低pH值的抑制,不能再利用发酵糖。这时酵母菌仍可以很好地生长繁殖,直至把发酵糖消耗殆尽为止,这一点对含有大量糖的胡萝卜类蔬菜的发酵,尤其如此。因此,酵母菌被广泛用于研究发酵中的代谢机理
[8]。
分子生物学技术,常常被用来鉴定酵母菌的种属
[9]。国外学者应用分子生物学技术,对来自苹果和柑橘中的、不同类型的酵母菌进行鉴定,成功分离出了红酵母和毕氏酵母
[10]。当今,乳酸菌对于发酵食品的作用不可替代,因此,酵母菌的研究不容忽视。只有对泡菜中的微生物进行多方面研究,才能更好地利用酵母,生产出更高品质的产品。
1 材料与方法
1.1 材料
1.1.1 采集的泡菜样品
从延吉朝鲜族传统自然发酵泡菜的11个不同样品中采集的结果见表1。
表1 样品采集结果
Table1Information about samples collected in this study

序号样品代号样品来源样品温度/℃样品pH酵母菌分离数1TL吉林图们县23.54.382 2TD吉林图们县23.53.563 3TB吉林图们县23.53.104 4LL吉林龙井县3.04.303 5LD吉林龙井县11.43.514 6LB吉林龙井县11.43.123 7AL吉林安图县10.03.573 8AB吉林安图县5.73.144 9YL吉林延吉市10.04.323 10YB吉林延吉市5.73.124 11YD吉林延吉市10.03.514
1.1.2 培养基
[11]
孟加拉红琼脂培养基、马铃薯(PDA)培养基、麦氏(McClary)培养基(醋酸钠培养基)、玉米粉琼脂培养基、硝酸盐培养基、0.6%酵母浸汁、尿素琼脂培养基和YEPD培养基。
1.1.3 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌锅郑州南北仪器设备有限公司;无菌操作台苏净集团安泰公司制造;DNP-9080生化培养箱上海精密实验设备有限公司;HH-6恒温水浴锅国华电器有限公司;VS-1涡旋仪北京鼎昊原料科技有限公司;CR-21G离心机(50mL)天美科技仪器有限公司;Centrifuge-5418离心机(1.5mL)上海艾研生物科技有限公司;PTC-200梯度基因扩增仪、琼脂糖凝胶电泳仪美国伯乐公司;UV-3200分光光度计上海美普达仪器有限公司。
1.2 方法
1.2.1 泡菜中微生物群落的分析
1.2.1.1 泡菜中乳酸菌活菌数的测定
[12]
采用平板计数法,分别对11个泡菜样品中的乳酸菌活菌数进行测定。
1.2.1.2 泡菜中酵母菌活菌数的测定
采用平板计数法,分别对11个泡菜样品中的酵母菌活菌数进行测定,具体步骤参照GB4789.15—2010《食品安全国家标准食品微生物学检验霉菌和酵母计数》。
1.2.1.3 泡菜中大肠杆菌活菌数的测定
[13]
分别对11个泡菜样品进行浓度稀释,先进行乳糖发酵实验,对产气的发酵管进行伊红美蓝琼脂培养基分离培养,最后,挑去可疑的大肠杆菌1~2个进行革兰氏染色。同时接种乳糖发酵管,培养之后,观察产气情况。凡乳糖管产气,革兰氏染色为阴性的无芽孢杆菌,即可报告为大肠杆菌阳性。实验具体步骤以及MPN检索表参照GB/T4789.3—2003《食品卫生微生物学检验 大肠菌群测定》。
1.2.2 泡菜样品的质构分析
将泡菜样品切成边长5.0cm相同大小的块状,进行质地剖面分析(texture profile analysis,TPA)实验,实验条件:TA3/100探头下实验参数设置为:探头预测试速率2mm/s,测试速率0.5mm/s,返回速率0.5mm/s,数据频率10点/s,触发点负载10g,等待时间0s。测量结果:测量3次取平均值。
1.2.3 泡菜中酵母菌的分离、纯化与鉴定
1.2.3.1 酵母菌的分离与纯化
在无菌条件下,取泡菜汁样品1mL加入蒸馏水中,再取1mL稀释液加入9mL蒸馏水中,依次从10
-1稀释到10
-6,分别取10
-5和10
-6两个稀释梯度的稀释液100☒L,用无菌涂布器以涂布的方式接种于孟加拉红琼脂培养基平板上,每个梯度两个平行,25℃培养48h
[14]。
在两个梯度的平板中,选取菌株分布均匀,数量适宜的平板,挑取不同的典型菌株接种于马铃薯液体培养基中,于25℃培养24h后,再继续接种于马铃薯液体培养基中,25℃培养24h
[15]。将分离出的酵母菌,经过平板划线纯化2~3次,接种于马铃薯琼脂培养基上,25℃培养48h,4℃保藏。
1.2.3.2 酵母菌的形态学以及生理生化鉴定
细胞形态学观察:将分离菌种接种于麦芽汁液体培养基。25~28℃培养3d观察
[16]。
特征培养观察:将分离菌种分别接种于PDA液体培养基和固体培养基,28℃培养3d观察
[17]。
子囊孢子的形成:将鉴定菌株接种于McClary培养基上,25~28℃培养3~5d,涂片在显微镜下观察
[18]。
假菌丝形成:新培养物划线接种于玉米粉琼脂培养基上,25~28℃培养3~5d,涂片在显微镜下观察
[19-20]。
葡萄糖发酵实验:在0.6g/100mL酵母浸汁中加入葡萄糖,使糖质量浓度达到2g/100mL,再将其分装于含杜氏管的试管中(注意使杜氏管中没有气泡)。在115℃高压灭菌15min后,将生长旺盛的菌种接入发酵管中,25℃培养,每天观察结果
[18]。
硝酸盐还原实验:将待检测的生长旺盛的酵母菌接种在硝酸盐培养基中,25℃培养1~7d,滴加甲、乙混合液(1∶1,V/V),每5mL培养液加混合液0.1mL后,观察结果,呈现红色为阳性,若无红色出现
[11],应进一步检查,向上述实验管中加少许锌粉,若出现红色,表示硝酸盐仍存在,为阴性反应(硝酸盐在醋酸的存在下,锌粉将其还原成亚硝酸盐,进一步形成芳基肼紫红色化合物);若不产生红色,表示硝酸盐已被还原为氨和氮,仍为阳性反应。
脲酶实验:取新培养的酵母菌,接种于作水解尿素的琼脂斜面上,28℃培养,每天观察结果
[21]。
1.2.4 泡菜中耐盐酵母菌的筛选
将37株酵母菌分别接种于0、4、7、10、15g/100mL盐的YEPD液体培养基,每个制作两个平行,28℃培养1d,选取生长良好的酵母菌株,再用平板涂布的方法在PDA固体培养基上于28℃培养2d
[22],进行菌落计数。
1.2.5 酵母菌26S rDNA序列测定
1.2.5.1 酵母菌基因组DNA的提取及聚合酶链式反应(polymerase chain reaction,PCR)扩增
将酵母菌培养到对数生长末期,采用十六烷基三甲基溴化铵(cetyltriethylammnonium bromide,CTAB) 法提取基因组DNA
[23],酵母菌的26S rDNA,采用PCR进行扩增
[24],扩增片段约为600bp。上游引物为NL-1:5'-GCATATCAATAAGCGGAGGAAAAG-3',下游引物为NL-4:5'-GGTCCGTGTTTCAAGACGG-3'。PCR扩增体系(50☒L):10×Buffer5☒L,dNTPs(2.5mmol/L)4☒L,引物NL-11☒L,引物 NL-41☒L,模板DNA1.25ng,Taq聚合酶(5U/☒L)0.4☒L,补充ddH
2O至50☒L,然后离心混匀。
1.2.5.2 酵母菌PCR产物检测与测序
预先制备1.2%的琼脂糖凝胶,扩增反应完毕后,取5☒L的PCR产物与1☒L6×Loading Buffer混合,加样于琼脂糖凝胶点样孔中,进行电泳,电压5V/cm,电泳液为0.5×TAE。电泳后,用溴化乙锭染色20~30min,紫外灯下观察。如果PCR成功,则分别可见到约为600bp的条带。测序工作由上海桑尼生物技术有限公司完成。
1.2.6 酵母菌的同源性分析及系统发育树的构建
[25]
利用BLAST(http://www.ncbi.nlm.nih.gov/BLAST),将所分离酵母菌的26S rDNA序列与GenBank/EMBL/DDBJ数据库中已知菌株的对应序列进行比较分析,寻找与目的基因序列同源性最高的已知菌种。然后从GenBank/EMBL/DDBJ数据库中,提取已知标准菌株的基因序列与分离菌株的序列,用ClustalX2.1软件进行校准排齐,用MEGA5.0软件绘制系统发育树。
2 结果与分析
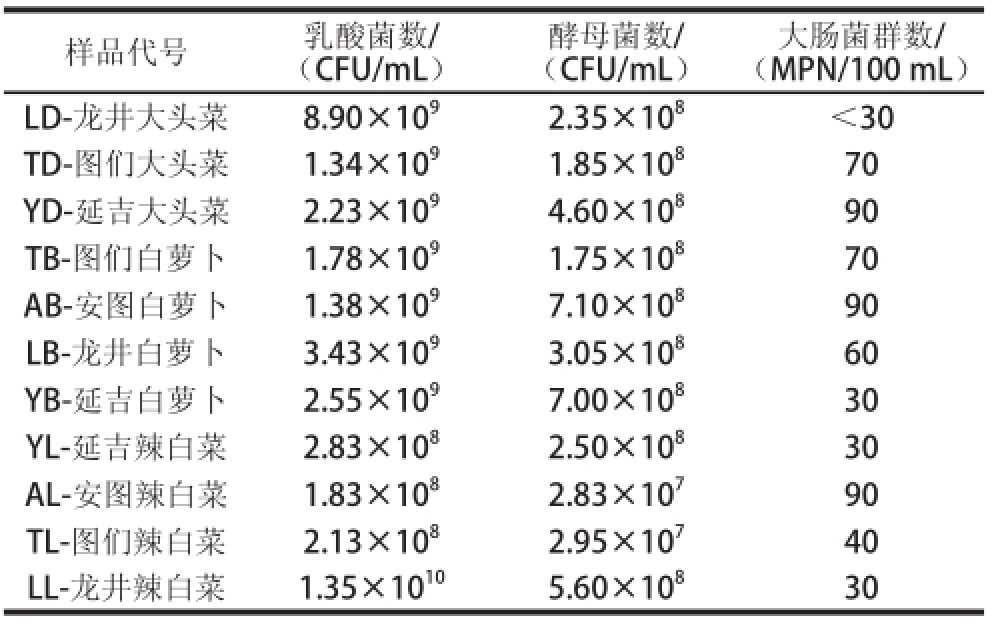
2.1 泡菜中微生物群落的检测结果由表2可知,乳酸菌总数为1.83×10
8~1.35× 10
10CFU/mL,酵母菌总数为2.83×10
7~7.10× 10
8CFU/mL,乳酸菌总数比酵母菌总数高1(lg(CFU/mL))左右。目前国内对泡菜中乳酸菌和酵母菌的数量,没有明确的规定。从表中还可以看出,乳酸菌数平均为
表2微生物群落的检测结果
Table2Microbial communities of kimchi samplesmples
大肠菌群数/(MPN/100mL)LD-龙井大头菜8.90×10
92.35×10
8<30 TD-图们大头菜1.34×10
91.85×10
870 YD-延吉大头菜2.23×10
94.60×10
890 TB-图们白萝卜1.78×10
91.75×10
870 AB-安图白萝卜1.38×10
97.10×10
890 LB-龙井白萝卜3.43×10
93.05×10
860 YB-延吉白萝卜2.55×10
97.00×10
830 YL-延吉辣白菜2.83×10
82.50×10
830 AL-安图辣白菜1.83×10
82.83×10
790 TL-图们辣白菜2.13×10
82.95×10
740 LL-龙井辣白菜1.35×10
105.60×10
830样品代号乳酸菌数/(CFU/mL)酵母菌数/(CFU/mL)
2.70 ×10
9CFU/mL,酵母菌数稍次于乳酸菌数,平均为
3.31 ×10
8CFU/mL。大头菜和白萝卜中乳酸菌数量较多,辣白菜稍少一些。白萝卜中的酵母菌数量较多,辣白菜的最少。对于大肠杆菌来讲,龙井样品的大肠杆菌数最少,延吉和图们的样品,大肠杆菌数稍多,但都符合GB2714—2003《酱腌菜卫生标准》的规定。
2.2 泡菜的质构分析结果
表3泡菜的质构分析结果
Table3Texture profile analysis of kimchiimchi
样品代号硬度/g黏力/g弹力/g黏性/mJ内聚性咀嚼性/mJ弹性/mm胶着性/g TB22640.200.40.765.02.96171 AB65200.210.00.478.42.81306 YB27060.290.00.736.53.34197 LB51970.270.20.648.82.73330 TL180450.190.00.4014.42.03725 YL84540.160.00.345.11.80291 AL1888300.190.20.4217.82.31785 LL1704210.180.60.4215.52.23709 YD146530.180.10.316.51.47448 LD252930.200.00.4019.51.951021 TD23300.180.00.472.42.23109
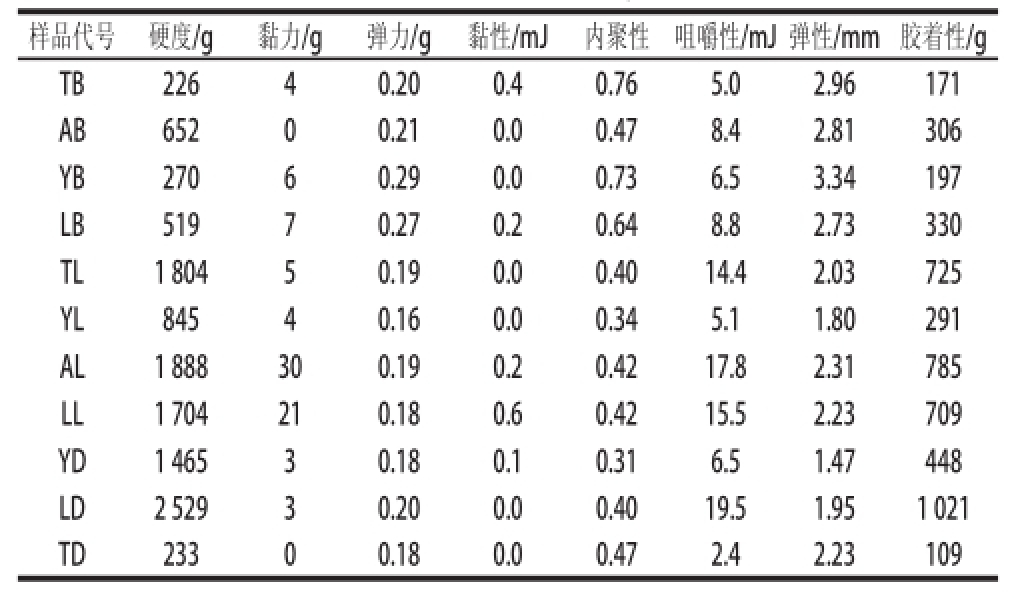
质构仪TPA测试的硬度、咀嚼性、内聚性、弹性和胶着性能够很好地反映泡菜的柔软度、组织结构和表皮质地,可以用来评价泡菜的品质。由表3可知,图们白萝卜(TB)的硬度、咀嚼性和胶着性这3个指标的数值最小,内聚性、弹性指标的数值最大,说明TB的品质最好,而龙井大头菜(LD)的硬度、咀嚼性和胶着性这3个指标的数值最大,内聚性和弹性指标的数值几乎为最小,说明LD的品质最差。
总体来看,按地区进行分类,延吉的泡菜样品硬度、咀嚼性和胶着性这3个指标的平均数值为860g、6.0mJ和312g,基本都为最小,内聚性和弹性指标的平均值分别为0.46和2.20g,各个地区的泡菜样品这两个指标的数值相差很小,说明延吉的泡菜样品品质最好。龙井的泡菜样品硬度、咀嚼性和胶着性这3个指标平均值为1584g、14.6mJ和687g,数值最大,说明龙井的泡菜样品品质最差。
总体来看,按泡菜的种类进行分类,辣白菜的硬度、咀嚼性、胶着性、内聚性和弹性指标的平均数值分别为1560g、13.2mJ、628g、0.40和2.09mm,白萝卜的硬度、咀嚼性、胶着性、内聚性和弹性指标的平均数值为417g、7.2mJ、251g、0.65和2.96mm,大头菜的硬度、咀嚼性、胶着性、内聚性和弹性指标的平均数值为1409g、9.5mJ、526g、0.39和1.88mm,对比后不难看出,白萝卜的硬度、咀嚼性和胶着性指标平均数值最大,内聚性和弹性指标的平均数值最小,说明白萝卜的品质最好。同理,可以看出辣白菜的品质最差。
2.3 酵母菌的形态学和生化鉴定结果
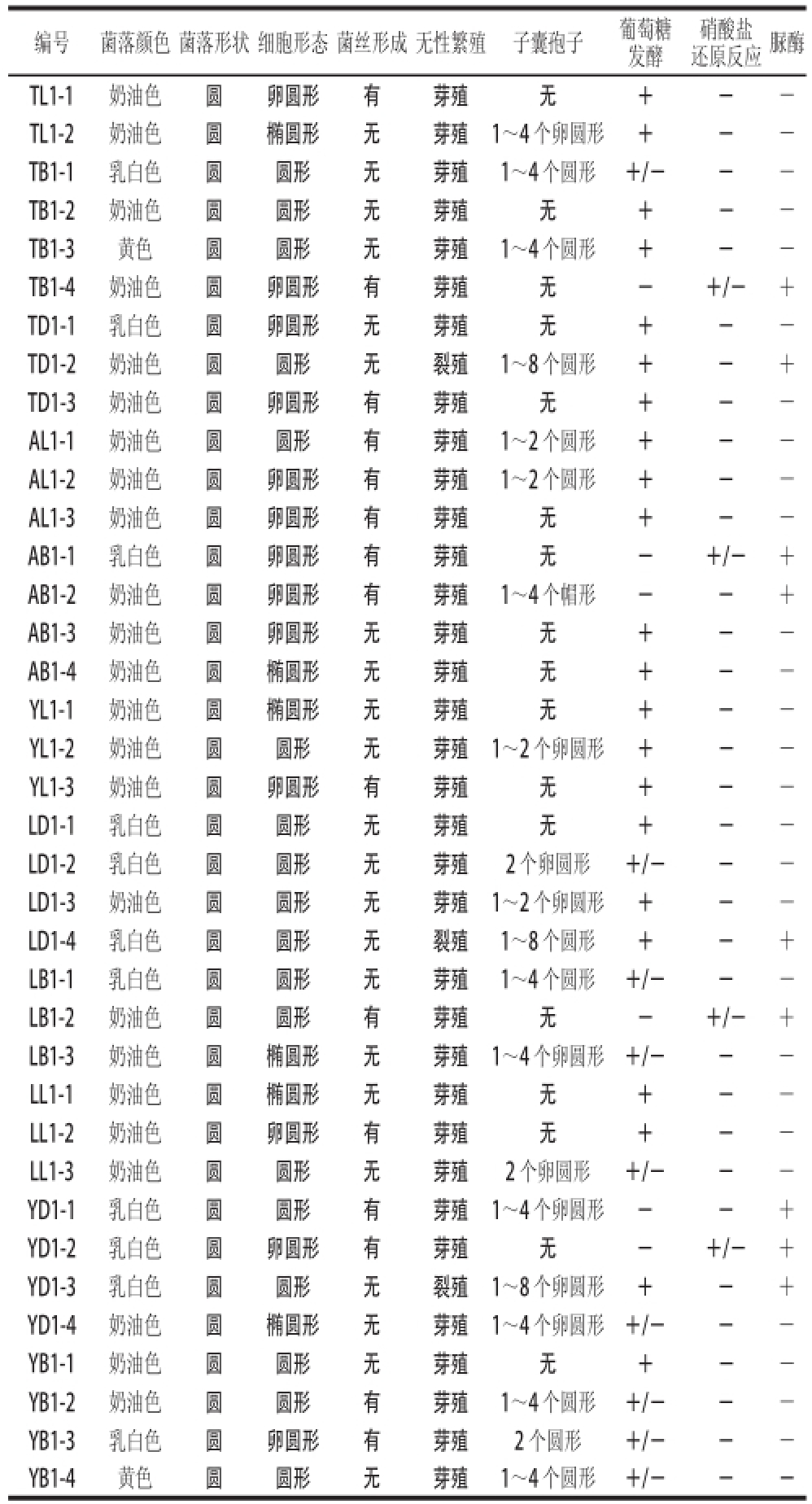
根据表4的实验结果显示,参照《酵母菌的特征与鉴定手册》可以将分离出的37株酵母菌分成爱尼拉酵母属、拿逊酵母属、毕赤氏酵母属、克勒克酵母属、德巴利酵母属、耶罗威亚酵母属、丝孢酵母属、酵母属以及裂殖酵母属等9个属,详细分类如下:
AL1-3、LL1-2、TL1-1、TD1-3和YL1-3的菌落呈乳白色和奶油色为主,细胞为芽殖,卵圆形或圆形,产生假菌丝,但不产生子囊孢子,葡萄糖发酵阳性,硝酸盐还原反应为阴性,脲酶实验结果为阴性,初步推断为爱尼拉酵母属。
AL1-1和AL1-2的菌落为奶油色,细胞为芽殖,卵圆形或圆形,产生假菌丝,产生子囊孢子,子囊孢子通常为1~2个,葡萄糖发酵阳性,硝酸盐还原反应为阴性,脲酶实验结果为阴性,初步推断为拿逊酵母属。
YB1-3、YB1-2的菌落为奶油色或乳白色,细胞为芽殖,卵圆形或圆形,产生假菌丝,产生子囊孢子,子囊孢子通常为1~4个,葡萄糖发酵阳性或阴性,硝酸盐还原反应为阴性,脲酶实验结果为阴性,初步推断为毕赤氏酵母属。
AB1-3、AB1-4、YL1-1、LL1-1、YB1-1、TB1-2、LD1-1和TD1-1的菌落为奶油色或乳白色,细胞为芽殖,椭圆形、卵圆形或圆形,不产生假菌丝,不产生子囊孢子,葡萄糖发酵阳性,硝酸盐还原反应为阴性,脲酶实验结果为阴性,初步推断为克勒克酵母属。
YD1-4、LD1-2、LB1-1、LL1-3、YB1-4、TB1-1和 LB1-3的菌落为奶油色、乳白色,有时为黄色,细胞为芽殖,圆形或椭圆形,不产生假菌丝,产生子囊孢子,子囊孢子通常为1~4个,葡萄糖发酵阳性或阴性,硝酸盐还原反应为阴性,脲酶实验结果为阴性,初步推断为德巴利酵母属。
表4 酵母菌的形态学和生化鉴定结果
Table4Morphological and biochemical identification of yeasts
注:“+”.反应呈阳性;“-”.反应呈阴性;“+/-”.反应呈阳性或阴性。
编号菌落颜色菌落形状细胞形态菌丝形成无性繁殖子囊孢子葡萄糖发酵硝酸盐还原反应脲酶TL1-1奶油色圆卵圆形有芽殖无+--TL1-2奶油色圆椭圆形无芽殖1~4个卵圆形+--TB1-1乳白色圆圆形无芽殖1~4个圆形+/---TB1-2奶油色圆圆形无芽殖无+--TB1-3黄色圆圆形无芽殖1~4个圆形+--TB1-4奶油色圆卵圆形有芽殖无-+/-+ TD1-1乳白色圆卵圆形无芽殖无+--TD1-2奶油色圆圆形无裂殖1~8个圆形+-+ TD1-3奶油色圆卵圆形有芽殖无+--AL1-1奶油色圆圆形有芽殖1~2个圆形+--AL1-2奶油色圆卵圆形有芽殖1~2个圆形+--AL1-3奶油色圆卵圆形有芽殖无+--AB1-1乳白色圆卵圆形有芽殖无-+/-+ AB1-2奶油色圆卵圆形有芽殖1~4个帽形--+ AB1-3奶油色圆卵圆形无芽殖无+--AB1-4奶油色圆椭圆形无芽殖无+--YL1-1奶油色圆椭圆形无芽殖无+--YL1-2奶油色圆圆形无芽殖1~2个卵圆形+--YL1-3奶油色圆卵圆形有芽殖无+--LD1-1乳白色圆圆形无芽殖无+--LD1-2乳白色圆圆形无芽殖2个卵圆形+/---LD1-3奶油色圆圆形无芽殖1~2个卵圆形+--LD1-4乳白色圆圆形无裂殖1~8个圆形+-+ LB1-1乳白色圆圆形无芽殖1~4个圆形+/---LB1-2奶油色圆圆形有芽殖无-+/-+ LB1-3奶油色圆椭圆形无芽殖1~4个卵圆形+/---LL1-1奶油色圆椭圆形无芽殖无+--LL1-2奶油色圆卵圆形有芽殖无+--LL1-3奶油色圆圆形无芽殖2个卵圆形+/---YD1-1乳白色圆圆形有芽殖1~4个卵圆形--+ YD1-2乳白色圆卵圆形有芽殖无-+/-+ YD1-3乳白色圆圆形无裂殖1~8个卵圆形+-+ YD1-4奶油色圆椭圆形无芽殖1~4个卵圆形+/---YB1-1奶油色圆圆形无芽殖无+--YB1-2奶油色圆圆形有芽殖1~4个圆形+/---YB1-3乳白色圆卵圆形有芽殖2个圆形+/---YB1-4黄色圆圆形无芽殖1~4个圆形+/---
AB1-2和YD1-1的菌落为奶油色或乳白色,细胞为芽殖,卵圆形或圆形,产生假菌丝,产生子囊孢子,子囊孢子通常为1~4个,葡萄糖发酵阴性,硝酸盐还原反应为阴性,脲酶实验结果为阳性,初步推断为耶罗威亚酵母属。
LB1-2、TB1-4、AB1-1、YD1-2的菌落为奶油色或乳白色,细胞为芽殖,卵圆形或圆形,产生假菌丝,不产生子囊孢子,葡萄糖发酵阴性,硝酸盐还原反应为阳性或阴性,脲酶实验结果为阳性,初步推断为丝孢酵母属。
YL1-2、TB1-3、LD1-3、TL1-2的菌落为奶油色或黄色,细胞为芽殖,圆形,不产生假菌丝,产生子囊孢子,子囊孢子通常为1~4个,葡萄糖发酵阳性,硝酸盐还原反应为阴性,脲酶实验结果为阴性,初步推断为酵母属。
TD1-2、LD1-4和YD1-3的菌落为奶油色或乳白色,细胞为裂殖,圆形,不产生假菌丝,产生子囊孢子,子囊孢子通常为1~8个,葡萄糖发酵阳性,硝酸盐还原反应为阴性,脲酶实验结果为阳性,初步推断为裂殖酵母属。
2.4 酵母菌的盐胁迫筛选结果
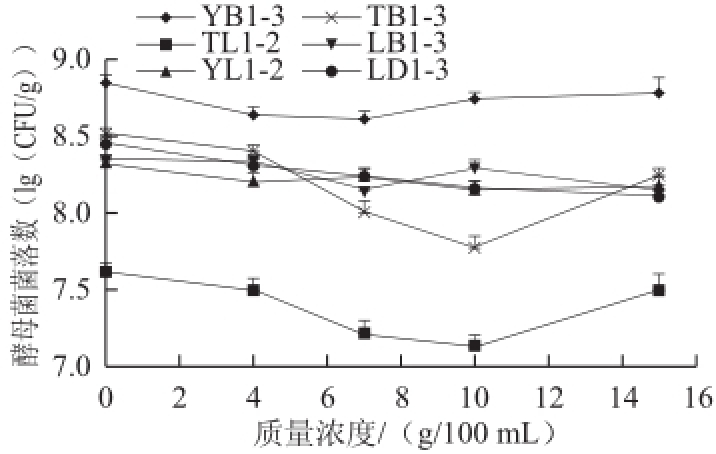
图1 6株耐盐酵母菌在不同盐质量浓度下的菌落计数结果
Fig.1Colony count results of6salt-tolerant yeast strains at different salt concentrations
利用YEPD培养基对分离出的37株酵母菌进行筛选,共筛选出6株耐盐菌,结果如图1所示。YB1-3在盐质量浓度为7g/100mL左右时数量最低,在10g/100mL和15g/100mL时又有所回升,说明其一开始虽因盐质量浓度的增加,酵母菌生长受到抑制,而后期酵母菌产生了耐盐性,所以在10g/100mL与15g/100mL盐质量浓度时酵母菌的数量又有一定程度的增加;TL1-2与LB1-3都是在10g/100mL盐质量浓度下酵母菌数量最低,而酵母菌同样产生了耐盐性,并且在15g/100mL盐质量浓度下酵母菌数量有一定程度的回升;YL1-2在7g/100mL与15g/100mL盐质量浓度时有小幅度的回升,但整体呈小幅度的下降趋势,盐质量浓度对其有一定的抑制作用,但影响不算太大;TB1-3在7g/100mL盐质量浓度时有着明显的下降趋势,酵母菌的生长收到了抑制,而在10g/100mL时又有着较大幅度的回升,说明其产生了耐盐性,而在15g/100mL盐质量浓度时又开始下降,说明15g/100mL盐质量浓度已经超越了其对盐的耐受性,酵母菌的生长又受到了抑制;LD1-3整体呈现出较为均匀的下降趋势,但下降幅度有着逐渐减小的趋势。
2.5 酵母菌26S rDNA D1/D2区域序列同源性及系统发育树构建
由表5可知,本实验筛选的6株耐盐酵母菌与标准菌株的同源性在97%以上,其中TB1-3与标准菌株的同源性达到100%,基本确定来自两个酵母菌菌属。其中,2株为酿酒酵母属(Kazachstania),分别是LB1-3和YB1-3。4株为酵母属(Saccharomyces),分别是LD1-3、TB1-3、TL1-2和YL1-2。图2为酵母菌根据26S rDNA建立的系统发育树,可以看出,LB1-3和YB1-3属于酿酒酵母属,LB1-3被鉴定为Kazachstania turicensis,YB1-3被鉴定为Kazachstania exigua。LD1-3、TB1-3、YL1-2和TL1-2属于酵母属,被鉴定为赛瓦酵母Saccharomyces servazzii。这与表5中序列同源性对比结果一致。
表5酵母菌26S rDNA D1/D2区域序列同源性对比结果
Table5Homology comparison of yeast26S rDNA D1/D2area sequences

菌株编号菌株鉴定结果同源性/% LB1-3Kazachstania turicensis 99 LD1-3Saccharomyces servazzii 99 TB1-3Saccharomyces servazzii 100 TL1-2Saccharomyces servazzii 99 YB1-3Kazachstania exigua 99 YL1-2Saccharomyces servazzii 97
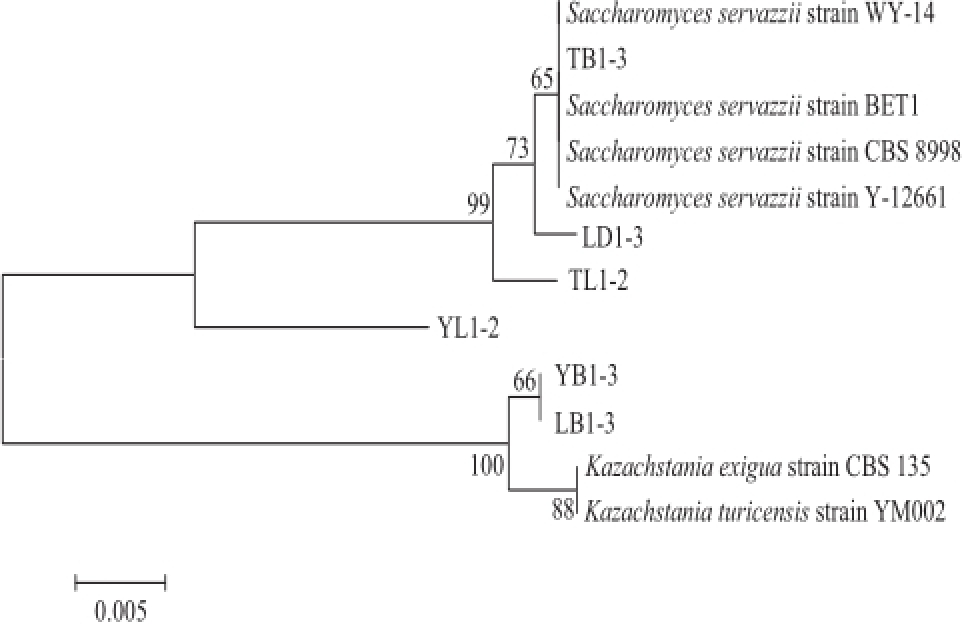
图2酵母菌根据26S rDNA建立的系统发育树
Fig.2Phylogenetic tree of yeasts established on the basis of26S rDNA sequence analysis
3 结论与讨论
通过对11个泡菜样品中微生物群落的检测结果可以看出,酵母菌和乳酸菌作为泡菜中的主要微生物,二者的数量比较接近,数量相差1(lg(CFU/mL))左右,这可能是由于乳酸菌和酵母菌在泡菜的发酵过程中所起的作用是协同的,互相促进彼此制约的结果。
泡菜的指标主要包括硬度、咀嚼性、弹性以及内聚性等,而咀嚼性在数值上等于弹性、内聚性和硬度的乘积,从而咀嚼性直接影响泡菜的口感和泡菜的品质。从泡菜的分析结果,单个来看,图们白萝卜的品质最好,龙井大头菜的品质最差。综合来看,延吉的泡菜品质最好,龙井的泡菜品质最差。总体来看,白萝卜的品质最好,辣白菜的品质最差。由于常规感官鉴定方法的可靠性和可比性差,而质构仪的测定结果又有着较高的灵敏度,使质构仪在食品品质的评价中的应用越来越广泛,但是,需要注意的是,质构仪只是一种仪器,其测定结果与口感品尝会有一定的差别,所以,本实验将采用质构仪和感官评价相结合的方法来研究泡菜的品质。
图1 可以看出,6株耐盐酵母菌在整个盐质量浓度区间的数量变化幅度,有一定的差异,这可能与不同酵母菌对盐的适应性的强弱有关,YB1-3、YL1-2、TB1-3和LD1-3对盐的适应性较好,而TL1-2对盐的适应性最差。从6株菌的对比可以看出,YB1-3对盐的耐受性比较稳定,并且耐受性最好,菌株YB1-3、TL1-2和LB1-3在盐质量浓度增加到15g/100mL时该菌仍有增长的趋势,说明该菌的最大耐受盐质量浓度可能高于15g/100mL,这对于酱油等高盐度发酵食品的研制开发提供了重要的理论依据。
表4 中生理生化鉴定结果得出YB1-3为毕赤氏酵母属,LB1-3为德巴利酵母属,LD1-3、TB1-3、YL1-2和TL1-2为酵母属,而表5酵母菌26S rDNA D1/D2区域序列同源性对比结果显示LB1-3和YB1-3属于酿酒酵母属,LD1-3、TB1-3、YL1-2和TL1-2属于酵母属,可以看出,LD1-3、TB1-3、YL1-2和TL1-2这4株菌的细胞生物学和生化鉴定与分子鉴定结果相一致,鉴定结果为酵母属。其余2株菌的生化鉴定与分子鉴定结果均不相符,说明细胞生物学和生理生化鉴定结果可以提供参考,但是可信度还不能达到百分之百,同时,生理生化实验不仅繁琐、费时,而且因实验条件的不同重现性不好,人的因素也是影响其准确度的主要因素之一。基于分子生物学和PCR鉴定方法,因其扩增片段的多态性,在短时间内极大地提高了菌株鉴定的特异性、重复性和准确性,进一步肯定了分子鉴定在酵母菌的种属鉴定中的作用。
本研究从11个延边朝鲜族自治州泡菜样品中共分离出37株酵母菌,经染色以及生理生化鉴定,37种酵母菌共来自9个属,分别是爱尼拉酵母属、拿逊酵母属、毕赤氏酵母属、克洛克酵母属、德巴利酵母属、耶罗威亚酵母属、丝孢酵母属、酵母属以及裂殖酵母属。
通过对酵母菌盐质量浓度胁迫的筛选,6株酵母菌的最高耐盐质量浓度可以达到15g/100mL,其中,YB1-3菌株在各个盐质量浓度条件下的酵母菌菌数最多,平均可以达到6×10
8CFU/mL;TL1-2菌种在各个盐质量浓度条件下的酵母菌菌数最少,平均只有2.5×10
7CFU/mL,但是,该菌在盐胁迫下菌种生长最稳定,而YB1-3在高质量浓度的盐胁迫下有着最好的生长趋势。
利用26S rDNA序列分析法,对6株耐盐菌进行鉴定,经同源性分析,并构建系统发育树,结果6株耐盐酵母菌分别来自两个酵母菌菌属。LB1-3和YB1-3属于酿酒酵母属,LB1-3被鉴定为Kazachstania turicensis,YB1-3被鉴定为Kazachstania exigua。LD1-3、TB1-3、YL1-2和TL1-2属于酵母属,被鉴定为赛瓦酵母Saccharomyces servazzii。
参考文献:
[1]何扩,张秀媛,李育峰,等.泡菜优质乳酸茵的筛选及其产酸性能鉴定[J].中国调味品,2012,37(11):48-49.
[2]PARK E J,CHUN J,CHA C J,et al.Bacterial community analysis during fermentation of ten representative kinds of kimchi with barcoded pyrosequencing[J].Food Microbiology,2012,30:197-204.[3]JUNG J Y,LEE S H,JEON C O.Kimchi microflora:history,current status,and perspectives for industrial kimchi production[J].Applied Microbiology and Biotechnology,2014,98(6):2385-2393.
[4]李斐.泡菜的制作工艺及关键[J].中国调味品,2005,30(11):36-37.
[5]SMITH A.Microbiology of fermented foods[J].Biochemical Education,1998,26(3):258-259.
[6]张兰威,郑冬梅.酸菜发酵与贮藏期间发生变色的机理研究[J].食品与机械,1997,13(3):23-24.
[7]JAZWINSKI S M.Metabolic mechanisms of yeast ageing[J].Experimental Gerontology,2000,35(6):671-676.
[8]KITAGAKI H,TAKAGI H.Mitochondrial metabolism and stress response of yeast:applications in fermentation technologies[J].Journal of Bioscience and Bioengineering,2013,117(4):383-393.
[9]☒LVAREZ-MART☒N P,BEL☒N FL☒REZ A L☒PEZ-D☒AZ T M,et al.Phenotypic and molecular identification of yeast species associated with Spanish blue-veined Cabrales cheese[J].International Dairy Journal,2007,17(8):961-967.
[10]MOKHTARI M,ETEBARIAN H,RAZAVI M,et al.Identification of yeasts isolated from varieties of apples and citrus using PCR-fragment size polymorphism and sequencing of ITS1-5.8S-ITS2region[J].Food Biotechnology,2012,26(3):252-265.
[11]巴尼特 J A,佩恩 R W,亚罗 D.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋出版社,1991:100-175.
[12]杨瑞,张伟,陈炼红,等.发酵条件对泡菜发酵过程中微生物菌系的影响[J].食品与发酵工业,2005,31(3):90-92.
[13]中华人民共和国卫生部中国国家标准化管理委员会.GB/T4789.3—2003食品卫生微生物学检验 大肠菌群测定[S].北京:中国标准出版社,2003.
[14]SHEARER ADRIENNE E H,MAZZOTTA ALEJANDRO S,ROLENDA C,et al.Heat resistance of juice spoilage microorganisms[J].Journal of Food Protection,2002,65(8):1271-1275.
[15]陈晓前,赵萍,王家利,等.贮藏苹果中酵母菌的分离初步鉴定及其抑制研究[J].中国酿造,2009,28(10):51-52.
[16]赵裕卿.应用微生物学[M].重庆:科学技术出版社重庆分社,1986:13.
[17]冯克宽,王明谊,曾家豫.酵母菌的分离与鉴定[J]. 西北师范大学学报,1997,33(2):56-59.
[18]周德庆.微生物学实验手册[M].上海:上海科技出版社,1986:58-90.
[19]KURTZMAN C,FELL J.The yeasts:a taxonomic study[M].4th ed.Amsterdam:Elsevier,1998:360-367.
[20]王文磊,鲁永强,苏东海,等.蒙古奶酪凝块中酵母菌的分离鉴定[J].食品工业科技,2012,33(3):149-151.
[21]马涛,王勃.煎饼自然发酵糊中酵母菌的分离鉴定[J].食品科技,2012,37(8):32-35.
[22]陈彬,王夫杰,殷丽君,等.酱油发酵增香用耐盐酵母菌的生长特性研究[J].中国酿造,2010,29(10):27-28.
[23]奥斯伯 F,布伦特 R,金斯顿 R E,等.精编分子生物学实验指南[M].颜子颖,王海林,译.北京:科学出版社,1998:37-39.
[24]白梅,王娟,卿蔓君,等.内蒙古西部区酸粥中酵母菌的分离鉴定及优势菌分析[J].微生物学通报,2010,37(9):1300-1301.
[25]王曦.野生沙棘酵母菌的筛选鉴定及多样性分析[D].呼和浩特:内蒙古农业大学,2012.
Quality Evaluation of and Salt-Tolerant Yeast Screening from Yanbian Kimchi
WU Rina
1,2,MENG Lingshuai
1,WANG Qianqian
1,YU Meiling
1,YUE Xiqing
1,WU Junrui
1,*
(1.College of Food Science,Shenyang Agricultural University,Shenyang110866,China;2.State Key Laboratory of Food Science and Technology,College of Food Science,Jiangnan University,Wuxi214122,China)
Abstract:Totally 37yeasts were isolated from11kimchi samples from Yanbian prefecture,Jilin province,and classified taxonomically into Eeniella,Nadsonia,Pichia and other6genera according to their ascospore,pseudohyphae and cell morphology.Out of these isolates,six with salt tolerance were selected and identified by26S rDNA D1/D2regional sequence and phylogenetic tree analyses.The results showed that the six strains with salt tolerance were from two yeast species.Among these strains,LB1-3and YB1-3belonged to Kazachstania,LB1-3was identified as Kazachstania turicensis,YB1-3was identified as Kazachstania exigua,and LD1-3,TB1-3,YL1-2and TL1-2were identified as Saccharomyces servazzii.
Key words:kimchi;yeast;26S rDNA;phylogenetic tree;homology analysis
中图分类号:Q93
文献标志码:A
文章编号:1002-6630(2015)05-0083-06
doi:10.7506/spkx1002-6630-201505016
收稿日期:2014-08-31
基金项目:国家自然科学基金面上项目(31471713;31370502);中国博士后科学基金资助项目(2014M560395);辽宁省农业领域青年科技创新人才培养资助计划项目(2014048);沈阳农业大学“天柱山英才支持计划”项目作者简介:乌日娜(1979—),女,副教授,博士,研究方向为生物技术。E-mail:wrn6956@163.com
*通信作者:武俊瑞(1977—),男,副教授,博士,研究方向为生物技术。E-mail:junruiwu@126.com






