熊涛,刘妍妍,黄涛,黄巧芬
(南昌大学生命科学与食品工程学院,食品科学与技术国家重点实验室,江西南昌330047)
摘要:通过体外实验研究副干酪乳杆菌NCU622的耐酸、耐胆盐性能;采用体外细胞模型(人体结肠腺癌细胞系Caco-2细胞)测定副干酪乳杆菌NCU622的黏附性能,考察了菌体浓度、作用时间及生长阶段对其黏附性能的影响,并对该菌株进行细胞毒性检测。结果表明:副干酪乳杆菌NCU622在pH2.5的MRS液体培养基中作用3h,存活率为98.21%;在胆盐质量浓度为0.3、0.5g/100mL的MRS液体培养基中作用4h,存活率分别为95.14%和85.07%。副干酪乳杆菌NCU622对Caco-2细胞的黏附能力较强,为(21.19±0.94)CFU/Caco-2细胞,且菌体浓度、作用时间及生长阶段对其黏附性能均有影响。副干酪乳杆菌NCU622与Caco-2单层细胞共培养24h后,对其无裂解作用。这表明副干酪乳杆菌NCU622具有良好的耐酸耐胆盐能力及较强的黏附性能,且对Caco-2细胞无裂解作用,符合微生态制剂和乳酸菌发酵功能食品的菌种要求。
关键词:副干酪乳杆菌NCU622;耐酸;耐胆盐;黏附性能;细胞毒性
益生菌是指具有生物活性,摄入适当量时可以对宿主产生有益作用的微生物 [1]。副干酪乳杆菌(Lactobacillus paracasei)广泛存在于传统发酵乳制品和人体胃肠道中,是近年来国内外研究较多的一种益生乳酸菌 [2]。口服益生菌若要到达肠道并发挥益生作用,需要一定数量的菌体能够耐受有机体的防御机制,如口腔酶、胃液中的低pH值环境和小肠中的胆汁酸等。在这些因素中,胃酸的杀伤力最强,其次是胆汁酸,因此在体外能够耐受一定浓度的酸和胆盐是益生菌筛选的主要技术指标 [3]。
益生菌对肠上皮细胞的黏附作用是其定殖的第一步 [4],能够增强菌体与肠道细胞之间的信号交流、抑制病原菌在肠道的定殖和提高机体的免疫力 [5]。因而,目前普遍把乳酸菌黏附性能作为评价其能否成为益生菌的重要标准。由于通过体内实验来评价益生菌的黏附性能非常困难,现普遍通过体外模拟实验来近似反映体内的情况 [6]。Caco-2细胞为人结肠腺癌细胞,其形态和功能与正常的小肠上皮细胞非常接近 [5],能表达正常人肠细胞的形态和某些生理特性,因此被广泛用作体外模型来评价乳酸菌的黏附性能 [7]。
作为人体正常菌群的重要组成部分 [8],乳酸杆菌一直被认为是安全的 [9]。通常情况下,这些人体正常定居者的致病性能是相当低的 [8],只有极少数感染病例的报道 [10-11]。对于一些易感人群如免疫功能严重低下者、新生儿或住院患者,使用适当的体外实验来评估益生菌的安全性是必要的。乳酸脱氢酶是真核细胞中一种稳定的胞质酶,该酶的释放被看作细胞膜完整性的重要指标,并被广泛用于细胞毒性检测 [12]。本实验研究了副干酪乳杆菌NCU622的耐酸耐胆盐能力及其黏附性能,考察了菌体浓度、作用时间及生长阶段对黏附性能的影响,并对该菌株进行细胞毒性检测,为该菌株能否在胃肠道环境中发挥有益作用提供参考。
1.1 菌种与试剂
副干酪乳杆菌NCU622、人结肠腺癌细胞系Caco-2细胞均由南昌大学食品科学与技术国家重点实验室保藏。
牛胆盐 上海蓝季科技发展有限公司;DMEM培养液、胰蛋白酶-EDTA消化液、10×磷酸盐缓冲液(phosphate buffered saline,PBS) 北京索莱宝科技有限公司;乳酸脱氢酶细胞毒性检测试剂盒 碧云天生物技术研究所。
1.2 仪器与设备
YXQ-LS-50SⅡ/75SⅡ立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;DNP-9272型生化培养箱 上海精宏实验设备有限公司;Airtech生物安全柜 苏净集团安泰公司;PHS-25型pH计 上海精密科学仪器有限公司;CO 2培养箱 长沙长锦科技有限公司;37XC倒置生物显微镜 上海光学仪器进出口有限公司;Varioskan flash酶标仪 赛默飞世尔科技有限公司。
1.3 培养基
MRS(man rogosa sharpe)培养基,参见GB4789.35—2010《食品微生物学检验 乳酸菌检验》 [13]中的配制方法。
DMEM完全培养液(补充有100U/mL青霉素、100☒g/mL链霉素、4mmol/L谷氨酰胺、体积分数1%非必需氨基酸和体积分数10%胎牛血清)用于Caco-2细胞的常规培养。
DMEM不完全培养液(补充有4mmol/L谷氨酰胺)用于黏附实验及细胞毒性实验。
1.4 方法
1.4.1 耐酸性实验
用盐酸调整MRS液体培养基的pH值至2.5、3.5和4.5,121℃高压蒸汽灭菌20min,冷却待用。将活化后的副干酪乳杆菌NCU622以体积分数1% [14]的接种量接种到上述处理后的培养基中,37℃恒温培养,分别于0、1、2、3h取样,用平板计数法测定活菌数。按式(1)计算存活率 [15]。
1.4.2 耐胆盐实验
用NaOH调整MRS液体培养基的pH值至8.0,在上述培养基中加入牛胆盐,使其质量浓度分别为0.03、0.3、0.5g/100mL,以不添加牛胆盐的MRS液体培养基作为对照,121℃高压蒸汽灭菌20min,冷却待用。将活化后的副干酪乳杆菌NCU622以体积分数1% [16]的接种量接种到上述处理后的培养基中,37℃恒温培养,分别于0、1、2、3、4h取样,用平板计数法测定活菌数。按式(2)计算存活率 [15]。
1.4.3 黏附性能实验
1.4.3.1 菌悬液的制备
将副干酪乳杆菌NCU622接种于MRS液体培养基中,37℃活化,离心(4500r/min,10min)收集菌体。用无菌PBS洗涤3次,将菌体重悬于PBS中,用乳酸菌活菌计数法 [17]快速测定菌悬液中菌体浓度。
1.4.3.2 Caco-2细胞培养
Caco-2加细胞冻存液保存在液氮中(-196℃),经复苏后置于50mL25cm 2培养瓶中,加入DMEM完全培养液,于CO 2培养箱(5%CO 295%空气)中37℃培养,每2d换液一次,待细胞生长良好时(70%~80%融合),用0.25%胰酶-EDTA消化液消化传代 [18]。
1.4.3.3 黏附实验
将培养好的Caco-2细胞进行消化后,用DMEM完全营养液调整细胞浓度为1×10 5个/mL,装于6孔组织培养板中,每孔2mL,于CO 2培养箱(5%CO 295%空气)中37℃培养至细胞长至单层。弃去组织培养板各孔中培养液,用无菌PBS缓冲液洗板2 次。其中一孔用0.5mL胰酶-EDTA消化液进行消化,之后加入0.5mL无菌PBS缓冲液,用移液枪吹打,使细胞完全消化并混匀,用血球计数板计算细胞浓度。其他5孔各加入1mL DMEM不完全培养液和1mL菌悬液,用移液枪吹打混合,37℃培养。之后弃去组织培养板各孔中混合液,用无菌PBS缓冲液洗涤5次,以除去未黏附的菌体 [19-20]。每孔用0.5mL胰酶-EDTA消化液进行消化后加入0.5mL无菌PBS缓冲液,进行梯度稀释,平板计数法计算黏附的细菌数。
1.4.3.4 菌体浓度对黏附性能的影响
取培养至14h的副干酪乳杆菌NCU622发酵液,离心(4500r/min,10min)收集菌体,用无菌PBS缓冲液调整其浓度为1×10 5、1×10 6、1×10 7、1×10 8、1×10 9CFU/mL,与Caco-2细胞共培养2h,计数黏附的细菌数。
1.4.3.5 作用时间对黏附性能的影响
取培养至14h的副干酪乳杆菌NCU622发酵液,离心(4500r/min,10min)收集菌体,用无菌PBS缓冲液调整其浓度为1×10 8CFU/mL,与Caco-2细胞共培养0.5、1、1.5、2、2.5、3h,计数黏附的细菌数。
1.4.3.6 生长阶段对黏附性能的影响
分别取培养至延滞末期(2h)、对数期(8h)、稳定初期(14h)、稳定末期(32h)、衰亡期(40h)的副干酪乳杆菌NCU622发酵液,离心(4500r/min,10min)收集菌体,用无菌PBS缓冲液调整其浓度为1×10 8CFU/mL,与Caco-2细胞共培养2h,计数黏附的细菌数。
1.4.3.7 副干酪乳杆菌NCU622对Caco-2细胞的黏附性能
取培养至14h的副干酪乳杆菌NCU622发酵液,离心(4500r/min,10min)收集菌体,用无菌PBS缓冲液调整其浓度为1×10 8CFU/mL,与Caco-2细胞共培养2h,进行黏附计数和黏附观察。共培养2h后,弃去组织培养板各孔中混合液,用无菌PBS缓冲液洗涤5次,以除去未黏附的菌体。之后自然晾干,革兰氏染色,显微镜下观察黏附情况,并拍照。
1.4.4 细胞毒性实验
1.4.4.1 菌悬液的制备
将副干酪乳杆菌NCU622接种于MRS液体培养基中,37℃活化14h后,4500r/min离心10min,收集菌体。用无菌PBS缓冲液洗涤3次,将菌体重悬于DMEM不完全培养液中,用乳酸菌活菌计数法 [17]快速测定菌悬液中菌体浓度,调整菌体浓度至1×10 8CFU/mL。
1.4.4.2 细胞毒性实验
参照Messaoudi等 [21]的方法并略做改动。将培养好的Caco-2细胞进行消化后,用DMEM完全培养液调整细胞浓度为1×10 5个/mL,加入96孔组织培养板中,每孔200μL,于CO 2培养箱(5%CO 295%空气)中37℃培养至细胞长至单层。弃去组织培养板各孔中培养液,用无菌PBS缓冲液冲洗板2遍。将各培养孔分成如下几组:包括无细胞的培养液孔(背景空白对照孔)、经样品处理的细胞孔(样品孔)、未经样品处理的对照细胞孔(样品对照孔)、未经样品处理的用于后续裂解的细胞孔(样品最大酶活性对照孔)、无细胞的培养液和释放剂孔(样品最大酶活性背景空白对照孔),并做标记。在背景空白对照孔、样品对照孔、样品最大酶活性对照孔、样品最大酶活性背景空白对照孔中各加入200μL DMEM不完全培养液,在样品孔加入200μL菌悬液(1×10 8CFU/mL),将组织培养板置于CO 2培养箱(5%CO 295%空气)中37℃培养24h。到预定检测时间点前1h,从CO 2培养箱中取出组织培养板,在样品最大酶活性对照孔、样品最大酶活性背景空白对照孔中加入试剂盒提供的乳酸脱氢酶(lactate dehydrogenase,LDH)释放试剂,加入量为原有培养液体积的10%。加入LDH释放试剂后,反复吹打数次混匀,然后继续在细胞培养箱中孵育。到达预定时间后,采用乳酸脱氢酶细胞毒性检测试剂盒处理待测样品,在490nm波长处测定各培养孔的吸光度,并按式(4)计算LDH释放率。
式中:A 0为样品孔或样品对照孔吸光度;A 1为背景空白对照孔吸光度;A 2为样品最大酶活性对照孔吸光度;A 3为样品最大酶活性背景空白对照孔吸光度。
1.5 数据分析
所有实验重复3次,数据分析采用SPSS16.0中的One-Way ANOVA进行统计和显著性分析,结果用±s表示。
2.1 耐酸性
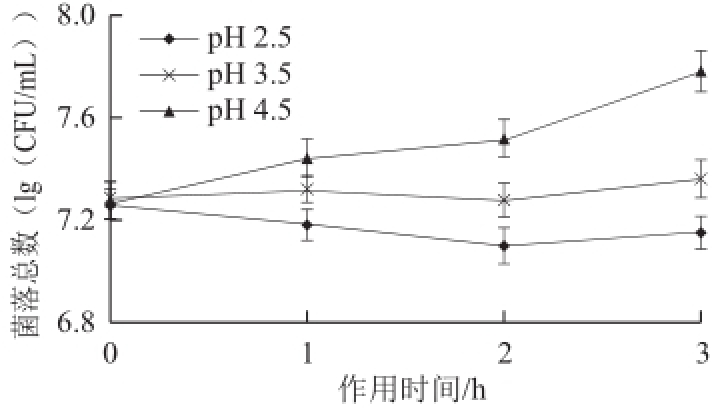
图1 副干酪乳杆菌NCU622在不同pH值条件下的生长情况
Fig.1Growth of L. paracasei NCU622at different pH values
细菌在经由胃部到达肠道的过程中,影响其活性的主要因素是胃液的pH值 [7]。人体胃液的pH值通常在2.5~3.5的范围内波动 [22],食物(尤其是流体)通过胃部的时间一般为1~2h [23]。副干酪乳杆菌NCU622的耐酸性实验结果如图1所示。在pH值为2.5的MRS液体培养基中作用3h后,副干酪乳杆菌NCU622的活菌数较0h处稍有下降,下降效果不显著(P>0.05);在pH值为3.5的MRS液体培养基中作用3h后,其活菌数较0h处增加不显著(P>0.05);在pH值为4.5的MRS液体培养基中能够生长。这说明,当活化后的副干酪乳杆菌NCU622转接至pH值分别为2.5、3.5和4.5的MRS液体培养基中培养时,菌体产生应激反应消除了酸胁迫带来的不利影响 [24],一定程度上保持了菌体细胞的稳定性。
副干酪乳杆菌NCU622在pH2.5的MRS液体培养基中作用3h后,存活率可高达98.21%,活菌数在10 7CFU/mL以上,说明该菌株对酸具有较好的耐受性,可在胃酸环境中及酸性食品,如发酵酸奶中,保持较高的活性 [7]。
2.2 耐胆盐性能
人体小肠中胆盐的质量浓度在0.03~0.3g/100mL范围内波动 [25],食物在小肠中的停留时间一般为1~4h [23],因此本实验研究了副干酪乳杆菌NCU622在胆盐质量浓度分别为0.03、0.3、0.5g/100mL的MRS液体培养基中作用0~4h后,其活菌数的变化情况,结果如图2所示。

图2副干酪乳杆菌NCU622在不同胆盐质量浓度条件下的生长情况
Fig.2Growth of L. paracasei NCU622at different concentrations of bile salts
由图2可知,胆盐对副干酪乳杆菌NCU622的生长有一定的抑制作用,且随其质量浓度的升高,抑制作用增强。在胆盐质量浓度为0.03g/100mL的MRS液体培养基中,随作用时间的延长,副干酪乳杆菌NCU622的活菌数呈增长趋势,培养4h后,其活菌数较0h处显著增加(P<0.05)。在胆盐质量浓度分别为0.3、0.5g/100mL的MRS液体培养基中作用1h后,活菌数均出现显著下降(P<0.05)。活菌数在短时间内显著下降可能是由于此质量浓度的胆盐使细胞膜质迅速溶解、膜内蛋白质解离,这种近乎瞬间的溶解导致细胞内物质流出,部分细胞迅速死亡 [26]。而当作用时间超过1h时,活菌数随作用时间的延长而略有增加,说明在此胆盐质量浓度条件下存活下来的菌体细胞能保持较好的稳定性且出现生长趋势。副干酪乳杆菌NCU622在胆盐质量浓度分别为0.3、0.5g/100mL的MRS液体培养基中作用4h后,存活率分别为95.14%和85.07%,活菌数均在10 6CFU/mL以上,满足乳酸菌发挥益生作用的菌体浓度(一般为10 6~10 9CFU/mL) [27]要求。以上结果表明,该菌株在一定程度上可有效消除胆盐胁迫所带来的不利影响,在人体胆盐生理浓度范围内可保持较高的活性,具有较好的胆盐耐受性。
2.3 黏附性能
2.3.1 不同因素对副干酪乳杆菌NCU622黏附Caco-2细胞性能的影响
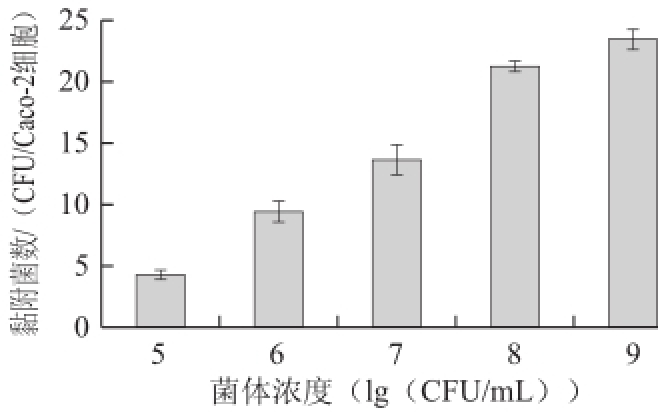
图3不同菌体浓度对副干酪乳杆菌NCU622黏附Caco-2细胞的影响
Fig.3Effect of different bacterial concentrations on the adherence of L. paracasei NCU622to Caco-2cells
2.3.1.1 菌体浓度对黏附性能的影响由图3可知,当菌体浓度小于10 8CFU/mL时,黏附的细菌数随菌体浓度的提高而显著增加(P<0.05);当菌体浓度达到10 8CFU/mL后,黏附菌数略有增加,增加效果不显著(P>0.05),黏附趋于饱和。推测该菌株的黏附性能在一定范围内具有浓度依赖性,而当菌体达到一定浓度后,其表面的黏附素已经和细胞中的大部分特异性受体结合,黏附在动态平衡中保持一定的数目。
2.3.1.2 作用时间对黏附性能的影响

图4不同作用时间对副干酪乳杆菌NCU622黏附Caco-2细胞的影响
Fig.4Effect of different incubation time on the adherence of L. paracasei NCU622to Caco-2cells
由图4可知,当副干酪乳杆菌NCU622与Caco-2细胞的作用时间小于2h时,黏附菌数随作用时间的延长而显著增加(P<0.05)。当作用时间大于2h时,黏附菌数随作用时间的延长而略有增加,增加效果不显著(P>0.05)。说明副干酪乳杆菌NCU622对Caco-2细胞的黏附作用在2h内存在时间依赖关系,在2h后达到平衡状态。
Chauvière等 [19]研究发现,在嗜酸乳杆菌LB对Caco-2细胞的黏附过程中,前1.5h内黏附的菌体数量随作用时间的延长而迅速增加,1.5h后趋于平稳。Elo等 [28]发现,鼠李糖乳杆菌GG与Caco-2细胞相互作用2h后黏附达到饱和,但在1h时的黏附菌数只有最大黏附菌数的1/3左右。乳酸菌的黏附性是吸附和脱附的综合效应,故黏附过程存在时间效应,需要作用一定的时间才能达到动态平衡 [29]。
2.3.1.3 生长阶段对黏附性能的影响
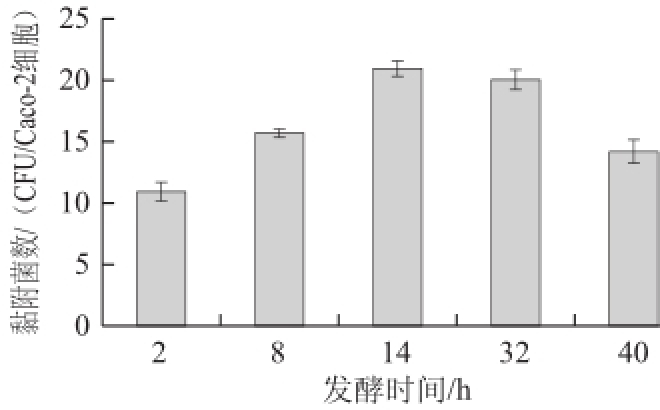
图5不同生长阶段的副干酪乳杆菌NCU622对Caco-2细胞黏附性能
Fig.5Effect of different growth stages on the adherence of L. paracasei NCU622to Caco-2cells
由图5可知,当培养时间小于14h时,黏附的细菌数随着菌龄的增加而显著增加(P<0.05)。稳定末期,黏附的细菌数略有下降,差异不显著(P>0.05)。而到了衰亡期时,黏附的细菌数与稳定期相比显著减少(P<0.05)。说明稳定期时副干酪乳杆菌NCU622对
Caco-2细胞的黏附性能最好,这与陈臣 [6]的研究结论一致。推测可能是由于稳定期时,菌体细胞不断积累黏附素及相关物质,且菌体表面结构较稳定,更利于黏附作用的发生。
2.3.2 副干酪乳杆菌NCU622对Caco-2细胞的黏附性能
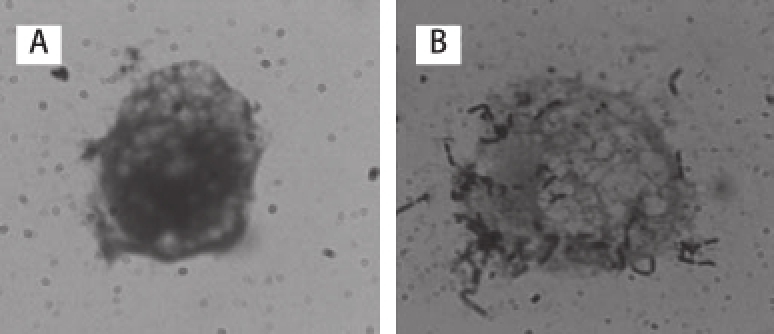
图6副干酪乳杆菌NCU622对Caco-2细胞的黏附(×1000)000
Fig.6Adherence of L. paracasei NCU622to Caco-2cells(×10001000)
A.空白对照;B.经副干酪乳杆菌NCU622处理。
副干酪乳杆菌NCU622对Caco-2细胞的黏附情况见图6,经平板计数黏附的细菌数为(21.19±0.94)CFU/Caco-2细胞。陈臣 [6]研究了4株乳杆菌与Caco-2细胞共培养2h后的黏附性能,植物乳杆菌ST-Ⅲ、鼠李糖乳杆菌LGG、干酪乳杆菌BD-Ⅱ和干酪乳杆菌LC2W的黏附菌数分别为(28.43±1.65)、(16.11±1.57)、(3.82±0.90)、(3.24±0.56)CFU/Caco-2细胞。本研究中副干酪乳杆菌NCU622对Caco-2细胞的黏附菌数为(21.19±0.94)CFU/Caco-2细胞,较植物乳杆菌ST-Ⅲ的低,较鼠李糖乳杆菌LGG、干酪乳杆菌BD-Ⅱ和干酪乳杆菌LC2W的高。任大勇 [5]体外研究了9株乳杆菌对Caco-2细胞的黏附性能,结果显示植物乳杆菌1.557、唾液乳杆菌23174及干酪乳杆菌20296的黏附效果较好,其黏附菌数分别为(9.12±0.65)、(6.65±0.57)、(4.92±0.61)CFU/Caco-2细胞,较副干酪乳杆菌NCU622的低。
2.4 细胞毒性

图7副干酪乳杆菌NCU622对Caco-2细胞的毒性
Fig.7Cytotoxicity of L. paracasei NCU622against Caco-2cells
由图7可知,副干酪乳杆菌NCU622与Caco-2单层细胞共培养24h后,培养液中LDH的释放率与单独培养Caco-2单层细胞时无显著性差异(P>0.05),说明副干酪乳杆菌NCU622在与Caco-2单层细胞共培养的过程中对其无明显裂解作用。
副干酪乳杆菌NCU622具有良好的耐酸及耐胆盐性能。在pH2.5的MRS液体培养基中作用3h后,存活率为
98.21 %,活菌数在10 7CFU/mL以上;在胆盐质量浓度分别为0.3、0.5g/100mL的MRS液体培养基中作用4h后,存活率分别为95.14%和85.07%,活菌数均在10 6CFU/mL
以上。副干酪乳杆菌NCU622对Caco-2细胞的黏附性能较强,当菌体浓度为1×10 8CFU/mL、共培养2h后,平均每个Caco-2细胞上黏附的细菌数为(21.19±0.94)CFU。菌体浓度、作用时间及生长阶段对其黏附性能均有影响。黏附菌数随着菌体浓度的增大而不断增加,当副干酪乳杆菌NCU622的菌体浓度达到10 8CFU/mL后,黏附菌数增加不显著(P>0.05)。副干酪乳杆菌NCU622对Caco-2细胞的黏附在一定时间范围(0~2h)内存在量效关系,培养2h后,黏附趋于饱和。稳定期的副干酪乳杆菌NCU622
对Caco-2细胞的黏附效果最好。副干酪乳杆菌NCU622与
Caco-2单层细胞共培养24h后,不会引起细胞的裂解。综上可知,副干酪乳杆菌NCU622具有较好的耐酸耐胆盐性能,对Caco-2细胞的黏附性能较强,且对其无明显裂解作用,符合益生菌的基本特征,值得进一步研究。
参考文献:
[1]FAO/WHO.Evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria:report of a joint FAO/WHO expert consultation[R].Córdoba:FAO/ WHO,2001.
[2] 巨晓英,寇晓虹.副干酪乳杆菌的功能及其在食品工业中的应用研究进展[J].中国乳品工业,2009,37(8):48-50.
[3]王玉华,高晶,冯印,等.鼠李糖乳杆菌耐酸及耐胆盐能力研究[J].食品科学,2008,29(12):449-451.
[4]李平兰,杨华,张篪.乳酸菌体外粘附人结肠腺癌细胞系HT-29细胞的研究[J].中国农业大学学报,2002,7(1):19-22.
[5]任大勇.益生乳酸杆菌的粘附及免疫调节作用研究[D].吉林:吉林大学,2013:19-54.
[6]陈臣.植物乳杆菌ST-Ⅲ对肠上皮细胞的粘附性质及机理的研究[D].无锡:江南大学,2008:3-21.
[7]BERTAZZONI MINELLI E,BENINI A,MARZOTTO M,et al.Assessment of novel probiotic Lactobacillus casei strains for the production of functional dairy foods[J].International Dairy Journal,2004,14(8):723-736.
[8]DOI A,NAKAJO K,KAMIYA T,et al.Splenic abscess caused by Lactobacillus paracasei[J].Journal of Infection and Chemotherapy,2011,17(1):122-125.
[9]贡汉生,孟祥晨.益生菌的安全性评价[J].现代食品科技,2005,21(4):76-79.
[10]STURDEE S,BAINTON R,BARNHAM M.Intravascular infection with Lactobacillus paracasei[J].Journal of Infection,1998,37(2):184-186.
[11]FRADIANI P A,PETRUCCA A,ASCENZIONI F,et al.Endocarditis caused by Lactobacillus jensenii in an immunocompetent patient[J].Journal of Medical Microbiology,2010,59(5):607-609.
[12]袁艳波,张文云.牙科生物材料细胞毒性试验方法的研究进展[J].生物医学工程学杂志,2009,26(3):688-691.
[13]GB4789.35—2010食品微生物学检验 乳酸菌检验[S].
[14]RAQUEL R,JOFR☒A,MART☒N B,et al.Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter cultures from fermented sausages[J].Food Microbiology,2014,38:303-311.
[15]GUO Zhuang,WANG Jicheng,YAN Liya,et al.in vitro comparison of probiotic properties of Lactobacillus casei Zhang,a potential new probiotic,with selected probiotic strains[J].LWT-Food Science and Technology,2009,42(10):1640-1646.
[16]LIN W H,YU B,JANG S H,et al.Different probiotic properties for Lactobacillus fermentum strains isolated from swine and poultry[J].Anaerobe,2007,13(3):107-113.
[17]熊涛,王韵,曾哲灵,等.一种改良的乳酸菌活菌数快速测定方法[J].食品与发酵工业,2009,35(10):132-134.
[18]陈臣,郭本恒,陈卫,等.三株益生菌粘附性质及机制的初步研究[J].中国微生态学杂志,2007,19(6):492-495.
[19]CHAUVI☒RE G,COCONNIER M H,KERN☒IS S,et al.Adhesion of human Lactobacillus acidophilus strain LB to human enterocytelike Caco-2cells[J].Journal of General Microbiology,1992,138(8):1689-1696.
[20]KIM,HEE I,PARK M S,et al.Characterization of adhesion of Bifi dobacterium sp.BGN4to human enterocyte-like Caco-2cells[J].Journal of Microbiology and Biotechnology,2003,13(2):276-281.
[21]MESSAOUDI S,MADI A,PR☒VOST H,et al. in vitro evaluation of the probiotic potential of Lactobacillus salivarius SMXD51[J].Anaerobe,2012,18(6):584-589.
[22]TULINI F L,WINKELSTR☒TER L K,de MARTINIS E C.Identification and evaluation of the probiotic potential of Lactobacillus paraplantarum FT259,a bacteriocinogenic strain isolated from Brazilian semi-hard artisanal cheese[J].Anaerobe,2013,22:57-63.
[23]熊涛,宋苏华,黄锦卿,等.植物乳杆菌NCU116在模拟人体消化环境中的耐受力[J].食品科学,2011,32(11):114-117.
[24]黄桂东.Lactobacillus brevis NCL912的耐酸特性及其酸胁迫下差异表达蛋白的研究[D].南昌:南昌大学,2011:16.
[25]王记成,郭状,闫丽雅,等.益生菌Lactobacillus casei Zhang与商业益生菌对胃肠转运耐受性及发酵特性的比较[J].中国食品 学报,2009,9(5):14-23.
[26]BEGLEY M,GAHAN C G M,HILL C.The interaction between bacteria and bile[J].FEMS Microbiology Reviews,2005,29(4):625-651.
[27]ISHIBASHI N,SHIMAMURA S.Bifidobacteria:research and development in Japan[J].Food Technology,1993,47(6):126-135.
[28]ELO S,SAXELIN M,SALMINEN S.Attachment of Lactobacillus casei strain GG to human colon carcinoma cell line Caco-2[J].Letters in Applied Microbiology,1991,13(3):154-156.
[29]熊涛,黄巧芬,李萍,等.植物乳杆菌NCU116的模拟人体肠道上皮细胞黏附性能研究[J].食品科学,2013,34(15):252-255.
Acid,Bile Tolerance and Adhesion Properties of Lactobacillus paracasei NCU622
XIONG Tao,LIU Yanyan,HUANG Tao,HUANG Qiaofen
(State Key Laboratory of Food Science and Technology,College of Life Science and Food Engineering,Nanchang University,Nanchang330047,China)
Abstract:Lactobacillus paracasei NCU622was examined for resistance to acid and bile,adhesion to Caco-2cells,and cytotoxicity against Caco-2cells.Furthermore,the impacts of bacterial concentration,incubation time and growth stage on the adhesion were also studied.It was found that L. paracasei NCU622showed a survival rate of98.21%after3h incubation in MRS broth adjusted to pH2.5.The survival rates of L. paracasei NCU622were95.14%and85.07%after4h incubation in MRS broth supplemented with0.3and0.5g/100mL oxgall,respectively.The adhesion(21.19±0.94)CFU/Caco-2cell)of L. paracasei NCU622was very excellent which was affected by the bacterial concentration,incubation time and growth stage.Moreover,L. paracasei NCU622did not cause Caco-2cells lysis after24h co-culture.In summary,L. paracasei NCU622tolerated well acid and bile,expressed high adhesion to Caco-2cells,and did not cause Caco-2cells lysis.These results demonstrate that L. paracasei NCU622presents favorable strain-specific properties for its utilization as probiotics in microecologics and fermented functional foods,and may have broad prospects for applications in fermented and functional foods.
Key words:L. paracasei NCU622;acid tolerance;bile tolerance;adhesion;cytotoxicity
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2015)05-0093-06
doi:10.7506/spkx1002-6630-201505018
收稿日期:2014-03-24
基金项目:国家高技术研究发展计划(863计划)项目(2011AA100904);“赣鄱英才555工程”领军人才培养计划项目(18000063);江西省教育厅高校科技落地计划项目(赣财教[2011]243号);国家重点实验室自由探索课题(SKLF-ZZB-201309)
作者简介:熊涛(1970—),男,教授,博士,研究方向为益生菌及大宗果蔬高值化利用。E-mail:xiongtao0907@163.com