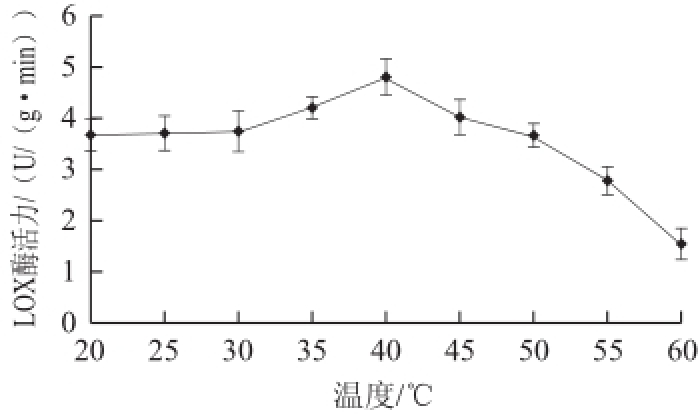
图1 不同温度对赤霞珠葡萄LOX酶活性的影响
Fig.1Effect of temperature on LOX activity in Cabernet Sauvignon grapes
鞠延仑,房玉林*,张莉,曾婕,刘吉彬
(西北农林科技大学葡萄酒学院,陕西省葡萄与葡萄酒工程技术研究中心,陕西杨凌712100)
摘要:以赤霞珠葡萄果实为研究材料,亚油酸钠为底物,测定脂氧合酶活性;采用气相色谱-质谱联用技术对葡萄果皮中的脂肪酸组分进行分析。结果表明:在温度为40℃,底物浓度为2×10 -4mol/L,pH值为7.0时该酶活性最高,同时该酶在80℃高温下仍表现出很好的热稳定性;在赤霞珠发育过程中该酶的活性从转色期开始上升,直到成熟前2~3周左右达到最大值,之后迅速下降,成熟期又趋于平稳。赤霞珠葡萄果皮中共检测出13种脂肪酸,其中棕榈酸和硬脂酸占据了饱和脂肪酸含量的大部分,油酸、亚油酸和亚麻酸是不饱和脂肪酸的主要组分,脂肪酸总含量在不断增大,成熟前1周左右含量最大。
关键词:赤霞珠;脂氧合酶;脂肪酸;酶活性;组分变化
脂氧合酶(lipoxygenase,LOX)首次发现于大豆中,又称为亚油酸氧化还原酶、脂肪氧化酶、脂肪氧合酶、脂肪加氧酶或类胡萝卜素氧化酶。研究发现脂氧合酶在各种高等植物中广泛存在,该酶是一种蛋白质并且含有非血红素铁,能够催化结构中含有顺,顺-1,4-戊二烯的多元不饱和脂肪酸发生加氧反应,大量存在于植物膜脂中的亚油酸和亚麻酸是该酶的主要底物,生成的过氧化氢物具有共轭双键 [1],其能通过各种反应生成醛、酮、脂类等具有挥发性的小分子物质,这些物质对葡萄的风味质量有很大影响 [2]。
LOX与植物的成熟、衰老密切相关,在植物受到机械伤害和病虫侵染时能产生信号分子进行调节 [3-5];LOX与植物抗旱等抗逆性密切相关 [6];LOX酶的作用又受到脂肪酸的影响,脂肪酸组分关系到细胞膜结构和脂类,直接调节细胞膜的组分 [7],两者的生理作用密切相关,共同对植物的生长发育起到调节作用,影响葡萄果实的质量。
随着经济的发展和消费水平的提高,我国对优质葡萄酒需求持续增加。由于葡萄酒质量和风格主要决定于原料,因此,通过改善葡萄原料的成熟质量,尤其是关键风味物质的含量,对于提高葡萄酒质量和风格具有重要的意义 [8]。目前关于脂氧合酶的研究主要集中在猕猴桃、黄瓜等 [9-10]植物果实中,对于葡萄果实脂氧合酶的相关研究报道很少,目前还没有一个系统的测定方法。本研究采用分光光度计法 [11-12],通过研究温度、底物浓度、pH值等因素对葡萄脂氧合酶活性的影响,进而确定葡萄果实脂氧合酶测定的方法,为葡萄果实脂氧合酶的测定提供理论依据。同时,通过研究赤霞珠发育过程中脂氧合酶活性及脂肪酸组分的变化,为葡萄园的管理、提高葡萄原料质量提供理论支撑。
1.1 材料与试剂
实验材料来源于陕西杨凌曹辛庄葡萄园2008年扦插定植的赤霞珠(Cabernet Sauvignon),欧亚种(Vitis vinifera L.)酿酒葡萄品种。从果实转色后到成熟(8月16日、8月18日、8月20日、8月22日、8月24日、8月26日、8月29日、8月30日、9月1日、9月3日、9月5日、9月7日)每3d取两次样。取样方法为随机取样:按照五点法,除去外周两行,每个取样区相对固定30株生长相对中庸一致的葡萄植株,取样保证植株阴阳两面随机采取。每次取样后,样品于0.5h内保存到—20℃的冰箱内。
石油醚、乙醚、甲醇(均为色谱级) 南京化学试剂公司;聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVPP)、吐温-100 美国Sigma公司。
1.2 仪器与设备
SiruaLLL RC-5C+冷冻高速离心机(配有SS-34铝合金角度转头、SLA-1000超轻铝合金角度转头及250、50、12mL离心管)、Thermo Finnigan TRACE DSQ气相色谱-质谱联用仪(含有直接进样装置、顶空进样器及热脱附仪) 美国科峻仪器公司;UV-2450紫外-可见分光光度计、AUW220D万分之一天平、超声波提取器 日本岛津公司。
1.3 方法
1.3.1 反应底物(亚油酸钠母液)的制备
参考Axelrod [13]、李强 [14]、陈昆松 [15]等的方法,略做修改。研究所用的酶反应底物为10mmol/L亚油酸钠母液、70mg亚油酸钠固体、70μL Triton X-100和4mL无氧水,混匀(避免产生气泡)后,用0.5mol/L NaOH滴定至溶液澄清,定容至25mL,分装(1~1.5mL),-18℃保存备用。操作过程避光。
1.3.2 提取缓冲液的制备
取1mL Triton X-100和4g聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVPP),加入到100mL0.1mol/L pH6.8的磷酸缓冲液中,摇匀,置于4℃的冰箱中预冷。
1.3.3 粗酶液的提取
参考陈昆松等 [15]的方法,略微改动。取不同时期的葡萄样品,分别剥取1g葡萄皮置于研钵内,在液氮下研磨,分别加入5mL经4℃预冷的提取缓冲液,4℃、12000r/min离心30min,收集上清液,得粗酶液,编号储存,用于LOX活性测定。
1.3.4 酶活性的测定
参考Axelrod [13]、李强 [14]、李铭韧 [16]等的方法,略做改动。反应体系中含亚油酸钠母液25μL、磷酸缓冲液2900μL、粗酶液75μL,反应温度25℃,于234nm波长处测定光密度值。加酶液后30s开始计时,记录120s(每隔15s测一次)内光密度值变化。用磷酸缓冲液作为空白对照,重复3次。酶活力单位定义为每克样品每分钟光密度变化值增加0.01为1个LOX酶活力单位(U)。
1.3.5 赤霞珠葡萄LOX酶最适反应温度的测定
将空试管置于一定温度(20、25、30、35、40、45、50、55、60℃)的水浴中,于试管中依次加入粗酶液75μL、磷酸盐缓冲液(pH6.8,0.1mol/L)2900μL、亚油酸钠母液25μL。加入底物后立刻准确计时,反应120s后立即加入4mol/L盐酸调节pH值到3.0,此时终止反应,在234nm波长处测定光密度值。空白对照为在加入粗酶液75μL后,先加入盐酸,再先后加入等量缓冲液和底物,反应120s。
1.3.6 赤霞珠葡萄LOX酶反应最适底物浓度的测定
在室温(25℃),pH6.8的磷酸缓冲液条件下,改变底物的浓度,测定LOX酶的活性。测定体系同1.3.4节,在3mL反应体系中加入底物(亚油酸钠母液)的量分别为0.83×10 -4、1.67×10 -4、2.0×10 -4、2.33×10 -4、2.67×10 -4、3.33×10 -4、5.0×10 -4mol/L,然后再通过改变所加缓冲液的体积来保证3mL反应体系保持不变。
1.3.7 赤霞珠葡萄LOX酶反应最适pH值的测定
室温条件下,改变缓冲液pH值(磷酸缓冲液pH6.0、6.2、6.4、6.6、6.8、7.0,硼酸-硼砂缓冲液pH7.4、7.6、7.8、8.0,浓度均为0.1mol/L),测定LOX酶的活性,测定体系同1.3.4节。
1.3.8 赤霞珠葡萄LOX酶热稳定性的测定
在缓冲液pH值为6.8的条件下,不同温度(20、30、40、50、60、70、80、90℃)处理LOX粗酶液1h,然后将粗酶液放到冰上冷却,在室温条件下测定处理后LOX酶的活性。
1.3.9 赤霞珠葡萄发育过程中LOX酶活性的变化
取2900μL0.1mol/L pH6.8磷酸缓冲液,加入25μL底物,在25℃中保温10min,再加入不同时期的粗酶提取液75μL,混匀,30s后开始计时,在234nm波长处记录120s(每隔15s测一次)内的光密度值,重复3次。测定LOX酶活性。
1.3.10 脂肪酸的提取
参考文献:[17-19]的研究方法,略微改动。取葡萄皮5g在液氮下充分研磨,加入10mL石油醚-乙醚(4∶3,V/V)混合液于0~4℃条件下提取24h。然后加入0.4mol/L氢氧化钾-甲醇溶液10mL,在室温条件下甲酯化2h,4000r/min室温离心10min,取上层有机相,置于10mL蒸馏烧瓶中,减压蒸馏,定容至5mL。取1mL样品于进样瓶中,并加入质量浓度为100mg/mL的十七烷酸甲酯1μL作为内标物。待用。
1.3.11 色谱条件
参考文献[20-21]设置色谱条件:DB5MS石英毛细管柱(30m×0.25mm,0.25μm);进样1μL;分流进样(分流比30∶l);进样口温度240℃;检测器温度250℃;升温程序;100℃保持1min,以8℃/min的速率升至205℃,保留0.l min,再以3℃/min的速率升至240℃,保留10min;载气压力(N 2)0.60kg/cm 2,燃气压力(H 2)0.65kg/cm 2,助燃气压力(空气)0.50kg/cm 2。
1.3.12 质谱条件
电子轰击(EI)离子源;电子能量70eV;传输线温度275℃;离子源温度250℃;激活电压1.5V;质量扫描范围m/z 40~500。
2.1 赤霞珠葡萄LOX酶最适反应温度

图1 不同温度对赤霞珠葡萄LOX酶活性的影响
Fig.1Effect of temperature on LOX activity in Cabernet Sauvignon grapes
由图1可知,当温度低于40℃时,LOX酶的活性随着温度升高有所增加,当温度为40℃时,LOX酶的活性达到最高,之后LOX酶活性随温度的升高开始迅速下降,温度超过45℃时酶活性比20℃时的活性更低。其他果实研究发现:黄瓜果实LOX酶在40℃时有很高活性 [14],牡丹花瓣LOX酶在45℃时有很高活性 [16],与本研究结果基本一致。
2.2 赤霞珠葡萄LOX酶的最适底物浓度
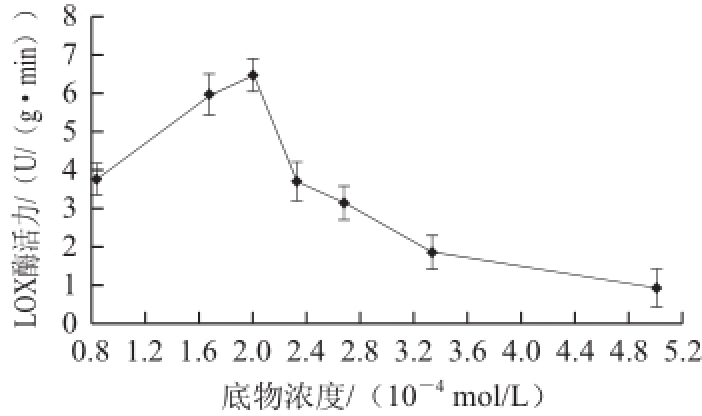
图2不同底物浓度对赤霞珠葡萄LOX酶活性的影响
Fig.2Effect of substrate concentration on LOX activity in Cabernet Sauvignon grapes
由图2可知,底物浓度小于2×10 -4mol/L时,酶活性随着底物浓度增加而不断增大,当底物浓度为
2×10 -4mol/L时LOX酶活性达到最高,之后随着底物浓度增大,酶活性减小。这可能是由于体系中添加的亚油酸量过多,亚油酸发生自氧化,有羟基过氧化物的生成,而当体系中含有过多的羟基过氧化物时便会引起
LOX酶失活 [5]。
2.3 赤霞珠葡萄LOX酶的最适反应pH值
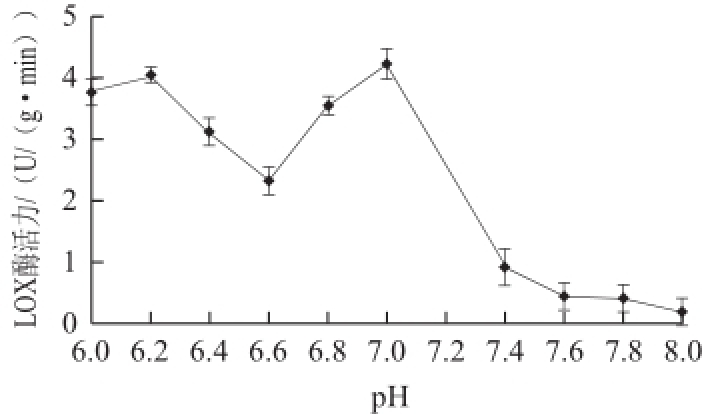
图3不同pH值对赤霞珠葡萄LOX酶活性的影响
Fig.3Effect of pH on LOX activity in Cabernet Sauvignon grapes
由图3可知,当pH值为7.0时,LOX酶活性最高,同时,当pH值在6.2左右时,酶活性也较高,有研究表明来源于黄瓜的LOX酶在pH7.0和pH9.0有两个峰 [14],来源于牡丹花瓣的LOX酶在pH4.5和pH6.0有两个峰 [16],来源于水稻的LOX酶在pH7.6和pH8.4有两个峰 [22]。植物LOX酶大都在酸性范围内有最高活性,如猕猴桃为5.0~5.5,桃为6.0和4.5,牡丹花瓣为4.5 [15-16,23]。出现两个峰的原因可能是LOX酶含有两种同工酶,这两种同工酶分别有不同的最适pH值 [5]。
2.4 赤霞珠葡萄LOX酶的热稳定性研究
由图4可知,当处理温度低于70℃时,LOX酶仍有很高活性,当处理温度达到80℃时,酶活性虽然很小,但仍有活性,表现出很好的热稳定性。这与李强 [14]、李铭韧 [16]等研究的黄瓜果实、牡丹花瓣LOX酶有很好的热稳定性结论一致。李强等 [14]对黄瓜果实LOX酶的研究表明,在20~70℃范围内其活性随处理温度升高而缓慢升高,李铭韧等 [16]对牡丹花瓣LOX酶的研究表明其活性在30~50℃和60~80℃内会随处理温度升高而升高,但是本研究中葡萄LOX酶活性此现象不是很明显。
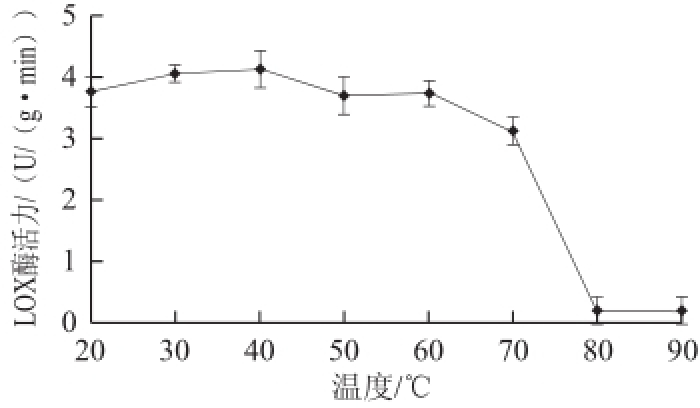
图4赤霞珠葡萄LOX酶热稳定性
Fig.4Thermal stability of lipoxigenase in Cabernet Sauvignon grapes
2.5 赤霞珠葡萄发育过程中LOX酶活性的变化
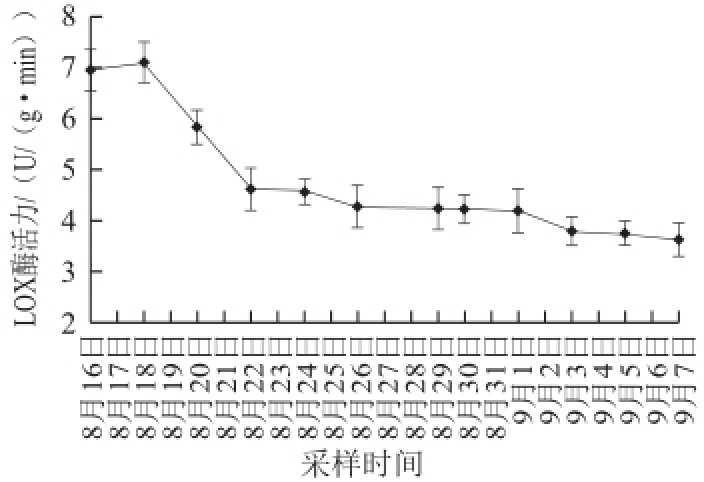
图5赤霞珠葡萄发育过程中LOX活性的变化
Fig.5Change in LOX activity during the development process of Cabernet Sauvignon grapes
由图5可知,赤霞珠葡萄在发育过程中LOX酶活性开始略有增加之后呈下降趋势,到成熟期基本趋于平稳。由于实验取样时间较晚,使得LOX酶活性增加趋势不够明显。由于LOX酶有很多对植株有利的生理功能 [1,4,24],研究葡萄果实发育过程中LOX酶活性的变化,对于研究葡萄植株的生长、发育、衰老、抗逆性等有很大帮助,可为葡萄园的管理提供理论支持,提供高质量的葡萄原料,有利于提高葡萄酒质量。
2.6 脂肪酸组分的变化
由表1可知,赤霞珠葡萄皮中共检测出13种脂肪酸,其中棕榈酸和硬脂酸含量在饱和脂肪酸含量中所占比例较大,油酸、亚油酸和亚麻酸是不饱和脂肪酸的主要组分。由表2可知,随着果实的不断成熟,果实中的脂肪酸总量开始不断增加,到完全成熟前1周达到最大值,之后又下降。
表1 赤霞珠葡萄果皮中脂肪酸(甲酯)的组成
Table1Fatty acid composition of grape skins kins
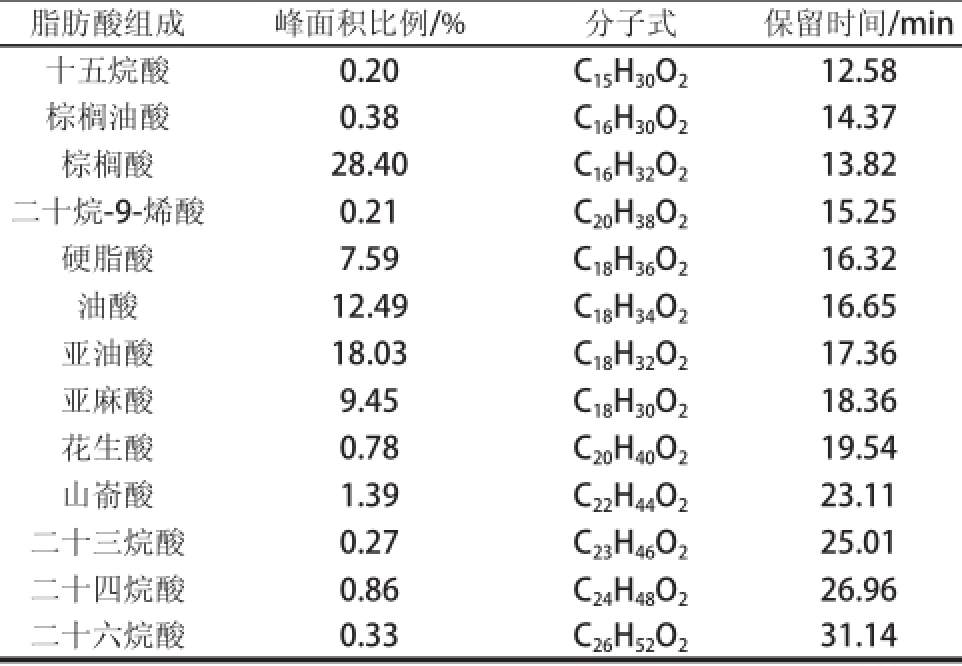
脂肪酸组成峰面积比例/%分子式保留时间/min十五烷酸0.20C 15H 30O 212.58棕榈油酸0.38C 16H 30O 214.37棕榈酸28.40C 16H 32O 213.82二十烷-9-烯酸0.21C 20H 38O 215.25硬脂酸7.59C 18H 36O 216.32油酸12.49C 18H 34O 216.65亚油酸18.03C 18H 32O 217.36亚麻酸9.45C 18H 30O 218.36花生酸0.78C 20H 40O 219.54山嵛酸1.39C 22H 44O 223.11二十三烷酸0.27C 23H 46O 225.01二十四烷酸0.86C 24H 48O 226.96二十六烷酸0.33C 26H 52O 231.14
表2葡萄果实不同采收时期脂肪酸含量的变化
Table2Change in fatty acids during different development periods of grapes pes mg/kg
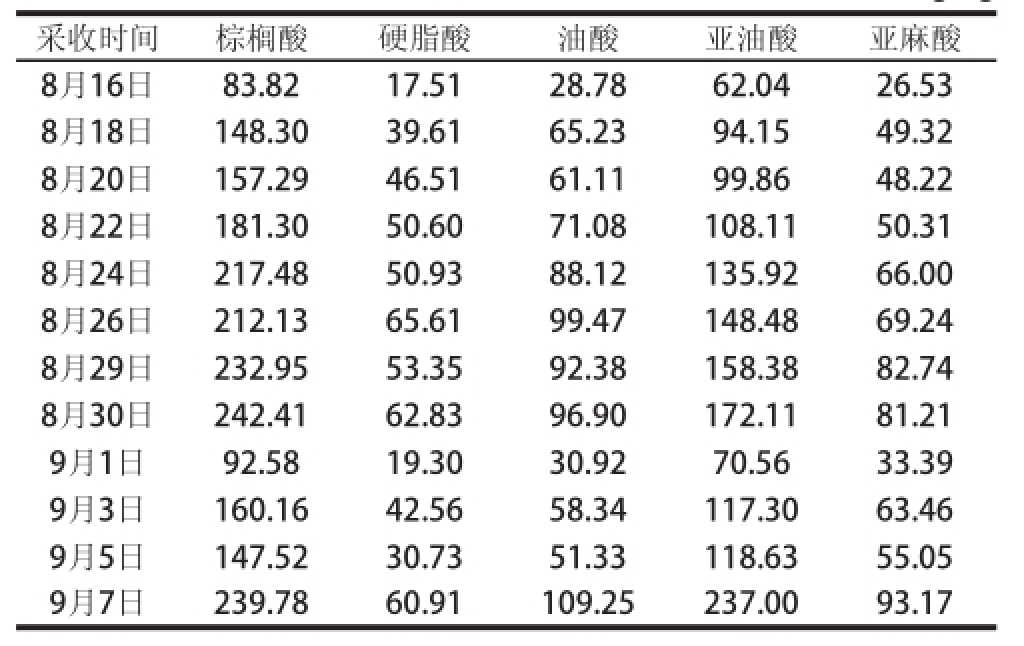
采收时间棕榈酸硬脂酸油酸亚油酸亚麻酸8月16日83.8217.5128.7862.0426.53 8月18日148.3039.6165.2394.1549.32 8月20日157.2946.5161.1199.8648.22 8月22日181.3050.6071.08108.1150.31 8月24日217.4850.9388.12135.9266.00 8月26日212.1365.6199.47148.4869.24 8月29日232.9553.3592.38158.3882.74 8月30日242.4162.8396.90172.1181.21 9月1日92.5819.3030.9270.5633.39 9月3日160.1642.5658.34117.3063.46 9月5日147.5230.7351.33118.6355.05 9月7日239.7860.91109.25237.0093.17
研究了不同反应温度、底物浓度、pH值对赤霞珠果实中脂氧合酶活性的影响,确立葡萄浆果中脂氧合酶活性的测定方法;研究了赤霞珠葡萄发育过程中脂氧合酶及脂肪酸组分的变化。本研究结果证明,当反应温度为40℃时,葡萄LOX酶有很高活性;该酶表现出较好的热稳定性。在其他植物LOX酶反应温度的研究中发现LOX酶也有很好的热稳定性 [14,16]。
随着底物添加量增大,底物浓度增大,LOX酶的活性也不断增大,到底物浓度为2×10 -4mol/L时活性达到最大,底物浓度大于2×10 -4mol/L时,酶活性不再增大,反而降低,这是由底物自身氧化产生的羟基过氧化物导致LOX酶失活引起的 [5]。
当pH值为7.0时,LOX酶活性最高,同时,当pH值在6.2左右时,酶活性也有一个相对最高值,表明葡萄LOX酶可能含有两种同工酶 [5]。在其他植物LOX酶最适pH值的研究中也有两个峰值的现象,本研究结果与此吻合 [5,14-15]。
在发育过程中赤霞珠葡萄LOX酶活性先增大后减小,成熟期趋于稳定,这可能与脂氧合酶的生理作用有关,在发育过程中LOX酶活性与外界的环境紧密相关 [5]。脂肪酸总量先增加到成熟前1周达到最大含量,之后又有所下降;赤霞珠葡萄皮中检测出13种脂肪酸,其中棕榈酸和硬脂酸占据了饱和脂肪酸含量的大部分,油酸、亚油酸和亚麻酸是不饱和脂肪酸的主要组分,这与梁茂雨 [19]、李浡 [25]等的研究结果基本一致。果实中脂氧合酶活性及脂肪酸的含量变化与其生理功能密切相关,研究为提高原料质量提供理论依据。
LOX酶是葡萄果实脂肪酸代谢途径中的关键酶,使脂肪酸代谢产生具有共轭双键的过氧化氢物,最终生成茉莉酸进而增强植株的抗性 [5],同时脂肪酸作为细胞膜的组成部分又潜在影响着LOX酶的活性。本研究测定了赤霞珠发育过程中LOX酶活性及脂肪酸组分的变化,分析了赤霞珠发育过程中LOX酶的变化规律,脂肪酸组分的变化及其主要成分,结合LOX酶和脂肪酸在植株生长发育过程中的生理学功能及相互作用,从而为葡萄园的管理提供理论支持,提供高质量的酿酒原料,对现实生产有重要意义。
参考文献:
[1]曹慧,永章,杜俊杰,等.脂氧合酶研究进展[J].安徽农业大学学报,2001,28(2):219-222.
[2]汪仁,沈文飚,翟虎渠,等.植物种子脂氧合酶[J].植物生理学通讯,2005,41(3):388-394.
[3]生吉萍,申琳,罗云波.果实成熟衰老相关酶的研究进展[J].食品与机械,2000,16(3):7-9.
[4]陈昆松,张上隆.脂氧合酶与果实成熟衰老[J].园艺学报,1998,24(4):338-344.
[5]BAYSAL T,DEMIRDOVEN A.Lipoxygenase in fruits and vegetables[J].Enzyme and Microbial Technology,2007,40(5):491-496.
[6]XIANG Zhenkong,LI Xianghong,WANG Hongjing,et al.Effect of lipoxygenase activity in defatted soybean flour on the gelling properties of soybean protein isolate[J].Food Chemistry,2008,106(10):1093-1099.
[7]张越华,曾和平.脂肪酸在生命过程中的作用研究进展[J].中国油脂,2006,31(12):11-15.
[8]李华,王华,袁春龙,等.葡萄酒工艺学[M].北京:科学出版社,2007:57-67.
[9]李彩凤,赵丽影,陈业婷,等.高等植物脂氧合酶研究进展[J].东北农业大学学报,2010,41(10):143-149.
[10]章银良,闫克玉,马庆一.脂氧合酶活性研究及其对食品质量的影响[J].食品工业科技,2002,23(7):22-24.
[11]李会容,赵昶灵,杨焕文,等.高等植物脂氧合酶活性测定的研究进展[J].中国农学通报,2011,27(15):217-223.
[12]钟芳,王璋,许时婴.3种脂肪氧合酶酶活测定方法[J].无锡轻工大学学报,2001,20(1):77-80.
[13]AXELROD B,CHEESBROUGH T M,LEAKSO S.Lipoxygenase from soy-beans[J].Methods in Enzymology,1981,10(7):443-451.
[14]李强,吴晓露,李红伟,等.黄瓜果实脂氧合酶活性测定方法的建立[J].东北农业大学学报,2008,39(5):62-65.
[15]陈昆松,徐昌杰,许文平,等.弥胡桃和桃果实脂氧合酶活性测定方法的建立[J].果树学报,2003,20(6):436-438.
[16]李铭韧,史国安.牡丹花瓣脂氧合酶测定方法的研究[J].山东农业科学,2010,9(4):91-93.
[17]边梅娜,刘红进,曾红,等.赤霞珠葡萄籽油的提取及脂肪酸组分分析[J].食品科学,2013,34(4):297-300.
[18]徐聃,朱传娟,苏海霞.气相色谱法测定葡萄子的脂肪酸含量[J].农产品加工,2005,9(8):74-76.
[19]梁茂雨,刘钢湖.红提葡萄中有机酸成分的GC-MS分析[J].食品研究与开发,2007,28(10):148-149.
[20]张莉,魏冬梅,王华.葡萄籽油脂肪酸GC-MS色谱分析条件优化[J].食品研究与开发,2013,34(3):63-65.
[21]牛翠娇,史玉琴,殷志萍,等.气相色谱-质谱法测定食品中的反式脂肪酸[J].安徽农业科学,2011,39(6):3649-3651.
[22]姚锋先,曾晓春,蒋海燕,等.水稻中以亚麻酸为底物的脂氧合酶活性测定[J].江西农业大学学报,2006,28(2):183-186.
[23]LYNCH D V,SRIDHARA S,THOMPSON J E.Lipoxygenase-generated hydroperoxides account for the nonphysiological features of ethy-lene formation from1-aminocyclop ropane-1-carboxylic acid by microsomal membranes of carnations[J].Planta,1995,164(5):121-125.
[24]黄珊珊,李长锁,杨明亮,等.水杨酸、茉莉酸途径4种关键酶与大豆抗蚜性的研究[J].作物杂志,2012,18(5):54-58.
[25]李浡,李双石,章宇宁,等.酿酒葡萄皮油成分的气相色谱-质谱分析[J].食品科技,2012,37(12):270-274.
Determination of Lipoxygenase Activity and Change in Fatty Acid Composition in Cabernet Sauvignon Grape Berries
JU Yanlun,FANG Yulin*,ZHANG Li,ZENG Jie,LIU Jibin
(Shaanxi Engineering Research Center for Viti-Viniculture,College of Enology,Northwest A&F University,Yangling712100,China)
Abstract:In this work,a spectrophotometric assay was used to investigate the lipoxygenase activity in Cabernet Sauvignon grapes using linoleic acid sodium as a substrate as a function of reaction temperature,substrate concentration and pH.Gas chromatography-mass spectrometry(GC-MS)was used to analyze the fatty acid composition in grape skin.The changes in lipoxygenase activity and fatty acid composition in Cabernet Sauvignon during grape berry development were examined.The enzyme had the highest activity under the reaction conditions:40℃,a substrate concentration of2×10 -4mol/L,and pH7.0.The enzyme activity also showed good thermal stability at80℃.At the veraison stage,the enzyme activity began to increase,and reached the maximum level at2-3weeks before maturity followed by a sharp decrease and then stabilization during the ripening stage.Thirteen kinds of fatty acids were detected in Cabernet Sauvignon grape skins.Palmitic acid and stearic acid dominated the identified saturated fatty acids;the predominant unsaturated fatty acids were oleic acid,linoleic acid and linolenic acid.The total fatty acid content reached the maximum at about1week before maturity.
Key words:Cabernet Sauvignon;lipoxygenase(LOX);fatty acid;enzyme activity;composition change
中图分类号:TS255.2
文献标志码:A
文章编号:1002-6630(2015)05-0115-05
doi:10.7506/spkx1002-6630-201505022
收稿日期:2014-05-02
基金项目:农业部“948”项目(2014K30902140);“十二五”国家科技支撑计划项目(2012BAD31B07);国家现代农业(葡萄)产业技术体系建设专项(nycytx-30-2p-04)
作者简介:鞠延仑(1990—),男,硕士研究生,主要从事葡萄生理生化研究。E-mail:1169679203@qq.com
*通信作者:房玉林(1973—),男,教授,博士,主要从事葡萄生理生化与葡萄资源综合利用研究。E-mail:fangyulin@nwsuaf.edu.cn