
图1 质粒低温PCR产物PCR
Fig.1Low temperature PCR products from plasmid
张丽媛 1,马红丹 1,赵邯郸 1,徐丹丹 1,曲 静 2,关淑艳 1,*,王丕武 2,*
(1.吉林农业大学生命科学学院,吉林长春130118;2.吉林农业大学农学院,吉林长春130118)
摘要:目的:利用低温聚合酶链式反应对大豆超氧化物歧化酶(superoxide dismutase,SOD)的活性进行改良。方法:将6种在较低退火温度下扩增出的超氧化物歧化酶基因插入到表达载体pREP5N上,构建pPM1、pPM2、pPM3、pPM4、pPM5、pPM6表达载体,转入大肠杆菌后得到工程菌,诱导其在大肠杆菌中进行蛋白表达,并进行酶活力测定,筛选高酶活力菌株。结果:将已克隆的目的基因序列与已知的大豆MnSOD基因序列比对分析,一致性平均为86.57%,氨基酸序列同源性平均为82.58%。对已获得的6种工程菌进行蛋白质提取,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果显示表达产物的分子质量约为26kD。经1%差异水平分析,改良后的SOD酶活力均有极显著提高,平均比对照菌株的酶活力提高1.95倍。结论:本实验证明低温聚合酶链式反应是改变酶活性的一种有效方法,为超氧化物歧化酶在生产中的应用提供了技术支持。
关键词:超氧化物歧化酶基因;低温聚合酶链式反应;酶活力
超氧化物歧化酶(superoxide dismutase,SOD)是一种源于生命体的活性物质,是一种特定的具有生物催化功能的蛋白质,是生物体内各个组织中唯一能够特异性清除、平衡氧自由基的抗氧化酶,消除生物体在新陈代谢过程中产生的有害物质 [1-3]。SOD在机体衰老过程中扮演着重要角色,现已被制成药丸或药片剂型的营养补充品 [4-5]。在食品工业中,SOD可作为食品抗氧化剂,防止过氧化酶引起的食品变质及腐烂现象,或作为食品营养的强化剂,有延缓衰老的作用;在化工行业中,SOD可作为化妆品的添加剂,有抗皱、祛斑、防晒及抗炎等功效;按照结合的金属离子不同,可将SOD分为3种类型:FeSOD、Cu/ZnSOD、MnSOD。其中,MnSOD主要存在于细胞线粒体中 [6-9],而线粒体是自由基产生的场所,因此MnSOD在线粒体中有非常重要的地位,此外,MnSOD无论在用药途径还是临床应用范围都是相当广泛的,已逐渐被公认为是一种新型肿瘤抑制因子和抗炎症药物,很可能在不久的将来用于恶性肿瘤的治疗 [6,10-11]。对MnSOD的研究已经受到生物化学界、医(药)学界、化工界的高度重视,因此积极开展MnSOD基因工程及其下游技术的研究有重大意义 [8,12-13]。
天然酶在自然条件下已经进化了千百万年,但是酶分子仍然蕴藏着巨大的进化潜力,这是酶体外定向进化的基本先决条件 [14]。低温聚合酶链式反应(polymerase chain reaction,PCR)技术是酶分子改造的一种新策略,该方法通过降低退火温度对待改造基因进行定向进化研究,以期获得酶活力提高及其他酶学性质有所改善的突变酶,此方法不需要事先了解酶的空间结构、活性位点和催化机制等因素,在待改造酶基因的PCR扩增反应中随机引入突变,构建突变库,凭借定向选择的方法选出所需性质优化的酶,可在较短时间内完成。迄今为止,利用PCR进行定点突变的方法主要包括:重组PCR法、重叠延伸法、含U模板法和大引物突变法等,然而这些方法操作较为复杂,步骤较为繁琐 [15]。本实验根据GenBank已发表的大豆MnSOD基因DNA序列,利用同源性设计引物 [16],采用低温PCR技术使已得到的超氧化物歧化酶基因发生随机突变,进行酶活性改造,提高超氧化物歧化酶活性,筛选高酶活性菌株,为超氧化物歧化酶在生产中的应用提供技术支持。
1.1 材料
1.1.1 菌株、质粒
大肠杆菌菌株DH5α(E. coli DH5α)、质粒pREP5NMnSOD、pMD18-T Vector、穿梭表达载体pREP5N,均由吉林农业大学植物生物技术中心实验室保存。
1.1.2 试剂
PCR相关试剂、T4连接酶、各种限制性内切酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)日本TaKaRa公司;质粒提取试剂盒、凝胶回收试剂盒、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)北京鼎国生物工程有限公司;其他试剂和药品均为国产分析纯。
1.2 方法
1.2.1 引物设计
根据GenBank已发表的大豆MnSOD基因的DNA序列(序列号AJ440726),应用Premier5.0引物设计软件,设计特异性引物,为了便于载体构建,在上游引物和下游引物的5'端分别引入限制性内切酶酶切位点。上游引物:5'-ATT GTC GAC ATG GCC GCG CGA GCT CTG T-3'(划线部分为SalⅠ的酶切位点),下游引物:5'-GCG GAT CCC TAA GAG CTC TCT TTC TCA TAC-3'
(划线部分为BamHⅠ的酶切位点)。引物由三博远志有限公司合成。
1.2.2 超氧化物歧化酶基因的低温PCR扩增
以质粒pREP5N-MnSOD为模板,设置6种退火温度对超氧化物歧化酶基因进行扩增 [17],分别为22.0、25.6、28.7、36.2、39.5、42.9℃,各自进行以下反应,反应体系为:5μL10×PCR Buffer(5mmol/L Mg 2+Plus);0.5μL dNTP(10mmol/L);上下引物各0.5μL;1μL质粒DNA;0.3μL Taq酶(5U/μL),超纯水补至总体积为25μL。PCR程序为:94℃预变性5min;94℃变性40s,按上述6种退火温度退火1min,72℃延伸70s,共30个循环,72℃后延伸10min,4℃保存 [18-19]。PCR产物电泳后,分别回收扩增片段并分别与pMD18-T Vector连接,转化E. coli DH5α感受态细胞,涂布固体LB(含100mg/mL氨苄青霉素(ampicillin,Amp))平板,抗性筛选阳性转化子,送至三博远志有限公司进行测序。
1.2.3 低温PCR扩增产物表达载体的构建
挑取转化子摇菌、提取质粒后,进行常规退火温度(52℃)的PCR,将纯化后的PCR产物和穿梭表达载体pREP5N经BamHⅠ和SalⅠ双酶切4h后回收,回收产物按1∶4(V/V)比例混合后加入T4DNA连接酶连接过夜,将连接液转化大肠杆菌感受态E. coli DH5α,在含氨苄青霉素(Amp +100mg/mL)的LB培养基上进行筛选 [20],利用质粒提取试剂盒进行质粒DNA的提取,分别将重组表达载体命名为pPM1、pPM2、pPM3、pPM4、pPM5、pPM6,进行PCR、双酶切鉴定。
1.2.4 目的基因氨基酸序列分析
利用DNAMAN软件将目的基因测序结果与GenBank(AJ440726)已发表的大豆MnSOD基因序列进行比对,同时与原序列基因进行氨基酸序列比对分析。
1.2.5 目的基因在大肠杆菌中的表达及酶活性测定
将重组表达载体pPM1、pPM2、pPM3、pPM4、pPM5、pPM6通过大肠杆菌转化法转入大肠杆菌后得到工程菌,命名为E. coli DH5α(pPM1)~E. coli DH5α(pPM6),利用终浓度为1mmol/L的IPTG对工程菌诱导培养,进行超声波破碎,条件为:功率1100W,超声波5s、间歇5s,总超声波时间15min。提取酶液,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分析 [21]。参照氮蓝四唑法(nitro-blue tetrazolium,NBT)进行酶活性测定,并对酶活性进行1%差异水平分析。
2.1 超氧化物歧化酶低温PCR扩增结果

图1 质粒低温PCR产物PCR
Fig.1Low temperature PCR products from plasmid
如图1所示,在800bp左右有扩增条带,测序结果显示,DNA片段大小分别为814、814、823、821、795、826bp。
2.2 低温PCR扩增产物表达载体的构建及鉴定
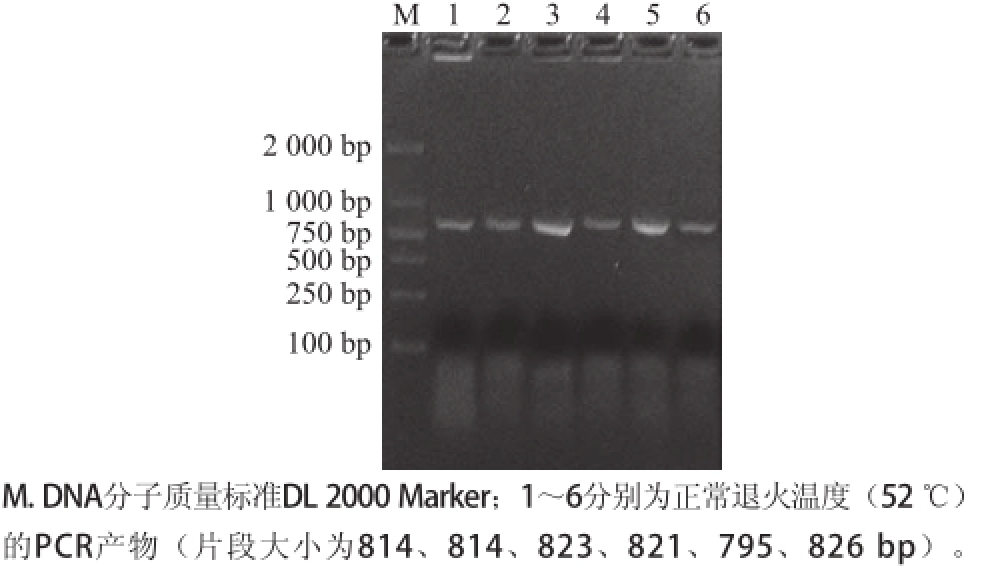
图2重组表达载体PCR产物凝胶电泳图
Fig.2Agarose gel electrophoresis of PCR products
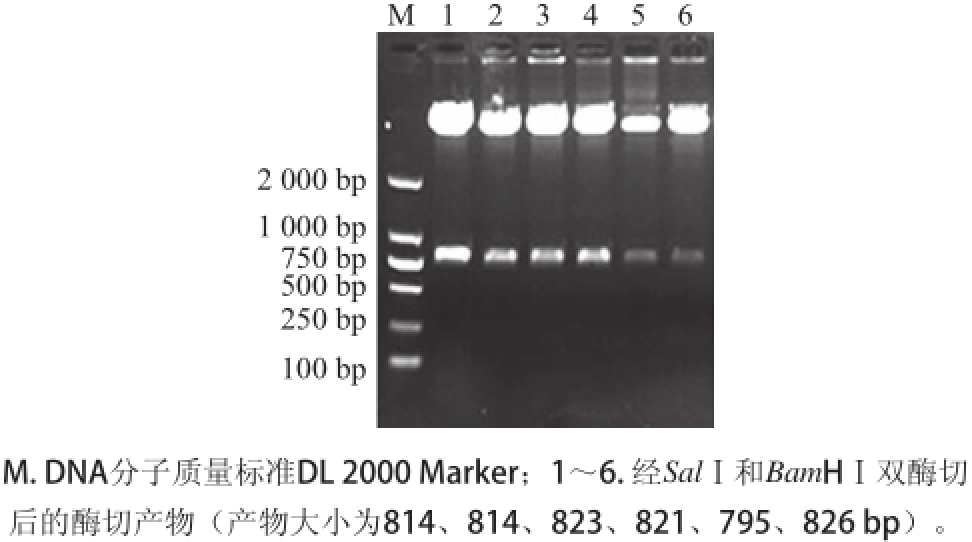
图3重组表达载体的酶切鉴定结果
Fig.3Enzyme digestion identification of expression vectors pPM1,pPM2,pPM3,pPM4,pPM5and pPM6
对已构建的pPM1、pPM2、pPM3、pPM4、pPM5、pPM6重组表达载体进行PCR和双酶切鉴定,如图2、3所示,经PCR及SalⅠ+BamHⅠ双酶切均得到大小约为814、814、823、821、795、826bp左右的特异带,结果表明经低温扩增的片段已成功连接到穿梭表达载体pREP5N上,保存菌种用于下一部分表达实验。
2.3 目的基因氨基酸序列比对结果
将已克隆的6个目的基因序列与已发表的大豆MnSOD基因序列进行氨基酸序列比对,比对结果(图4)表明氨基酸序列同源性分别为86.19%、86.52%、84.87%、87.73%、88.59%、64.55%。

图4目的基因氨基酸序列与原氨基酸序列比对结果
Fig.4Alignment of target amino acid sequence and original gene sequence
2.4 目的蛋白结构分析
经ProMod Version3.70的分析,6种酶蛋白均有MnSOD的特征性催化位点,表明该蛋白属于MnSOD型超氧化物歧化酶蛋白的类似物,同时构建目的基因表达产物的3D立体结构图(图5),其立体结构中含有典型的MnSOD特征性催化位点的折叠结构,当退火温度分别为22.0、25.6、28.7、36.2、39.5、42.9℃时,6种酶蛋白的理论等电点及原酶等电点分别为7.37、6.64、8.50、8.45、8.30、8.27、8.56。其中在206~213、206~213、210~217、218~225、217~226、208~215、202~209处共含有1个MnSOD特征性催化位点。如图5所示,突变酶蛋白与原超氧化物歧化酶三维蛋白结构整体相似。
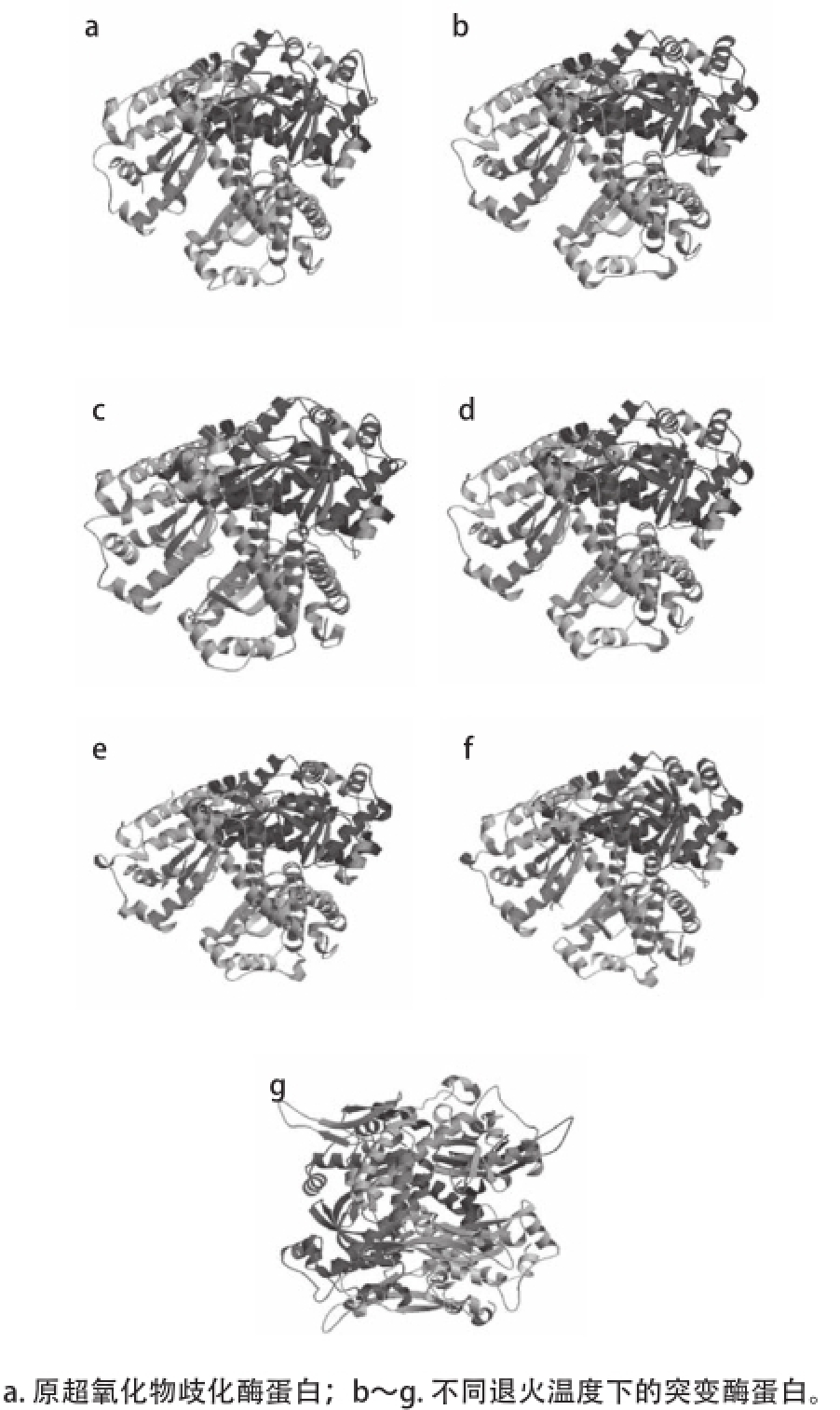
图5目的基因表达产物的3D立体结构预测图
Fig.5Predicted three-dimensional stru ctures of the expression products of target genes
根据突变后的比对结果,结合文献[22]中MnSOD的空间位点,其第62、117、200、204位以及第82、83、160位的氨基酸对于活性中心与底物的结合有一定作用,结合本研究所获得的突变氨基酸序列与原序列对比的结果,发现MnSOD活性中心组氨酸(His)周围存在酪氨酸(Tyr)突变为苯丙氨酸(Phe)的突变位点,由于此位点靠近酶的活性区域,因此对酶活性有很大影响,酪氨酸(Tyr)为极性氨基酸,苯丙氨酸(Phe)为非极性氨基酸,此突变降低了此区域的极性,因此更加突显出了超氧化物歧化酶活性中心组氨酸(His)与天冬氨酸(Asp)等关键氨基酸的极性,进而提高了底物分子对于Mn 2+的识别能力,同时还发现在其识别底物分子的敏感区域第82位的蛋氨酸(Met)突变为苏氨酸(Thr),虽然此突变导致环境极性有所提高,但由于此位点与超氧阴离子自由基进入活性区域有直接关系且苏氨酸(Thr)对于蛋氨酸(Met)而言空间位阻较小,因此也有提高自由基结合活性中心的可能性,进而提高超氧化物歧化酶的活性。

图6蛋白质在大肠杆菌中表达的SDS-PAGE分析AGE
Fig.6SDS-PAGE analysis of expressed proteins in E. coli DH5α
2.5 目的基因在大肠杆菌中的表达如图6所示,目的蛋白的分子质量约为26.0kD,蛋白质表达量基本相同。另外在含空载体大肠杆菌的细胞裂解物中,不存在分子质量大小约为26.0kD的条带。
2.6 表达产物的酶活力
表1 SOD酶活力分析
Table1Superoxide dismutase activities of different strains

注:同列小写字母不同表示差异显著(P<0.05);同列大写字母不同表示差异极显著(P<0.01)。
菌株酶活力/(U/mL)与原菌株酶活力比值E. coli DH5α(pPM3)71.61±2.35 aA2.32 E. coli DH5α(pPM4)63.96±2.11 abAB2.07 E. coli DH5α(pPM1)63.51±5.87 abAB2.05 E. coli DH5α(pPM2)60.35±8.77 abB1.96 E. coli DH5α(pPM5)53.73±8.71 bcB1.75 E. coli DH5α(pPM6)47.62±4.71 cB1.55 E. coli DH5α(pPEP5N-MnSOD)30.79±8.44 dC
如表1所示,由突变菌株E. coli DH5α(pPM1)~E. coli DH5α(pPM6)与原菌株酶活力的比值可知其酶活力均有极显著提高(P<0.01),平均提高1.95倍。
关于SOD酶活力的测定方法,目前已建立了很多种,但由于SOD的底物极不稳定,至今尚未找到一种既简便又准确的检测SOD酶活性的方法,一般测定SOD酶活性的方法均属间接法,主要有化学测定法、免疫测定法、等电凝胶法 [23],但各方法间测定结果的差异很大,不具有可比性,本研究利用NBT光化还原法对超氧化物歧化酶活性进行检测,该方法在测定比较纯的样品时重复性较好、无需贵重仪器和试剂、方法简便、灵敏度高、结果稳定,适用于一般实验室采用。
本研究通过低温PCR扩增大豆超氧化物歧化酶MnSOD基因,并成功构建穿梭表达载体(pPM1~pPM6),将目的基因序列与已知大豆MnSOD基因序列进行比对分析,结果表明基因一致性平均为86.57%,氨基酸序列同源性平均为82.58%。诱导其在大肠杆菌中表达,通过SDS-PAGE检测,得到了与预期大小相符的目的蛋白条带,经分析6种蛋白均有MnSOD特征性催化位点,属于MnSOD型酶蛋白,证明了目的基因表达产物的催化功能。根据测定超氧化物歧化酶常用的方法NBT光还原法分别测定E. coli DH5α(pPM1)~E. coli DH5α(pPM6)菌株已表达的蛋白酶活力,结果表明目的蛋白酶酶活力平均比对照菌株的酶活力提高1.95倍。本研究表明利用低温PCR技术改变酶活性是一种有效的方法,上述结果为超氧化物歧化酶在生产中的应用提供技术支持,对利用大肠杆菌工业化发酵生产SOD具有一定的指导借鉴作用。
参考文献:
[1]TANG Yuhan,XU Jian,QU Wei,et al.Resveratrol reduces vascular cell senescence through attenuation of oxidative stress by SIRT1/ NADPH oxidase-dependent mechanisms[J].The Journal of Nutritional Biochemistry,2012,23(11):1410-1416.
[2]何献君,梁晓冬,吕晓峰,等.超氧化物歧化酶应用研究状态[J].中国医药指南,2010,8(15):37-39.
[3]CHEN Hai,ROMO-LEROUX P A,SALIN M L.The iron-containing superoxide dismutase-encoding gene from Chlamydomonas reinhardtii obtained by direct and inverse PCR[J].Gene,1996,168(1):113-116.
[4]吴军帅,李培环,李鼎立,等.桃果实铜锌超氧化物歧化酶基因PpCuZnSOD的克隆与分析[J].核农学报,2013,27(4):408-417.
[5]王春花,刘克明,张明月,等.SOD基因表达与衰老的相关性[J].中国公共卫生,2004,20(8):953-954.
[6]OZTURK P,ARICAN O,KURUTAS E B,et al.Oxidative stress in patients with scalp seborrheic dermatitis[J].Acta Dermatovenerologica Croatica,2013,21(2):80-85.
[7]KARAHALIL B,KESIMCI E,EMERCE E,et al.The impact of OGG1,MTH1and MnSOD gene polymorphisms on8-hydroxy-2’-deoxyguanosine and cellular superoxide dismutase activity in myocardial ischemia-reperfusion[J].Molecular Biology Reports,2011,38(4):2427-2435.
[8]BRESCIANI G,CRUZ I B M,de PAZ J A,et al.The MnSOD Ala16Val SNP:relevance to human diseases and interaction with environmental factors[J].Free Radical Research,2013,47(10):781-792.
[9]王占庆,赵维娟,王金萍.超氧化物歧化酶同功酶基因多态性研究进展[J].中国新药杂志,2012,21(16):1884-1888.
[10]BAFANA A,DUTT S,KUMAR A,et al.The basic and applied aspects of superoxide dismutase[J].Journal of Molecular Catalysis B:Enzymatic,2011,68(2):129-138.
[11]董亮,何永志,王远亮,等.超氧化物歧化酶(SOD)的应用研究进展[J].中国农业科技导报,2013,15(5):53-58.
[12]KANG D H,KANG S W.Targeting cellular antioxidant enzymes for treating atherosclerotic vascular disease[J].Biomolecules&Therapeutics,2013,21(2):89-96.
[13]马伟荣,童军茂,单春会.超氧化物歧化酶(SOD)的特征及在植物抗逆性方面的研究进展[J].食品工业,2013,34(9):154-158.
[14]ZHU Jiang,YU Haibo,FAN Hao,et al.Design of new selective inhibitors of cyclooxygenase-2by dynamic assembly of molecular building blocks[J].Journal of Computer-Aided Molecular Design,2001,15(5):447-463.
[15]陈英,朱绮霞,张搏,等.基于易错PCR技术的黏质沙雷氏菌脂肪酶基因LipA的定向进化[J].生物技术通报,2011(4):181-185.
[16]李相前,邵蔚蓝.极耐热内切葡聚糖酶Cel12B的基因克隆,表达和酶学性质的研究[J].南京师范大学学报:自然科学版,2006,29(3):71-75.
[17]徐鹏飞,鹿文成,靳立梅,等.野生大豆接种大豆疫霉根腐病菌后超氧化物歧化酶活性变化[J].作物杂志,2011(5):31-35.
[18]PONG K.Oxidative stress in neurodegenerative diseases:therapeutic implications for superoxide dismutase mimetics[J].Expert Opinion on Biological Therapy,2003,3(1):127-139.
[19]严万里,陈晓明,郭丽燕,等.超氧化物歧化酶活性测定的影响因素研究[J].生物学通报,2011,46(3):50-53.
[20]SOMPOL P,XU Y,ITTARAT W,et al.NF-κB-associated MnSOD induction protects againstβ-amyloid-induced neuronal apoptosis[J].Journal of Molecular Neuroscience,2006,29(3):279-288.
[21]陈素娟,董文宾.超声波辅助提取猪血超氧化物歧化酶的研究[J].食品科技,2010,35(12):228-231.
[22]王伟霞,李福后,吕玲玲.高产SOD海洋酵母菌的筛选及其发酵条件的研究[J].食品科技,2007,32(5):29-32.
[23]李宝红,王庆松,马惠苹,等.氯化硝基四唑氮蓝(NBT)法在蟾蜍血细胞中乳酸脱氢酶定性定位中的应用[J].继续医学教育,2013,27(3):43-45.
Improved Superoxide Dismutase Activity in Soybean by Low Temperature Polymerase Chain Reaction(PCR)
ZHANG Liyuan
1,MA Hongdan
1,ZHAO Handan
1,XU Dandan
1,QU Jing
2,GUAN Shuyan
1,*,WANG Piwu
2,*
(1.College of Life Sciences,Jilin Agricultural University,Changchun130118,China;2.Faculty of Agronomy,Jilin Agricultural University,Changchun130118,China)
Abstract:Objective:This study aims at modifying the activity of superoxide dismutase in soybean by low temperature PCR.Methods:Six amplified superoxide dismutase genes at low annealing temperatures were inserted into the expression vector pREP5N to construct the new vectors pPM1,pPM2,pPM3,pPM4,pPM5and pPM6.These expression vectors were introduced into E. coli for enzyme expression.The enzyme activity was determined for screening strains with high enzyme activity.Results:The alignment analysis of cloned sequences versus published MnSOD sequences showed that the consistency was86.57%on average.The homology of amino acid sequences was82.58%.The molecular weights of the proteins extracted from six strains were approximately26kD as determined by SDS-PAGE.Enzyme activity was significantly improved(P <0.01)by1.95folds on average.Conclusion:The findings of this study provide technical support for the application of superoxide dismutase.
Key words:superoxide dismutase gene;low temperature polymerase chain reaction;enzyme activity
中图分类号:Q786
文献标志码:A
文章编号:1002-6630(2015)05-0126-05
doi:10.7506/spkx1002-6630-201505024
收稿日期:2014-04-16
基金项目:农业科技成果转化资金项目(2013GB2B100125);吉林省科技支撑计划项目(20120215);吉林农业大学启动基金项目(201242)
作者简介:张丽媛(1987—),女,硕士,研究方向为重要农艺性状基因的分离功能鉴定及品种改良。E-mail:790844929@qq.com
*通信作者:关淑艳(1971—),女,教授,博士,研究方向为重要农艺性状基因的分离功能鉴定及品种改良。
E-mail:458194095@qq.com
王丕武(1958—),男,教授,博士,研究方向为重要农艺性状基因的分离功能鉴定及品种改良。
E-mail:piwuw@163.com