段宙位,谢辉,窦志浩*,何艾,万祝宁
(海南省农业科学院农产品加工设计研究所,海南海口571100)
摘要:以冰鲜石斑鱼肉为原料,采用碱性蛋白酶酶解的方法制备蛋白肽。以水解度和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为评价指标,在单因素试验的基础上,运用正交试验设计优化肽的制备工艺;利用DPPH自由基法、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothi azoline-6-sulfonic acid)ammonium salt,ABTS)自由基法、羟自由基(·OH)法和铁氰化钾还原法评价酶解物的抗氧化性。结果表明:石斑鱼肉肽的最佳制备条件为:酶解温度55℃、酶解pH9、酶用量5000U/g、底物质量浓度8g/100mL、酶解时间5h;石斑鱼肉肽酶解物具有较强的抗氧化性,清除DPPH自由基能力、ABTS +·能力、·OH能力和总还原力均随酶解物质量浓度的增加而增强;酶解物清除DPPH自由基、ABTS +·、·OH的半抑制浓度(IC 50)值分别为(1.18±0.26)、(0.89±0.05)mg/mL和(0.35±0.02)mg/mL。关键词:冰鲜石斑鱼肉;肽;水解度;清除率;抗氧化
石斑鱼属硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、鮨科(Serranidae)、石斑鱼属(Epinephelus),为肉食性珊瑚礁鱼类 [1]。在我国,石斑鱼主要分布在海南、广东、福建等沿海地区 [2],其肉质细嫩洁白、脂肪含量低、蛋白质含量高,营养价值丰富,有“海鸡肉”之称 [3]。近年来由于市场需求量大,石斑鱼养殖量迅速增加。据统计,2013年,海南全省石斑鱼产量约为6万t,约占全国石斑鱼养殖产量的60%,居全国第一位。目前,我国对石斑鱼的研究多以养殖 [4-7]、防治病害 [8]、遗传变异 [9]等方面为主,尚未开展对其进行深加工研究,不利于石斑鱼经济价值的提升。石斑鱼在养殖、销售过程中死亡率较高,这些死亡的石斑鱼常以冰冻的形式销售或者丢弃,经济价值低。研究开发分子质量小 、易吸收的蛋白肽,应用于功能性食品、保健品、化妆品、生物医药领域,具有广阔的市场前景。
目前,国内外对多肽的研究,按其来源主要分为植物肽与动物肽两类。植物肽的研究主要集中在豆类、谷类、油料类中蛋白肽的制备及其抗氧化,降血压、抗疾病、抗衰老等活性 [10-12]的评价上。动物肽的研究相对较少,关于鱼肉肽的酶法制备及其活性研究更少,主要表现在鲢鱼、鳙鱼、鲤鱼、鳕鱼肉肽的制备及其活性的研究上 [13-15]。然而,关于石斑鱼肉肽的制备及其抗氧化性研究尚未见相关报道。本实验以冰鲜石斑鱼肉为原料,采用酶法制备蛋白肽,同时测定其抗氧化性,以期为石斑鱼高值化利用提供理论依据,促进石斑鱼加工业的发展。
1.1 材料与试剂
冰鲜石斑鱼,购于海口市大润发超市。
碱性蛋白酶、中性蛋白酶、酸性蛋白酶、木瓜蛋白酶北京索莱宝科技有限公司;胃蛋白酶、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)美国Sigma公司;2,2’-联氮双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)生工生物工程(上海)股份有限公司;铁氰化钾、三氯乙酸、氯化铁、磷酸氢二钠、磷酸二氢钠、水杨酸、盐酸、硫酸亚铁、双氧水广州化学试剂厂;其他试剂均为国产分析纯。
1.2 仪器与设备
CPA225D电子天平德国Sartorius公司;恒温摇床上海世平实验设备有限公司;循环水式真空泵巩义市予华仪器有限责任公司;TU-1810紫外-可见分光光度计北京普析通用仪器有限责任公司;RE-52AA式旋转蒸发仪上海亚荣生化仪器厂。
1.3 方法
1.3.1 原料预处理
将石斑鱼洗净,去头、去尾、去皮、去骨、去内脏,捣碎,依次用丙酮、乙醇脱脂,得到石斑鱼肉实验原料(含水率约为81.36%),4℃冷藏,备用。
1.3.2 工艺流程
石斑鱼→预处理→匀浆→酶解→灭酶→冷却→离心→取上清液→测定水解度与DPPH自由基清除率→优化酶解工艺→制备蛋白肽→测定肽含量→浓缩→干燥→评价抗氧化活性→成品
1.3.3 水解度(degree of hydrolysis,DH)的测定
水解后生成的游离—NH 2量按甲醛滴定法 [8]测定,样品总氮含量由凯氏定氮法测定。水解度按照下式计算。
式中:N 1为水解后生成的氨基氮含量/(mmol/L);N 2为样品总氮含量/(mmol/L)。
1.3.4 DPPH自由基清除能力的测定
参考文献:[16-17],略有修改,将石斑鱼肉酶解液稀释1倍,取2mL稀释溶液,加入2mL6.5×10 -5mol/L DPPH溶液,混合后避光反应30min,以95%乙醇调零,在517nm波长处测其吸光度(A i);同时测定2mL95%乙醇与2mL样品稀释溶液混合后的吸光度(A j)以及2mL DPPH溶液与2mL95%乙醇混合后的吸光度(A 0),DPPH自由基清除率按下式计算。
1.3.5 多肽含量的测定
参考鲁伟等 [18]的方法测定石斑鱼肉酶解液多肽含量。
1.3.6 最适作用酶的选择
选择碱性蛋白酶、中性蛋白酶、酸性蛋白酶、胃蛋白酶、木瓜蛋白酶,分别在各酶最适pH值与温度条件下,酶解石斑鱼肉,测定酶解液的水解度及DPPH自由基清除率,确定其最适作用酶。
1.3.7 石斑鱼肉蛋白肽制备的单因素试验
1.3.7.1 酶解温度对水解度与DPPH自由基清除率的影响
将石斑鱼肉分别置于不同温度(40、45、50、55、60℃)下,在底物质量浓度10g/100mL、酶用量4000U/g、pH8的条件下酶解5h,考察酶解温度对水解度与DPPH自由基清除率的影响。
1.3.7.2 pH值对水解度与DPPH自由基清除率的影响
将石斑鱼肉分别置于不同pH值(7、8、9、10、11)下,在温度55℃,底物质量浓度10g/100mL、酶用量4000U/g条件下酶解5h,考察酶解pH值对水解度与DPPH自由基清除率的影响。
1.3.7.3 酶用量对水解度与DPPH自由基清除率的影响
将石斑鱼肉分别置于不同酶用量(2000、3000、4000、5000、6000U/g)反应体系中,在pH9,温度55℃,底物质量浓度10g/100mL条件下酶解5h,考察酶用量对水解度与DPPH自由基清除率的影响。
1.3.7.4 底物质量浓度对水解度与DPPH自由基清除率的影响
将石斑鱼肉分别置于不同底物质量浓度(4、6、8、10、12g/100mL)反应体系中,在酶用量4000U/g,pH9,温度55℃条件下酶解5h,考察底物质量浓度对水解度与DPPH自由基清除率的影响。
1.3.7.5 酶解时间对水解度与DPPH自由基清除率的影响
将石斑鱼肉置于温度55℃、pH9、酶用量4000U/g、底物质量浓度8g/100mL条件下,分别酶解3、4、5、6、7h,考察酶解时间对水解度与DPPH自由基清除率的影响。
1.3.8 石斑鱼肉蛋白肽制备的正交试验
在单因素试验的基础上,运用L 9(3 4)正交表,以水解度与DPPH自由基清除率为评价指标,选择酶解温度、pH值、底物质量浓度、酶解时间做四因素三水平试验,确定石斑鱼肉蛋白肽最佳制备工艺。
1.3.9 蛋白肽的活性评价
将石斑鱼肉肽酶解液浓缩干燥,稀释成不同质量浓度的样液,按照DPPH自由基法、ABTS +·法 [19]、·OH法 [20]与总还原力法 [21]评价其抗氧化活性。
2.1 最适作用酶的选择由表1可知,不同蛋白酶对石斑鱼肉的水解能力、酶解产物的抗氧化活性有着较为明显的差异。碱性蛋白酶对石斑鱼肉的水解能力最强,所得酶解产物清除DPPH自由基的效果最好。这是因为酶具有专一性,不同蛋白酶的作用位点不同,其与底物作用时具有一定的特异性。在不同蛋白酶的作用下,同一蛋白质的水解度、水解产物中多肽长度及结构存在差异,进而影响酶解产物的抗氧化性。因此,选用碱性蛋白酶进行后续试验。
表1 不同蛋白酶对水解度与DPPH自由基清除率的影响
Table1Effect of different proteases on DH and DPPH radical scavenging rate of hydrolysatessates

注:同行不同小写字母表示差异显著(P<0.05)。
酶种类酸性蛋白酶中性蛋白酶碱性蛋白酶胃蛋白酶木瓜蛋白酶水解度/%4.56±0.31 c6.05±0.36 b7.52±0.46 a2.78±0.12 d3.02±0.21 dDPPH自由基清除率/%28.52±1.21 c37.28±1.45 b45.26±2.26 a14.85±0.32 d18.36±0.87 d
2.2 单因素试验
2.2.1 酶解温度对水解度与DPPH自由基清除率的影响

图1 酶解温度对石斑鱼肉肽水解度与DPPH自由基清除率的影响
Fig.1Effect of hydrolysis temperature on DH and DPPH radical scavenging rate of hydrolysates
由图1可知,当温度小于55℃时,石斑鱼肉蛋白的水解度、DPPH自由基清除率均随温度的升高而增加;此后反而下降。这是因为温度是影响蛋白酶活性的主要因素,每种酶都有其最适温度,当温度小于55℃时,低于碱性蛋白酶的最适温度,随着温度的升高,反应速率加快,酶解物还原能力增强,水解度增大,酶解产物中抗氧化肽含量增加,DPPH自由基清除率增大;当温度高于55℃时,高于碱性蛋白酶的最适温度,酶活性降低,水解反应速率减慢,水解度减小,酶解产物抗氧化肽含量减少,DPPH自由基清除率减小。因此,酶解温度选择55℃左右为宜。
2.2.2 pH值对水解度与DPPH自由基清除率的影响

图2酶解pH值对石斑鱼肉肽水解度与DPPH自由基清除率的影响
Fig.2Effect of hydrolysis pH on DH and DPPH radical scavenging rate of hydrolysates
由图2可知,当pH值小于9时,石斑鱼肉蛋白的水解度、DPPH自由基清除率均随pH值升高而增大;此后反而下降。这是因为pH值的变化影响酶与底物结合、酶稳定性及产物转化,进而影响酶的催化效果。pH9的弱碱性环境有利于碱性蛋白酶与鱼肉的反应,pH值过低或过高均会抑制酶的活性,进而影响水解度及肽的抗氧化性。因此,酶解pH值选择9左右为宜。
2.2.3 酶用量对水解度与DPPH自由基清除率的影响
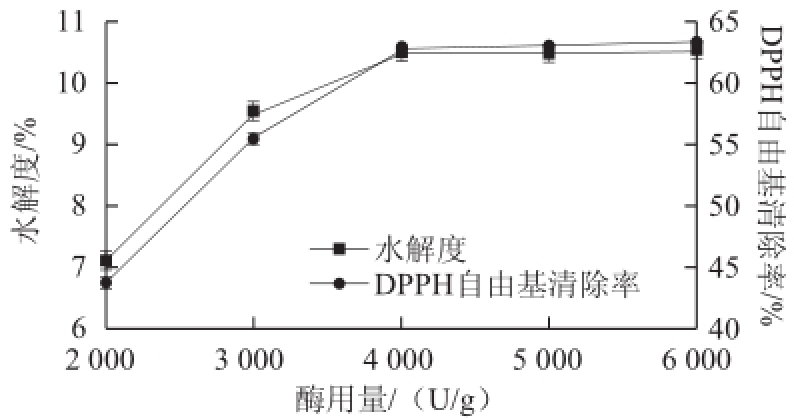
图3酶用量对石斑鱼肉肽水解度与DPPH自由基清除率的影响
Fig.3Effect of enzyme dosage on DH and DPPH radical scavenging rate of hydrolysates
由图3可知,随着酶用量的增加,水解度、DPPH自由基清除率均先增加后趋于平缓。这主要是因为在底物充足的条件下,增加酶用量可提高底物与酶结合的效率,加快反应速率,使水解度、DPPH自由基清除率增加;当酶用量大于4000U/g时,底物与酶分子结合基本饱和时,使得反应趋于平缓,水解度变化不大,但多余的酶分子可能会降解酶解的长肽链,使得短链含量增加(一般短链肽的活性较长链肽的活性高),抗氧化活性增强,清除率增加。考虑到水解度、DPPH自由基清除率、经济效益。酶用量选择4000U/g左右为宜。
2.2.4 底物质量浓度对水解度与DPPH自由基清除率的影响

图4底物质量浓度对石斑鱼肉肽水解度与DPPH自由基清除率的影响
Fig.4Effect of substrate concentration on DH and DPPH radical scavenging rate of hydrolysates
由图4可知,随着底物质量浓度的增加,水解度先缓慢增加后减小,DPPH自由基清除率先快速增加后缓慢增加。这可能是因为底物质量浓度较低时,酶相对过量,酶与底物结合的机率增加,酶能充分发挥作用,水解度、清除率增加;底物质量浓度较高时,底物分子基本上占据酶的全部活性部位,酶促反应趋于极限,水解能力降低,水解度减小;但由于底物质量浓度较高,水解度的减小,并未影响同体积下抗氧化肽的含量,相反在较大的底物质量浓度下,酶解产物中抗氧化肽的含量略有增加,清除DPPH自由基能力增强,清除率增大。综合考虑水解度、DPPH自由基清除率及经济效益,底物质量浓度选择8g/100mL左右为宜。
2.2.5 酶解时间对水解度与DPPH自由基清除率的影响

图5酶解时间对石斑鱼肉肽水解度与DPPH自由基清除率的影响
Fig.5Effect of hydrolysis time on DH and DPPH radical scavenging rate of hydrolysates
由图5可知,当酶解时间小于5h时,随着酶解时间的延长,水解度、DPPH自由基清除率增加,这主要是因为在水解初始,底物质量浓度较高,水解较快,水解度和DPPH自由基清除率增加;当酶解时间大于5h时,随着时间的延长,水解度、DPPH自由基清除率趋于平缓,这是因为5h时,酶解反应基本完成,增加酶解时间对水解度与DPPH自由基清除率影响不大。因此酶解时间选择5h为宜。
2.3 正交试验优化结果
在单因素试验基础上,选取酶解温度、酶解pH值、酶用量、底物质量浓度四因素进行正交试验。由表2可知,各因素对碱性蛋白酶解石斑鱼肉蛋白水解效果的影响顺序为A>B>C>D,即酶解温度>酶解pH值>酶用量>底物质量浓度,最优水平为A 2B 2C 3D 3。各因素对DPPH自由基清除率的影响顺序为A>B>D>C,即酶解温度>酶解pH值>底物质量浓度>酶用量,最优水平为A 2B 2C 3D 3。由于水解度、DPPH自由基清除率的最优水平均为A 2B 2C 3D 3,初步确定石斑鱼肉蛋白肽的制备工艺为A 2B 2C 3D 3。对照正交表,正交试验9组试验中没有A 2B 2C 3D 3,按A 2B 2C 3D 3条件补加试验,重复3次取平均值,得石斑鱼肉的水解度为12.26%,蛋白肽酶解液(稀释1倍)对DPPH自由基的清除率为63.35%,优于正交表中最好条件A 2B 2C 3D 1的结果,最终确定石斑鱼肉蛋白肽的制备工艺为A 2B 2C 3D 3,即酶解温度55℃、酶解pH9、酶用量5000U/g、底物质量浓度8g/100mL、酶解时间5h。同时,测得A 2B 2C 3D 3条件下石斑鱼肉酶解液中多肽含量为10.32mg/mL。
表2正交试验优化设计方案及结果
Table2Orthogonal array design and resultssults
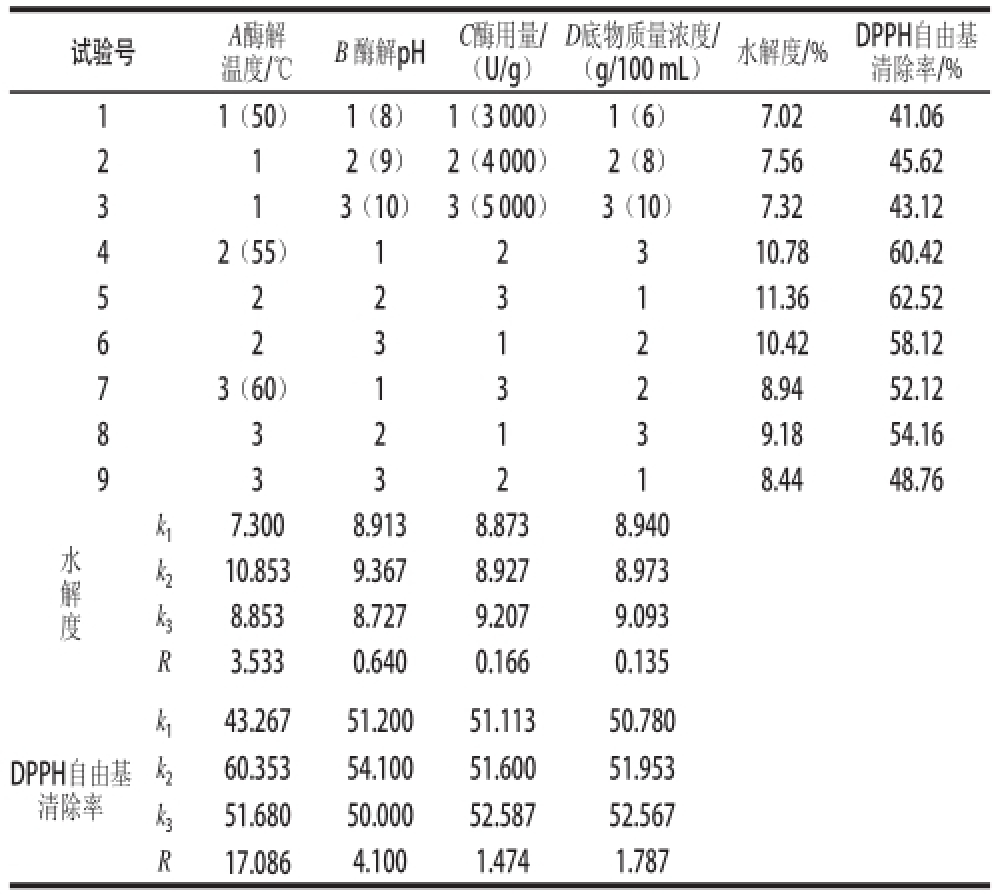
试验号A酶解(g/100mL)水解度/%DPPH自由基清除率/% 11(50)1(8)1(3000)1(6)7.0241.06 2 12(9)2(4000)2(8)7.5645.62 3 13(10)3(5000)3(10)7.3243.12 42(55)12310.7860.42 5 223111.3662.52 6 231210.4258.12 73(60)1328.9452.12 8 32139.1854.16 9 33218.4448.76温度/℃B 酶解pHC酶用量/(U/g)D底物质量浓度/水解度k 17.3008.9138.8738.940 k 210.8539.3678.9278.973 k 38.8538.7279.2079.093 R3.5330.6400.1660.135 DPPH自由基清除率k 143.26751.20051.11350.780 k 260.35354.10051.60051.953 k 351.68050.00052.58752.567 R17.0864.1001.4741.787
2.4 石斑鱼肉肽酶解物抗氧化活性的测定结果
2.4.1 DPPH自由基清除作用
DPPH分子溶液具有典型紫色,在517nm波长处有强吸收,当它与抗氧化物质作用时,生成无色产物,溶液的典型紫色变浅。由图6可知,石斑鱼肉肽酶解物对DPPH自由基具有一定的清除能力,且随其质量浓度的增加而增强,在低质量浓度实验范围内(1.0~2.5mg/mL)服从线性分布y=12.074x+35.708(R 2=0.9964)。根据方程求出石斑鱼的半抑制浓度(the half inhibitory concentration,IC 50)为(1.18±0.26)mg/mL,抗坏血酸的IC 50为(0.0057±0.0004)mg/mL,说明石斑鱼肉肽酶解物清除DPPH自由基能力弱于抗坏血酸,这可能是因为石斑鱼肉的水解产物是混合物,有些多肽产物的抗氧化性较弱,拮抗作用抑制了其活性。一般认为某种物质的IC 50值低于10mg/mL,表明其具有较好的抗氧化性 [22],况且石斑鱼肉肽酶解物清除DPPH自由基的能力明显优于马井喜等 [14]制备的鲤鱼肽,可见石斑鱼肉肽酶解物仍表现出较强清除DPPH自由基能力。
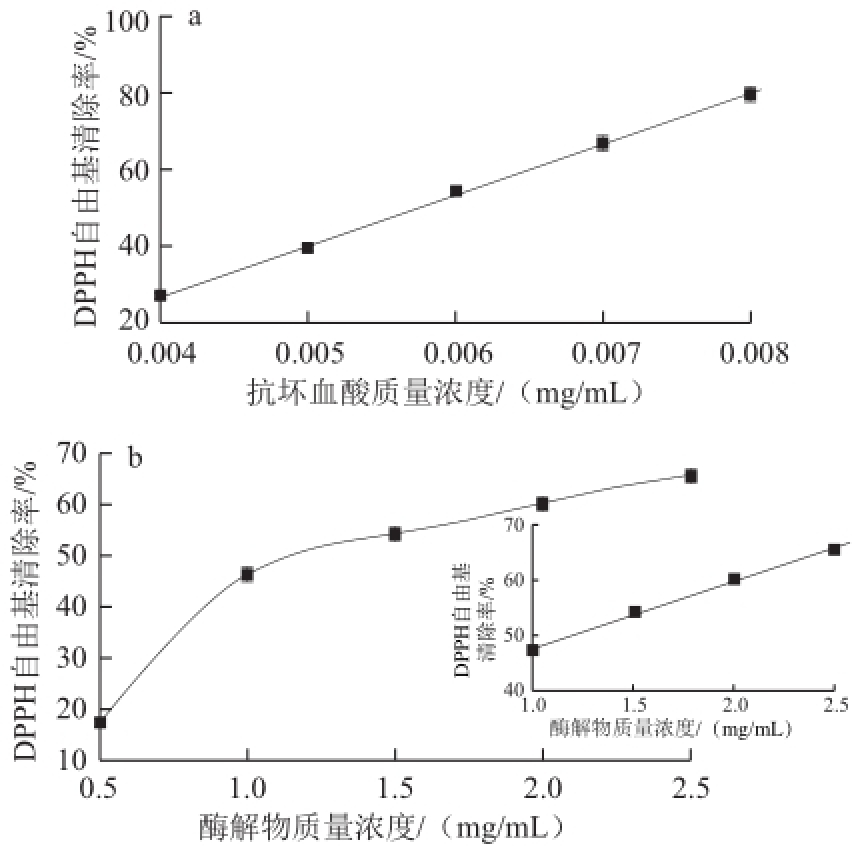
图6石斑鱼肉肽酶解物质量浓度对DPPH自由基清除率的影响
Fig.6Effect of hydrolysate concentration on DPPH radical scavenging rate
2.4.2 ABTS +·清除作用
ABTS经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS +·,当有抗氧化物质作用时,则会与ABTS +·发生反应而使反应体系颜色变浅。由图7可知,随着其质量浓度的增加,石斑鱼肉肽酶解物对ABTS +·的清除率也随之增大,在实验质量浓度范围内服从线性分布y=37.907x+16.254(R 2=0.9954),求得其IC 50为(0.89±0.05)mg/mL。同样根据线性方程,求得抗 坏血酸的IC 50为(0.0067±0.0004)mg/mL。可见,石斑鱼肉肽酶解物具有较强的清除ABTS +·能力,但仍弱于抗坏血酸。2.4.3·OH清除作用
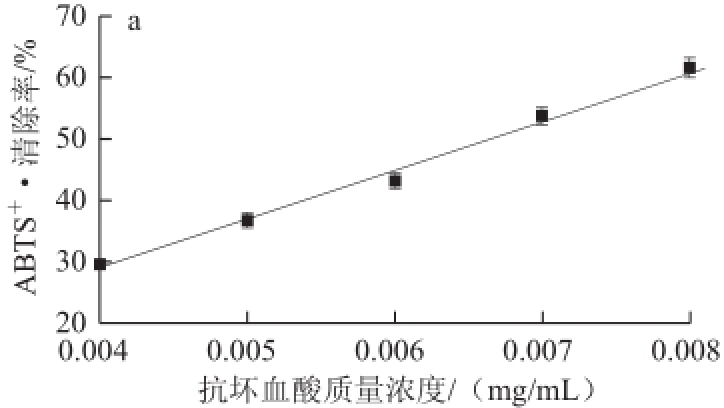
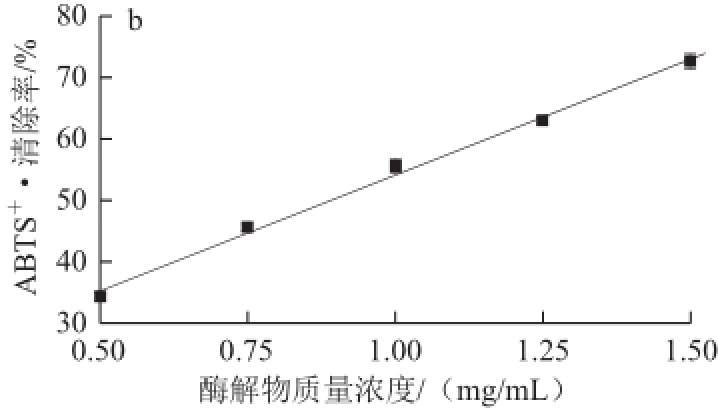
图7石斑鱼肉肽酶解物质量浓度对ABTSABTS
+·清除率的影响
Fig.7Effect of hydrolysate concentration on ABTS radical scavenging rate
H 2O 2与Fe 2+反应产生·OH,在体系中加入水杨酸捕捉并产生有色物质,该物质在510nm波长处有最大吸收,当它与抗氧化物质作用时,反应体系溶液颜色变浅。由图8可知,随着其质量浓度的增加,石斑鱼肉肽酶解物对·OH的清除率也随之增大,在实验质量浓度范围内服从线性分布y=40.407x+36.000(R 2=0.9852),其IC 50值为(0.35±0.02)mg/mL。同样根据线性方程,求得抗坏血酸的IC 50为(0.15±0.01)mg/mL。可见,石斑鱼肉肽酶解物具有较强的清除·OH能力,但仍略弱于抗坏血酸。
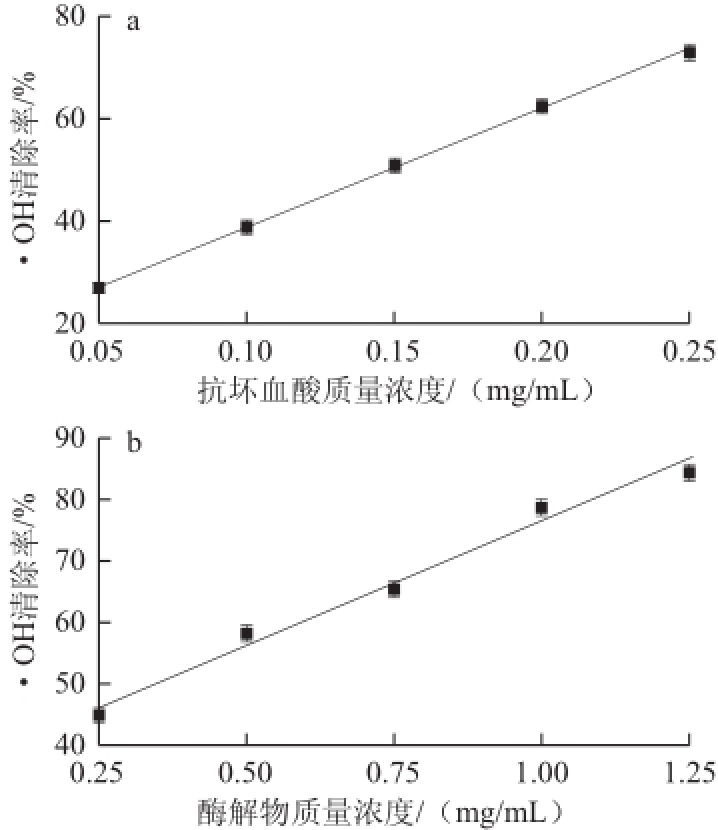
图8石斑鱼肉肽酶解物质量浓度对·OH清除率的影响
Fig.8Effect of hydrolysate concentration on hydroxyl radical scavenging rate
2.4.4 总还原力的测定结果
据研究报道 [23],可通过测定总还原力来表示抗氧化活性的强弱,吸光度(A 700nm)越高,总还原能力越强,抗氧化性越强。由图9可知,石斑鱼肉肽酶解物具有一定的还原能力,随酶解物质量浓度的增加而增强,在实验质量浓度范围内服从线性分布y=0.182x+0.097(R 2=0.9886)。抗坏血酸的总还原能力明显强于石斑鱼肽酶解物,但酶解物仍表现出较强的还原力,这与清除DPPH自由基、ABTS +·与·OH表现的抗氧化效果类似。

图9石斑鱼肉肽酶解物质量浓度对总还原力的影响
Fig.9Effect of hydrolysate concentration on total reducing power
在单因素试验的基础上,选择酶解温度、pH值、酶用量、底物质量浓度四因素,运用正交试验设计优化石斑鱼肉肽的制备工艺。结果表明,碱性蛋白酶制备石斑鱼肉肽的最优条件为:酶解温度55℃、酶解pH9、酶用量5000U/g、底物质量浓度8g/100mL、酶解时间5h,此条件下,石斑鱼肉的水解度为12.26%,蛋白肽酶解液(稀释1倍)对DPPH自由基的清除率为63.35%,酶解液中多肽含量为10.32mg/mL。
抗氧化性实验表明,石斑鱼肉肽酶解物具有较强的抗氧化性,清除DPPH自由基、ABTS +·、·OH能力和总还原力均随酶解物质量浓度增加而增强;酶解物清除DPPH自由基、ABTS +·、·OH的IC 50值分别为(1.18±0.26)、(0.89±0.05)、(0.35±0.02)mg/mL。参考文献:
[1]廖经球,尹绍武,陈国华,等.褐点石斑鱼的核型研究[J].水产科学,2006,26(11):567-569.
[2]李鑫伟.点带石斑鱼仔稚鱼消化系统组织学及消化酶活性研究[D].海口:海南大学,2012.
[3]丁旭.斜带石斑鱼Toll样受体22基因的cDNA克隆、表达模式分析及其信号通路的初步探讨[D].海口:海南大学,2012.
[4]郑乐云,杨求华,黄种持,等.循环水养殖密度和氨氮对斜带石斑鱼生长和免疫力的影响[J].上海海洋大学学报,2013,22(5):706-712.
[5]夏汉钦,杨红玲,叶维丹,等.活性和热带原籍嗜冷杆菌SE6对斜带石斑鱼幼鱼生长性能和免疫功能的影响[J].水产学报,2013,37(1):86-93.
[6]覃映雪,池信才,苏永全,等.网箱养殖青石斑鱼的溃疡病病原[J].水产学报,2004,28(3):297-302.
[7]SHIAU S, LIN Y N.Carbohydrate utilization and its protein-sparing effect in diets for grouper(Epinephelus malabaricus)[J].Animal Science,2001,73(6):299-304.
[8]蒙子宁,杨丽萍,吴丰,等.斜带石斑鱼、赤点石斑鱼RAPD和线粒体Cytb基因序列变异分析[J].中山大学学报:自然科学版,2007,46(1):75-80.
[9]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998:119-124.
[10]KIM J S,WILSON J M,LEE S R.Dietary implications on mechanisms of sarcopenia:roles of protein,amino acids and antioxidants[J].Journal of Nutritional Biochemistry,2010,21(1):1-13.
[11]BEERMANN C,EULER M,HERZBERG J,et al.Anti-oxidative capacity of enzymatically released peptides from soybean protein isolate[J].Europe Food Research and Technology,2009,229(4):637-644.
[12]BHAIL S K,DAY L.Functional properties of enzymatically hydrolysed wheat gluten[J].Cereal Chemistry,2005,55(5):267-271.
[13]尤娟.鲢鱼鱼肉蛋白抗氧化肽的制备及其糖基化产物功能特性的研究[D].北京:中国农业大学,2014.
[14]马井喜,孙永杰,冯印,等.鲤鱼肽的酶法制备工艺及其抗氧化性[J].食品科学,2013,34(1):225-229.
[15]PACHECO R,MAZORRA M A,RAMIREZ J C.Functional properties of fish protein hydrolysates from Pacific whiting(Merluccius productus)muscle produced by a commercial protease[J].Food Chemistry,2008,109(4):782-789.
[16]SUN Ting,HO C T.Antioxidant activities of buckwheat extrats[J].Food Chemistry,2005,90(4):743-749.
[17]段宙位,申铉日,李鹏,等.罗非鱼尾色素中抗氧化成分的提取及活性研究[J].食品工业科技,2012,33(10):143-150.
[18]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[19]FANG Zhongxiang,ZHANG Yuhuan,LU Yuan,et a1.Phenolic compounds and antioxidant capacities of bayberry juices[J].Food Chemistry,2009,113(4):884-888.
[20]LI Yanhong,JIANG Bo,ZHANG Tao,et al.Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate(CPH)[J].Food Chemistry,2008,106(2):444-450.
[21]董欢欢,曹树稳,余燕影.半枝莲、白花蛇舌草及其药对提取物抗氧化及清除自由基活性[J].天然产物研究与开发,2008,20(5):782-786;802.
[22]郑义,邵颖,陈安徽,等.益智仁总黄酮超声辅助提取工艺优化及其抗氧化性活性[J].食品科学,2014,35(6):44-49.
[23]DORMAN H,KOSAR M,KAHLOS K,et al.Antioxidant properties and composition of aqueous extracts from Mentha species,hybrids,varieties,and cultivars[J].Journal of Agricultural and Food Chemistry,2003,51(16):4563-4569.
Enzymatic Preparation and Antioxidant Activities of Bioactive Peptides from Epinephelus Meat
DUAN Zhouwei,XIE Hui,DOU Zhihao*,HE Ai,WAN Zhuning
(Institute of Processing and Design of Agro-products,Hainan Academy of Agricultural Sciences,Haikou571100,China)
Abstract:The fresh meat of Epinephelus was hydrolyzed with alkaline protease to prepare peptides.Based on degree of hydrolysis and1,1-diphenyl-2-picrylhydrazyl(DPPH)radical scavenging activity,an orthogonal design combined with single facto experiments was applied to optimize enzymatic hydrolysis conditions for peptide preparation.Antioxidant activities of peptides were evaluated by four different methods,DPPH,2,2’-azinobis(3-ethylbenzothi azoline-6-sulfonic acid)ammonium salt(ABTS)and hydroxyl radical scavenging assays,and potassium ferricyanide reduction method.The results showed that the optimum hydrolysis conditions were55℃,9,5000U/g,8g/100mL and5h for temperature,initial pH,enzyme dosage,substrate concentration and hydrolysis duration,respectively.The antioxidant activity assays showed that the hydrolysates presented strong antioxidant activity.DPPH radical scavenging activity,ABTS radical cavenging activity,hydroxyl radical scavenging activity and potassium ferricyanide reducing power of hydrolyzates from Epinephelus meat were concentration dependent.The half inhibitory concentration(IC 50)for DPPH radical scavenging activity,ABTS radical scavenging activity and hydroxyl radical scavenging activity were(1.18±0.26),(0.89±0.05)and(0.35±0.02)mg/mL,respectively.
Key words:ice-stored Epinephelus meat;peptides;degree of hydrolysis;scavenging rate;antioxidation
中图分类号:TS218
文献标志码:A
文章编号:1002-6630(2015)05-0142-06
doi:10.7506/spkx1002-6630-201505027
收稿日期:2014-10-10
基金项目:2013年海南省农业科学院农业科技创新专项;海南省自然科学基金项目(314155)
作者简介:段宙位(1985—),男,实习研究员,硕士,研究方向为农产品加工。E-mail:universeduan@163.com
*通信作者:窦志浩(1961—),男,研究员,学士,研究方向为农产品加工与保鲜。E-mail:513408658@qq.com