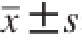 表示数据统计结果。
表示数据统计结果。
王东风, 梁惠*,王文成
(青岛大学医学院,医学营养研究所,山东青岛266000)
摘要:探讨D-柠檬烯(D-limonene)对大鼠酒精性肝损伤脂质代谢紊乱的保护作用及可能作用机制,利用持续酒精灌胃的方法建立大鼠酒精肝损伤模型,分为A、B、C、D、E、F、G共7组。A组为空白对照组,每日给予蒸馏水灌胃,前2周8mL/(kg·d),后4周12mL/(kg·d);B组为酒精模型组,每日灌胃体积分数为50%的乙醇,前2周8mL/(kg·d),后4周12mL/(kg·d);C、D、E组分别为D-柠檬烯低、中、高剂量组,每日分别灌胃D-柠檬烯100、200、400mL/(kg·d),其中D-柠檬烯与A、B组等量的50%的乙醇混合后灌胃;F组为水和D-柠檬烯空白高剂量组,每日给予D-柠檬烯400mL/(kg·d);G组为甘利欣药物对照组,灌胃量200mL/(kg·d)。HE染色和电镜观察肝组织形态结构和肝组织超微结构的变化,测定血清谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(phosoporic acid,ALP)、胆碱酯酶(cholinesterase,CHE)、甘油三酯(triglyceride,TG)、胆固醇(cholesterol,CHO)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)水平。结果电镜下观察到A组肝细胞结构正常,核呈圆形或椭圆,线粒体形态正常。B组肝细胞次级溶酶体数量增加,线粒体形状不规则,脂滴多。C组可见少量脂滴,高尔基体正常,线粒体清楚。D组少量脂滴,胆小管有内容物,线粒体正常。E组线粒体高尔基体正常,少量脂滴,核圆。F组细胞器无异常,少量脂滴。G组少量脂滴,偶见溶酶,体线粒体正常。B组大鼠血清ALT、AST、ALP、CHE、TG、CHO、LDL-C均高于空白对照组,差异显著(P<0.05);F组大鼠血清所测各指标与空白对照组无明显差异;而D-柠檬烯低、中、高剂量干预组和酒精模型组比较,血清所测各指标水平均有不同程度地降低,其中D-柠檬烯中、高剂量干预组血清所测各指标水平明显低于酒精模型组,差异显著(P<0.05)。结论:过量酒精摄入引起的肝组织超微结构病理损伤与升高血清ALP、CHE、ALT、AST、TG、CHO、LDL-C水平,在D-柠檬烯干预下有所减轻和降低。因此,D-柠檬烯可调节过量酒精摄入造成的脂质代谢紊乱。
关键词:D-柠檬烯;酒精性肝损伤;脂质代谢紊乱;谷丙转氨酶;谷草转氨酶;甘油三酯;总胆固醇;低密度脂蛋白胆固醇
D-柠檬烯(D-limonene)是单环单萜,安全无毒性 [7]。本实验通过D-柠檬烯对酒精性肝损伤大鼠的干预,探究其对大鼠酒精性肝损伤脂质代谢的保护,同时为D-柠檬烯在酒精性肝损伤保护作用研究中提供实验支持、理论和实践依据。
1.1 材料与试剂
D-柠檬烯(D-limonene):纯度97%德国Sigma公司。
谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(phosoporic acid,ALP)、胆碱酯酶(cholinesterase,CHE)、甘油三酯(triglyceride,TG)、胆固醇(cholesterol,CHO)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)南京建成生物工程研究所;甘利欣(甘草酸二铵胶囊)江苏正大天晴药业股份有限公司。
1.2 仪器与设备
7600型全自动生化分析仪日本日立公司;3K30型低温离心机德国Sigma公司;JEM-1200EX型电子显微镜日本JEOL公司。
1.3 方法
1.3.1 动物分组与实验
Wistar品系雄性大鼠,SPF级,70只,体质量180~200g,动物合格证号:SCXK(鲁)20130001,实验动物由青岛派特福德白鼠养殖专业合作社提供。饲喂普通饲料,自由饮水进食。7d适应性喂养后,采用随机数字表法按体质量将70只大鼠随机分为7组,每组10只。A组为空白对照组,每日给予蒸馏水灌胃,前2周8mL/(kg·d),后4周12mL/(kg·d)。B组为酒精模型组,每日灌胃体积分数为50%的乙醇,前2周8mL/(kg·d),后4周12mL/(kg·d)。3个不同剂量D-柠檬烯低、中、高剂量处理组每日分别灌胃D-柠檬烯100、200、400mL/(kg·d),其中D-柠檬烯与A、B组等量的50%的乙醇混合后灌胃。F组为水和D-柠檬烯空白高剂量组,每日给予D-柠檬烯400mL/(kg·d),D-柠檬烯与A、B组等量的蒸馏水混匀后灌胃。G组为甘利欣药物对照组,灌胃量200mL/(kg·d),甘利欣与A、B组等量50%乙醇混合后灌胃。实验周期为6周。末次灌胃后禁食不禁水12h后,水合氯醛麻醉,腹主动脉取血,分离血清,留取肝组织,-20℃保存备用。
1.3.2 检测指标与方法 [8-9]
HE染色法(×400)观察肝组织形态结构:肝组织经固定、包埋、切片后染色观察。
透射电镜(×5000)观察超微结构:肝组织4%戊二醛灌流固定,包埋,制作切片,电镜下观察肝细胞超微结构变化。
转氨酶等酶类及血脂水平测定:具体操作方法按试剂盒说明书进行生化检测。
1.4 统计学处理
采用SPSS16.0软件方差分析对数据进行结果统计分析,以P<0.05表示结果有统计学意义,并用
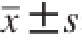 表示数据统计结果。
表示数据统计结果。
2.1 实验动物基本情况
实验期间,酒精模型组和D-柠檬烯中剂量、高剂量组大鼠各死亡2只,D-柠檬烯低剂量组死亡1只。
2.2 组织形态与超微结构观察
HE染色观察与评分:A组肝组织形态结构正常,肝细胞无变性、坏死等形态学改变,汇管区无少量炎细胞浸润(图1A)肝脂肪变性程度0级,炎性程度0级,综合评分0级;B组肝组织呈大泡性脂肪变性,有大量炎细胞浸润(图1B),肝脂肪变性程度2级,炎性程度3级,综合评分5级;C组可见大泡性脂肪变性,中央静脉周围脂变明显,有大量炎细胞浸润(图1C),肝脂肪变性程度2级,炎性程度2级,综合评分4级;D组有大量空泡,脂肪变性形成少量大脂滴,并有少量炎细胞浸润(图1D)肝脂肪变性程度1级,炎性程度1级,综合评分2级;E组肝细胞分布整齐,大小均匀,无明显脂滴,有少量炎细胞浸润(图1E),肝脂肪变性程度1级,炎性程度1级,综合评分2级;F组肝细胞大小均匀,排列整齐,肝细胞形态学未见变性、坏死等改变,有少量炎细胞浸润(图1F),肝脂肪变性程度0级,炎性程度0级,综合评分0级;G组肝细胞分布整齐,肝细胞形态学未见变性、坏死等改变有,少量炎细胞浸润(图1G),肝脂肪变性程度1级,炎性程度1级,综合评分2级。
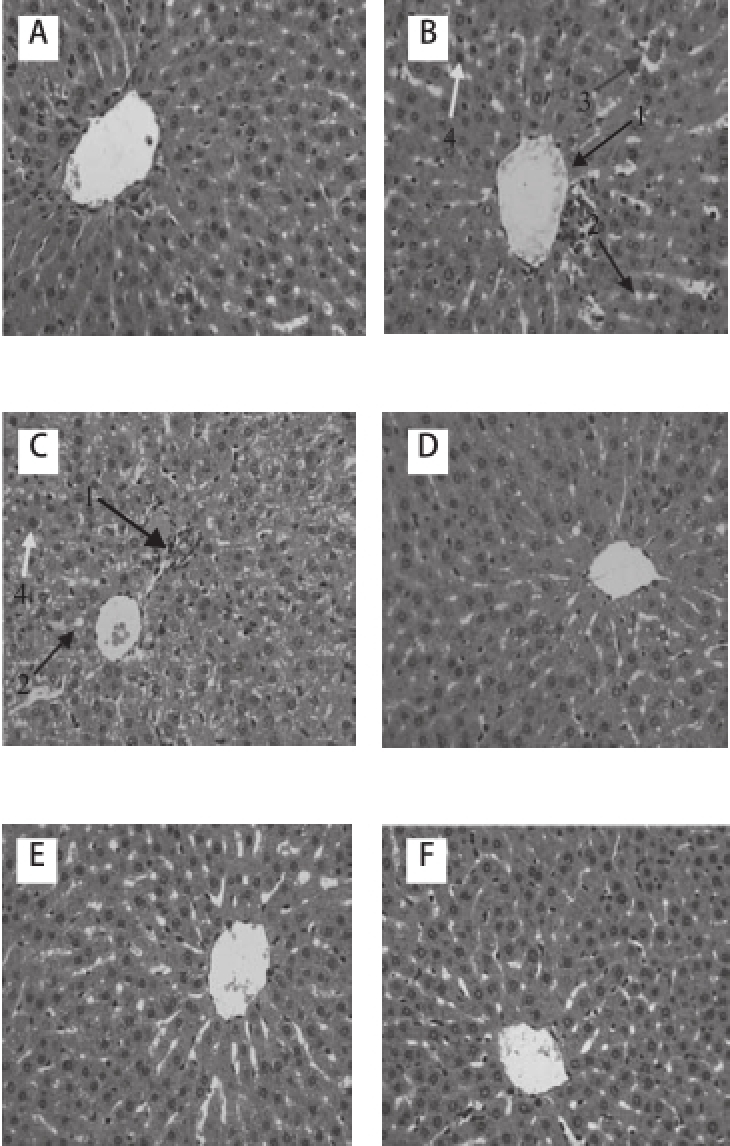
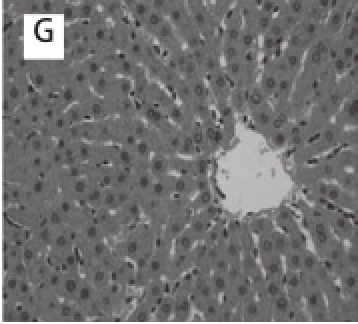
图1 各实验组大鼠肝脏组织形态的改变(×400)400
Fig.1Hepatic tissues of rats from different groups(×400)
A.正常组;B.酒精模型组;C.D-柠檬烯低剂量干预组;D.D-柠檬烯中剂量干预组;E.D-柠檬烯高剂量干预组;F.D-柠檬烯空白单独高剂量干预组;G.甘利欣药物对照组。1.炎性浸润;2.脂肪空泡;3.脂肪肉芽肿;4.肝细胞微多孔状脂肪变性。
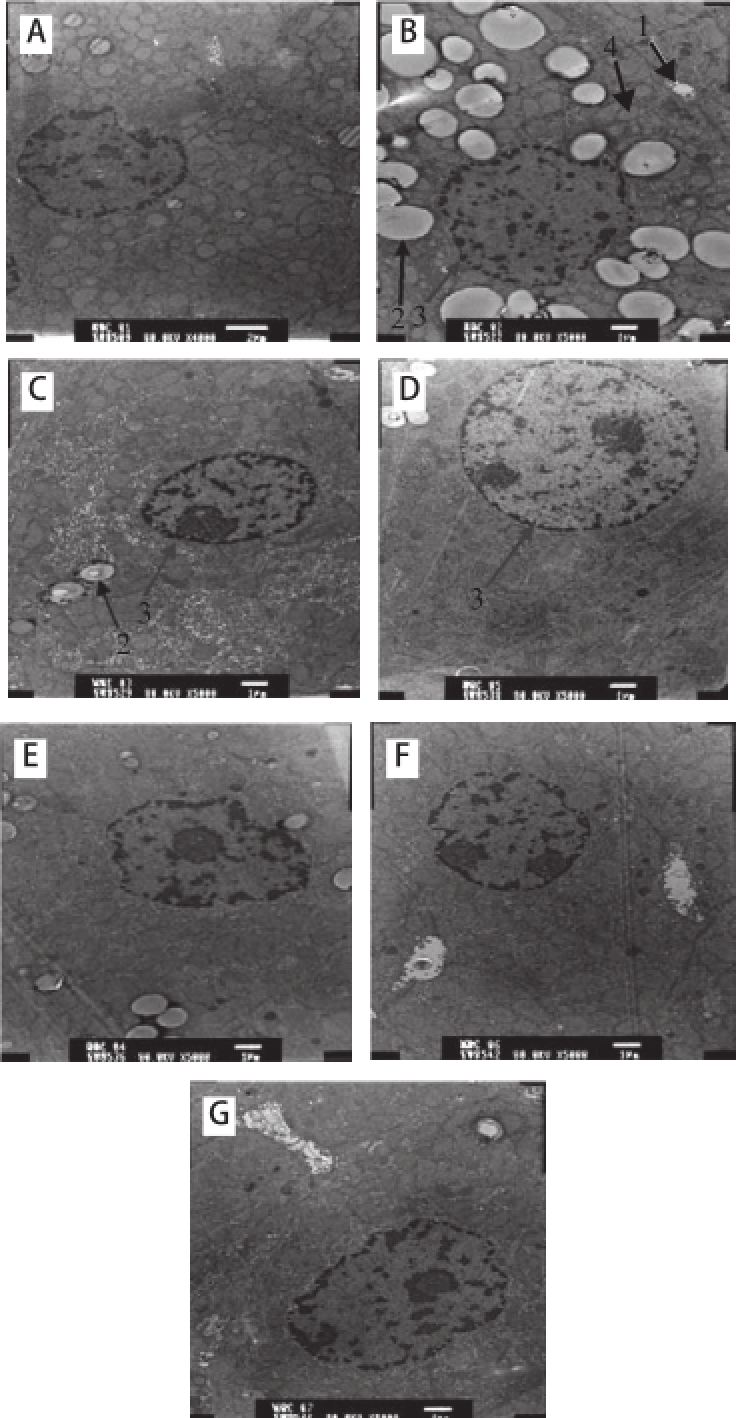
图2各实验组大鼠肝细胞超微结构(×5000)000
Fig.2Rat hepatic cell ultrastructure in different groups(×5000)
A.正常组;B.酒精模型组;C.D-柠檬烯低剂量干预组;D.D-柠檬烯中剂量干预组;E.D-柠檬烯高剂量干预组;F.D-柠檬烯空白单独高剂量干预组;G.甘利欣药物对照组。1.线粒体;2.脂肪空泡;3.细胞核;4.胆小管。
电镜下观察到A组肝细胞形态结构正常,线粒体、高尔基体形态正常(图2A)。B组可见脂滴多,线粒体形状不规则,嵴断裂模糊,次级溶酶体数量增加,微绒毛数量有所减少,胶原纤维化明显(图2B)。C组胆小管内无内容物,可见少量脂滴,高尔基体正常,线粒体清楚,有绒毛,糖原颗粒(图2C)。D组少量脂滴,胆小管有内容物,线粒体正常(图2D)。E组线粒体,高尔基体,胆小管都正常,少量脂滴,核圆(图2E)。F组胆小管扩张,有内容物,细胞器无异常,少量脂滴(图2F)。G组少量脂滴,偶见溶酶体,线粒体正常(图2G)。
2.3 D-柠檬烯对酒精暴露大鼠血清转氨酶类及血脂水平的影响
表1 1D-柠檬烯对酒精暴露大鼠血清ALT、AST、ALP、CHHEE水平的影响
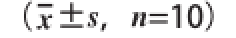
Table1Effectt ooff D-limonene on serum ALT,AST,ALP and CHEE iinn rats induced by alcohhooll
注:a.与A组比较,P<0.05;b.与B组比较,P<0.05。下同。
组别ALT活力/(U/L)AST活力/(U/L)ALP活力/(U/L)CHE活力/(U/L)A46.20±2.4491.30±12.3186.50±7.1063.40±15.57 B72.00±7.30 a118.62±13.00 a130.75±9.14 a127.62±21.10 aC66.78±6.28113.22±11.38124.56±13.04122.22±13.04 D57.12±2.99 b100.38±6.59 b104.88±10.38 b100.75±7.97 bE57.00±5.34 b98.75±5.72 b97.75±10.44 b94.00±11.18 bF52.40±5.2593.00±7.6086.70±8.7669.70±17.69 G49.80±6.94 b96.00±12.01 b95.50±8.50 b78.30±14.17 b
表22D-柠檬烯对酒精暴露大鼠血清TG、CHO、LDL-C水平的影响

Table2Effect of tofD-limonene on serum TG,CHO and LDL-C in rats rats induced by alcohol
 hol
hol
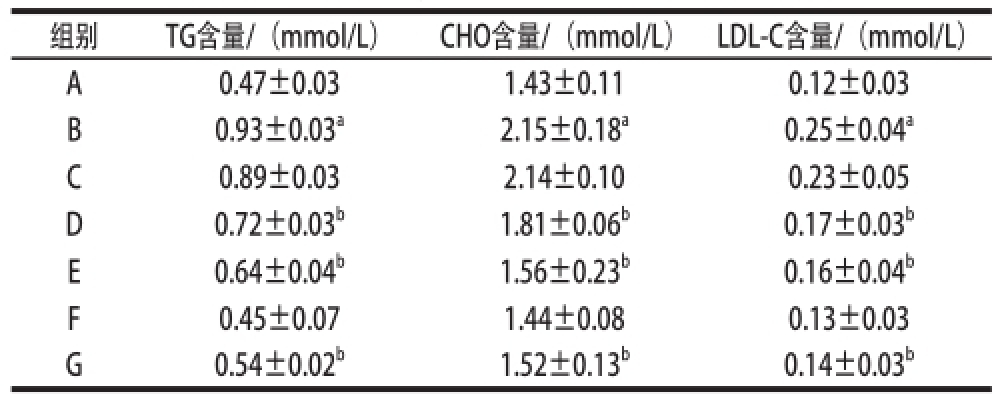
组别TG含量/(mmol/L)CHO含量/(mmol/L)LDL-C含量/(mmol/L)A0.47±0.031.43±0.110.12±0.03 B0.93±0.03 a2.15±0.18 a0.25±0.04 aC0.89±0.032.14±0.100.23±0.05 D0.72±0.03 b1.81±0.06 b0.17±0.03 bE0.64±0.04 b1.56±0.23 b0.16±0.04 bF0.45±0.071.44±0.080.13±0.03 G0.54±0.02 b1.52±0.13 b0.14±0.03 b
由表1、2可知,酒精模型组大鼠血清所测各指标均高于空白对照组(P<0.05);F组大鼠血清所测各指标与空白对照组无明显差异;而不同剂量的D-柠檬烯干预组和酒精模型对照组比较,血清所测各指标水平均有不同程度地降低,其中D-柠檬烯中、高剂量干预组及甘利欣对照组血清各所测指标水平明显低于模型组的(P<0.05)。
据统计,我国居民嗜酒者中20%存在酒精性肝损伤 [4]。对肝脏造成损害的除了酒精及其代谢产物乙醛之外,还有多方面因素。脂质代谢紊乱是酒精性肝损伤出现的早期征兆,并与多种慢性疾病的发生密切相关。研究表明,酒精摄入后某些脂肪因子如肿瘤坏死因子-α等的分泌增加,在酒精性脂肪肝发病中起到一定促进作用 [10-11];同时脂联素的分泌减少,脂联素受体表达受抑制,脂肪酸合成酶活性增加,脂肪酸分解利用受抑制 [12]。酒精刺激下,腺苷酸活化蛋白激酶活性降低,脂肪分化相关蛋白表达增加,促进肝细胞内游离脂肪酸增多,导致肝细胞内脂肪堆积 [13-14]。另外,过量酒精摄入还可导致肝细胞线粒体功能受损,抑制过氧化物酶增殖体(peroxisome prolifetatoractivated receptor,PPARα)的表达,PPARα表达减少抑制肝脏脂类的氧化利用,导致肝脏TG沉积,诱发糖脂代谢紊乱 [15-16]。
本实验通过HE染色和电镜观察,发现酒精模型组肝细胞有脂肪变性和大量炎细胞浸润,线粒体形状不规则,与空白对照组相比,表现出肝损伤的病理改变,表示建模成功。D-柠檬烯200、400mL/(kg·d)剂量组大鼠肝细胞内脂肪变性减轻,炎性细胞数量减少,线粒体、高尔基体形态趋于正常,提示一定剂量D-柠檬烯可以通过保护线粒体、高尔基体等细胞器,使酒精在肝细胞内的代谢维持在一定水平,从而降低酒精对肝细胞的损伤程度。
转氨酶是肝细胞损害的敏感指标,也是酒精所致肝损伤的最敏感指标。实验模型组大鼠血清ALT、AST活力分别为(72.00±7.30)、(118.62±13.00)U/L,空白对照组分别为(46.20±2.44)、(91.30±12.31)U/L,两组比较,差异有显著性(P<0.05),可见长期过量酒精摄入对肝脏损伤非常大。模型组血清TC、CHO和LDL-C增高亦表明脂质代谢紊乱加重;D-柠檬烯中、高剂量组大鼠肝功能、血脂水平均有不同程度改善,差异具有显著性(P<0.05)。
D-柠檬烯在多种蔬菜水果中含量丰富,天然香料亦是D-柠檬烯的天然贮存库。D-柠檬烯具有多种生物活性,可作为肿瘤抑制剂、防腐抗菌剂、抗氧化剂,并具有免疫调节作用 [17-21]。本实验结果表明D-柠檬烯可明显改善肝组织超微结构的病理损伤,降低因酒精暴露引起的ALT、AST、ALP、CHE活力升高,降低机体TC、CHO和LDL-C水平,对酒精造成的脂质代谢紊乱有一定的调节作用,为D-柠檬烯保肝的临床应用提供了参考。有关D-柠檬烯改善大鼠肝损伤脂质代谢紊乱的机制还需要做进一步研究。
参考文献:
[1]逄丹,梁惠,马爱国,等.CYP2E1在乙醇性肝病发病机制中的作用[J].青岛大学医学院学报,2011,47(4):285-287.
[2]曾民德,范建高.酒精性肝病的诊断与治疗[J].中国实用内科杂志,2007,1(3):21-23.
[3]沈冬.柑橘可以用来预防酒精肝[J].肝博士,2011,17(4):55-56.
[4]张艾玲,梁惠,逢丹,等.海藻萜类化合物对大鼠急性酒精性肝损伤的保护作用研究[J].中国食品学报,2008,8(3):23-27.
[5]谭靓,李珊平,吴梦茹,等.丹参注射液对小鼠急性酒精性肝损伤保护作用研究[J].现代医药卫生,2013,29(15):2276-2277.
[6]孙丽萍,王大仟,廖磊,等.油菜蜂花粉及其提取物对大鼠酒精性肝损伤组织学影响[J].食品科学,2008,29(7):442-444.
[7]王伟江.天然活性单萜-柠檬烯的研究进展[J].中国食品添加剂,2005,6(1):34-37.
[8]MAK K M,REN C,PONOMARENKO A,et al.Adipose differentiation-related protein is a reliable lipid droplet marker in alcoholic fatty liver of rats[J].Alcoholism:Clinical and Experimental Research,2008,32(4):683-689.
[9]中华医学会肝脏病学会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南[J].中华肝脏病杂志,2001,18(3):167-170.
[10]BYUN J S,JEONG W I.Involvement of hepatic innate immunity in alcoholic liver disease[J].Immune Network,2010,10(6):181-187.
[11]TSOCHATZIS E A,PAPATHEODORIDIS G V,ARCHIMANDRITISA J.Adipokines in nonalcoholic steatohepatitis:from pathogenesis to implications in diagnosis and therapy[J].Mediators of Inflammation,2009,200:831670.
[12]YOU M,ROGERS C Q.Adiponectin:a key adipokine in alcoholic fatty liver[J].Experimental Biology and Medicine,2009,234:850-859.
[13]LEE W H,KIM S G.AMPK-dependent metabolic regulation by PPAR agonists[J].PPAR Research,2010,10(7):491-494.
[14]LI Dan,WANG Duan,WANG Yun,et al.Adenosine monophosphateactivated protein kinase induces cholesterol efflux from macrophagederived foam cells and alleviates atherosclerosis in apolipoprotein E-deficient mice[J].Journal of Biological Chemistry,2010,285:33499-3350.
[15]KONG Lingbo,REN Weiguang,LI Wencong,et a1.Activation of peroxisome proliferator activated receptor alpha ameliorates ethanol induced steatohepatitis in mice[J].Lipids Health Disease,2012,10:246.doi:10.1186/1476-511X-10-246.
[16]LARTER C Z,YEH M M,VAN D M,et al.Peroxisome proliferatoractivated receptor-alpha agonist,Wy14,643,improves metabolic indices,steatosis and ballooning in diabetic mice with non-alcoholic steatohepatitis[J].Journal of Gastroenterol and Hepatology,2011,27:341-350.
[17]王雪梅,谌徽,李雪姣,等.天然活性单萜-柠檬烯的抑菌性能研究[J].吉林农业大学学报,2010,32(1):24-28.
[18]JING Li,ZHANG Yu,FAN Shengjie,et al.Preventive and ameliorating effects of citrus D-limonene on dyslipidemia and hyperglycemia in mice with high-fat diet-induced obesity[J].European Journal of Pharmacology,2013,715(1):46-55.
[19]SANTIAGO J V A,JAYACHITAR J,SHENBAGAM M,et al.Dietary D-limonene alleviates insulin resistance and oxidative stressinduced liver injury in high-fat diet and L-NAME-treated rats[J].European Journal of Nutrition,2012,51(1):57-68.
[20]MURALI R,KARTHIIKEVAN A,SARAVNNAN R.Protective effects of D-limonene on lipid peroxidation and antioxidant enzymes in streptozotocin-induced diabetic rats[J].Basic and Clinical Pharmacology and Toxicology,2013,112(3):175-181.
[21]李思思,王涛,董志红,等.右旋柠檬烯的研究进展及其新型专利技术[J].河南医学研究,2013,22(4):636-638.
Effect of D-Limonene on Lipid Metabolism Disorder in Rats with Alcohol-Induced Liver Damage
WANG Dongfeng,LIANG Hui
*,WANG Wencheng
(Institute of Human Nutrition,Medical College,Qingdao University,Qingdao266000,China)
Abstract:Objective:This study evaluated the protective effect of D-limonene against ethanol-induced hepatic injury in rats and analyzed the associated mechanisms.Methods:The alcoholic liver disease(ALD)model of rats was established by administration of50%alcohol.Seven groups of mice were created,namely blank control(A),alcoholic damage model(B),low-dose D-limonene(C),middle-dose D-limonene(D),high-dose D-limonene(E),high-dose D-limonene blank(F),and diammonium glycyrrhizinate(DG)control(G)groups.Group A was daily administered by gavage with distilled water at a volume of8mL/(kg·d)first for two weeks followed by8mL/(kg·d)for another four weeks,Group B was administered with50%aqueous by the same schedule as for group A,Groups C,D and E were respectively given100,200and400mL/(kg·d)D-limonene in50%aqueous ethanol at the same volume as that used for groups A and B,Group F was daily administered with400mL/(kg·d)D-limonene without alcohol-induced liver injury,and Group G was treated with200mL/(kg·d)of DG.HE staining and electronic microscopic evaluation were conducted for examining the morphologyand ultrastructure of liver tissues.The levels of alanine transaminase(ALT),aspartate transaminase(AST),phosoporic acid(ALP),cholinesterase(CHE),triglyceride(TG),cholesterol(CHO),and low-density lipoprotein-cholesterol(LDL-C)were detected.Results:Normal liver tissue structure was observed in Group A.Many secondary lysosomes were observed in Group B.A small amount of lipid droplets was observed in Group C while Golgi was normal and mitochondria was clear.Normal mitochondria were observed in Group D.Normal mitochondria and Golgi were observed in Group E.The organelles without abnormalities were observed in Group F.Normal mitochondria were observed in Group G.Serum ALT,AST,ALP,CHE,TG,CHO and LDL-C were higher in group B than in other groups(P<0.05);serum levels of the indicators measured were reduced in different D-limonene groups at various doses than those in alcohol model group(P<0.05).Conclusion:D-limonene can ameliorate the damage of ultrastructure in liver tissues,reduce serum indexes caused by alcohol exposure and the body’s lipids.Moreover,it has a regulatory role in lipid metabolism disorders caused by alcohol.
Key words:D-limonene;ethanol-caused hepatic damage;lipid metabolism disorder;alanine aminotransferase(ALT);aspartate aminotransferase(AST);triglyceride(TG);total cholesterol(CHO);low density lipoprotein cholesterol(LDL-C)
收稿日期:2014-06-03
基金项目:“十二五”国家科技支撑计划项目(2012BAD33B01);国家自然科学基金面上项目(31171671)
作者简介:王东风(1988—),男,硕士研究生,研究方向为营养与食品卫生学。E-mail:312334874@qq.com
*通信作者:梁惠(1964—),女,教授,博士,研究方向为医学营养学。E-mail:qdlianghui@126.com
中图分类号:R931.71;R285.5
文献标志码:A
文章编号:1002-6630(2015)05-0163-05
doi:10.7506/spkx1002-6630-201505031近几十年以来,酒精滥用一直是全球性的公共健康问题 [1]。长期过量饮酒可引发酒精性肝病(alcoholic liver disease,ALD),ALD是一种进行性疾病,早期病理改变为肝细胞氧化损伤,进一步可发展为酒精性脂肪肝,发展到晚期则无法治愈,因此在肝细胞氧化损伤之前干预有重要意义 [2-6]。从天然、动植物中寻找具有生物活性的保肝成分,已成为国内外科研工作者研究的热点之一。