二甲基甘氨酸钠对肉鸡屠宰性能、肉品质及肌肉抗氧化能力的影响
寇涛,胡志萍,董丽,何进田,白凯文,王恬*
(南京农业大学动物科技学院,江苏南京210095)
摘要:目的:研究日粮中添加二甲基甘氨酸钠(N,N-dimethylglycine sodium salt,Na-DMG)对肉鸡屠宰性能、肉品质及肌肉抗氧化能力的影响。方法:实验选用1 日龄爱拔益加(Arbor Acres,AA)肉鸡720 只,随机分成6 组,每组6 个重复,对照组饲喂基础日粮,实验组在基础日粮中添加300、500、1 000、1 500、2 000 mg/kg二甲基甘氨酸钠。结果:1)二甲基甘氨酸钠可提高肉鸡的全净膛率和腿肌率,且以添加1 500 mg/kg二甲基甘氨酸钠组的效果最好(P<0.05)。2)二甲基甘氨酸钠主要影响胸肌的肉品质。1 000、1 500 mg/kg二甲基甘氨酸钠较对照组极显著地降低了烹饪损失率(P<0.01),2 000 mg/kg二甲基甘氨酸钠则显著降低了烹饪损失率(P<0.05);1 500、2 000 mg/kg二甲基甘氨酸钠组的96 h滴水损失率显著低于对照组(P<0.05)。就剪切力而言,1 000~2 000 mg/kg二甲基甘氨酸钠可极显著降低肉鸡胸肌的剪切力(P<0.01)。3)二甲基甘氨酸钠对胸肌的抗氧化能力影响较为显著。与对照组相比,1 000 mg/kg的二甲基甘氨酸钠可显著提高胸肌的总抗氧化能力(total antioxidative capacity,T-AOC)活性(P<0.05)。结论:二甲基甘氨酸钠可显著提高肉鸡的屠宰性能,改善肉品质,提高胸肌的抗氧化能力,且以1 000~1 500 mg/kg的添加剂量效果最佳。
关键词:二甲基甘氨酸钠;肉鸡;屠宰性能;肉品质;抗氧化能力
随着生产水平的提高,集约化肉鸡饲养模式日益满足了人们对肉产品数量增长的需求,但饲养过程中的各种应激因子和饲料的氧化酸败均会造成肉鸡机体稳态的破坏,加速肉鸡机体内的氧化应激,导致肉鸡肌肉和肉品中的脂质和蛋白质氧化,造成机体组织损伤、肉品质下降和生长发育受阻。目前通过营养调节剂来提高肉鸡肉品质和屠宰性能已成为一种重要的调控手段。二甲基甘氨酸是一种氨基酸的衍生物,能作为甲基的供体在机体内发挥重要的生理作用,已有研究报道二甲基甘氨酸能提高氧气利用率,从而改善运动员和赛马的运动机能
[1]。Mackenzie
[2]和Meduski
[3]等研究报道称二甲基甘氨酸是机体内细胞重要的代谢加强剂,可提高细胞的代谢能力、加强机体组织对氧气的利用率、促进免疫应答;此外,二甲基甘氨酸可促进蛋白质合成、减少体脂沉积、增强动物抗应激能力、促进动物生长
[4]。而这些功能的改善与肉质有着密不可分的关系,Kalmar等
[5]发现二甲基甘氨酸可通过增强机体脂肪代谢,降低体脂肪的含量来增加肉鸡产肉率。但目前有关于二甲基甘氨酸钠对肉鸡屠宰性能、胴体品质及肌肉抗氧化能力影响的研究报道不多。本实验在肉鸡日粮中添加二甲基甘氨酸钠,研究其对爱拔益加(Arbor Acres,AA)肉鸡屠宰性能、胴体品质及肌肉抗氧化能力的影响,为二甲基甘氨酸钠在肉鸡生产中的应用提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
体质量相近的1 日龄AA肉鸡720 只,购自安徽和威集团。
实验用添加剂为二甲基甘氨酸钠(C
4H
10NNaO
2),有效成分为二甲基甘氨酸,纯度为99.0%,由齐鲁晟华制药有限公司提供。
丙二醛(malondialdehyde,MDA)试剂盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、总抗氧化能力(total antioxygentic capacity,T-AOC)试剂盒 南京建成生物工程研究所。
基础日粮以玉米-豆粕为主,实验日粮配制参照NRC(1994)《家禽的营养需要量》
[6],基础日粮的组成及营养水平见表1。
表1 基础日粮组成及营养水平
Table1Composition and nutrient levels of daily diets
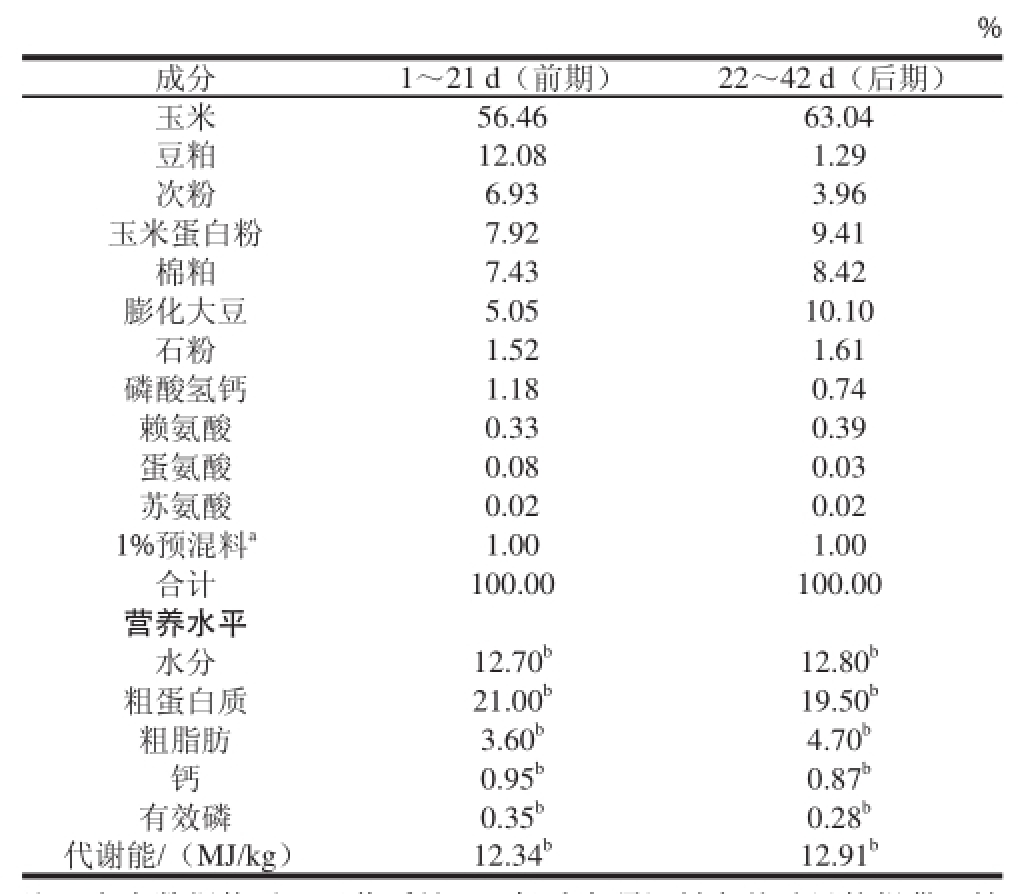
注:表中数据均以风干物质计;a. 每千克预混料向基础日粮提供:铁60 mg、铜7.5 mg、锌65 mg、锰110 mg、碘1.1 mg、硒0.4 mg、杆菌肽锌30 mg、VA 4 500 IU、VD
31 000 IU、VK 1.3 mg、VB
12.2 mg、VB
210 mg、VB
310 mg、氯化胆碱400 mg、VB
550 mg、VB
64 m
g、VH 0.04 mg、VB
111 mg、VB
121.013 mg。b. 计算值。
%成分1~21 d(前期)22~42 d(后期)玉米56.4663.04豆粕12.081.29次粉6.933.96玉米蛋白粉7.929.41棉粕7.438.42膨化大豆5.0510.10石粉1.521.61磷酸氢钙1.180.74赖氨酸0.330.39蛋氨酸0.080.03苏氨酸0.020.02 1%预混料
a1.001.00合计100.00100.00营养水平水分12.70
b12.80
b粗蛋白质21.00
b19.50
b粗脂肪3.60
b4.70
b钙0.95
b0.87
b有效磷0.35
b0.28
b代谢能/(MJ/kg)12.34
b12.91
b
1.2 仪器与设备
HI9025型pH计 意大利Hanna Instruments公司;CR-400型色度计 日本柯尼卡美能达集团;C-LM3B数显式肌肉嫩度仪 北京维欣仪奥科技发展有限公司;ZKSY-600智能恒温水浴锅 上海浦东荣丰科学仪器有限公司;Model PRO 200 Double Insulated匀浆机 美国ProScience公司。
1.3 方法
1.3.1 动物分组
选择体质量相近、1 日龄的AA肉鸡720 只,随机分为6 个处理组,每组6 个重复,每个重复20 只肉鸡,雌雄各半。各组分别为:CON组为对照组,饲喂基础日粮;T1组、T2组、T3组、T4组、T5组分别为在基础日粮中添加300、500、1 000、1 500、2 000 mg/kg二甲基甘氨酸钠的实验组。整个饲养过程中不外添加含抗氧化成分及具有促生长作用的物质。实验期分为1~21 d(前期)和22~42 d(后期)两阶段。肉鸡在同一鸡舍同一管理条件下饲养。
1.3.2 动物饲养管理
实验前对雏舍及器具进行消毒,实验鸡采用笼养方式。实验期内肉鸡自由饮水和采食,每天冲刷洗引水管1 次,日喂料2 次。定期清理粪便,持续光照。饲养期间1 周进行两次带鸡消毒和一次鸡舍外的环境消毒;肉鸡的免疫程序按常规方法进行。
1.3.3 样品采集与制备
于第42天08:00开始采样,从每个处理组中各随机抓取6 只鸡,每个重复1 只,雌雄各半,称质量后颈静脉放血屠宰,整个饲养过程和屠宰前无应激经历。按杨宁
[7]的方法进行常规屠宰指标测定,在活质量的基础上计算屠宰率、全净膛率,在全净膛质量的基础上计算胸肌率、腿肌率和腹脂率。并在每只鸡大约相同的部位取适量的胸肌和腿肌样品,迅速置于-20 ℃冰箱保存备用,采集样品时,同时在每只鸡另一侧大约相同的部位取胸肌、腿肌(去除脂肪和结缔组织)各5 块,用于测定pH值(24 h)、滴水损失率(48、96 h)、烹饪损失率、剪切力和肉色。
1.3.4 指标测定及方法
1.3.4.1 屠宰性能指标测定
于肉鸡42 日龄时每个重复随机选取1 只,每只分别称质量后屠宰,测定胴体质量、全净膛质量、腹脂质量、胸肌质量和腿肌质量,并计算屠宰率、全净膛率、腹脂率、胸肌率和腿肌率。
1.3.4.2 肉品质指标测定
pH值测定:肉样品置于4 ℃冰箱保存24 h后用pH计测定左侧胸肌和腿肌的pH值。
肉色测定:肉鸡屠宰24 h后用色度计测定左侧胸肌和腿肌的L*、a*和b*值;分别从每个样品的上、中、下部位各取一块肉样,取出切取新鲜横切面,测定不同区域的肉色,最后求平均值。
滴水损失率和烹饪损失率测定:屠宰后称量右侧胸肌和腿肌并记录质量m
1(g),用铁钩悬挂肉样,并保证肌纤维方向平行于重力方向,放置于充气的自封袋中,样品不接触自封袋,4 ℃悬挂48 h和96 h,取出后用滤纸轻轻拭去肉样表层汁液后称质量m
2(g),按照下式计算滴水损失率。另外分别取10 g左右的胸肌和腿肌,用锡箔纸包住,于恒温水浴锅中75 ℃水浴15 min后称质量,记录水分损失量,计算烹饪损失率
[8]。
剪切力测定:用肌肉嫩度仪测定右侧胸肌和腿肌的剪切力。先从每个样品中取3 小块肉样用自封袋包装,水浴加热至肉样中心温度约70 ℃,此时水浴锅温度约为75~80 ℃。取出肉样修剪,胸肌为2.5 cm×1.0 cm×0.5 cm,腿肌为2.5 cm×1.0 cm×0.25 cm。修剪时保证肉样长轴与肌纤维方向平行。用嫩度仪垂直肌纤维方向切割3 个点,求平均值。
1.3.4.3 胸肌腿肌抗氧化能力指标测定
使用匀浆机制备胸肌腿肌匀浆液,按照试剂盒说明书方法测定42 日龄肉鸡胸肌、腿肌的MDA含量,T-SOD、GSH-Px及T-AOC活力。GSH-Px活力测定采用还原型谷胱甘肽氧化法、SOD活力测定采用黄嘌呤氧化法、T-AOC活力测定采用Fe
3+还原法、MDA含量测定采用硫代巴比妥酸法。
1.4 数据处理与分析
实验数据采用Excel 2010进行初步整理,用SPSS 20.0软件进行统计分析,采用单因子方差(One-Way ANOVA)分析进行差异显著性检验,并采用邓肯氏(Duncan’s)法进行多重比较。结果以±s表示。
2 结果与分析
2.1 饲喂二甲基甘氨酸钠对肉鸡屠宰性能的影响
表2不同添加剂量二甲基甘氨酸钠对42日龄肉鸡屠宰性能的影响
Table2Effect of dietary supplementation with Na-DMG at different dose levels on slaughter performance of broilersilers

注:同行小写字母不同表示差异显著(P<0.05);同行大写字母不同表示差异极显著(P<0.01)。表3、4同。
指标CON组T1组T2组T3组T4组T5组全净膛率/%79.68±1.85
b81.91±4.32
ab84.71±2.70
ab83.44±0.88
ab87.30±2.65
a84.70±0.43
ab屠宰率/%96.67±0.32
a97.30±0.12
a91.72±5.50
a95.76±0.70
a96.07±0.56
a97.85±0.39
a腹脂率/%2.67±0.22
a2.30±0.23
a2.48±0.36
a2.09±0.13
a2.05±0.34
a2.52±0.24
a胸肌率/%16.15±0.75
ABab14.98±1.11
Bb15.04±0.68
Bb16.88±0.56
ABab17.86±0.48
Aa16.62±0.38
ABab腿肌率/%12.93±0.37
b12.9 8±0.31
b13.30±0.35
ab13.93±0.33
ab14.25±0.37
a13.58±0.39
ab
由表2可知,T4组的全净膛率显著高于CON组(P<0.05),但其他处理组与CON组相比差异不显著(P>0.05)。各实验组的屠宰率与腹脂率差异均不显著(P>0.05),但各二甲基甘氨酸钠处理组的腹脂率较CON组有降低的趋势。就胸肌率和腿肌率而言,二甲基甘氨酸钠各处理组的胸肌率与CON组相比差异不显著(P>0.05),但T4组的胸肌率极显著高于T1组和T2组(P<0.01),但与T3和T5组相比差异不显著(P>0.05);T4组的腿肌率显著高于CON组和T1组(P<0.05),分别提高了10.2%和9.78%。
2.2 饲喂二甲基甘氨酸钠对肉鸡肉品质的影响
表3不同添加剂量二甲基甘氨酸钠对肉鸡胸肌肉品质的影响
Tabble3Efffect of dietary suppementation with Na-DMG at different dose levels on breast muscle meat quality indices of broilers

指标CON组T1组T2组T3组T4组T5组pH
24
h5.76±0.04
ab5.69±0.03
b5.79±0.05
ab5.86±0.04
a5.85±0.09
a5.74±0.02
ab烹饪损失率/%22.16±1.99
Aa17.75±0.75
ABab18.17±0.61
ABab15.25±2.65
Bb14.5±0.28
Bb16.67±2.00
ABb48 h滴水损失率/%2.30±0.33
a2.33±0.70
a2.26±0.57
a1.89±0.1 2
a1.80±0.33
a1.56±0.41
a96 h滴水损失率/%5.26±0.93
a5.81±1.11
a3.72±0.41
abc5.21±0.66
ab3.43±0.53
bc3.29±0.40
c肉色L*31.79±2.0 3
a27.27±0.85
a28.81±4.02
a31.62±3.08
a30.38±1.74
a32.49±1.73
a肉色a*5.16±0.42
a5.77±0.23
a5.52±0.41
a4.98±0.47
a5.03±0.39
a5.25±0.15
a肉色b*3.86±0.61
a2.61±0.18
a2.52±0.87
a3.06±0.63
a3. 40±0.46
a4.02±0.45
a剪切力/N18.60±1.32
Aab20.15±2.02
Aa15.52±1.66
ABbc12.10±1.24
Bc12.60±0.35
Bc13.36±0.79
Bc
由表3可知,T3组与T4组胸肌的pH
24
h值显著高于T1组(P<0.05),但较CON组差异不显著(P>0.05)。与CON组相比,T3组与T4组的烹饪损失率极显著降低(P<0.01),T4组与T5组的96 h滴水损失率显著低于CON组(P<0.05),但各组间的48 h滴水损失率差异不显著(P>0.05)。各二甲基甘氨酸钠处理组较CON组胸肌肉色值的差异同样均不显著(P>0.05)。T3、T4和T5组的剪切力极显著低于CON组(P<0.01)。
表4 不同添加剂量二甲基甘氨酸钠对肉鸡腿肌肉品质的影响
Table 4 Effect of dietary supplementation with Na-DMG at different dose levels on thigh muscle meat quality indices of broilers
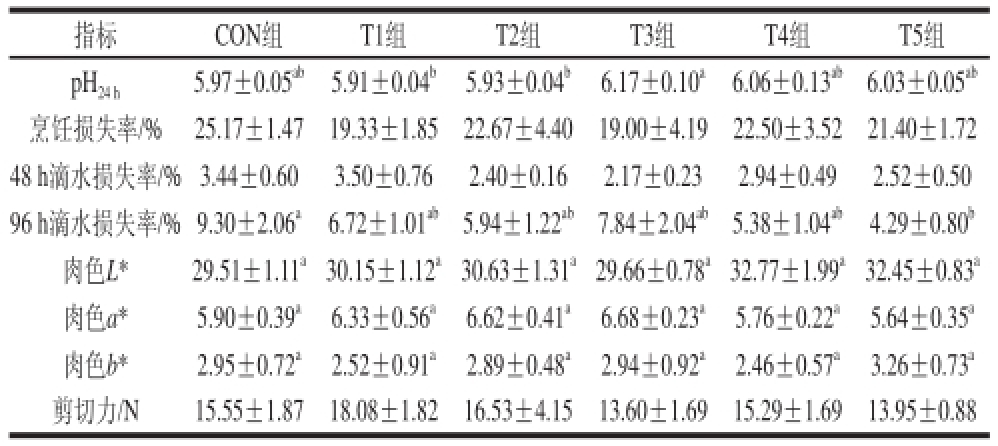
指标CON组 T1组T2组T3组T4组T5组pH
24
h5.97±0.05
ab5.91±0.04
b5.93±0.04
b6.17±0.10
a6.06±0.13
ab6.03±0.05
ab烹饪损失率/%25.17±1.4719.33±1.8522. 67±4.4019.00±4.1922.50±3.5221.40±1.72 48 h滴水损失率/%3.44±0.603.50±0.762.40±0.162.17±0.232.94±0.492.52± 0.50 96 h滴水损失率/%9.30±2.06
a6.72±1.01
ab5.94±1.22
ab7.84±2.04
ab5.38±1.04
ab4.29±0.80
b肉色L*29.51±1.11
a30.15±1.12
a30.63±1.31
a29.66±0.78
a32.77±1.99
a32.45±0.83
a肉色a*5.90±0.39
a6.33±0.56
a6.62±0.41
a6.68±0.23
a5.76±0.22
a5.64±0.35
a肉色b*2.95±0.72
a2.52±0.91
a2.89±0.48
a2.94±0.92
a2.46±0.57
a3.26± 0.73
a剪切力/N15.55±1.8718.08±1.8216.53±4.1513.60±1.6915.29±1.6913.95±0.88
由表4可知,T3组腿肌的pH
24
h值显著高于T1组和T2组(P<0.05),且较其他各组差异不显著(P>0.05),但与CON组相比有提高的趋势。各二甲基甘氨酸钠处理组与CON组相比,96 h滴水损失率有降低的趋势,其中T5组显著低于CON组(P<0.05)。就肉色值而言,各组间的
L*、a*和b*值差异均不显著(P>0.05),但T4组的L*值较CON组有升高的趋势。
2.3 饲喂二甲基甘氨酸钠对肉鸡肌肉抗氧化能力的影响
表5不同添加剂量二甲基甘氨酸钠对肉鸡肌肉抗氧化能力的影响
Table5Effect of dietary supplementation with Na-DMG at different dose levels on muscle antioxidant performance of broilers
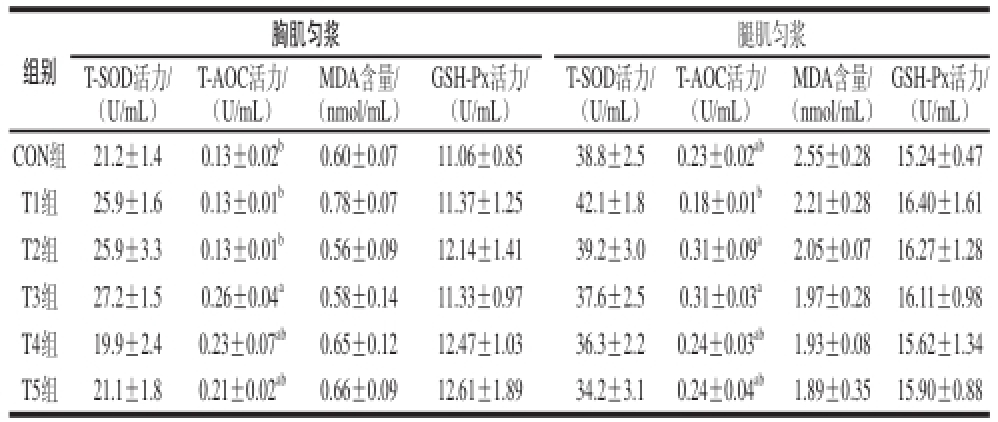
注:同列小写字母不同表示差异显著(P<0.05);同列大写字母不同表示差异极显著(P<0.01)。
GSH-Px活力/(U/mL)CON组21.2 ±1.40.13±0.02
b0.60±0.0711.06±0.8538.8±2.50.23±0.02
ab2.55±0.2815.24±0.47 T1组25.9±1.60.13±0.01
b0.78±0.0711.37±1.2542.1±1.80.18±0.01
b2.21±0.2816.40±1.61 T2组25.9±3.30.13±0.01
b0.56±0.0912.14±1.4139.2±3.00.31±0.09
a2.05±0.0716.27±1.28 T3组 27.2±1.50.26±0.04
a0.58±0.1411.33±0.9737.6±2.50.31±0.03
a1.97±0.2816.11±0.98 T4组19.9±2.40.23±0.07
ab0.65±0.12 12.47±1.0336.3±2.20.24±0.03
ab1.93±0.0815.62±1.34 T5组21.1±1.80.21±0.02
ab0.66±0.0912.61±1.8934.2±3.10.24±0.04
ab1.89± 0.3515.90±0.88组别胸肌匀浆腿肌匀浆T-SOD活力/(U/mL)T-AOC活力/(U/mL)MDA含量/(nmol/mL)GSH-Px活力/(U/mL)T-SOD活力/(U/mL)T-AOC活力/(U/mL)MDA含量/(nmol/mL)
由表5可知,各组间的胸肌和腿肌的T-SOD、GSH-Px活力和MDA含量差异均不显著(P>0.05)。T3组胸肌的T-AOC活力显著高于CON 组、T1组和T2组(P<0.05),T4组与T5组胸肌的T-AOC活力较CON组、T1组和T2组有升高的趋势。对于腿肌而言,T2组和T3组的T-AOC活力较CON组有所升高,但差异不显著(P>0.05)。
3 讨论
3.1 饲喂二甲基甘氨酸钠对肉鸡屠宰性能的影响
肌肉和腹脂是肉鸡的主要屠宰形状,直接决定着肉鸡的屠宰性能。本实验结果表明,日粮中添加1 500 mg/kg的二甲基甘氨酸钠可显著提高肉鸡的全净膛率和腿肌率,并且随着添加剂量的增加,胸肌率有提高的趋势;但实验结果显示二甲基甘氨酸钠并未对肉鸡的屠宰率产生显著影响,这可能是由于二甲基甘氨酸钠促进了脂肪的代谢,减少了脂肪的沉积,但又增加了蛋白质的合成,才使得屠宰率没有提高。对于腹脂率而言,二甲基甘氨酸钠能从一定程度上降低肉鸡的腹脂率,但是差异并不显著。而Kalmar等
[5]研究发现在肉鸡中添加二甲基甘氨酸能提高3.3%的胸肌率,并且显著地降低20.5%的腹脂率,与本实验的发现有所差异,这可能与日粮中的脂肪类型、含量以及肉鸡的品种有关。
肉鸡腿肌率和胸肌率的提高说明了二甲基甘氨酸钠对蛋白质的生物积累有一定的促进作用。有研究报道在肉鸡日粮中添加二甲基甘氨酸可以使得粗蛋白的表观消化率显著提高6.3%
[5]。而Cools等
[4]在雌猪日粮中添加1 000 mg/kg的二甲基甘氨酸,发现粗蛋白的表观消化率提高了20.9%,这说明随着二甲基甘氨酸钠的添加,肉鸡对粗蛋白的消化率提高,进而促进了氨基酸的生物积累,为蛋白质的积累提供了物质基础。还有研究发现随着蛋白质生物积累的增多,脂肪的积累逐渐降低
[9]。一方面,二甲基甘氨酸钠的添加降低了胆碱的生物消耗,使得胆碱介导的肉碱组织吸收增多,促进了线粒体内长链脂肪酸的氧化,从而降低了脂肪的沉积
[10-11]。另一方面,加速脂肪酸的氧化能为肉鸡更好地提供能量,降低了氨基酸的功能需求,减少了氨基酸的分解代谢,进一步促进了蛋白质的积累。此外,二甲基甘氨酸钠的供甲基作用加强了同型半胱氨酸向蛋氨酸转化,而蛋氨酸是肉鸡的第一限制性氨基酸,这可能提高了蛋氨酸在肉鸡上的利用效率,促进了肌肉的沉积,降低了脂肪的积累,从而提高了肉鸡的屠宰性能
[12]。
3.2 饲喂二甲基甘氨酸钠对肉鸡肉品质的影响
pH值是肌肉酸度的直观表现,它反映了宰后胴体内糖原酵解的速度。肉鸡屠宰后,体内的调节机能破坏,肌肉的pH值开始下降,肌肉pH值不仅是肌肉酸度的直观表现,还对肉的系水力有直接影响
[13]。据报道,pH值和肉色、系水力呈正相关,高pH值的肉具有较长的货架期
[14-15]。滴水损失率和烹饪损失率是评价肉质的重要指标,也是影响产肉率的重要因素,肌肉滴水损失率增大,不仅引起经济损失,而且影响肉的外观品质,烹调时出水过多使肉枯柴无味
[16]。本实验发现日粮中添加1 000~1 500 mg/kg的二甲基甘氨酸钠可以从一定程度上提高屠宰后24 h的胸肌pH值;Levine等
[17]研究发现给动物饲喂二甲基甘氨酸可显著降低机体乳酸的积累,这提示二甲基甘氨酸可能通过减少肉鸡饲养过程中乳酸的产生来提高肌肉的pH值。此外,添加1 000~2 000 mg/kg的二甲基甘氨酸钠组胸肌的烹饪损失率、96 h滴水损失率显著降低。这可能是由于二甲基甘氨酸钠能提高机体对蛋白质的利用率,造成肌肉蛋白质与脂肪的比例增高,肌肉亲水能力提高,使得胸肌的系水力得到提高;实验还发现二甲基甘氨酸钠可降低胸肌剪切力,提高胸肌嫩度,这可能是由于二甲基甘氨酸钠提高了宰后胸肌的pH值,才使得熟化后的肉嫩度明显改善
[18]。肉色是肉质重要的性状之一,Sandusky等
[19]研究发现L*和a*值分别与亮度和红度高度相关,b*值和黄度相关。a*值大小反映肌肉中肌红蛋白含量的高低,b*值大小与肌间脂肪沉积的多少和色素沉积有关,L*值大小直接反映肌肉光泽度的高低
[20]。肉色直接影响消费者的直观感受和重复购买行为。本实验结果显示,日粮中添加二甲基甘氨酸钠对胸肌的肉色值无显著影响,但有提高腿肌L*值的趋势,二甲基甘氨酸钠添加剂量为1 500、2 000 mg/kg的日粮分别使得腿肌L*值升高了11.1%和9.96%,这说明二甲基甘氨酸钠对腿肌光泽度的改善有一定促进作用。
3.3 饲喂二甲基甘氨酸钠对肉鸡肌肉抗氧化能力的影响
肉鸡饲养过程中机体可通过酶系统和非酶系统产生氧自由基,自由基能攻击生物膜中的不饱和脂肪酸,引起脂质过氧化反应,形成脂质过氧化物。肉品中脂类氧化会产生酸败味等不良气味,降低肌肉中多不饱和脂肪酸、脂溶性维生素和色素的含量,从而影响肌肉的风味
[21]。研究发现,宰后肌肉的抗氧化能力可影响肌肉的持水性,肌肉的抗氧化能力弱导致自由基攻击不饱和脂肪酸,引起细胞膜脂质过氧化,细胞膜脂质过氧化的后果是膜流动性降低,通透性增加;另外脂质过氧化使细胞膜饱和脂肪酸相对增多,会使膜变为刚性状态,造成膜功能异常,最终导致细胞膜破裂,使得细胞膜通透性和完整性受到破坏
[22],这样细胞内的不易流动水失去了细胞膜的屏障作用,较容易转移到细胞外变为自由水,自由水增加超过一定量便会从肌肉中滴出,最终导致肌肉持水性的降低
[23]。而肌肉的持水性作为评价肉质最重要的指标之一,直接影响肉的滋味、香气、多汁性、营养成分、嫩度、颜色等食用品质
[24]。因此提高肉鸡的抗氧化能力,防止肉品中脂类氧化是改善肉品质的重要手段之一。 抗氧化剂能抑制氧自由基的衍生和脂质过氧化物的形成,而二甲基甘氨酸是一种食品抗氧化营养添加剂,已有研究报道称二甲基甘氨酸能提高肌肉组织中氧气的利用率,并能有效降低肉鸡的氧化应激
[1,5]。研究发现小鼠口服二甲基甘氨酸能清除肠道内的氧自由基,并且能显著降低血液和组织中MDA含量及由氧化应激造成的胃黏膜损伤
[25]。但目前有关于二甲基甘氨酸钠对肉鸡肌肉抗氧化能力的影响鲜有报道。本研究发现肉鸡日粮中添加二甲基甘氨酸钠主要影响肌肉中胸肌的抗氧化能力,添加1 000~1 500 mg/kg的二甲基甘氨酸钠能显著提高肉鸡胸肌的总抗氧化能力,并且随着添加剂量的提高,其能从一定程度上提高肉鸡的抗氧化能力,但抗氧化效果并不呈现量效关系。实验结果还显示二甲基甘氨酸钠并未影响肌肉中的T-SOD、GSH-Px活力及MDA含量,但肌肉中总抗氧化能力却显著提高,这说明二甲基甘氨酸钠可能通过非抗氧化酶机制来提高胸肌的抗氧化能力。有研究发现,二甲基甘氨酸可增加机体干扰素的产生及其淋巴细胞的增殖,并预防人体组织器官的癌变,而组织器官的抗氧化功能与机体的免疫功能密切相关
[26-27]。因此,二甲基甘氨酸可能通过加强体内抗体、淋巴细胞及细胞因子等免疫物质的功能来延长细胞寿命以抵抗组织细胞的氧化
[28-30]。此外,二甲基甘氨酸还是一种氨基酸的衍生物,有研究报道称二甲基甘氨酸的葡萄糖酸内酯能激活细胞内的Cu
2+的螯合,Cu
2+的螯合作用抑制了由Cu
2+诱导的低密度脂蛋白的共轭二烯化作用,而低密度脂蛋白的氧化程度可由其共轭二烯化程度决定,因此二甲基甘氨酸可能通过这种机制抑制了肌蛋白的氧化,提高了肌肉的抗氧化能力
[28]。这可能是二甲基甘氨酸钠提高肉鸡肌肉总抗氧化能力的原因,也是其能改善肉品质的重要原因,但目前关于二甲基甘氨酸提高机体抗氧化能力的具体机制鲜有报道,还有待进一步的研究证实。
4 结论
日粮中添加二甲基甘氨酸钠可改善AA肉鸡的屠宰性能,显著提高肉鸡的全净膛率和腿肌率,且以1 500 mg/kg的添加剂量效果最佳。
添加1 000 mg/kg以上二甲基甘氨酸钠能有效提高42 日龄AA肉鸡的胴体品质,可以有效提高屠宰后24 h胸肌和腿肌的pH值,其中胸肌的烹饪损失率、96 h滴水损失率和剪切力显著降低。
二甲基甘氨酸钠能提高AA肉鸡胸肌的总抗氧化能力,从添加效果来看,1 000~1 500 mg/kg的添加剂量效果最佳。
参考文献:
[1] CUPP M J, TRACY T S. Dietary supplements: toxicology and clinical pharmacology[M]. New Jersey: Humana Press, 2003: 149-160.
[2] MACKENZIE C G, FRISELL W R. The metabolism of dimethylglycine by liver mitochondria[J]. Journal of Biological Chemistry, 1958, 232(1): 417-427.
[3] MEDUSKI J, HYMAN S, KILZ R, et al. Decrease of lactic acid concentration in blood of animals given N,N-dimethylglycine[C]// Pacific Slope Biochemical Conference.San Diego: University of California, 1980: 7-9.
[4] COOLS A, MAES D, BUYSE J, et al. Effect of N, N-dimethylglycine supplementation in parturition feed for sows on metabolism, nutrient digestibility and reproductive performance[J]. Animal, 2010, 4(12): 2004-2011.
[5] KALMAR I, COOLS A, VERSTEGEN M W, et al. Dietary supplementation with dimethylglycine affects broiler performance and plasma metabolites depending on dose and dietary fatty acid profile[J]. Journal of Animal Physiology and Animal Nutrition, 2011, 95(2): 146-153.
[6] Subcommittee on Poultry Nutrition, National Research Council. Nutrient requirements of poultry[M]. 9th ed. Washington DC: National Academy Press, 1994.
[7] 杨宁. 家禽生产学[M]. 北京: 中国农业出版社, 2002: 7.
[8] 倪迎冬, 洪文杰, 任灵芝, 等. 大豆黄酮对母鸡蛋品质及后代仔鸡肉品质的影响[J]. 畜牧兽医学报, 2007, 38(11): 1188-1194.
[9] NAMROUD N, SHIVAZAD M, ZAGHARI M. Effects of fortifying low crude protein diet with crystalline amino acids on performance, blood ammonia level, and excreta characteristics of broiler chicks[J]. Poultry Science, 2008, 87(11): 2250-2258.
[10] DAILY J W, SACHAN D S. Choline supplementation alters carnitine homeostasis in humans and guinea pigs[J]. The Journal of Nutrition, 1995, 125(7): 1938-1944.
[11] DODSON W L, SACHAN D S. Choline supplementation reduces urinary carnitine excretion in humans[J]. The American Journal of Clinical Nutrition, 1996, 63(6): 904-910.
[12] SLOW S, MCGREGOR D O, LEVER M, et al. Dimethylglycine supplementation does not affect plasma homocysteine concentrations in pre-dialysis chronic renal failure patients[J]. Clinical Biochemistry, 2004, 37(11): 974-976.
[13] 黄进. 大豆磷脂对AA肉鸡脂肪代谢及肉品质影响的研究[D]. 南京:南京农业大学, 2008.
[14] 侯建国, 李加琪, 陈瑶生, 等. 微卫星DNA标记与猪肉质性状的相关分析[J]. 华南农业大学学报: 自然科学版, 2003, 24(2): 63-66.
[15] YANG C, CHEN T. Effects of refrigerated storage, pH adjustment, and marinade on color of raw and microwave cooked chicken meat[J]. Poultry Science, 1993, 72(2): 355-362.
[16] 黄冠庆, 林红英, 黄晓亮, 等. 谷氨酰胺对黄羽肉鸡生长、抗氧化力及肉品质的影响[J]. 中国畜牧杂志, 2010, 46(21): 60-64.
[17] LEVINE S, MYHRE G, SMITH G, et al. Effect of a nutritional supplement containing N,N-dimethylglycine (DMG) on the racing standardbred [Horses] [J]. Equine Practice, 1982: 31-36.
[18] 汤晓艳, 周光宏, 徐幸莲, 等. 肉嫩度决定因子及牛肉嫩化技术研究进展[J]. 中国农业科学, 2007, 40(12): 2835-2841.
[19] SANDUSKY C, HEATH J. Sensory and instrument-measured ground chicken meat color[J]. Poultry Science, 1998, 77(3): 481-486.
[20] 吕锦芳, 宁康健, 金光明, 等. 肌肽对肉鸡生长性能及胸肌肉品质的影响[J]. 粮食 与饲料工业, 2007(7): 41-43.
[21] GRAY J, GOMAA E, BUCKLEY D. Oxidative quality and shelf life of meats[J]. Meat Science, 1996, 43: 11 1-123.
[22] TSUCHIHASHI H, KIGOSHI M, IWATSUKI M, et al. Action of β-carotene as an antioxidant against lipid peroxidation[J]. Archives of Biochemist ry and Biophysics, 1995, 323(1): 137-147.
[23] FUKUZAWA K, INOKAMI Y, TOKUMURA A, et al. Rate constants for quenching singlet oxygen and activities for inhibiting lipid peroxidation of carotenoids and alpha-tocop herol in liposomes[J]. Lipids, 1998, 33(8): 751-756.
[24] 柳艳霞, 高晓平, 赵改名, 等. 宰后因素对肌肉保水性的影响[J]. 安徽农业科学, 2007, 35(16): 4846-4848.
[25] HARIGANESH K, PRATHIBA J. Effect of dimethylglycine on gastric ulcers in rats[J]. J ournal of Pharmacy and Pharmacology, 2000, 52(12): 1519-1522.
[26] 徐跃飞, 潘佩兰, 杨康成, 等. 抗氧化剂对荷癌小鼠淋巴样器官LPO、SOD水平的影响[J]. 大连医学院学报, 1992(3): 53-56.
[27] KENDALL R V, LAWSON J W, REAP E A. Treatment of melanoma using N,N-dimethylglycine: U.S., Patent 4994492[P]. 1991-02-19.
[28] SCHNEIDER D, HELWIG V, STANIEK K, et al. Studies on the chemical identity and biological functions of pangamic acid[J]. Arzneimittel-Forschung, 1999, 49(4): 335-343.
[29] GRABER C D, GOUST J M, GLASSMAN A D, et al. Immunomodulating properties of dimethylglycine in humans[J]. Journal of Infectious Diseases, 1981, 143(1): 101- 105.
[30] REAP E, LAWSON J. Stimulation of the immune response by dimethylglycine, a nontoxic metabolite[J]. The Journal of Laboratory and Clinical Medicine, 1990, 115(4): 481-486.
Effect of N,N-Dimethylglycine Sodium on Slaughter Performance,Meat Quality Indices and Antioxidant Performance of Broilers
KOU Tao,HU Zhiping,DONG Li,HE Jintian,BAI Kaiwen,WANG Tian*
(College of Animal Science and Technology,Nanjing Agricultural University,Nanjing210095,China)
Abstract:The study was conducted to evaluate the effect of N,N-dimethylglycine sodium salt(Na-DMG)on slaughter performance,meat quality indices and antioxidant performance of broilers.Totally720one-day-old AA broilers were randomly allocated to six groups with6replicates,and fed commercial starter diet supplemented with Na-DMG at doses of300,500,1000,1500and2000mg/kg for42days,respectively.The results showed that1)dietary addition of Na-DMG increased the percentage of eviscerated carcass and thigh muscle in broilers(P <0.05).The1500mg/kg Na-DMG group displayed the best slaughter performance;2)dietary Na-DMG mainly affected meat quality in dices of breast muscle.The cooking loss of breast muscle from42-day-old broilers was decreased extremely significantly by Na-DMG supplementation at doses of1000and1500mg/kg when compared with the control group(P <0.01),and significantly reduced at2000mg/kg(P <0.05).Na-DMG when supplemented at1500and2000mg/kg led to a significant decrease in drip loss(96h postmortem)of chicken breast muscle when compared with the control group(P <0.05).Moreover,Na-DMG at doses between1000and2000mg/kg could reduce the shear force of chicken breast muscle significantly(P <0.01);and3)dietary Na-DMG could also affect antioxidant performance of breast muscle by increasing T-AOC levels at1000mg/kg when compared with the control group(P <0.05).In conclusion,N,N-dimethylglycine sodium salt can improve the slaughter performance and meat quality of broilers significantly,and also enhance the antioxidant capacity of breast muscle,especially at doses of1000-1500mg/kg.
Key words:N,N-dimethylglycine sodium salt;broilers; slaughter performance; meat quality;antioxidant performance
中图分类号:S831.5
文献标志码:A
文章编号:1002-6630(2015)05-0179-06
doi:10.7506/spkx1002-6630-201505034
收稿日期:2014-03-26
基金项目:江苏省科技支撑计划(农业)项目(BE2010356)
作者简介:寇涛(1991—),男,硕士研究生,研究方向为动物营养与饲料科学。E-mail:koutao91526@163.com
*通信作者:王恬(1958—),男,教授,博士,研究方向为动物营养与饲料科学。E-mail:twang18@163.com




