 表示;采用3p97药物代谢动力学软件拟合血药质量浓度经时过程,并计算药物代谢动力学参数。
表示;采用3p97药物代谢动力学软件拟合血药质量浓度经时过程,并计算药物代谢动力学参数。
张丹,叶逵,王家家,徐海,宋星星,金忠秀,盛杰,李李,刘开永*
(安徽医科大学公共卫生学院,安徽合肥230601)
摘要:研究邻苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl)phthalate,DEHP)在青春期小鼠体内的代谢动力学,以300mg/kg DEHP灌胃青春期小鼠,血清样品经固相萃取(solid phase extraction,SPE)提取和净化,气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法测定不同时间点的血药质量浓度,以3p97软件拟合其动力学参数。DEHP在青春期小鼠体内的主要药物代谢动力学参数:药峰质量浓度ρ max为(0.47 6±0.028) μg/mL,达峰时间T peak为(2.539±0.424) h,药-时曲线下面积AUC (0-t)为(32.209±11.220) h•μg/mL,分布半衰期t 1/2α为(1.886±0.480) h,消除半衰期t 1/2β为(36.473±8.324) h。本方法简便快捷,其灵敏度和准确度均可满足青春期小鼠体内DEHP代谢动力学研究。DEHP在青春期小鼠体内药物代谢动力学过程符合一级吸收二室开放模型,其分布较快,代谢较慢。
关键词:药物代谢动力学;气相色谱-质谱联用;固相萃取;邻苯二甲酸二(2-乙基己基)酯
邻苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl)phthalate,DEHP)是增塑剂的一种,以非共价键形式与塑料产品的聚烯烃类分子结合,因而容易脱落进入环境中,广泛存在于食品和化妆品包装、儿童玩具等 [1-5]。邻苯二甲酸酯对生殖系统的毒性作用被认为具有年龄依赖性,可能是由于胎儿期和青春期机体器官发育,较成人更为敏感 [6-10]。DEHP作为一种环境激素类物质,可扰乱机体内分泌功能 [11-13]。已有多项研究证实其具有肝脏和肾脏毒性 [14-16],从而影响DEHP在 机体内的吸收、分布、代谢和排泄及血液药物浓度的动态变化规律。青春期的发动和进程受到神经内分泌系统的调控,人类的青春期性征发育或性功能发育年龄正在提前,由此也产生了一系列负面作用 [17-18]。同样DEHP在青春期人群体内的代谢动力学也将改变,但遗憾的是鲜有该方面的研究报道。本实验以青春期小鼠为研究对象,气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法测定血清样品中的DEHP含量,研究其在青春期小鼠体内药物代谢动力学特征,为进一步评估DEHP在动物体内的代谢与检测其在食品中的残留提供参考依据。
1.1 动物、材料与试剂
6 周龄清洁级ICR小鼠,雄鼠30 只、雌鼠30 只,购自安徽医科大学实验动物中心,许可证号:SCXK(皖)2011-002。实验前适应性喂养一周,自由饮食,温度23~25 ℃,昼夜均衡;饲料和垫料购自江苏省协同医药生物工程有限责任公司,饲料合格证号和垫料检测报告编号分别为苏饲审(2008)01008和104242016608D。
HLB固相萃取柱(1 mL,30 mg) 美国Waters公司;DEHP标准品(纯度≥99.5%) 美国Sigma公司;色谱级甲醇 美国Tedia公司;DEHP原料药(纯度>99.0%)、甲基叔丁基醚(纯度≥99%) 国药集团化学试剂有限公司。
1.2 仪器与设备
7890A-5975C气相色谱-质谱联用仪 美国Agilent公司;ASE-12固相萃取装置、AP-02B型无油真空泵天津奥特赛恩斯仪器有限公司;N-EVAP-112氮吹仪 美国Organomation公司。
1.3 方法
1.3.1 动物分组、处理及取样
随机挑选48 只健康ICR小鼠(雌雄各半)分为8 组,灌胃前禁食(不禁水)8 h,DEHP(溶于玉米油)按300 mg/kg(以体质量计,下同)灌胃给药,分别于给药后0.25、0.67、1.5、3、6、12、24、48 h对小鼠进行眼球摘除法采血,离心取血清。剩余小鼠灌胃等量玉米油,于灌胃后1 h同样采血分离血清。
1.3.2 样品处理
吸取0.2 mL血清,加入0.6 mL生理盐水混匀,涡旋10 s,混匀备用。固相萃取柱活化:加入1 mL甲醇,流速2 mL/min;萃取柱平衡:加入1 mL生理盐水,流速2 mL/min;上样:将0.8 mL血清生理盐水混合样品加入固相萃取柱,流速1 mL/min;萃取柱洗脱:依次加入生理盐水、10%、30%、50%甲醇溶液,流速1 mL/min;萃取柱洗脱:加入1 mL 10%甲醇-甲基叔丁基醚,流速1 mL/min,收集洗脱液,氮气吹干后加入0.6 mL甲醇复溶,上机检测。样品处理过程所使用的玻璃器具均用铬酸洗液浸泡24 h,超纯水冲洗后,色谱级甲醇润洗3 次,105 ℃烘干2 h。
1.3.3 样品测定
1.3.3.1 色谱条件
色谱柱:Agilent HP-5MS(30 m×250 μm,0.25 μm);升温程序:180 ℃保持1 min,以15℃/min升至200 ℃,保持1 min,再以30 ℃/min升至290 ℃,保持3 min;载气(He)流速1 mL/min;前进样口温度250 ℃;压力81.4 kPa,进样量1 μL,不分流。
1.3.3.2 质谱条件
电子轰击离子源;电子能量70 eV;离子源温度230 ℃;接口温度280 ℃;四极杆温度150 ℃;溶剂延迟时间5 min。质量扫描范围m/z 50~500;根据保留时间和特征性离子m/z 279、167、149对DEHP定性;选择离子监测模式,m/z 167为定量离子。
1.3.4 方法学考察
1.3.4.1 标准曲线绘制
取空白血清加入DEHP标准溶液,得到DEHP系列质量浓度:0.05、0.10、0.50、1.00、5.00 μg/mL,进行GC-MS分析后,以定量离子m/z 167色谱峰高为纵坐标,系列标准质量浓度为横坐标,进行线性回归分析。
1.3.4.2 精密度与回收率测定
空白血清添加DEHP标准品,使DEHP终质量浓度为0.1、1.0、5.0 μg/mL,每个质量浓度重复3 个样品,然后以1.3.2节样品处理方法进行前处理及1.3.3节方法进行测定,计算血清加入标准品实测峰高与相应标准品峰高比值,得到绝对回收率。同一天、同一批样品重复3 次,连续3 d,测得其日内和日间精密度,以相对标准偏差(relative standard deviation,RSD)表示。
1.3.4.3 方法灵敏度
通过加标实验,以0.1 μg/mL的添加质量浓度进样3 次,以信噪比(signal to noise ratio,R SN)等于10来计算最低定量限(limit of quantification,LOQ),以R SN等于3计算最低检测限(limit of detection,LOD)。
1.4 药代动力学参数分析
所有数据以
 表示;采用3p97药物代谢动力学软件拟合血药质量浓度经时过程,并计算药物代谢动力学参数。
表示;采用3p97药物代谢动力学软件拟合血药质量浓度经时过程,并计算药物代谢动力学参数。
2.1 标准曲线
线性回归方程为Y=99 411X-6 195.4,R 2= 0.999 4。通过标准曲线的绘制可以看出本分析方法在DEHP质量浓度较宽的范围内具有较好的线性关系。
2.2 方法精密度和回收率
表1 小鼠空白血清添加DEHP的回收率和精密度
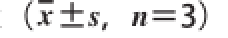
Table1Recoveris and precision of DEHP spiked in mouse serum


添加质量浓度/(μg/mL)日内日间绝对回收率/%RSD/%绝对回收率/%RSD/% 0.164.23±6.219.6765.78±5.908.97 171.01±5.187.2970.54±3.765.34 574.87±2.162.8973.01±2.753.7 8
如表1所示,实验的绝对回收率在64.23%~74.87%之间,RSD均小于10%。本实验对固相萃取条件进行了优化,在固相萃取的洗脱过程中,若洗脱剂的浓度选择不当会使目标物脱附,回收率降低。洗脱曲线实验结果显示,10%、30%、50%的甲醇洗脱小柱,均未在洗脱流出液中检测到DEHP,达到60%时目标物被检测到。考虑到血清样品直接过柱处理,选择甲醇梯度洗脱,逐渐增加溶剂强度以避免血清蛋白沉淀堵塞小柱。在预实验阶段,50%甲醇可以使血清出现少许絮状沉淀,故未选择50%甲醇做一步洗脱。
在选择洗脱溶剂时,直接用100%甲醇一次洗脱目标物时,发现小柱仍有目标物未被洗脱,而10%甲醇-甲基叔丁基醚洗脱效果很好,故选用10%甲醇-甲基叔丁醚作为洗脱剂。本方法采用血清样品直接稀释过柱,简便易行,回收率较好。
2.3 方法灵敏度
结果显示最低检测限LOD = 0.004 μg/mL,最低定量限LOQ = 0.013 μg/mL,表明该测定方法的灵敏度较好。
2.4 血药质量浓度-时间曲线

图1 DEHP在小鼠体内平均血药质量浓度--时间曲线
Fig.1Average concentration-time curve of DEHP in mouse serum
如图1所示,血药质量浓度-时间曲线显示,DEHP口服吸收速率较快,在给药后3 h,DEHP的血药质量浓度达到最大,为(0.782±0.105) μg/mL。在第48小时,DEHP仍维持较高的质量浓度,暗示其体内消除速率较慢。
2.5 DEHP动力学特点
以AIC(Akaike’s Information Criterion)值和WSS(加权残差平方和)为指标,AIC和WSS越小,拟合程度越好。结果表明:以权重为1/ρ 2时,拟合为一级吸收二室开放模型较好,相关参数见表2。分布半衰期t 1/2α为(1.886±0.480) h,消除半衰期t 1/2β为(36.473±8.324) h,表明DEHP在体内分布较快,而代谢较慢,暗示DEHP在体内有较强的蓄积性。拟合的药物动力学方程为ρ t=1.6e -0.386t+0.256e -0.019t。
表2DEHP在青春期小鼠体内代谢的主要动力学参数
Table2Major pharmacokinetic parameters of DEHP in pubertal mice

参数A/(μg/mL)B/(μg/mL)α/h -1β/h -1K a/h -1K 10/h -1平均值1.600±0.7340.256±0.0300.386±0.0920.019±0.0060.670±0.1010.028±0.007参数t 1/2α/ht 1/2β/ht 1/2Ka/hK 21/h -1K 12/h -1AUC (0-t)/(h·μg/mL)平均值1.886±0.48036.473±8.3241.052±0.1470.122±0.0330.245±0.06332.209±11.220参数CL/(mL/h)T peak/hρ max/(μg/mL)平均值10.059±2.7412.539±0.4240.476±0.028
注:A.分布相初始质量浓度;B.消除相初始质量浓度;α.分布相速率常数;β.消除相速率常数;K a.吸收速率常数;K 10.转运速率常数;t 1/2α.分布半衰期;t 1/2β.消除半衰期;t 1/2Ka.吸收半衰期;K 21.周边室至中央室转运速率常数;K 12.中央室至周边室转运速率常数;AUC (0-t).药-时曲线下面积;CL.清除率;T peak.达峰时间;ρ max.达峰质量浓度。
DEHP分布半衰期为(1.886±0.480) h,消除半衰期为(36.473±8.324) h,表明DEHP在小鼠体内吸收较快,而消除较慢,说明DEHP易在小鼠体内蓄积。有学者的研究表明:人类口服DEHP后2 h其一级代谢产物邻苯二甲酸单(2-乙基己基)酯(mono(2-ethylhexyl)phthalate,MEHP)达到最大值,24 h后,约67%的DEHP代谢至尿液中,另外有3.8%的DEHP在第2天代谢至尿液中,与DEHP在人体内吸收较快而消除较慢的结论基本一致 [19-20]。
因此,研究DEHP在小鼠各组织中的消长规律,建立准确可靠的DEHP在小鼠体内的生理药物代谢动力学模型,获得生理药物代谢动力学模型的参数,验证所建立的生理模型并进行生理模型的种属(人)间外推,通过生理模型建立DEHP在靶组织残留的预测模式以保护人类健康显得尤为重要 [21]。本研究的结果表明,DEHP灌胃内服后在小鼠体内符合二室开放模型,分布半衰期约为1.9 h,消除半衰期约为36.5 h,认为该化合物是一种长半衰期毒物,而且测得DEHP在体内分布相速率常数α约为消除相速率常数β的20 倍,表明该化合物在体内具有分布过程较快、消除过程慢的特征。同其他成年哺乳动物比较,DEHP在青春期小鼠体内的消除半衰期较长,其原因有待进一步研究 [22-25]。
肥胖及其相关的代谢性疾病已经成为人类健康的主要杀手。由于DEHP是一种脂溶性物质,更容易囤积在脂肪细胞内,因此,肥胖者体内更容易发生DEHP蓄积,也更容易受到其类雌激素作用的影响。开展DEHP在青春期肥胖模型小鼠体内的代谢动力学过程研究具有深远意义。
本实验测定方法采用血清样品直接稀释过柱,简便易行,所获得的模型线性关系、回收率和精密度较好。DEHP在青春期小鼠体内代谢动力学过程符合一级吸收二室开放模型,分布半衰期约为1.9 h,消除半衰期约为36.5 h,DEHP在青春期小鼠体内的代谢符合分布快、消除慢的特征。
参考文献:
[1] GEVAO B, AL-GHADBAN A, BAHLOUL M, et al. Phthalates in indoor dust in Kuwait: implications for non-dietary human exposure[J]. Indoor Air, 2013, 23(2): 126-133.
[2] ZHANG Rongfei, WANG Weili, SHI Xiaorong, et al. Health risk of semi-volatile organic pollutants in Wujin river inflow into Taihu Lake[J]. Ecotoxicology, 2011, 20(5): 1083-1089.
[3] 赵宇翔, 黄玉翠. ASE萃 取-气相色谱/质谱法测定化妆品包装材料中增塑剂的含量[J]. 香料香精化妆品, 2013(3): 47-49.
[4] 林铌, 靳洪涛, 王爱平. 医疗器械中增塑剂的应用和安全性研究进展[J]. 中国药物警戒, 2014, 11(2): 100-103.
[5] 高松, 王志伟, 胡长鹰, 等. 纸包装油墨中增塑剂向奶粉的迁移 [J].食品科学, 2014, 35(1): 18-22.
[6] BUSER M C, MURRAY H E, SCINICARIELLO F. Age and sex differences in childhood and adulthood obesity association with phthalates: analyses of NHANES 2007-2010[J]. International Journal of Hygiene and Environmental Health, 2014, 217(6): 687-694.
[7] SUI Haixia, ZHANG Lei, WU Pinggu, et al. Concentration of di (2-ethylhexyl) phthalate (DEHP) in foods and its dietary exposure in China[J]. International Journal of Hygiene and Environmental Health, 2014, 217(6): 695-701.
[8] WU Chiafang, CHANG-CHIEN Guoping, SU Shengwen, et al. Findings of 2731 suspected phthalate-tainted foodstuffs during the 2011 phthalates incident in Taiwan[J]. Journal of the Formosan Medical Association, 2014, 113(9): 600-605.
[9] 杨春英, 刘学铭, 徐玉娟. 果汁饮料中邻苯二甲酸二(2-乙基己基)酯的测定及其来源分析[J]. 食品科学, 2013, 34(10): 259-262.
[10] 蔡晶, 柴丽月, 胡秋辉. 食品中邻苯二甲酸酯的检测及安全评价[J].食品科学, 2005, 26(12): 242-245.
[11]TEIL M J,TLILI K,BLANCHARD M,et al.Polychlorinated biphenyls,polybrominated diphenyl ethers,and phthalates in roach from the Seine River basin(France):impact of densely urbanized areas[J].Archives of Environmental Contamination and Toxicology,2014,66(1):41-57.
[12] 时国庆, 李栋, 卢晓坤, 等. 环境内分泌干扰物质的健康 影响与作用机制[J]. 环境化学, 2011, 30(1): 211-223.
[13] 赵力军, 沈晟, 王静, 等. 邻苯二甲酸二辛酯对大鼠卵巢颗粒细胞分泌功能的影响[J]. 中国工业医学杂志, 2012, 25(4): 278-280.
[14] EVEILLARD A, LASSERRE F, de TAYRAC M, et al. Identifi cation of potential mechanisms of toxic ity after di-(2-ethylhexyl)-phthalate (DEHP) adult exposure in the liver using a systems biology approach[J]. Toxicology and Applied Pharmacology, 2009, 236(3): 282-292.
[15] 陈文婕, 戴红, 陈敏, 等. 邻苯二甲酸二乙基己酯(DEHP)对小白鼠肝脏毒性及脂质过氧化损伤[J]. 生态毒理学报, 2012, 7(1): 93-98.
[16] 方鑫, 李海玲, 胡月玲, 等. 邻 苯二甲酸二(2-乙基己基)酯对小鼠肾脏损害及氧化应激机制的研究[J]. 中国预防医学杂志, 2014, 15(1): 8-12.
[17] 肖延风. 内分泌干扰物对儿童青春期发育的影响[J]. 中国儿童保健杂志, 2013, 21(3): 230-231.
[18] 王红, 郝加虎, 陶芳标. 环境内分泌干扰物与青春发动时相提前[J].实用儿科临床杂志, 2009, 24(20): 1604-1606.
[19] 林兴桃, 王小逸, 吕文涛, 等. 邻苯二甲酸酯代谢研究进展[J]. 环境与健康杂志, 2009, 26(2): 182-184.
[20] KOCH H M, BOLT H M, PREUSS R, et al. New metabolites of di (2-ethylhexyl) phthalate (DEHP) in human urine and serum after single oral doses of deuterium-labelled DEHP[J]. Archives of Toxicology, 2005, 79(7): 367-37 6.
[21] 陈琳, 钱青, 张喆, 等. 医疗途径中增塑剂DEHP的溶出及其安全性研究概况[J]. 中国药房, 2011, 22(33): 3073-3075.
[22] LJUNGVALL K, TIENPONT B, DAVID F, et al. Kinetics of orally administered di (2-ethylhexyl) phthalate and its metabolite, mono (2-ethylhexyl) phthalate, in male pigs[J]. Archives of Toxicology, 2004, 78(7): 384-389.
[23] SJÖBERG P, BONDESSON U, SEDIN G, et al. Dispositions of diand mono-(2-ethylhexyl) phthalate in newborn infants subjected to exchange transfusions[J]. European Journal of Clinical Investigation, 1985, 15(6): 430-436.
[24] KLUWE W M. Overview of phthalate ester pharmacokinetics in mammalian species[J]. Environmental Health Perspectives, 1982, 45: 3-9.
[25] 孙俊红, 张克荣, 吴德生. 邻苯二甲酸酯在兔体内的毒代动力学[J].环境与健康杂志, 2004, 21(4): 213-214.
Pharmacokinetics of Di-(2-ethylhexyl)phthalate in Pubertal Mice
ZHANG Dan,YE Kui,WANG Jiajia,XU Hai,SONG Xingxing,JIN Zhongxiu,SHENG Jie,LI Li,LIU Kaiyong
*
(School of Public Health,Anhui Medical University,Hefei230601,China)
Abstract:A pharmacokinetic study of di-(2-ethylhexyl)phthalate(DEHP)was carried out in pubertal mice.The serum of pubertal mice was collected after oral administration of DEHP at a dose of300mg/kg,and DEHP was extracted from the serum samples and purified by solid phase extraction(SPE).The DEHP concentrations in serum at different time points were assayed by gas chromatography-mass spectrometry(GC-MS)and the pharmacokinetic parameters were calculated by3p97software.The major pharmacokin etic parameters of DEHP in pubertal mice were obtained as follows:ρ max(0.476±0.028)μg/mL,T peak(2.539±0.424)h,AUC (0-t)(32.209±11.220)h·μg/mL, t 1/2α(1.886±0.480)h,and t 1/2β(36.473±8.324)h.The method presented is sensitive,accurate and fast,and can meet the requirements for the pharmacokinetic study of DEHP in pubertal mice.The pharmacokinetics of DEHP in pubertal mice was found to be fitted to a two-compartment open model with first order absorption and DEHP reveals the quick distribution and slow elimination.
Key words:pharmacokinetics;gas chromatography-mass spectrometry;solid-phase extraction;di-(2-ethylhexyl)phthalate(DEHP)
中图分类号:R155.5
文献标志码:A
文章编号:1002-6630(2015)05-0185-04
doi:10.7506/spkx1002-6630-201505035
收稿日期:2014-05-04
基金项目:安徽省高校省级自然科学研究项目(KJ2012Z168);安徽医科大学中青年学术骨干资助基金项目(2012051);安徽医科大学博士科研基金项目(XJ201112)
作者简介:张丹(1989—),男,硕士研究生,研究方向为食品卫生学。E-mail:zhangdan2148@163.com
*通信作者:刘开永(1978—),男,副教授,博士,研究方向为食品卫生学。E-mail:liukaiyong163@163.com