 ±s表示。
±s表示。
杭兴伟 1,增田泰伸 2,木村守 2,臼田美香 2,王 唯 2,陈 洁 1,张晓安 1,奚印慈 1,*
(1.上海海洋大学食品学院,上海201306;2.日本丘比株式会社,东京1500002)
摘要:目的:探讨硫酸氨基葡萄糖(glucosamine sulfate,GS)对口服透明质酸(hyaluronic acid,HA)缓解小鼠佐剂性关节炎的增效作用。方法:将50只8周龄ICR雄性小鼠随机分成5组:正常组、模型组、HA组、GS组和HA+GS组。除正常组以外,其余4组小鼠左后足注射弗氏完全佐剂(freund’s complete adjuvant,FCA)建立佐剂性关节炎模型,然后进行4周的HA和GS口服给药,并分别对小鼠体质量、足跖肿胀度进行测定,同时采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测小鼠血清中白细胞介素-1(interleukin-1,IL-1)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量。结果:口服HA和GS都能够减轻小鼠的足跖肿胀度,而同时口服HA和GS能起到更好的消肿效果,血清中IL-1及TNF-α的含量也显著降低。结论:给予小鼠口服HA+GS,比单独服用HA、GS能更有效、更快地缓解小鼠的足跖肿胀症状,同时能够降低血清中IL-1及TNF-α含量,进而对小鼠佐剂性关节炎起到更好的治愈效果。
关键词:口服透明质酸;口服硫酸氨基葡萄糖;佐剂性关节炎
关节炎是一种由于关节磨损退化而引起的慢性关节疾病,随着年龄的增长,其发病率会逐渐上升。关节炎患者通常会有关节组织水肿、关节僵硬、活动受限等症状,他们的日常生活也因此受到了困扰。根据相关研究报道,关节炎的病因主要与关节内透明质酸(hyaluronic acid,HA)的降解有关,因此HA在关节炎病理机制中的作用受到了广泛关注 [1]。
透明质酸是存在于人体关节软骨和滑液中的一种多糖成分,主要由关节软骨细胞和滑膜细胞分泌,在人体关节内有一定的生理功能,有利于缓解关节炎症状 [1]:1)关节液内的HA具有黏弹性,能够保护软骨组织不受损,并对伤害性感受器的膜起到稳定作用,减少疼痛感;2)HA在软骨内能够形成一道屏障,抵挡炎性介质侵入,防止组织受到破坏;3)滑膜内HA含量的升高能对炎性细胞起到抑制作用,减轻滑膜炎症。国内已有实验报道:口服透明质酸能够降低关节炎指数,并通过促进体内HA含量的升高,有效地缓解了关节炎症状 [2]。目前,透明质酸已经被国家卫生部认定作为新资源食品的一种。
硫酸氨基葡萄糖(glucosamine sulfate,GS)作为一种天然活性物质,主要存在于人体的结缔组织和软骨基质中,是滑液中聚氨基葡萄糖的主要成分,在关节内能够发挥一定的生理功能,主要是刺激关节软骨的蛋白聚糖合成及抑制其分解 [3]。如今,硫酸氨基葡萄糖在医药及保健品领域得到了广泛的应用,相关专家已认可并将其列为具有保健功能的健康食品之一;硫酸氨基葡萄糖于2000年被卫生部门批准为保健食品 [4]。
国内已有许多临床实验研究报道 [5],口服硫酸氨基葡萄糖联合关节内注射透明质酸能够起到抑制关节炎恶化的效果,但由于关节内注射HA在实际操作中不方便,长期注射可能会给患者的关节造成一些负面影响,从而使患者产生畏惧感。因此,本研究以透明质酸和硫酸氨基葡萄糖为材料,通过建立小鼠佐剂性关节炎模型,探究在透明质酸中加入硫酸氨基葡萄糖后,联合口服二者对佐剂性关节炎症状的缓解效果,并试图为患者确立一种安全、便利、有效的联合用药新途径。
1.1 动物、材料与试剂
ICR雄性小鼠50只,8周龄,体质量约30g,上海西普尔-必凯实验动物有限公司提供;清洁级颗粒鼠粮、清洁级垫料江苏协同医药生物工程有限公司。
透明质酸(相对分子质量约为1.0×10 6,纯度≥95%)日本丘比株式会社;硫酸氨基葡萄糖胶囊(维固力)罗达药厂。
弗氏完全佐剂(freund’s complete adjuvant,FCA) 美国Chondrex公司;乙醇、氯化钠国药集团化学试剂有限公司;小鼠白细胞介素-1(interleukin-1,IL-1)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒、小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒上海抚生实业有限公司。
1.2 仪器与设备
YP5002电子天平上海佑科有限公司;CT14RD台式高速冷冻离心机上海天美仪器有限公司;游标卡尺 杭州瑞腾精测食品有限公司;550型酶标仪美国Bio-Rad公司。
1.3 方法
1.3.1 动物分组与关节炎模型建立
ICR雄性小鼠50只分为5组,每组10只:正常组、模型组、HA组、GS组和HA+GS组。在恒温条件下适应性饲养一周,自由饮食、饮水。
将弗氏完全佐剂(FCA)和蒸馏水以1∶1(V/V)均匀混合后充分乳化,用1mL注射器吸取乳化好的FCA,然后分别对模型组、HA组、GS组以及HA+GS组小鼠左后足跖注射0.1mL FCA进行关节炎造模,同时对正常组小鼠左后足跖注射等剂量的生理盐水。
1.3.2 透明质酸与硫酸氨基葡萄糖的制备
透明质酸(HA)的制备:将粉末状的HA和蒸馏水混合,配制成质量浓度为12mg/mL液体状的HA,并通过磁力搅拌器将其制备成性状均匀的HA溶液,每天配制一次,现配现用。
硫酸氨基葡萄糖(GS)的制备:将粉末状的GS和蒸馏水混合,配制成质量浓度为6mg/mL液体状的GS,并通过磁力搅拌器将其制备成性状均匀的GS溶液,每天配制一次,现配现用。
透明质酸和硫酸氨基葡萄糖混合液(HA+GS)的制备:将粉末状的HA和GS与蒸馏水混合,配制成每毫升含有12mg HA和6mg GS的混合液,并通过磁力搅拌器将其制备成性状均匀的HA+GS混合溶液,每天配制一次,现配现用。
1.3.3 小鼠口服给药处理
正常组:其余组小鼠造模后第2天,口服给予每只小鼠0.5mL生理盐水,每天一次,连续4周。模型组:注射FCA后第2天,口服给予每只小鼠0.5mL生理盐水,每天一次,持续4周。HA组:注射FCA后第2天,口服给予每只小鼠0.5mL HA,每天一次,持续4周。GS组:注射FCA后第2天,口服给予每只小鼠0.5mL GS,每天一次,持续4周。HA+GS组:注射FCA后第2天,口服给予每只小鼠0.5mL HA+GS混合液,每天一次,持续4周。
1.3.4 小鼠体质量测定
在适应性饲养期间,每天称取小鼠体质量,并做记录。在适应性饲养的最后一天,根据小鼠的体质量,将其分为体质量相近的5组进行关节炎实验。在实验期间,每天一次称体质量,记录各组小鼠体质量的变化情况。
1.3.5 小鼠足跖肿胀度的测定
小鼠足坧肿胀度的测量:实验开始前(即适应性饲养的最后一天,计为第0天),在每只小鼠左、右足跖同一处做好标记,在标记处用游标卡尺对足跖厚度和宽度进行测量,并将测得的厚度和宽度相乘,即得到初始足跖肿胀度。每隔10d(第10、20、30天时)测量一次足跖肿胀度,并将第10、20、30天时测得的肿胀度数值与初始足跖肿胀度相减,即得到足跖肿胀度变化值。
图像采集:在第30天,利用数码相机对各组小鼠注射足的足跖部位进行拍摄,并进行组别间对比。
1.3.6 血清中免疫学指标的含量测定
5组小鼠按照1.3.3节方法口服给药4周后,从小鼠背部大动脉及心脏中取血置于无菌EP管中,5000r/min离心15min,取上清液,按照IL-1及TNF-αELISA试剂盒说明书用酶标仪进行检测(如果暂时不检测,可将上清液移至另一无菌EP管中,-20 ℃保存待测)。
1.4 统计学分析
所有数据都采用SPSS20.0软件处理,通过Tukey’s test进行显著性差异分析,结果均以
 ±s表示。
±s表示。
2.1 口服HA和GS对佐剂性关节炎小鼠的一般影响
模型组、HA组、GS组和HA+GS组小鼠在注射FCA后,左足跖都出现红肿现象,与正常组小鼠相比,行动变得迟缓,饮食略微减少,体质量增长也开始减缓。其中,模型组小鼠的左足跖肿胀现象不断恶化,而HA组、GS组和HA+GS组小鼠在经过一段时间的口服给药之后,左足跖及脚踝的肿胀情况得到了不同程度的缓解,饮食、体质量等各项指标都得到了有效改善。
2.2 口服HA和GS对佐剂性关节炎小鼠体质量变化的影响
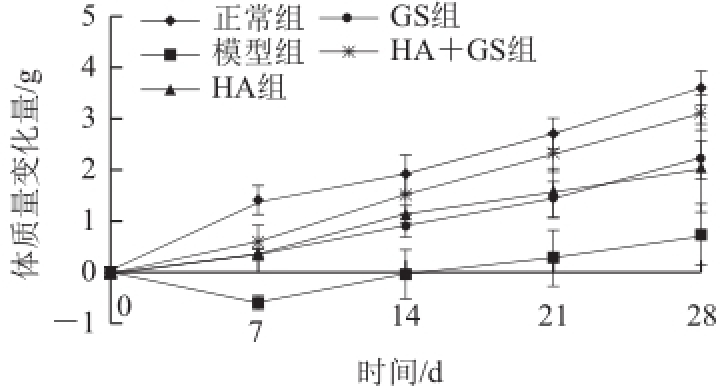
图1 口服HA和GS对佐剂性关节炎小鼠体质量的影响
Fig.1Effect of HA and GS on body weight in mice with adjuvant arthritis
如图1所示,各组小鼠经过一周的适应性饲养后,基本都保持在同一生长状态,因此各组小鼠的初始体质量变化为0,之后建立模型并对各组小鼠口服给药,此时计为第0天,观察给药28d内各组小鼠体质量的变化情况。在0~7d内,模型组小鼠体质量差值出现负增长,并且与HA组、GS组、HA+GS组存在显著差异(P<0.05),这可能是由于关节炎给小鼠带来疼痛感,从而极大地影响了它们的生长状态,导致体质量有略微下降;而正常组、HA组、GS组和HA+GS组小鼠体质量差值都呈现增长趋势,其中HA、GS和HA+GS组小鼠虽然患有关节炎症,但体质量并未下降,这可能是由于这3组小鼠经过药物治疗后,炎症得到了一定缓解的作用,从而使体质量呈现缓慢的增长趋势,但增长的速率略低于正常组。
在7~28d内,HA组、GS组和HA+GS组小鼠体质量始终保持着持续增长状态,而HA+GS组小鼠体质量的增长速率略高于HA组和GS组,但并未出现显著性差异(P>0.05)。在14~28d内,模型组小鼠体质量也呈现增长趋势,并且与HA组、GS组不存在显著差异(P>0.05)。从食用饲料的情况来看,模型组、HA组、GS组和HA+GS组小鼠的食用量相近(模型组914.97g、HA组993.96g、GS组988.47g、HA+GS组980.6g)。而在7~28d内,各组小鼠体质量都有明显的增长趋势,这在一定程度上可以说明饲料的食用情况并未对小鼠的生长状态产生较大影响,在给药期间的大部分时间内,各组小鼠体质量都保持着增长的状态。
2.3 口服HA和GS对佐剂性关节炎小鼠足跖肿胀度的影响

图2口服给药28d后各组佐剂性关节炎小鼠左足跖的肿胀情况
Fig.2Swelling status of the left paw mice with adjuvant arthritis after oral administration for28days
如图2所示,通过图像采集结果发现,模型组小鼠左足跖肿胀情况最为显著。与模型组相比,HA组、GS组和HA+GS组则有不同程度的消肿迹象;与HA组和GS组比较,在HA中加入GS后(HA+GS组)给予小鼠口服的效果更为明显。
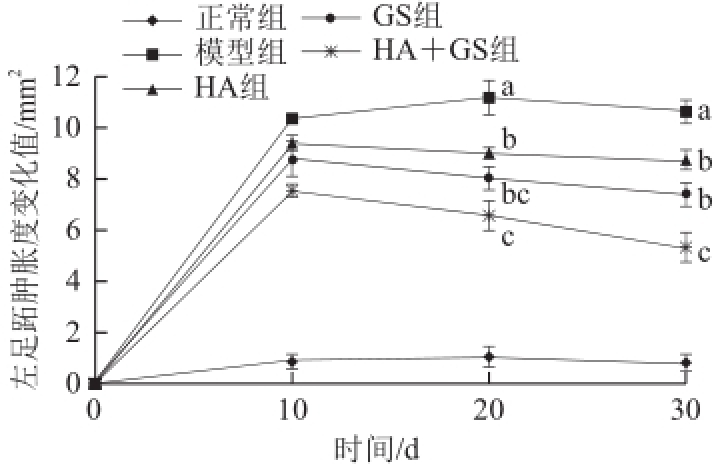
图3口服HA和GS对佐剂性关节炎小鼠左足跖肿胀度的影响
Fig.3Effect of HA and GS on the swelling degree of the left paw in mice with adjuvant arthritis
小写字母不同表示相同时间点组间相比差异显著(P<0.05)。图4同。
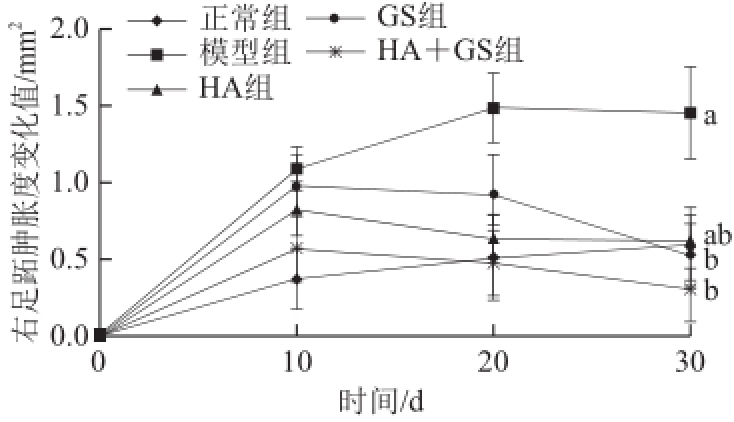
图4口服HA和GS对佐剂性关节炎小鼠右足跖肿胀度的影响
Fig.4Effect of HA and GS on the swelling degree of the right paw in mice with adjuvant arthritis
如图3所示,将适应性饲养的最后一天计为第0天,在第10天,模型组、HA组、GS和HA+GS组小鼠的左足跖都出现明显的肿胀现象,其中模型组最为显著,左足跖肿胀度变化值显著高于HA组、GS组和HA+GS组(P<0.05),这表明小鼠在注射了FCA后,其左足跖产生了炎症反应。如图4所示,模型组小鼠右足跖的肿胀度也有一定程度的增长,但增长趋势较为缓慢,到第30天时,模型组与HA组、GS组和HA+GS组间相比表现出一定的差异,但与左足跖相比,肿胀度的变化并不明显。在注射FCA后的第20天,模型组小鼠的左足跖肿胀度变化值达到峰值,而HA组、GS组和HA+GS组小鼠左足跖肿胀度则呈现不同程度的下降趋势,其中HA+GS组小鼠左足跖的肿胀度变化值低于HA组和GS组,且与HA组比较,存在显著差异(P<0.05)。而HA组、GS组和HA+GS组与模型组之间也都存在显著差异(P<0.05)。到第30天,模型组小鼠左足跖出现略微的消肿现象,而HA组、GS组和HA+GS组的左足跖肿胀度变化值则继续减小,其中HA+GS组最为明显,肿胀度变化值远低于HA组和GS组,且存在显著性差异(P<0.05)。
在HA中加入GS后,给予小鼠口服4周内,HA+GS组小鼠左足跖肿胀度变化值始终低于HA组和GS组,且肿胀度的减小速率大于这两组,并在第20天时就表现出显著差异(P<0.05)。而HA组和GS组小鼠左足跖肿胀度变化值的减小速率相近,且二者之间不存在显著差异(P>0.05)。2.4口服HA和GS对佐剂性关节炎小鼠血清中IL-1含量的影响连续口服给药4周后,对各组小鼠血清中IL-1的含量进行检测,观察各组之间的差异。如图5所示,模型组小鼠血清中IL-1的含量与正常组相比显著升高,HA组、

图5口服HA和GS对佐剂性关节炎小鼠血清中IL-1含量的影响
Fig.5Effect of oral administration of HA and/or GS by on serum IL-1level in mice with adjuvant arthritis
小写字母不同表示组间相比差异显著(P<0.05)。
GS组和HA+GS组小鼠在口服HA和GS后,血清中IL-1
的含量都明显降低,且与模型组相比,都存在显著差异(P<0.05)。其中HA+GS组表现更为明显,与HA组比较,存在显著差异(P<0.05)。以正常组为基准,计算其余4组IL-1含量的增长率:模型组为156.23%、HA组为
57.79 %、GS组为53.00%、HA+GS组为27.51%。
2.5 口服HA和GS对佐剂性关节炎小鼠血清中TNF-α含
量的影响

图6口服HA和GS对佐剂性关节炎小鼠血清中TNF-TNF-α含量的影响
Fig.6Effect of oral administration of HA and/or GS by on serum TNF-αlevel in mice with adjuvant arthritis
经过4周的口服给药后,检测各组小鼠血清中TNF-α的含量,比较各组之间的差异。如图6所示,模型组小鼠血清中TNF-α的含量与正常组相比显著升高,HA、GS和HA+GS组小鼠在口服HA和GS后,血清中TNF-α的含量都明显降低,且与模型组相比都存在显著差异(P<0.05)。其中HA+GS组最为显著,与其余3组之间存在显著差异(P<0.05)。
透明质酸是构成人体内关节软骨和滑液的主要成分,是由葡糖醛酸和乙酰氨基葡糖构成的双糖单位连接而成的高分子黏性多糖。它在人体关节内能起到保护软骨以及合成滑膜内HA的作用 [6]。而硫酸氨基葡萄糖是存在于机体内关节软骨中的氨基单糖。据报道,GS所产生的无机硫酸基团可以控制多聚氨基葡萄糖和蛋白多糖的合成,从而保护和修复受损的软骨基质和软骨细胞 [7];另外,补充外源性的硫酸氨基葡萄糖还可以调节胶原酶和磷脂酶A2的活性,减少损伤软骨细胞的内毒性因子释放,对软骨内多聚氨基葡萄糖的代谢起到促进和平衡的作用。
在关节炎发病机理过程中,IL-1被认为是最核心的炎症因子,它的表达程度与关节炎的严重程度呈正相关。IL-1可通过不同途径引起关节软骨退变、破坏及降解:1)IL-1对基质金属蛋白酶(matrix metalloproteinases,MMPs)的异常调控是导致软骨破坏的主要途径之一,MMPs对软骨中的Ⅱ型胶原蛋白和蛋白聚糖都具有高度的裂解活性,能够降解软骨外基质,进而破坏软骨组织 [8];2)在滑膜细胞中,IL-1的表达增加,对滑膜炎症起着促进作用,进一步增加了炎症因子以及MMPs的产生,从而破坏软骨组织,加速关节炎的发展;3)刺激TNF-α、一氧化氮等炎症因子的高度表达,加剧软骨细胞的凋亡,并且IL-1与TNF-α之间有着协同作用,共同促进软骨细胞分泌纤维蛋白溶酶原激活剂,使纤维蛋白溶酶原转换成纤维蛋白溶酶而降解纤维蛋白,加速胶原的分解代谢,这些均可造成软骨的损伤 [9-11]。所以IL-1和TNF-α可作为评判关节炎病情的重要指标。已有实验研究证明 [12-15],关节炎患者血清中IL-1和TNF-α的含量明显高于健康人群。因此通过测定血清中IL-1和TNF-α的含量,可以初步判断关节炎的严重程度。而本实验也证实模型组小鼠血清中IL-1和TNF-α的含量远高于正常组。
经过口服外源性透明质酸后,HA会与小肠上皮细胞中HA接收器Toll样受体-4(toll-like receptor-4,TLR-4)结合,刺激细胞因子信号传导抑制因子3(suppressor of cytokine signaling3,SOCS3)的表达,通过SOCS3的引导,产生抑炎症因子IL-10,抑制IL-1的表达;IL-10作为重要的抗炎Th2型细胞因子,能够通过抑制核因子κB(nuclear factorκB,NF-κB)进而抑制TH1细胞产生TNF-α,控制其对软骨的破坏 [16-17]。另外,HA本身具有清除关节滑液内自由基的功能,调节关节内巨噬细胞吞噬作用及白细胞趋化性,从而抑制关节内的炎症反应,阻止关节软骨的退化 [18-21]。
硫酸氨基葡萄糖作为一种小分子化合物,口服之后,在小肠中被分解为氨基葡萄糖和硫酸根离子。硫酸根离子对软骨中蛋白多糖的合成能起到一定的作用;同时氨基葡萄糖能通过载体扩散进入软骨细胞,抑制与IL-1调控的相关酶,从而下调IL-1的表达;由于IL-1与TNF-α之间有着协同作用,IL-1的表达下降在一定程度上也导致TNF-α的表达降低,进而减缓炎症的恶化 [22]。而在软骨表面,GS还有阻断与IL-1表达相关的信号途径的作用,主要是抑制NF-κB的活性,同时促进非活性的IL-1受体,使之与IL-1相结合,阻断信号传导产生炎症效应 [22]。国外已有研究报道 [23],关节炎发生会导致软骨内蛋白多糖的含量减少。从理论上说,口服外源性GS能够刺激关节软骨内蛋白聚糖的合成,并且抑制某些破坏软骨的酶的产生,从而下调TNF-α的表达 [24]。但具体机制尚未发现,有待进一步研究论证。本实验结果表明,GS组小鼠血清中IL-1以及TNF-α的含量远低于模型组,且它们之间存在显著差异(P<0.05)。
在本实验中,小鼠作为研究对象,由于其个体过小,一部分关节测量的效果并不十分明显,但通过分析小鼠的各项指标发现,单独给予HA或GS都能对关节炎症状起到一定的缓解效果,但它们之间不存在显著性差异(P>0.05),这说明,单独口服HA或GS,对关节炎症状的缓解有着相似的效果。在HA中加入GS后给予小鼠口服,不仅使HA在小鼠小肠内产生免疫反应,下调炎性介质的表达,而且还保留了HA在关节内的生理功能,抑制炎症的进一步恶化;同时GS通过小肠分解,形成硫酸根离子和氨基葡萄糖,在软骨表面发挥不同的作用,硫酸根离子能促进蛋白多糖的合成,起到稳定软骨组织结构的作用。而氨基葡萄糖则协同HA抑制炎症因子的高度表达,对软骨进行有效保护,促进缓解炎症,有效地抑制了软骨退化。已有很多临床研究报道 [25-30],采用口服硫酸氨基葡萄糖联合关节腔内注射透明质酸对关节炎患者进行治疗,结果在各项评价指标中都得到了良好的效果,并且优于单独口服GS或关节腔内注射HA,同时两者联合治疗的疗效持久、治愈率高;但关节注射可能会给患者带来不必要的疼痛,使患者产生心理负担。因此在本次研究中,通过口服的方式,将GS添加到HA中,给予小鼠食用,结果对足跖肿胀度差值结果的分析发现:在口服HA和GS后的第20天,HA+GS组就与HA组有显著性差异,而到了第30天与HA组和GS组都存在差异(P<0.05)。以上结果表明:GS加快了HA缓解关节炎症状的作用,并增强了这种疗效的持久性。
给小鼠单独口服HA和GS,在一定程度上能够缓解其关节炎症状。而在HA中添加GS后给小鼠口服,不仅保留了HA抑制关节炎症的功能特性,同时还发挥了GS对软骨的保护作用,更有效地减轻了小鼠足跖肿胀度以及降低了相关炎症因子IL-1及TNF-α的含量,对关节炎起到了更为显著的治愈效果。
参考文献:
[1]杨小立,刘淼.透明质酸与骨关节炎的研究进展[J].中国疼痛医学杂志,2006,12(1):47-49.
[2]肖金鱼,王炳胜,王书杰.IL-1及TNF-α在关节炎大鼠模型血清中表达的实验研究[J].中国中医急症,2011,20(4):607-608.
[3]陈怡.硫酸氨基葡萄糖临床应用的研究进展[J].中国药业,2012,21(9):96-98.
[4]汤世钦,陈仲刚.氨基葡萄糖在保健食品和医药方面的应用[C]//中国化学会第三届甲壳素化学与应用研讨会,2001:42-43.
[5]时建卫.氨基葡萄糖口服联合透明质酸钠关节腔注射治疗膝骨性关节炎疗效观察[J].中国实用医刊,2012,39(7):28-30.
[6]梁克玉.关节内注射透明质酸治疗骨性关节炎近3年研究进展[J].中国骨伤,2010(12):962-964.
[7]吴文坚,曾炳芳.硫酸氨基葡萄糖治疗骨关节炎新进展[J].国外医学:骨科学分册,2005,26(1):22-24.
[8]刘宏潇,殷海波,王海南.白介素-1在骨关节炎发病机制中的研究进展[J].中国骨伤,2012,25(2):175-178.
[9]宋光,裘红梅.胶原性关节炎大鼠血清中TNF-α,IL-17及IL-10水平分析[J].大连医科大学学报,2012,34(5):492-494.
[10]陈万军,鲍同柱.白介素-1家族与骨性关节炎研究进展[J].重庆医学,2011,40(31):3198-3200.
[11]窦晓丽,段晓琴,夏玲,等.骨关节炎:关节软骨退变的相关研究与进展[J].中国组织工程研究与临床康复,2011,15(20):3763-3766.
[12]何昌谋.关节腔注射透明质酸钠对成人大骨节病患者血清NO、TNF-α和IL-1β含量的影响[J].陕西医学杂志,2011,40(10):1401-1402.
[13]张志刚,曹靖,陈德生,等.IL-1和TGF-β1在膝骨关节炎滑膜中的表达及意义[J].山东医药,2009,49(19):7-9.
[14]张其亮,戴世友,刘红云.玻璃酸钠对骨关节炎关节液中IL-1β、TNF-α和PGE-2含量的影响[J].中国医师杂志,2013,15(11):1564-1566.
[15]许永权,李康华,林建水,等.透明质酸钠对膝骨性关节炎患者关节滑液白介素-1β的影响及意义[J].实用医学杂志,2012,28(5):750-753.
[16]ASARI A,KANEMITSU T,KURIHARA H.Oral administration of high molecular weight hyaluronan(900kDa)controls immune system via Toll-like receptor4in the intestinal epithelium[J].Journal of Biological Chemistry,2010,285(32):24751-24758.
[17]HIRABARA S,KOJIMA T,TAKAHASHI N,et al.Hyaluronan inhibits TLR-4dependent cathepsin K and matrix metalloproteinase1expression in human fibroblasts[J].Biochemical and Biophysical Research Communications,2013,430(2):519-522.
[18]董军峰,郑之和.透明质酸治疗骨关节炎[J].中国临床医学,2006,13(3):483-484.
[19]陈洁,增田泰伸,臼田美香,等.口服透明质酸对小鼠佐剂性关节炎的作用[J].食品科学,2012,33(23):287-290.
[20]刘杰.口服透明质酸对实验性小鼠骨关节炎的作用及其药物动力学初步探讨[D].上海:第二军医大学,2010:1-62.
[21]岩噌,弘志,佐藤.ヒアルロン酸[ヒアべスト(J)]による变形性膝關節症に对する有効性の検討[J].新藥と臨床,2009,57(2):249-256.[22]王攀.两种氨基葡萄糖对兔膝骨性关节炎模型关节液中IL-1和TNF-α含量影响的实验研究[D].遵义:遵义医学院,2013:1-32.
[23]ENAS M,ABEER S.Efficacy of glucosamine sulfate in lowering serum level of interleukin-1βin symptomatic primary knee osteoarthritis:clinical and laboratory study[J].Alexandria Journal of Medicine,2014,50(2):159-163.
[24]NAITO K,WATARI T,FURUHATA A,et al.Evaluation of the effect of glucosamine on an experimental rat osteoarthritis model[J].Life Sciences,2010,86(13):538-543.
[25]冯利刚.透明质酸钠治疗膝骨性关节炎的临床效果及分析[J].中国医药指南,2011,9(16):24-25.
[26]黄其方,孔晖.透明质酸关节腔内注射治疗膝关节骨性关节炎的疗效及安全性[J].中国基层医药,2011,18(18):2530-2531.
[27]许百洁,李奕琏.硫酸氨基葡萄糖联合透明质酸钠治疗膝关节炎的疗效观察[J].中国医药指南,2010,8(22):42-43.
[28]原涛,张琼,章祖林.硫酸氨基葡萄糖联合膝关节腔内注射透明质酸钠治疗膝骨关节炎的研究[J].海峡药学,2013,25(1):110-111.
[29]吴旭辉.硫酸氨基葡萄糖与膝关节腔内注射透明质酸钠联合治疗膝骨关节炎的效果观察[J].临床研究,2013,51(22):37-39.
[30]李亚芹.透明质酸钠联合硫酸氨基葡萄糖治疗膝骨关节炎的疗效分析[J].中国医药指南,2011,9(15):260-261.
Synergism of Glucosamine Sulfate in Relieving Effect of Hyaluronic Acid by Oral Administration on Mice with Adjuvant Arthritis
HANG Xingwei
1,YASUNOBU Masuda
2,MAMORU Kimura
2,MIKA Usuda
2,WANG Wei
2,CHEN Jie
1,ZHANG Xiaoan
1,XI Yinci
1,*
(1.College of Food Science and Technology,Shanghai Ocean University,Shanghai201306,China;2.Japan Kewpie Corporation,Tokyo1500002,Japan)
Abstract:Aim:To explore the synergism of glucosamine sulfate(GS)with hyaluronic acid(HA)by oral administration in relieving adjuvant arthritis in mice with.Methods:Fifty8-week-old ICR male mice were randomly divided into5groups at random with an equal number of animals in each group:normal,model,HA,GS,and HA+GS groups.Except normal group,the animal models with adjuvant arthritis from4other groups were established by injecting0.1mL of Freund’s complete adjuvant(FCA)into the left rear paw,followed by oral administration of HA and/or GS for4weeks.The body weights and swelling degree of mouse rear feet were evaluated respectively.The serum concentration of IL-1and TNF-α in mice were detected by enzymelinked immunosorbent assay(ELISA).Results:Swelling degree of mouse feet could be inhibited by oral administration of HA or GS,and this inhibitory effect was more pronounced when both compounds were administrated.In addition,an obvious decrease in IL-1and TNF-αlevels in serum was observed.Conclusion:In addition to decreasing serum IL-1and TNF-αlevels,HA and GS could alleviate the swelling of mouse feet more effectively and rapidly when used in combination than when used individually,so that exerting a better curative effect on mouse arthritis.
Key words:oral administration of hyaluronic acid;oral administration of glucosamine sulfate;adjuvant arthritis
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2015)05-0189-06
doi:10.7506/spkx1002-6630-201505036
收稿日期:2014-07-01
基金项目:上海海洋大学-日本丘比株式会社合作研究基金项目
作者简介:杭兴伟(1989—),男,硕士研究生,研究方向为天然物质对关节炎的疗效。E-mail:Strongb@126.com
*通信作者:奚印慈(1957—),女,博士,研究方向为天然物质的生物活性。E-mail:ycxi@shou.edu.com