鸡枞菌多糖对急性酒精肝损伤小鼠超微病理结构及ADH2、ALDH2mRNA表达的影响
赵云霞
1,陶明煊
1,*,程光宇
2,邢佳
1,陆文娟
1
(1.南京师范大学金陵女子学院,江苏南京210097;2.南京师范大学生命科学学院,江苏南京210046)
摘要:目的:从小鼠肝脏超微病理结构及酒精代谢相关酶乙醇脱氢酶2(alcohol dehydrogenase2,ADH2)、乙醛脱氢酶2(aldehyde dehydrogenase2,ALDH2)的mRNA表达方面研究鸡枞菌多糖(refined polysaccharides from Termitomyces albuminosus,RPTA)对酒精所致小鼠急性肝损伤的保护作用。方法:小鼠被随机分为空白对照组、模型对照组、药物对照组(联苯双酯组,150mg/(kg·d))、RPTA各剂量组(100、200、400mg/(kg·d)),连续灌胃30d,空白对照组灌胃等量生理盐水。第31天,给予50%乙醇(12mL/kg)建立动物急性肝损伤模型。12h后处死,取小鼠肝脏分别观察肝组织超微结构变化,并采用荧光实时定量聚合酶链式反应(real time polymerase chain reaction,real time-PCR)法检测肝脏ADH2和ALDH2的mRNA表达。结果:超微结构观察结果表明,模型对照组小鼠肝脏细胞内可见大量脂滴,细胞核呈不规则形态,局部核膜凹陷严重,线粒体严重变形,线粒体嵴模糊,内质网严重肿胀,核糖体脱落;而RPTA小鼠肝细胞内上述病变有所改善,尤以高剂量组最佳。Real time-PCR结果表明,与空白对照组相比,模型对照组ADH2和ALDH2的mRNA表达量降低,而RPTA组随着剂量的增加ADH2和ALDH2mRNA的表达逐渐升高。结论:RPTA可以上调ADH2和ALDH2 mRNA的表达,具有改善小鼠酒精性肝损伤状况的作用。
关键词:鸡枞菌多糖;酒精性肝损伤;超微病理结构;乙醇脱氢酶2;乙醛脱氢酶2;mRNA
酒精性肝病(alcoholic liver disease,ALD)是由于饮酒过量引起的中毒性肝脏疾病,重度饮酒者中80%以上有一定程度的脂肪肝,其中10%~35%可发展为酒精性肝炎,而10%~20%将发展为肝硬化,尤其是近年来随着酒精消费的增加ALD的发病率呈逐年上升趋势
[1],ALD已经成为当今全世界范围内倍受关注的公共卫生问题。ALD的发病机制目前尚不明确,其发生可能与多种因素密切相关,酒精在体内代谢引起的氧化应激作用被认为是最主要的原因,氧化应激主要会引起肝细胞部分细胞器结构的改变,进而导致肝细胞功能紊乱
[2-5]。另有研究
[6-10]发现,乙醇在人体的代谢途径中,乙醇脱氢酶2(alcohol dehydrogenase2,ADH2)和乙醛脱氢酶2(aldehyde dehydrogenase2,ALDH2)是人体内清除乙醇的两种重要酶,ADH2促使乙醇氧化为乙醛,ALDH2则使得乙醛氧化为乙酸,若这两种酶的mRNA无法正常表达,将导致酒精代谢发生异常反应。因此,研究ADH2和ALDH2mRNA的表达对于进一步明确ALD的发病机理和开发药物预防治疗ALD有重要意义。
鸡枞菌(Termitomyces albuminosus),又叫伞把菇、鸡丝菇、白蚁菇等,属于担子菌纲,伞菌目,侧耳科,鸡枞菌属,其营养丰富,味道鲜美,为珍贵的药食两用菌。民间常用于疗痔止血,可治脾虚纳呆、消化不良等症
[11]。现代研究表明,鸡枞菌含有脑苷、皂苷、多糖、纤维素酶、多酚等多种活性成分
[12-15],具有醒脑、镇痛抗炎和抗氧化等生物活性
[11,16-18]。另有研究表明
[19],多糖类物质是鸡枞菌中主要的抗氧化活性成分。因此本研究以鸡枞菌为原材料,通过超声波辅助的水提醇沉方法提取鸡枞菌多糖,探讨鸡枞菌多糖对酒精所致小鼠急性肝损伤超微结构的影响及对酒精代谢相关酶ADH2、ALDH2的mRNA表达的干预作用,以期为进一步探究ALD发病机制、开发预防ALD的药物提供理论基础和实验依据。
1 材料与方法
1.1 材料与试剂
鸡枞菌子实体干品云南丽江市古城区喜玛拉雅贸易有限责任公司。
ICR雄性小鼠(6周龄左右),体质量(19.01± 0.82) g,动物实验在江苏省中医院动物饲养中心进行,动物饲养许可证号(SYXK(苏)2012-0047)。
Trizol试剂盒 美国Life Technologies公司;DEPC H
2O、AMV反转录酶、cDNA合成试剂盒 美国BBI公司;SY BRGreen试剂盒 美国ABI公司;联苯双酯滴丸 浙江医药有限公司新昌制药厂;氯仿、异丙醇、无水乙醇、丙酮等 南京荣世德有限公司。
1.2 仪器与设备
H-7650日立透射电镜日本日立公司;Leica EM UC7切片机德国莱卡公司;C2500-R-230V微型高速离心机美国BBI公司;PCR-3A1专用超净台新加坡ESCO公司;HH-δ数显恒温水浴锅金坛市杰瑞尔电器有限公司;Stepone plus型荧光定量PCR仪美国ABI公司。
1.3 方法
1.3.1 鸡枞菌多糖的制备
鸡枞菌子实体经去杂质,剪去含培养基的根部,于60℃低温烘干后粉碎,过60目筛。将细粉以1∶10(m/V)的料液比加入蒸馏水,于冰浴中100W超声10min,然后在80℃水浴中热水浸提2h,4500r/min离心15min,取上清,残渣以1∶5(m/V)的料液比加入蒸馏水于80℃中水浴提取2h,4500r/min离心15min,取上清,残渣以1∶3的比例加入蒸馏水,按照上述方法再重复提取一次,合并3次上清液,浓缩至20mL,加4倍体积的95%乙醇静置过夜。同上条件离心,弃上清液,沉淀于60℃低温干燥得鸡枞菌粗多糖(crude polysaccharides from Termitomyces albuminosus,CPTA),CPTA经Sevag法脱蛋白、透析、乙醇沉淀、低温干燥后得鸡枞菌精多糖(refined polysaccharides from Termitomyces albuminosus,RPTA),得率为3.46%,经蒽酮-硫酸法
[20]测定多糖含量约为75.02%,Bradford法
[21]间接测定蛋白质含量约为2.11%。
1.3.2 造模
小鼠适应性喂养3d,随机分为空白对照组、模型对照组、药物对照组(联苯双酯组,150mg/(kg·d))、RPTA各剂量组(100、200、400mg/(kg·d)),每组11只。RPTA溶于蒸馏水,每天灌胃1次,连续灌胃30d,实验期间供给全价颗粒饲料,不限制饮食饮水,空白对照组和模型对照组每天灌胃等体积生理盐水,实验至第31天,各组动物禁食不禁水12h后,模型对照组、药物对照组及RPTA各剂量组以12mL/kg剂量,灌以50%的乙醇溶液,建立动物急性肝损伤模型,空白对照组灌胃等体积生理盐水。去除死亡小鼠,在灌胃12h后取小鼠肝脏分别观察肝组织超微结构变化,并采用荧光实时定量聚合酶链式反应(real time polymerase chain reaction,real time-PCR)法检测ADH2和ALDH2mRNA的表达。
1.3.3 透射电镜样本的制备
小鼠处死后,于冰上取肝脏左叶中部,用双面刀片切成1mm
3大小,在4%戊二醛中固定24h后,取组织在室温下于0.1mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)配制的1g/100mL四氧化锇酸固定2h,0.1mol/L PBS缓冲液清洗数次,然后分别用体积分数30%、50%、70%、80%、90%丙酮各脱水一次,每次15min,接着用无水丙酮再脱水两次,每次10min,脱水之后分别用1∶1(V/V)的丙酮树脂混合液和1∶2(V/V)的丙酮树脂混合液浸透1h,最后用纯树脂浸透2h,浸透之后将样品放入包埋板中,立即加入包埋剂进行包埋,包埋之后将装有样品的包埋板依次放入30、45、60℃的聚合炉中聚合,聚合之后取出装有样品的包埋块,修块后进行半薄切片定位,用钻石刀切成超薄切片并附到铜网上,用醋酸铀和柠檬酸铅染色,透射电子显微镜进行观察和拍照。
1.3.4 Real time-PCR检测酒精代谢相关基因的表达
目的基因的引物设计如表1所示,由生工生物工程(上海)股份有限公司使用美国PE公司391型DNA自动合成仪合成引物。总RNA提取和检测按Trizol试剂盒说明书进行,紫外分光及琼脂糖电泳检测总RNA的纯度、浓度及完整性。然后按AMV反转录酶和cDNA合成试剂盒操作说明进行反转录,-20℃保存备用。最后采用Real time-PCR检测ADH2、ALDH2mRNA的表达,反应条件如下:95℃预变性120s;95℃,10s,60℃,40s,40个循环。反应结束后,每个标本设3个复孔,计算平均Ct值,每一次反应均设定阴性对照。采用2
-ΔΔCt计算各目的基因相对反应起始拷贝数,以GAPDH基因为内参。
表1 目的基因的引物设计
Table1Primers for the target genes enes

基因名称序列(5’→3’)GAPDH上游:GGTTGTCTCCTGCGACTTCA下游:TGGTCCAGGGTTTCTTACTCC ADH2上游:AACGGTGAGAAGTTCCCAAAA下游:ACGACCCCCAGCCTAATACA ALDH2上游:ATCCTCGGCTACATCAAATCG下游:GTCTTTTACGTCCCCGAACAC
1.4 数据分析
统计方法用DPS13.50统计软件进行统计学分析,结果以
 表示。
表示。
2 结果与分析
2.1 鸡枞菌多糖对急性酒精肝损伤小鼠肝脏超微结构的影响

图1 RPTA对急性酒精肝损伤小鼠肝脏超微结构的影响
Fig.1Effect of RPTA on liver ultrastructure in mice
A.空白对照组,B.模型对照组,C.药物对照组,D.RPTA高剂量组,E.RPTA中剂量组,F.RPTA低剂量组,图序下脚标1、2分别为细胞核和线粒体;c.嵴,e.内质网,l.脂滴,k.核膜,m.线粒体,n.核仁,r.核糖体。
如图1所示,电镜下观察空白对照组小鼠肝脏,其细胞形态规则,核膜完好无损,染色质平均分布在核内,核内可见3个核仁,线粒体形状规则,双层膜及嵴清晰,粗面内质网整齐排列,可见丰富的核糖体颗粒在其上分布,无核糖体脱落及脂质化现象。而造模后模型对照组小鼠肝脏细胞视野内可见大量脂滴,细胞核呈不规则形态,核膜凹陷,线粒体变形严重,粗面内质网肿胀,核糖体颗粒脱落。而RPTA各剂量组小鼠肝脏较模型对照组症状有改善,其中以RPTA高剂量组小鼠肝脏最佳,其细胞趋于规则,无脂质化出现,核膜完整,只有局部核膜呈不规则锯齿状,线粒体形状基本恢复,有轻微的内质网肿胀及核糖体脱落现象,可见线粒体嵴和双层膜,结构基本接近药物对照组水平;RPTA中剂量组小鼠肝脏细胞核呈不规则锯齿状,细胞质内可见少量不规则的线粒体存在,核膜凹凸不平,视野内未见脂滴的存在,线粒体形状基本趋于正常,其粗面内质网扩张现象较模型对照组明显改善,有少量的核糖体脱落;RPTA低剂量组小鼠肝脏细胞视野内还可见少量脂滴存在,局部核膜凹陷,呈不规则锯齿状,线粒体形状趋于正常化,线粒体嵴和其双层膜模糊,内质网扩张严重并见较多核糖体颗粒脱落,但较模型对照组已经有一定程度的改善。
2.2 RPTA对急性酒精肝损伤小鼠肝脏ADH2、ALDH2mRNA表达的影响
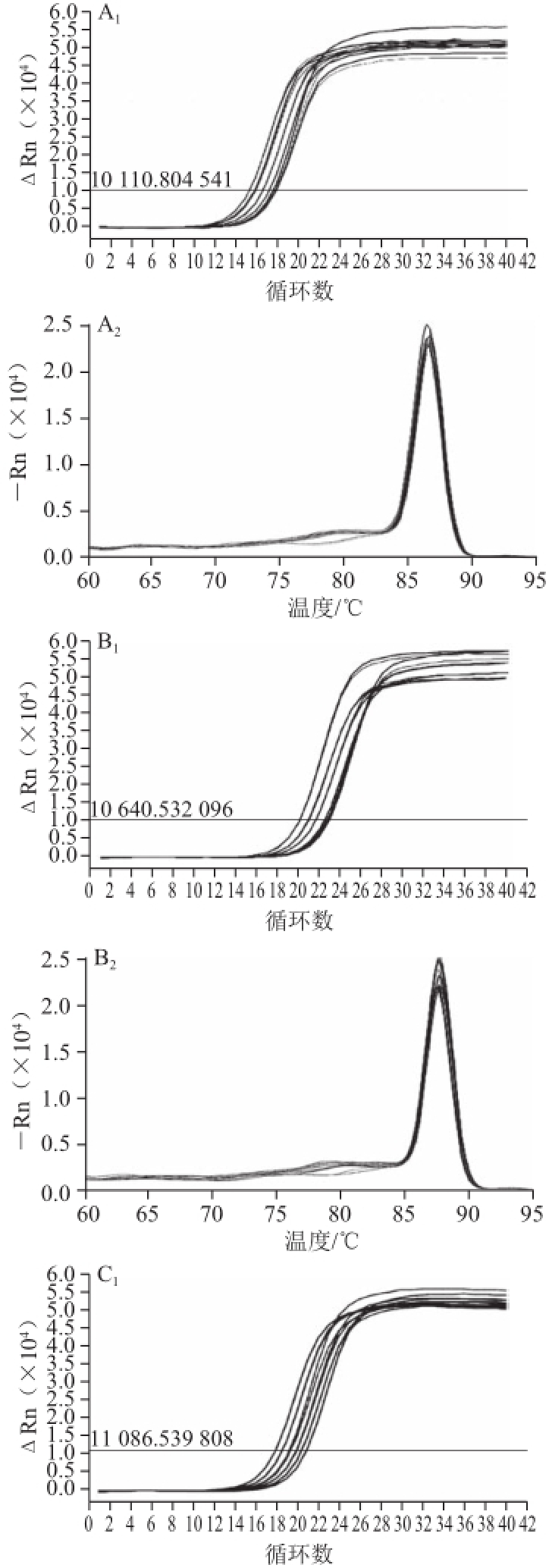
2.2.1Real time-PCR产物鉴定
由图2可知,各产物的熔解曲线为单峰,说明为单一片段扩增,熔解温度分别为GAPDH为86.79℃(图2A
2),ADH2为87.85℃(图2B
2),ALDH2为89.47℃(图2C
2)。

图2内参基因GAPDHGAPDH(A)和目的基因ADH2ADH2(B)、BALDH2ALDH2(C)的C PCR扩增曲线及溶解曲线
Fig.2Amplification curve and melting curve of reference(A),ADH2(B)and ALDH2(C)
2.2.2 ADH2和ALDH2mRNA表达量
表2RPTA对酒精所致急性肝损伤小鼠肝脏AADDHH22、AALLDDHH22mmR
 RNNAA表达的影响(x±s,n==33)
RNNAA表达的影响(x±s,n==33)
Table2Effect of RPTA on the mRNA expressionn of
 cee(x ±s,, nn ==33)
cee(x ±s,, nn ==33)

注:同列小写字母不同表示差异显著(P<0.05);同列大写字母不同表示差异显著(P<0.01)。
组别相对表达量ADH2mRNAALDH2mRNA空白对照组1.000±0.000
aA1.000±0.000
aA模型对照组0.141±0.001
fE0.162±0.001
eD药物对照组0.946±0.005
bB0.923±0.044
bARPTA高剂量组0.918±0.004
cB0.913±0.025
bARPTA中剂量组0.734±0.014
dC0.701±0.007
cBRPTA低剂量组0.539±0.022
eD0.429±0.018
dC
以空白对照组为参照标准,由表2可知,造模后模型对照组小鼠ADH2和ALDH2的mRNA表达量显著降低,RPTA剂量组小鼠肝脏的ADH2、ALDH2mRNA表达量较模型对照组增加,且随着剂量的增加而增加,其中RPTA高剂量组小鼠肝脏ADH2、ALDH2mRNA表达量与药物对照组无显著差异(P>0.01)。结果表明,RPTA能上调小鼠肝脏ADH2和ALDH2的mRNA表达量,从而改善急性酒精所导致的小鼠肝损伤情况。
3 讨论
细胞核是细胞的控制中心,在细胞代谢、生长、分化中起着重要作用,是遗传物质的主要存在部位
[22],酒精在一定程度上能改变细胞核的结构,影响了细胞核本身遗传信息的传递;线粒体是细胞质中活细胞进行生物氧化产生能量的重要细胞器,糖、蛋白质、脂肪等营养物质都是在线粒体内ATP的参与下生成的,且有研究表明线粒体电子传递链提供细胞生命活动所需将近80%的能量
[23],酒精可通过改变线粒体的结构影响线粒体的功能,抑制氧化磷酸化和三羧酸循环
[24]。大部分中、长链脂肪酸均是通过线粒体β-氧化进行代谢,由于乙醛干扰三羧酸循环的正常进行,从而影响脂肪酸的β-氧化,阻碍蓄积脂肪酸的清除,最终形成脂肪肝
[25];而粗面内质网是内质网的一种,其膜表面有大量核糖体,在蛋白质合成、加工及分泌过程中起着重要作用
[26],过量摄入酒精会导致内质网整体功能紊乱,从而使得脂蛋白合成受到抑制,但甘油三酯的合成正常,脂肪不能运输出去,引发脂肪堆积、沉积,出现脂滴
[26]。小鼠电镜超微结构显示:模型对照组视野内可见大量脂滴,小鼠肝细胞的细胞核变形,核膜不规则,线粒体变形严重,嵴模糊,粗面内质网肿胀严重,核糖体脱落,提示酒精已经导致肝细胞坏死,造模成功;而RPTA剂量组小鼠肝细胞中细胞核、线粒体及粗面内质网虽然有不同程度的损伤,但是与模型对照组相比,已经有很大程度的改善,尤其是RPTA高剂量组,视野内基本不见脂滴的存在,小鼠细胞核形状基本趋于正常,只有轻微的凹陷情况出现,线粒体嵴及双层膜清晰可见,粗面内质网只有轻微脱颗粒现象,与药物对照组基本相当。
肝脏是体内酒精代谢的主要器官,摄入体内的乙醇90%以上在肝脏代谢,ADH2和ALDH2则是肝脏清除乙醇的两种重要酶。研究
[10,27]表明,ADH2、ALDH2mRNA的异常表达会导致乙醇代谢紊乱,而乙醇及其代谢产物和代谢过程中产生的代谢混乱是导致酒精性肝损伤的重要原因,当酒精摄入过量时,体内代谢系统发生紊乱,导致酒精代谢异常,生成的乙醛无法完全被细胞防御体系所清除,残留的乙醛会破坏核膜的完整性、断裂粗面内质网、抑制线粒体呼吸链的电子传递,造成核膜凹陷、核糖体脱颗粒及线粒体能量生成障碍,进而影响细胞核、线粒体及粗面内质网形态的改变。在本研究中Real time-PCR检测ADH2和ALDH的mRNA表达,结果表明:造模后模型对照组ADH2、ALDH2mRNA表达量较空白对照组降低,提示造模成功;而RPTA各剂量组小鼠肝脏的ADH2和ALDH2mRNA表达量随着剂量的增加而逐渐升高,其中高剂量组小鼠肝脏ADH2mRNA表达量与药物对照组无显著差异(P>0.01),而其ALDH2mRNA表达量已经达到药物对照组水平,且无显著性差异。提示RPTA可通过上调ADH2、ALDH2的mRNA表达,有效改善小鼠急性酒精肝损伤。
参考文献:
[1]吴黎艳,陈芝芸,严茂祥,等.三七对酒精性肝病大鼠肝组织CYP2E1表达的影响[J].中华中医药杂志,2011,26(6):1395-1397.
[2]GARMEN A,WOO M D.Long-term management of alcoholic liver disease[J].Clinics in Liver Disease,2012,16(4):763-781.
[3]ARTEEL G E.Oxidants and antioxidants in alcohol induced liver disease[J].Gastroenterology,2003,124(3):778-790.
[4]WU Defeng,CEDERBAUM A I.Oxidative stress and alcoholic liver disease[J].Seminars in Liver Disease,2009,29(2):141-154.
[5]黄泽伟,程江风,吴科锋.酒精性肝病的研究现状[J].广东医学院报,2011,29(1):87-90.
[6]ELIZABETH B W,LAURA W S,MAX S C,et al.Rodent models of alcoholic liver disease:of mice and men[J].Alcohol,2012,46(8):715-725.
[7]RAJESH K S,VIDHU A S,APARNA M,et al.Differential expression of the mango alcohol dehydrogenase gene family during ripening[J].Phytochemistry,2010,71(13):1485-1494.
[8]LI Tingkai,YIN Shihjiun,CRABB D W,et al.Genetic and environmental influence on alcohol metabolism in human[J].Alcoholism Clinical and Experimental Research,2001,25(1):136-144.
[9]MA Heng,YU Lu,BYRA E A,et al.Aldehyde dehydrogenase2knockout accentuates ethanol-induced cardiac depression:role of protein phosphatases[J].Journal of Molecular and Cellular Cardiology,2010,49(2):322-329.
[10]CHAO Youchen,YOUNG Tongho,TANG Hungshang,et al.Alcoholism and alcoholic organ damage and genetic polymorphisms of alcohol metabolizing enzymes in Chinese patients[J].Hepatology,1997,25(1):112-119.
[11]陆奕宇,敖宗华,成成,等.鸡枞菌粉提取物镇痛抗炎作用的研究[J].中成药,2007,29(12):1742-1745.
[12]周继平,许泓瑜.鸡枞发酵菌粉中皂苷的大孔树脂分离纯化[J].中国野生植物资源,2008,27(6):50-53.
[13]聂晓东,许泓瑜,陆震鸣,等.鸡枞菌菌丝体皂甙含量测定方法的研究[J].食品与生物技术学报,2010,29(2):289-291.
[14]QI Jianhua,MAKOTO O,YOUJI S.Termitomyces phins A-D,novel neuritogenic cerebrosides from the edible Chinese mushroom Termitomyces albuminosus[J].Tetrahedron,2000,31(45):5835-5841.[15]QI Jianhua,MAKOTO O,YOUJI S.Neuritogenic cerebrosides from an edible Chinese mushroom.Part2:structures of two additional termitomyces phins and activity enhancement of an inactive cerebroside by hydroxy lation[J].Bioorganic and Medicinal Chemistry,2001,9(8):2171-2177.
[16]TSAI Shuyao,WENG Chienching,HUANG Shihjeng,et al.Nonvolatile taste components of Grifola frondosa,Morchella esculenta and Termitomyces albuminosus mycelia[J].Food Science and Technology,2006,39:1066-1071.
[17]LU Yiyu,AO Zonghua,LU Zhenming,et al.Analgesic and antiinflammatory effects of the dry matter of culture broth of Termitomyces albuminosus and its extracts[J].Journal of Ethnopharmacology,2008,120(3):432-436.
[18]MAU Jengleun,CHANG Chiehno,HUANG Shihjeng,et al.Antioxidant properties of methanolic extracts from Grifola frondosa,Morchella esculenta and Termitomyces albuminosus mycelia[J].Food Chemistry,2004,87:111-118.
[19]周继平,许泓瑜.鸡枞菌粉不同组分的体外抗氧化活性研究[J].中国野生植物资源,2008,27(5):46-49.
[20]郭晓蕾,朱思潮,翟旭峰,等.硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J].中华中医药学刊,2010,28(9):2000-2002.
[21]谢宁昌.生物化学实验多媒体教程[M].上海:华东理工大学出版社,2001:41-45.
[22]朱孔锡.乙醇脱氢酶乙醛脱氢酶基因多态性与酒精性肝病关系的研究现状[J].临床肝胆病杂志,2003,9(5):273-275.
[23]徐莉.医学生物学[M].上海:上海科学技术出版社,2005:66-72.
[24]BETALLER R,NORTH K E,BRENNER D A.Genetic polymorphisms and the progression of liver fibrosis:acritical appraisal[J],Hepatology,2003,37(3):493-503.
[25]BERGERON R,PREVIS S F,CLINE G W,et al.Effect of5-aminoimidazone-4-carbo-xamide-1-beta-D-ribofuranoside infusion on in vivo glucose and lipid metabolism inlean and obese Zucker rats[J].Diabetes,2001,50:1076-1082.
[26]MALHI H,KAUFMAN R J.Endoplasmic reticulum stress in liver disease[J].Journal of Hepatology,2011,54(4):795-809.
[27]陶明煊,周斌,郭永月,等.姬菇多糖对急性酒精性肝损伤小鼠的肝组织超微结构的影响[J].南京师范大学学报:自然科学版,2013,36(1):85-89.
Effects of Polysaccharides from Termitomyces albuminosus on Pathological Liver Ultrastructure and Gene Expression in Mice with Alcoholic Liver Injury
ZHAO Yunxia
1,TAO Mingxuan
1,*,CHENG Guangyu
2,XING Jia
1,LU Wenjuan
1
(1.Ginling College,Nanjing Normal University,Nanjing210097,China;2.College of Life Science,Nanjing Normal University,Nanjing210046,China)
Abstract:Objective:The protective effect of refined polysaccharides from Termitomyces albuminosus (RPTA)on acute alcoholic hepatic injury in mice was investigated by electron microscopic examination and real-time PCR.Methods:The mice were randomly divided into blank control group,alcoholic control model group,bifendate(150mg/(kg·d)group and RPTA(100,200and400mg/(kg·d)groups.All the mice were administered with50%alcohol(12mL/kg)for30days except for those in blank control group.Twelve hours after alcohol treatment,all mice were executed to assay changes of hepatic ultrastructure,while the mRNA expression of ADH2and ALDH2in mice were analyzed by real-time PCR.Results:Comparing with the blank control group,we found that in the alcoholic model group there were accumulations of lipid droplets and glycogen and irregular nuclear membranes.Meanwhile,duplicative mitochondria were found injured and indistinct,and the endoplasmic reticulum was expanded as well as the ribosomes were dropped off.In contrast,in the RPTA treatment groups,the cardinal symptom gradually became better.Compared with the blank control group,the mRNA expression of ADH2and ALDH2in the model group revealed an obvious decrease,but in the RPTA treatment groups showed an increasing trend.Conclusion:RPTA plays an important role in protecting liver cells by promoting t he mRNA expression of ADH2and ALDH2.
Key words:Termitomyces albuminosus polysaccharidese;alcoholic hepatic injury;ultrastructure;alcohol dehydrogenase2;aldehyde dehydrogenase2;mRNA
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2015)05-0195-05
doi:10.7506/spkx1002-6630-201505037
收稿日期:2014-05-29
基金项目:江苏省高校自然科学基础研究项目(10KJD550003)
作者简介:赵云霞(1989—),女,硕士研究生,研究方向为生物活性物质与保健功能因子。E-mail:xy4z@sina.com
*通信作者:陶明煊(1970—),男,副教授,硕士,研究方向为生物活性物质与保健功能因子。E-mail:45017@njnu.edu.cn

 表示。
表示。



 RNNAA表达的影响(x±s,n==33)
RNNAA表达的影响(x±s,n==33)
 cee(x ±s,, nn ==33)
cee(x ±s,, nn ==33)
