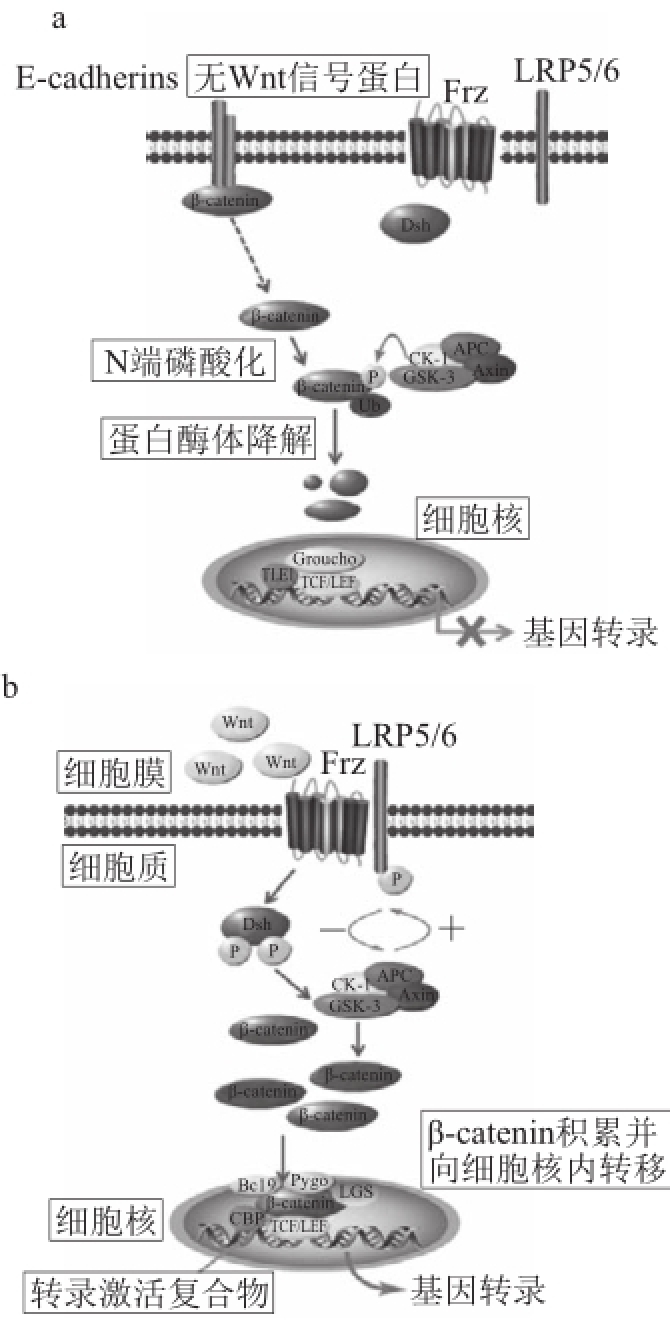
图1 Wnt/Wnt/β-catenin信号通路受抑制(a)和激活(b)的调节过程
[12,16]216
Fig.1Wnt/β-catenin signaling pathway(a)and its regulation(b)
[12,16]
张小利 1,王慧清 1,张月巧 1,卢可可 1,明 建 1,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学国家食品科学与工程实验教学中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全与风险评估重点实验室,重庆 400715)
摘要:Wnt信号传导通路是传递生长、发育信息的重要通路,与胚胎发育,细胞存活、生长、增殖、分化关系密切。此条通路的激活或抑制对肿瘤的发生发展有重要作用。植物多酚因其抗肿瘤潜能而成为开发防癌物质的重要来源。本文通过介绍Wnt/β-catenin信号通路的组成、调节机制及其与肿瘤的关系,总结植物多酚对肿瘤细胞中Wnt信号通路的作用机制,明确植物多酚对Wnt通路的有效靶点,为植物多酚保健食品(或药物)的开发提供新的依据。
关键词:植物多酚;Wnt/β-catenin;信号通路;抗肿瘤活性
植物多酚是一类广泛存在于植物中的多元酚类化合物,主要存在于植物皮、根、叶、果中,含量仅次于纤维素、半纤维素和木质素,是种类最丰富的植物次生代谢产物之一 [1]。许多研究证实植物多酚具有多种有益于人体健康的生物学活性,如抗氧化、抗肿瘤、抗炎、降血糖、降血脂、降血压、抑菌、抑制酶活性和增强机体免疫力等。植物多酚作为极具发展前景的功能因子,是目前国际食品界最热门的研究课题,其在相关疾病的预防及治疗中受到越来越多的关注。
在高等生物的发育过程中,细胞之间的通讯主要是通过信号细胞产生的信号分子实现的,这些信号分子包括氨基酸、肽、蛋白质、类固醇、脂肪酸衍生物和一些气体成分。靶细胞通过特异性受体识别细胞外的信号分子,并将其转变成细胞内的信号,最终调节特定基因的表达,引起细胞的应答反应,继而完成信号传导过程。Wnt蛋白是由Wnt基因编码的一组富含半胱氨酸的分泌性糖蛋白家族,以自分泌或旁分泌的方式激活,然后与细胞表面基质及其特异性受体相互作用,启动细胞内信号传导途径,从而传导生长刺激信号,参与不同的发育机制。因为这一信号传导途径是由Wnt蛋白启动的,故称其为Wnt信号通路。它是一条高度保守的信号通路,在控制胚胎发育,调节细胞分化、增殖、迁移,细胞存活和凋亡,组织结构、器官发育以及机体协调性等生命活动中发挥重要作用 [2]。β-catenin是Wnt/β-catenin信号通路中的关键调控因子,其在细胞核内累积,并通过下游途径引起特定靶基因的转录,激活Wnt/β-catenin信号通路,造成肿瘤等疾病 [3]。Wnt通路与人类肿瘤的关系是当今国际研究的热点,明确此通路在肿瘤发生过程中的分子机制,了解植物多酚抗肿瘤的有效途径及作用靶点,有助于为植物多酚作为预防肿瘤(或抗肿瘤)保健食品(或药物)的开发提供新的依据。
1973年,Sharma等 [4]率先发现了导致无翅表型的Wingless基因(Wg)。1982年,Nusse等 [5]在小鼠的乳腺癌细胞中克隆出Wg基因的同源基因——Int1(Integration 1)。后将二者合称为Wnt [6-7]。Wnt信号通路参与胚胎发育的各个方面,在维持成体动物组织稳态过程中起重要作用 [8]。Wnt信号在细胞间的转导是个复杂的过程,其间涉及多种调节基因和蛋白质,若它们发生异常,可能会造成细胞生长、分化、代谢等生理异常,引起疾病甚至癌变 [9]。
卷曲蛋白(frizzled,Frz)是Wnt蛋白的特异性受体。根据Wnt/Frz复合体所激活的机制不同,Wnt信号转导通路有以下几条分支:1)经典Wnt通路(即Wnt/ β-catenin通路),在生物进化中高度保守;2)细胞极性通路(planer cell polarity pathway)即Wnt/JNK通路,通过小G蛋白激活JNK(c-Jun N-terminal kinase,c-Jun氨基末端激酶)来调控细胞骨架重排,主要作用是阶段性调控胚胎发育;3)Wnt/Ca 2+通路,此通路由Wnt-11和Wnt-5α激活,引起细胞内Ca 2+增加和Ca 2+敏感信号成分的激活,该通路能拮抗经典的Wnt通路;4)调节纺锤体的方向和非对称细胞分裂的细胞内途径。目前研究比较深入并不断证明与肿瘤的发生发展有密切关系的是Wnt/ β-catenin信号转导通路,对于其他非经典通路的研究也在不断深入。
1.1 Wnt/β-catenin信号通路的组成
Wnt/β-catenin信号通路在进化上具有高度保守性,从果蝇、线虫到高等的哺乳动物,它的组成成员具有高度同源性 [10-11]。主要包括Wnt家族分泌蛋白(Wnt)、特异性受体卷曲蛋白(Frz)、辅助受体低密度脂蛋白受体相关蛋白5/6(low density lipo-protein receptor related protein5/6,LRP5/6)、散乱蛋白(dishevelled,Dsh)、结肠腺瘤性息肉蛋白(adenomatous polyposis coli,APC)、β-连接蛋白(β-catenin)、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、轴蛋白(Axin)、酪蛋白激酶-1(casein kinase-1,CK-1)、E-钙黏蛋白(E-cadherin)核内转录因子T细胞因子/淋巴样增强因子(T cell transcription factor/lymphoid enhancer factor,TCF/LEF)、转录活化因子CBP(cAMP response element binding protein)、泛素蛋白(ubiquitin,Ub)及靶因子(C-myc、Cyclin D1、MMP27、CD44、Claudin-1)等。
另外还存在四大类Wnt拮抗因子 [12]:分泌型卷曲相关蛋白SFRPs(secreted frizzled related protein)、Wnt抑制蛋白WIF-1(Wnt inhibitory factor-1)、DKKs(dickkopf family)、Wise/Sost家族蛋白。它们都属于分泌型糖蛋白,前二者能与Wnt结合,从而竞争性抑制Wnt与Frz/LRP受体结合,后二者能与LRP5/6结合而阻遏信号通路的传导。其中SFRPs包括SFRP1~5;DKKs包括DKK1~4及1个DKK3相关蛋白(DKKL1或称SGY-1)组成。后来又发现3种激动分子制剂(agonistic molecules):R-spondins(Rspo1~4)、Norrin和Glypican-3(GPC-3)。GPC-3是一种硫酸乙酰肝素蛋白聚糖,通过糖基磷脂酰肌醇锚定结合到细胞膜上,与Wnt配体结合,促进自分泌/旁分泌Wnt信号传导,从而方便Wnt配体和Frz受体之间的相互作用。Rspo和Norrin对经典Wnt通路的激活机制尚不明确 [13]。
1.2 Wnt/β-catenin信号通路的调节机制
在无Wnt信号或受体(相关受体)受阻时,Wnt通路关闭。细胞质中大部分的β-catenin与胞内的α-catenin及胞膜上的E-cadherin胞内肽段结合,黏附于细胞骨架蛋白肌动蛋白上;还有少部分与APC、Axin、GSK-3β和CK-1结合形成蛋白降解复合物。CK-1能使β-catenin的第45位丝氨酸磷酸化,随后GSK-3β可将β-catenin的第41、37、33位丝氨酸/苏氨酸残基磷酸化。磷酸化后的β-catenin经Ub泛素化后被蛋白酶体识别降解,这样细胞内的为数不多的游离β-catenin允许募集辅阻遏物TLE1、Groucho与TCF/LEF家族结合,阻碍靶基因的激活,确保转录被抑制,如图1a所示。
正常细胞受到刺激后,Wnt基因分泌Wnt蛋白,它作为细胞外信号结合并激活Frz受体及辅助受体LRP5/6,胞质中Dsh蛋白被募集到胞膜下与磷酸化的LRP5/6结合。随后Axin与磷酸化的LRP5/6和Dsh结合,使β-catenin降解所依赖的APC复合体解体,导致胞质内的β-catenin得以积累而转位至细胞核取代Groucho与TCF/LEF家族转录因子结合。TCF/LEF、Bcl9、LGS、CBP、Pygo与β-catenin在细胞核内结合形成转录激活复合物,开启下游靶基因(包括C-myc、Cyclin D1、MMP27、CD44、Claudin-1)的转录 [10,14-15],如图1b所示。另外,有研究发现β-catenin与钙黏蛋白复合物的分离可能导致细胞内游离的β-catenin的积累,这点还存在争议(图1a中虚线表示)。

图1 Wnt/Wnt/β-catenin信号通路受抑制(a)和激活(b)的调节过程
[12,16]216
Fig.1Wnt/β-catenin signaling pathway(a)and its regulation(b)
[12,16]
1.3 Wnt信号通路与肿瘤的发生
肿瘤的发生发展是多因素、多基因、多阶段渐进性累积的演变过程。其中细胞信号转导途径对其发生发展、侵袭转移起着至关重要的作用。β-catenin积累可以激活Wnt/β-catenin信号途径。β-catenin是一种多功能的蛋白质,在细胞连接处它与E-cadherin相互作用,参形成黏合带,而游离的β-catenin可进入细胞核,调节基因表达。Wnt信号传导通路在细胞分化、增殖、生存凋亡等生理过程中,以及细胞的癌变、肿瘤的侵袭等病理过程中均发挥了重要的调控作用。Wnt/β-catenin信号的异常表达或激活能引起肿瘤(鼻咽癌、胃癌、肝癌、肺癌、子宫内膜癌、卵巢癌、乳腺癌、前列腺癌等)的发生。
结肠癌(colorectal cancer,CRC)是世界上第四大致死恶性肿瘤疾病 [17]。80%的散发性和遗传性的结肠癌是由于APC基因、β-catenin基因突变引起Wnt通路过度激活造成的。APC是公认的与CRC发生密切相关的基因 [18-19]。APC基因突变使其蛋白与β-catenin结合的区域异常,造成二者不能结合。散发型CRC中Axin突变率达11%,β-catenin本身基因突变10%,此外还存在TCF突变。以上情况都会造成β-catenin不能被蛋白酶体降解,导致其在细胞质内积聚,引发细胞异常增殖、恶变,最终导致CRC的发生 [20]。
非肠道散发型癌细胞中常存在β-catenin基因突变造成的Wnt通路激活。如在子宫内膜样卵巢癌中常存在β-catenin基因突变,且与癌细胞的阶段有关。一般多存在于早期高度分化的子宫内膜样卵巢癌细胞中,而在浆液性、透明及黏液性卵巢癌细胞中较罕见 [21]。在卵巢癌中一些Wnt通路的激活助剂(如Pygo、Bcl9/LGS)及胞外激活因子(如Wnt-1、Wnt-2b、Wnt-5α、Wnt-11)的上调,Wnt通路抑制因子(如SFRP4)的表达缺失都会激活Wnt通路。正常情况下,β-catenin与E-cadherin在细胞连接处相互作用,参与形成黏合带。研究发现某些卵巢癌细胞中二者的结合受到影响,另外,E-cadherin在细胞连接处密度降低使细胞易离散,造成肿瘤细胞的侵润与转移。大部分卵巢癌中存在由于基因扩增引起的磷脂酰肌醇3-激酶(phosphatidylinositol3-kinase,PI3K)活化,PI3K能磷酸化GSK-3而阻碍β-catenin的磷酸化。MAPK和mTOR信号通路也会使GSK-3磷酸化,进而干扰Wnt信号通路[22-25]。
Wnt通路在胃癌组织中的活化状态与胃癌的发展有密切关系。Wnt家族的Wnt-2在胃癌中的表达比较常见 [26]。韩竞春等 [27]研究发现Wnt-2、β-catenin和TCF-4在胃癌组织中的表达明显高于癌前病变组织。Wnt-3和Wnt-3αmRNA的表达在胃癌组织中较慢性萎缩性胃炎组织中高,而Wnt-5α和Wnt-8α在两种组织中无显著差异 [28]。还有文献报道发现胃癌中存在CTNNB基因突变,β-catenin磷酸化位点突变,Cyclin D1表达过度,SFRP表达下降 [29]。幽门螺杆菌感染是胃癌发生的主要生物学因素,幽门螺杆菌的CagA +蛋白菌株能导致β-catenin表达,而促进胃癌上皮细胞向肠道型转变。47%的胃癌细胞中E-cadherin与β-catenin结合表达量降低 [30-31]。
Wnt/β-catenin通路会影响肝癌细胞的增殖、迁移和侵袭。Cheng Hongxia等 [32]研究证明原发性肝癌(primary hepatocellular carcinoma,HCC)中β-catenin蛋白的异质表达程度与患者肝内转移及淋巴结转移呈正相关。除此之外,在HCC及癌变前病变周围肝组织中发现有配体Wnt1/3/4/5α/10b和受体Frz3/6/7、LRP6的上调及抑制剂SFRP1/4/5、WIF-1、DKK3、DKK4的下调。推测它们的上调和/或下调发生在肝癌的早期阶段。3%~44%的肝癌患者病变组织中β-catenin外显子突变,导致其N端缺乏正常磷酸化的位点,不能被蛋白酶体降解。虽然β-catenin的累积是肝癌发展恶化的关键,但这并不足以引发肝癌变。小鼠模型中发现β-catenin的活化可能与其他致癌合作途径(如H-RAS、MET、Akt、insulin/IGF-1/IRS-1/ MAPK)及化学物质共同诱导肝癌形成 [12,33]。
乳腺癌是女性肿瘤疾病中主要的致死原因,其中Wnt通路与其发生发展密切相关。与其他肿瘤不同,乳腺癌中β-catenin突变并不常见,但存在其他突变包括APC、Axin突变,另外Wnt信号抑制剂SFRP1、SFRP2、SFRP5、WIF-1、DKK1、DKK2、DKK3、DKK4基因启动子频繁甲基化也会使经典通路异常激活 [34]。
植物多酚的抗肿瘤活性已被广泛认可,以往的研究将其抗炎抗肿瘤功效归因于抗氧化活性,然而近年来研究表明,多酚可以直接作用于病变过程中的特定靶分子,调节靶基因的表达水平,进而影响癌细胞的增殖和凋亡 [35]。
大量研究表明,激活与细胞周期和增殖有关的原癌基因会使Wnt信号通路异常表达,进而引发肿瘤。因而抑制Wnt信号通路被认为是一条有效的抗肿瘤途径。近年来,国内外关于植物多酚对肿瘤细胞信号转导通路的作用均有较多报道。在众多具有生物活性的植物多酚类物质中,仅有少数被证实能抑制Wnt通路,如表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、槲皮素、黄酮类物质、姜黄素、白藜芦醇等。
2.1 EGCG
临床研究显示,EGCG能抑制肝癌、胃癌、皮肤癌、肺癌、乳腺癌、结肠癌的发病率和多样性 [36]。体外实验表明:EGCG对多种癌细胞的多条信号通路(如MAPK、NF-κB、JAK/STAT、PI3K/AKT、Notch、EGFR、Wnt)都有影响。Singh等 [37]研究发现EGCG能通过抑制Wnt/ β-catenin信号通路而降低A431、SCC13皮肤癌细胞存活率。主要机制归因于EGCG能增加CK-1α的水平,减少GSK-3β的磷酸化,从而促进β-catenin45、33、37位丝氨酸残基的磷酸化,降低细胞核内β-catenin数量,抑制下游靶基因如MMPs、C-myc、VEGF、TCF/LEF的表达。除此之外,EGCG还可以通过下调炎症介质环氧合酶-2(cyclooxygenase-2,COX-2)和前列腺素E2(prostaglandin E2,PGE2)的表达量来抑制β-catenin。
龙丽等 [38]研究发现,40μg/mL EGCG干预人卵巢癌细胞HO-8910会影响其细胞周期。EGCG以剂量-时间的依赖关系显著降低HO-8910细胞的Cyclin D1基因和β-catenin mRNA的转录水平和蛋白质表达水平。Yee等 [39]发现三阴乳腺癌细胞中SFRP1、HBP1表达下降,这种下调还会造成预后不良。实验中用EGCG和地西他滨(decitabine,DAC)共同处理,可以恢复SFRP1、HBP1的表达量,从而抑制Wnt/β-catenin通路。另外,有研究显示槲皮素和EGCG在促细胞凋亡方面有协同作用,且能阻止结直肠癌的迁移和侵袭。
2.2 槲皮素
大量研究证实槲皮素是一种有效的Wnt通路调节剂,影响Wnt通路中C-myc、Cyclin D1和Survivin的转录水平和蛋白表达水平 [40]。李润青等 [41]将槲皮素作用于人结肠癌SW480细胞,可以使Wnt/β-catenin下游的靶基因Cyclin D1和Survivin的mRNA表达和蛋白表达水平显著下降,从而抑制人结肠癌SW480细胞的增殖。Park等 [42]研究槲皮素对SW480和HEK293细胞中Wnt/β-catenin的作用时,发现槲皮素不作用于细胞质中的β-catenin,也不影响GSK-3β与其结合,主要影响Wnt/β-catenin下游通路,即抑制核内β-catenin和TCF-4的蛋白表达,阻遏TCF与相应DNA结合位点及β-catenin结合。Kim等 [43]用槲皮素处理Wnt通路异常激活引起的人乳腺癌细胞,发现其呈剂量依赖性抑制4T1细胞生长,诱导细胞凋亡。推测槲皮素通过提高DKK1~3的表达量,降低β-catenin的稳定性来抑制Wnt/ β-catenin通路活性,从而降低乳腺癌细胞的活性,诱导细胞凋亡。
2.3 黄酮类物质
2005年,Park等 [44]研究黄酮类物质对胃癌的作用,发现其能够抑制AGS胃癌细胞中β-catenin/TCF转录活性且呈剂量依赖关系,但不影响β-catenin含量、分布以及与TCF的结合。黄酮类物质影响TCF活性的具体机制尚待研究。2010年,Park等 [45]发现4种黄酮类物质:山奈酚、异鼠李素、染料木黄酮和黄芩素在结肠癌细胞SW480和HEK293细胞中阻止β-catenin与TCF-4结合,并抑制β-catenin/TCF复合物与其特定DNA结合。推测山奈酚、黄芩素和异鼠李素的作用与β-catenin/TCF途径的下游调节因子有关,而与GSK-3β和Akt无关;而染料木素可以抑制GSK-3β和Akt的磷酸化并能降低核内β-catenin的水平。同时,有研究表明汉黄芩素也可以使人结直肠癌细胞HCT-116阻滞于G 1期,并下调CDK/Cyclin,降低β-catenin介导的核因子转录活性,抑制Wnt/β-catenin通路 [46]。Sarkar等 [47]研究发现染料木黄酮可上调GSK-3β表达,并促进其与β-catenin结合,并且促使β-catenin磷酸化,表明染料木黄酮可以抑制Wnt/β-catenin通路从而抑制前列腺癌的生长。另外,其还可以抑制Wnt-1诱导的肿瘤细胞增殖,降低靶基因C-myc和Cyclin D1的表达。Tarapore等 [48]发现染料木黄酮可以抑制Wnt-1诱导的乳腺上皮细胞增殖,通过促进E-cadherin-β-catenin细胞黏附物的形成减弱β-catenin信号。
2.4 姜黄素
姜黄素对子宫颈癌、结肠癌、胃癌、肝癌、白血病、口腔上皮、卵巢癌、胰腺癌、乳腺癌和前列腺癌都有抑制作用 [49]。Tanaka [50]研究发现姜黄素能减少细胞核内β-catenin和TCF蛋白的数量,从而降低胃癌、结肠癌及肠道癌细胞中β-catenin/TCF的转录活性。
Prasad等 [51]用免疫荧光法和Western blotting方法分析,发现姜黄素可以降低乳腺癌细胞MCF-7和MDAMB-231中Dsh、β-catenin、CD1和slug的表达水平。而且姜黄素通过下调MCF-7细胞中slug蛋白水平,来调节E-cadherin的表达,这验证了在乳腺癌细胞治疗中姜黄素具有抗肿瘤转移的潜力。另外,姜黄素会使MCF-7细胞中GSK-3β增加,而MDA-MB-231细胞中不改变。赵琳琳等 [52]用姜黄素处理肝癌细胞Bel7402、QGY7703时,C-myc、VEGF、Cyclin D1mRNA表达量下降,姜黄素能有效抑制细胞增殖并促进其凋亡,推测可能与姜黄素下调经典Wnt/β-catenin信号通路有关。Liu Yuliang等 [53]研究发现非小细胞肺癌A549、H460和SPC-A-1细胞系中WIF-1的启动子高度甲基化使其低表达或不表达,失去对Wnt配体的抑制作用,造成Wnt通路异常激活。实验中发现姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素具有不同程度的低甲基化能力,其中双去甲氧基姜黄素已被证实能够通过对WIF-1启动子低甲基化恢复WIF-1表达,从而下调Wnt通路。
2.5 白藜芦醇
目前,白藜芦醇对癌症的防治处于临床前研究阶段。许多研究证实,白藜芦醇的抗癌活性是通过上调促凋亡基因,同时下调抗凋亡基因而诱导癌细胞凋亡实现的。同时还可以调整死亡受体的再分配,促进其与相应配体结合,从而启动死亡途径。此外还可以通过诱导CDK抑制剂p21/CDKN1A和p27/CDKN1B的表达使细胞周期阻滞于G 1和G 1/S期 [54]。Chen等 [55]研究发现白藜芦醇可以作用于下游的Cyclin D1及GSK-3β,但不改变β-catenin的数量及其在细胞质和细胞核内的分布。推测白藜芦醇不影响β-catenin的积累和核转位。免疫共沉淀结合体外分析证实白藜芦醇通过破坏β-catenin与TCF-4的结合,从而降低Wnt信号。但也有文献报道白藜芦醇处理SMMC-7721肝癌细胞可以降低胞质中β-catenin的数量 [56],处理结肠癌细胞可影响β-catenin核转位。舒晓宏 [57]研究发现白藜芦醇可以上调CYP1A1和下调CYP1B1表达,活化Wnt、Notch和Stat3等信号通路,另外还能干扰髓母细胞瘤细胞的细胞周期,并明显下调C-myc、Survivin和Cyclin D1表达。
肿瘤是多因素作用、多基因参与、多阶段发展,最终形成极为复杂的生物学现象。正是由于这种发病发展的复杂性导致至今仍未找到彻底治愈肿瘤的方法。分子生物学研究发现众多的信号通路参与肿瘤的发生、侵袭、转移等过程,探究各通路的分子机制,开发相应的靶标治疗剂对肿瘤疾病的治疗至关重要。使用传统合成药剂或化疗方法虽能使肿瘤变小,但不能使其消除,且肿瘤会产生多药耐药性,另外还有严重的副作用,因此迫切需要开发天然安全的防癌物质。多酚类物质因其显著的抗癌性能受到关注,富含多酚物质的果蔬、谷物、食用菌等天然食物无疑是最好的资源。
Wnt信号通路在胚胎的发育过程中,包括细胞增殖、分化和上皮-间充质相互作用等有重要作用。Wnt/ β-catenin的异常激活是已知的人类癌症中常见的异常信号调节通路,因此,有必要探索该信号通路中的靶位点并寻找相应的有效作用物,以抑制癌细胞中Wnt通路的异常活化,从而为癌症治疗提供一种可能。迄今,还没研发出能够在临床上使用的针对Wnt通路的具体药物。大量研究表明,多酚可以通过调节与癌症相关的信号转导通路而影响癌症的发生发展。来自植物的多酚天然无毒安全,除了对Wnt通路起作用,还可以作用于其他细胞通路如NF-κB、Akt、MAPK、Notch、p53、ERAR等,通过不同通路的交互协同,抗肿瘤效果更好。因此,合理利用植物多酚抗肿瘤功能,一方面可以通过膳食摄入富含多酚的食物,增强机体预防疾病的能力;另一方面可以利用植物多酚开发多靶点制剂,既可以单独使用又可以与传统合成药物结合使用。另外,由于不同类型的癌细胞中Wnt通路异常的具体原因不同,因此应当选用针对性强的药物。以植物多酚研制抗癌药物,还需考虑多酚在体内的生物利用和代谢情况。
参考文献:
[1]邓泽元.食品营养学[M].3版.北京:中国农业出版社,2009:299-302.
[2]郑群,徐立红.经典Wnt信号通路中β-连环蛋白的影响因素[J].细胞生物学杂志,2009,31(2):183-190.
[3]HAHNE G,GROSSMANN T N.Direct targeting ofβ-catenin:inhibition of protein-protein interactions for the inactivation of Wnt signaling[J].Bioorganic&Medicinal Chemistry,2013,21(14):4020-4026.
[4]SHARMA R P,CHOPRA V L.Effect of the wingless(wg 1)mutation on wing and haltere development in Drosophila melanogaster[J].Developmental Biology,1976,48(2):461-465.
[5]NUSSE R,VARMUS H E.Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome[J].Cell,1982,31(1):99-109.
[6]CABRERA C V,ALONSO M C,JOHNSTON P,et al.Phenocopies induced with antisense RNA identify the wingless gene[J].Cell,1987,50(4):659-663.
[7]RIJSEWIJK F,SCHUERMANN M,WAGENAAR E,et al.The Drosophila homology of the mouse mammary oncogene int-1 is identical to the segment polarity gene wingless[J].Cell,1987,50(4):649-657.
[8]KRAUSOVA M,KORINEK V.Wnt signaling in adult intestinal stem cells and cancer[J].Cellular Signalling,2014,26(3):570-579.
[9]LOGAN C Y,NUSSE R.The Wnt signaling pathway in development and disease[J].Annual Review of Cell and Developmental Biology,2004,20(1):781-810.
[10]WODARZ A,NUSSE R.Mechanisms of Wnt signaling in development[J].Annual Review of Cell and Developmental Biology,1998,14(1):59-88.
[11]CADIGAN K M,NUSSE R.Wnt signaling:a common theme in animal development[J].Genes and Development,1997,11(24):3286-3305.
[12]PEZ F,LOPEZ A,KIM M,et al.Wnt signaling and hepatocarcinogenesis:molecular targets for the development of innovative anticancer drugs[J].Journal of Hepatology,2013,59(5):1107-1117.
[13]CAPURRO M I,XIANG Yunyan,LOBE C,et al.Glypican-3promotes the growth of hepatocellular carcinoma by stimulating canonical Wnt signaling[J].Cancer Research,2005,65(14):6245-6254.
[14]CLEVERS H.Wnt/β-catenin signaling in development and disease[J].Cell,2006,127(3):469-480.
[15]ANGERS S,MOON R T.Proximal events in Wnt signal transduction[J].Nature Reviews Molecular Cell Biology,2009,10(7):468-477.
[16]BAARSMA H A,KONIGSHOFF M,GOSENS R.The Wnt signaling pathway from ligand secretion to gene transcription:molecular mechanisms and pharmacological targets[J].Pharmacology&Therapeutics,2013,138(1):66-83.
[17]JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA:A Cancer Journal for Clinicians,2011,61(2):69-90.
[18]BARKER N,CLEVER S H.Mining the Wnt pathway for cancer therapeutics[J].Nature Reviews Drug Discovery,2006,5(12):997-1014.
[19]COOMBS G S,COVEY T M,VIRSHUP D M.Wnt signaling in development,disease and translational medicine[J].Current Drug Targets,2008,9(7):513-531.
[20]杨升,卢辉山.Wnt信号通路与消化道肿瘤关系的研究进展[J].世界华人消化杂志,2007,15(27):2880-2884.
[21]DUBEAU L.The cell of origin of ovarian epithelial tumours[J].Lancet Oncology,2008,9(12):1191-1197.
[22]JACOB F,UKEGJINI F,NIXDORF S,et al.Loss of secreted frizzledrelated protein4correlates with an aggressive phenotype and predicts poor outcome in ovarian cancer patients[J].PLoS One,2012,7(2):e31885.doi:10.1371/journal.pone.0031885.
[23]BAST R C,HENNESSY B,MILLS G B.The biology of ovarian cancer:new opportunities for translation[J].Nature Reviews Cancer,2009,9(6):415-428.
[24]BADIGLIAN FILHO L,OSHIMA C T F,de OLIVEIRA LIMA F,et al.Canonical and noncanonical Wnt pathway:a comparison among normal ovary,benign ovarian tumor and ovarian cancer[J].Oncology Reports,2009,21(2):313-320.
[25]AREND R C,LONDOÑO-JOSHI A I,STRAUGHN J M,et al.The Wnt/β-catenin pathway in ovarian cancer:a review[J].Gynecologic Oncology,2013,131(3):772-779.
[26]KATOH M.Frequent up-regulation of Wnt2in primary gastric cancer and colorectal cancer[J].International Journal of Oncology,2001,19(5):1003-1007.
[27]韩竞春,黄磊,张开立,等.Wnt信号途径在胃癌组织和细胞系中的活化[J].临床军医杂志,2008,36(1):7-9.
[28]官文华,杨堃,赵文君,等.Wnt3,Wnt3a在胃癌组织中的表达及意义[J].世界华人消化杂志,2013,21(7):624-628.
[29]余娜,梅武轩.Wnt信号通路与消化道肿瘤研究进展[J].中国医疗前沿,2013,8(17):11-13.
[30]MURATA-KAMIYA N,KURASHIMA Y,TEISHIKATA Y,et al.Helicobacter pylori CagA interacts with E-cadherin and deregulates the β-catenin signal that promotes intestinal transdifferentiation in gastric epithelial cells[J].Oncogene,2007,26(32):4617-4626.
[31]WU W K K,CHO C H,LEE C W,et al.Dysregulation of cellular signaling in gastric cancer[J].Cancer Letters,2010,295(2):144-153.
[32]CHENG Hongxia,LIANG Hui,QIN Yejun,et al.Nuclear betacatenin overexpression in metastatic sentinel lymph node is associated with synchronous liver metastasis in colorectal cancer[J].Diagnostic Pathology,2011,6(1):109-116.
[33]FATIMA S,LEE N P,TSANG F H,et al.Dickkopf4(DKK4)acts on Wnt/β-catenin pathway by in☒uencingβ-catenin in hepatocellular carcinoma[J].Oncogene,2012,31(38):4233-4244.
[34]XIANG Tingxiu,LI Lili,YIN Xuedong,et al.Epigenetic silencing of the Wnt antagonist Dickkopf3disrupts normal Wnt/β-catenin signalling and apoptosis regulation in breast cancer cells[J].Journal of Cellular and Molecular Medicine,2013,17(10):1236-1246.
[35]KANG N J,SHIN S H,LEE H J,et al.Polyphenols as small molecular inhibitors of signaling cascades in carcinogenesis[J].Pharmacology&Therapeutics,2011,130(3):310-324.
[36]SINGH B N,SHANKAR S,SRIVASTAVA R K.Green tea catechin,epigallocatechin-3-gallate(EGCG):mechanisms,perspectives and clinical applications[J].Biochemical Pharmacology,2011,82(12):1807-1821.
[37]SINGH T,KATIYAR S K.Green tea polyphenol,(-)-epigallocatechin-3-gallate,induces toxicity in human skin cancer cells by targetingβ-catenin signaling[J].Toxicology and Applied Pharmacology,2013,273(2):418-424.
[38]龙丽,唐良萏.绿茶提取物表没食子儿茶素-3-没食子酸酯对人卵巢癌HO-8910细胞增殖及Wnt/β-catenin信号通路相关基因表达的影响[J].中国生物制品学杂志,2012,25(9):1165-1170.
[39]YEE A S,PAULSON K E,CASTANER M,et al.Abstract B260:Wnt signaling,triple-negative breast cancer,and green tea[J].Molecular Cancer Therapeutics,2013,12(Suppl11):B260.doi:10.1158/1535-7163.TARG-13-B260.
[40]陈景林,柳建军.槲皮素诱导肿瘤细胞凋亡的研究进展[J].医学综述,2010,16(1):55-58.
[41]李润青,单保恩.槲皮素抗肿瘤作用与Wnt/β-catenin信号转导关系的研究[J].中华肿瘤防治杂志,2008,15(21):1632-1635.
[42]PARK C H,CHANG J Y,HAHM E R,et al.Quercetin,a potent inhibitor againstβ-catenin/Tcf signaling in SW480colon cancer cells[J].Biochemical and Biophysical Communications,2005,328(1):227-234.
[43]KIM H,SEO E M,SHARMA A R,et al.Regulation of Wnt signaling activity for growth suppression induced by quercetin in4T1murine mammary cancer cells[J].International Journal of Oncology,2013,43(4):1319-1325.
[44]PARK C H,HAHM E R,LEE J H,et al.Inhibition ofβ-cateninmediated transactivation by flavanone in AGS gastric cancer cells[J].Biochemical and Biophysical Research Communications,2005,331(4):1222-1228.
[45]PARK S, CHOI J. Inhibition of β-catenin/Tcf signaling by fl avonoids[J]. Journal of Cellular Biochemistry, 2010, 110(6): 1376-1385.
[46]HE L,LU N,DAI Q,et al.Wogonin induced G 1cell cycle arrest by regulating Wnt/β-catenin signaling pathway and inactivating CDK8in human colorectal cancer carcinoma cells[J].Toxicology,2013,312:36-47.
[47]SARKAR F H,LI Yiwei,WANG Zhiwei,et al.Cellular signaling perturbation by natural products[J].Cellular Signalling,2009,21(11):1541-1547.
[48]TARAPORE R S,SIDDIQUI I A,MUKHTAR H.Modulation of Wnt/β-catenin signaling pathway by bioactive food components[J].Carcinogenesis,2012,33(3):483-491.
[49]IRVING G R B,KARMOKAR A,BERRY D P,et al.Curcumin:the potential for efficacy in gastrointestinal diseases[J].Best Practice&Research Clinical Gastroenterology,2011,25(4):519-534.
[50]TANAKA T.Colorectal carcinogenesis:review of human and experimental animal studies[J].Journal of Carcinogenesis,2009,8(1):5.doi:10.4103/1477-3163.49014.
[51]PRASAD C P,RATH G,MATHUR S,et al.Potent growth suppressive activity of curcumin in human breast cancer cells:modulation of Wnt/ β-catenin signaling[J].Chemico-Biological Interactions,2009,181(2):263-271.
[52]赵琳琳,陈剑群,徐学军.姜黄素对肝癌细胞Bel7402、QGY7703增殖凋亡及Wnt/β-catenin信号通路的影响[J].中华临床医师杂志:电子版,2013,7(11):4902-4906.
[53]LIU Yuliang,YANG Heping,ZHOU Xiangdong,et al.The hypomethylation agent bisdemethoxycurcumin acts on the WIF-1promoter,inhibits the canonical Wnt pathway and induces apoptosis in human non-small-cell lung cancer[J].Current Cancer Drug Targets,2011,11(9):1098-1110.
[54]SHANKAR S,SINGH G,SRIVASTAVA R K.Chemoprevention by resveratrol:molecular mechanisms and therapeutic potential[J].Frontiers in Bioscience,2006,12:4839-4854.
[55]CHEN H J,HSU L S,SHIA Y T,et al.Theβ-catenin/TCF complex as a novel target of resveratrol in the Wnt/β-catenin signaling pathway[J].Biochemical Pharmacology,2012,84(9):1143-1153.
[56]范恺谊.β-连环蛋白在白藜芦醇抑癌过程中的作用研究[D].上海:复旦大学,2004.
[57] 舒晓宏.白藜芦醇在原发性脑肿瘤中的代谢特点、活性形式、作用靶点及其与抗癌效果的关系[D].大连:大连医科大学,2010.
Recent Progress in Research Antitumor Activity of Plant Polyphenols by Wnt/β-catenin Signaling Pathway
ZHANG Xiaoli
1,WANG Huiqing
1,ZHANG Yueqiao
1,LU Keke
1,MING Jian
1,2,3,*
(1.College of Food Science,Southwest University,Chongqing400715,China;2.National Food Science and Engineering Experimental Teaching Center,Southwest University,Chongqing400715,China;3.Key Laboratory of Agricultural Products Quality Safety and Risk Assessment during Storage,Ministry of Agriculture,Chongqing400715,China)
Abstract:Wnt signal transduction pathway,which is closely related to normal embryonic development,and cell survival,growth,proliferation and differentiation,could deliver the information associated with growth and development.Its aberrant activation or inhibition plays important roles in the development of cancers.While plant polyphenols are becoming important sources of chemopreventive agents because of their antitumor potential.This review describes the relationships between Wnt/β-catenin signaling pathway components and regulation mechanisms and tumors as well as the targets and mechanisms by which the plant polyphenols act on Wnt signaling pathway in cancer progression.We hope that this paper can provide some evidence for developing health-promoting foods or drugs containing plant polyphenols.
Key words:plant polyphenols;Wnt/β-catenin;signaling pathway;antitumor activity
中图分类号:R282.7
文献标志码:A
文章编号:1002-6630(2015)05-0227-06
doi:10.7506/spkx1002-6630-201505042
收稿日期:2014-07-31
基金项目:国家自然科学基金面上项目(31471576)
作者简介:张小利(1989—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:zhangxiaoli0912@163.com
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com