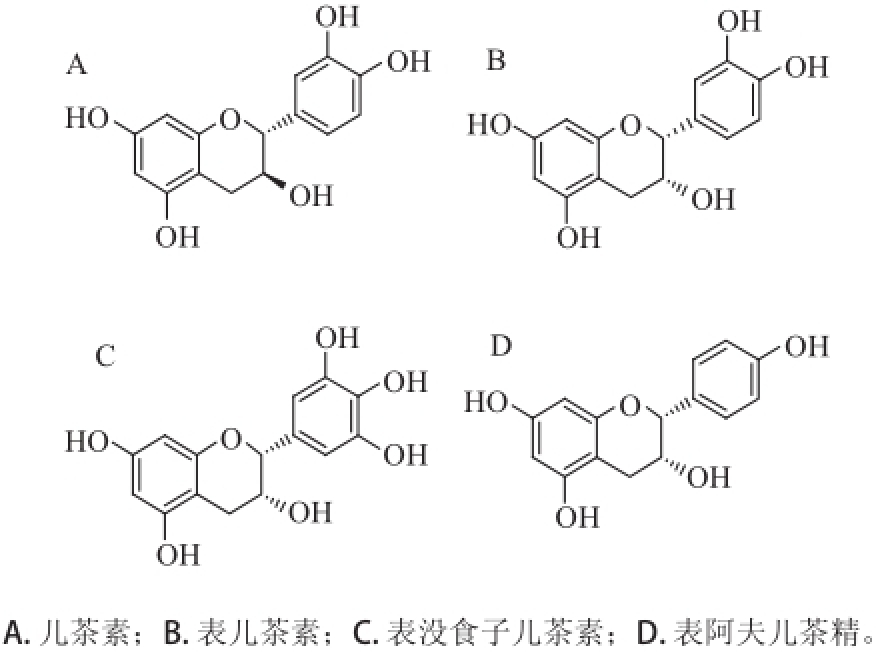
图1 单倍体的化学结构
Fig.1Structures of monomers
张慧文 1,2,张 玉 1,马超美 1,*
(1.内蒙古大学生命科学学院,内蒙古呼和浩特010021;2.包头医学院,内蒙古包头014040)
摘要:原花青素是一类广泛存在于自然界中的黄烷-3-醇类化合物。本文详细整理国内外有关原花青素的报道,就其化学结构、生物活性、吸收代谢和毒理学特性做详细综述。其中,原花青素的化学结构根据其聚合度分类,结合结构单元、连接方式、空间构型和取代基的不同,并配结构图列举说明每种类型;原花青素有很强的生物活性,如抗氧化活性、防治心血管疾病、抗癌、抗高血压、降血脂、降血糖等;原花青素的吸收代谢包括体外Caco-2细胞模型和体内代谢的研究;毒理学研究表明原花青素的安全性很高。本文结合国内外的最新文献,较为全面地介绍生物活性强、食源性和低毒性的原花青素类成分,为该类成分的进一步研究提供参考。
关键词:原花青素;化学结构;生物活性;吸收;代谢;毒理学
原花青素又名缩合鞣质,在自然界分布广泛,且常存在于日常食品和许多植物中,如红酒、松树皮等 [1-2]。很多食源性的原花青素可以在日常生活中被人们所摄取,并且具有很强的生物活性,如花生种皮中的原花青素可以降血糖 [3],苹果中的原花青素具有抗癌活性 [4],红酒中的原花青素可预防心血管疾病 [5]等。这些研究结果揭示原花青素可作为食源性药物用于疾病治疗。目前,原花青素已被应用于药品、保健品和食品等领域。美国近年批准的仅有的两个天然药物均为原花青素类,分别是绿茶的儿茶素组分(商品名Veregen)和秘鲁巴豆中纯化出的原花青素低聚体Fulyzaq(商品名Crofelemer),国内外也开发出许多原花青素保健品,如康恩贝生产的葡萄籽芦荟软胶囊等;在食品领域,原花青素可作为天然的食源性防腐剂 [6],原花青素的生物活性强、自然来源丰富、可通过饮食摄取,对人体健康和疾病防治有重要作用。本文将详细介绍近年来对原花青素的化学成分、生物活性、吸收代谢及毒理学方面的研究。
原花青素是以黄烷-3-醇为结构单元通过C—C键聚合而形成的化合物,其结构取决于五方面:1)黄烷-3-醇单元的类型;2)单元之间的连接方式;3)聚合程度(组成单元的数量);4)空间构型;5)羟基是否被取代(如羟基的酯化、甲基化等)。根据原花青素的聚合程度可分为单倍体(monomer)、寡聚体(oligomer)和多聚体(polymer),其中单倍体是基本结构单元,寡聚体由2~10个单倍体聚合而成,多聚体则由10个以上的单倍体聚合而成。
1.1 单倍体
单倍体是构成原花青素的结构单元,属于黄烷-3-醇类化合物,该类成分可通过一定方式连接形成原花青素。单倍体一般是儿茶素(catechin)和表儿茶素(epiactechin) [7],但是也有其他的单倍体,如多一个羟基的表没食子儿茶素(epigallocatechin) [8]或少一个羟基的表阿夫儿茶精(epiafzelechin) [7]。上述4种单倍体的化学结构如图1所示。

图1 单倍体的化学结构
Fig.1Structures of monomers
1.2 寡聚体
寡聚体是指由2~10 个单倍体通过一定方式连接起来的化合物,该类成分是原花青素研究中最活跃的部分,不断有新的化合物被报道。寡聚体的分类标准有聚合度、连接方式和单倍体类型:聚合度是指组成原花色素的结构单元个数,是区分原花青素的重要标准之一。随着原花青素聚合程度的增加,分子质量也成倍地增加,羟基越多,和填料之间的吸附越大,分离越困难,在图谱解析中,各个结构单元的峰重叠在一起,结构鉴定难度随着聚合度增加而加大,因此随着聚合度的增加(四聚体以上),被报道的原花青素单体从数量上减少 [2]。寡聚体的连接方式有两种,一种为单倍体通过C2—O—C7的醚键和C4—C8或C4—C6两个键连接在一起,称之为A型(A-type procyanidins);另一种为单倍体通过C4—C8或C4—C6一个键连接在一起,称之为B型(B-type procyanidins),在自然界中,多数植物含有的是B型原花青素,只有少数植物,如花生、荔枝和肉桂等富含A型二聚体 [9]。大多数寡聚体的结构单元是儿茶素或表儿茶素,但是也有少数寡聚体是由表没食子儿茶素或表阿夫儿茶精组成的。本文将寡聚体按照聚合度分类,对每种聚合度包含的不同连接方式和单倍体进行一一介绍。
1.2.1 二聚体
二聚体是由两个单倍体通过一定的方式连接起来的化合物,根据其连接方式分为两种,分别是通过C—C键和C—O—C连接的A型,如原花青素A1(proanthocyanidin A1) [10]和通过一个C—C键连接的B型,如原花青素B1(procyanidin B1) [11]。结构单元种类也很多,如结构单元含有表阿夫儿茶精的表阿夫儿茶精-表儿茶素(epiafzelechin-(4β→8)-epicatechin) [12]、含有表没食子儿茶素的表没食子儿茶素-(2β→O-7,4β→8)-表儿茶素(epigallocatechin-(2β→O-7,4β→8)-epicatechin) [13](图2)。
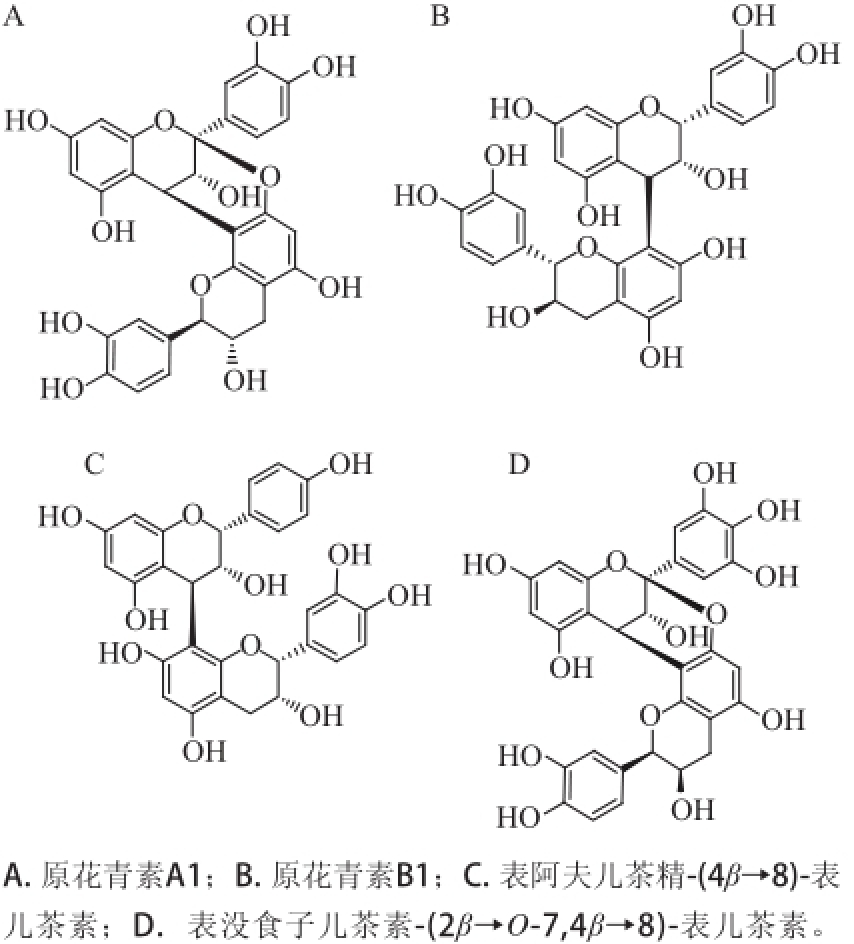
图2二聚体的化学结构
Fig.2Structures of dimers
1.2.2 三聚体
三聚体是通过一定方式连接的3个单倍体组成的化合物。多数三聚体,如原花青素C1(procyanidin C1) [14]通过两个C—C单键连接。也有三聚体如肉桂鞣质B1(cinnamtannin B1) [15]混合有两个C—C单键和一个C—O—C醚键连接的单元。还有非常少见的三聚体具有两组C—C单键和醚键的连接方式,如七叶树鞣质C(aesculitannin C) [16]。还有比较特殊的三聚体,其结构单元并非全部是儿茶素或表儿茶素,而是其他单倍体构成,如表儿茶素-(2β→O-7,4β→8)-表阿夫儿茶精-(4α→8)-表儿茶素(epicatechin-(2β→O-7,4β→8)-epiafzelechin-(4α→8)-epicatechin) [17](图3)。
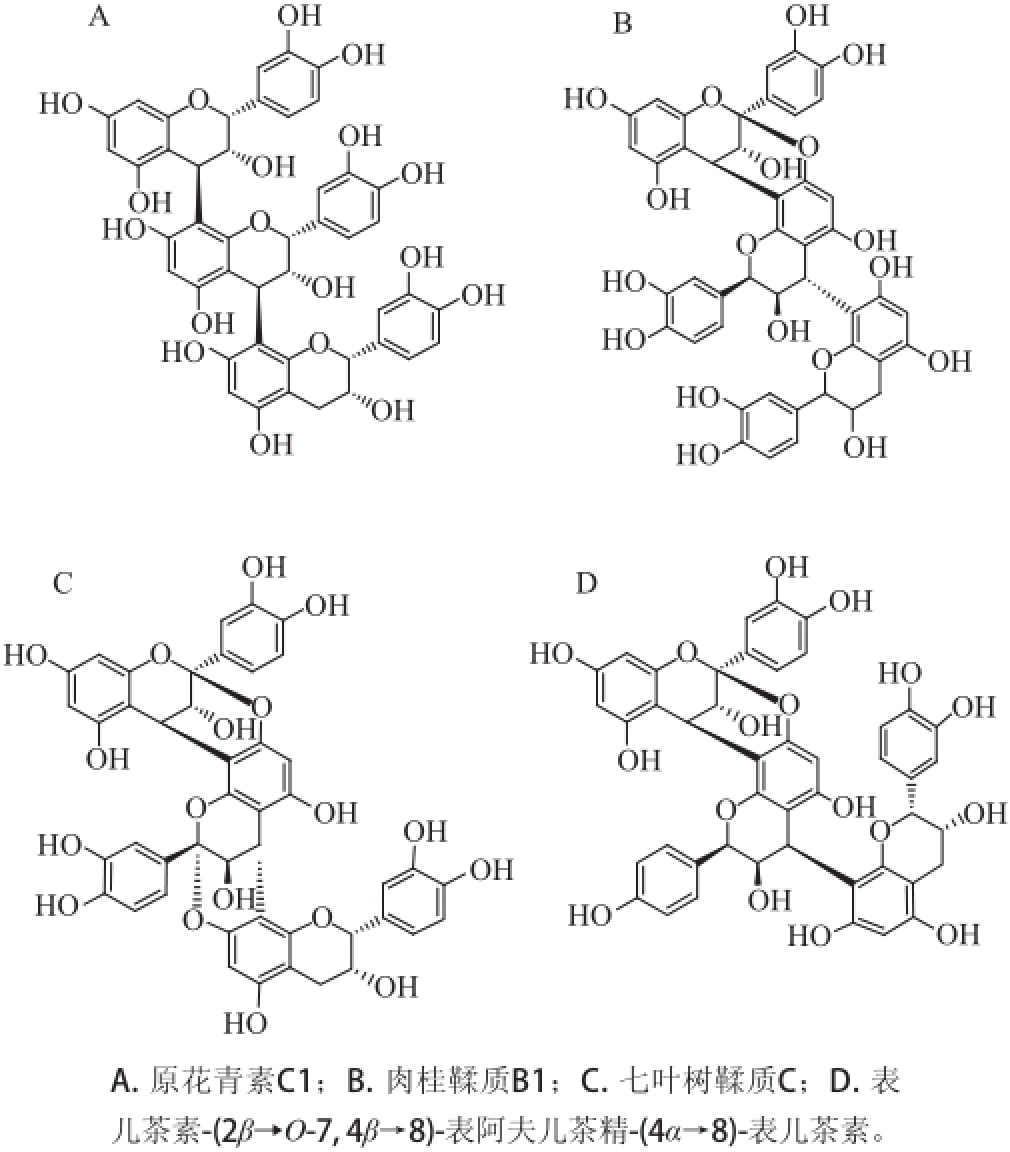
图3三聚体的化学结构
Fig.3Structures of trimers
1.2.3 四聚体
四聚体是4个单倍体通过一定连接方式组成的化合物。连接方式有很多种,如只是通过C—C单键连接的化合物如肉桂鞣质A2(cinnamtannin A2) [18],或者除了C—C单键还有1个C—O—C醚键的连接如表儿茶素-(2β→O→7,4β→8)-表儿茶素-(4β→8)-儿茶素-(4α→8)-表儿茶素(epicatechin-(2β→O→7,4β→8)-epicatechin-(4β→8)-catechin-(4α→8)-epicatechin) [19],或者结构中有两个C—O—C醚键形成的四聚体,如长节珠鞣质A2(parameritannin A2) [20]。结构单元组成也有多种,如从蕨类植物中分离得到的骨碎补素(davallin) [21]四聚体的构成单元含有表阿夫儿茶精(图4)。
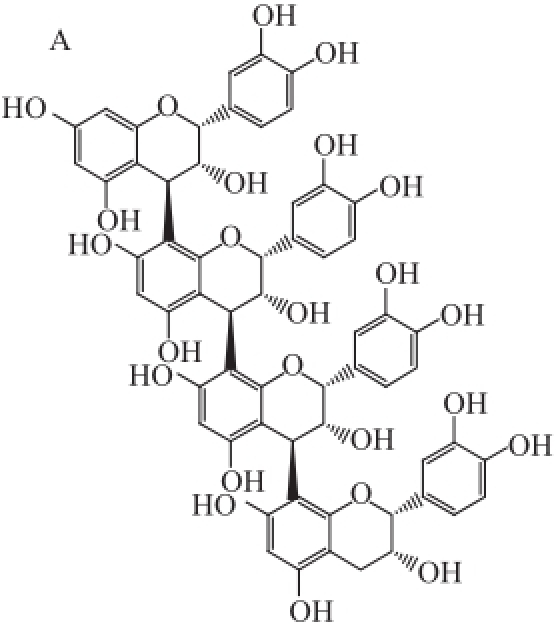

图4四聚体的化学结构
Fig.4Structures of tetramers
1.2.4 五聚体
5个单倍体通过一定连接方式形成的化合物是五聚体,目前分离得到的单体较少,种类也较少。已分离得到的五聚体大多的是通过C—C单键连接,如肉桂鞣质A3(cinnamtannin A3) [22]。目前仅有一个化合物是含有C—O—C醚键的五聚体:表儿茶素-(4β→8)-表儿茶素-(4β→8)-表儿茶素-(2β→O→7,4β→8)-表儿茶素-(4α→8)-儿茶素(epicatechin-(4β→8)-epicatechin-(4β→8)-epicatechin-(2β→O→7,4β→8)-epicatechin-(4α→8)-catechin) [23]。五聚体结构单元具有多样性,如表阿夫儿茶精-(4β-8)-[表没食子儿茶素-(4β-8)-] 3-儿茶素(epiafzelechin-(4β-8)-[epigallocatechin-(4β-8)-] 3-catechin) [24]中同时具有表没食子儿茶素和表阿夫儿茶精(图5)。

图5五聚体的化学结构
Fig.5Structures of pentamers
1.2.5 六聚体
六聚体是指6个单倍体通过一定方式连接在一起形成的化合物,也是目前从天然产物中分离得到的聚合度最高的原花青素单体。随着聚合度的增大,分离难度加大,被报道的六聚体的种类和数量都较少,其结构单元种类也较少,仅有儿茶素或表儿茶素。如结构中只有C—C单键的肉桂鞣质A4(cinnamtannin A4) [22],或结构中有1个C—O—C醚键的菲律宾楠B(machiphilitannins B) [25](图6)。
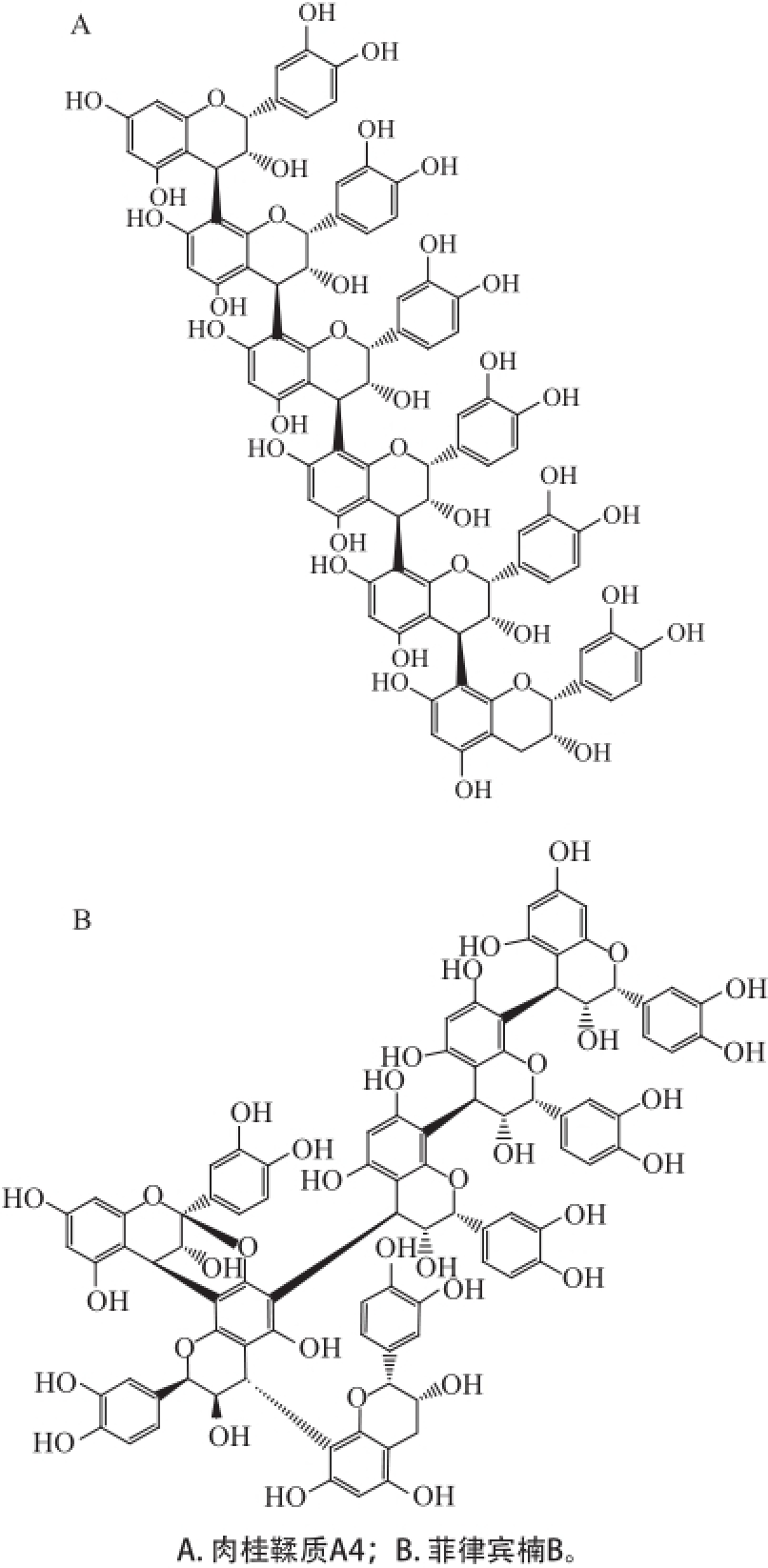
图6六聚体的化学结构
Fig.6Structures of hexamers
1.3 多聚体
多聚体是指聚合度大于10的原花青素,由于分子结构庞大,一般是以混合物的形式存在,该类化合物很难分离得到单体,其化学结构通常以图7中的形式表示。多聚体通常以分子质量区间来定义,其鉴定也和单体原花青素不同,通常是检测其构成单元的类型和种类,以及连接方式的类型 [26]。
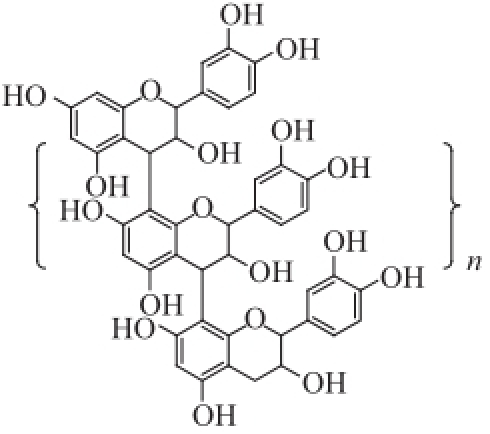
图7多聚体的化学结构
Fig.7Structure of polymer
2.1 抗氧化活性
原花青素具有极强的抗氧化活性,是一种良好的自由基清除剂和脂质过氧化抑制剂,其作用机制是原花青素结构中有多个酚性羟基在体内释放H +,竞争性地与自由基结合,从而保护脂质不被氧化,阻断自由基链式反应,并且反应后产生的半醌自由基能通过亲核加成反应生成具有儿茶酸及焦酚结构的聚合物,仍然具有很强的抗氧化活性,实验证实原花青素及其代谢产物的自由基清除活性一般强于VC和VE [27]。
原花青素的构效关系显示其抗氧化活性与聚合度、羟基的数量及位置、连接方式和空间构型有关,活性强度一般随着聚合度的增加而增加,但是有的四聚体活性低于三聚体;C3位置的甲氧基化和糖基化会降低活性;对于B型二聚体,C4—C8连接方式的活性要大于C4—C6连接方式;表儿茶素的活性大于其同分异构体儿茶素。同时,抗氧化活性强度受溶剂影响,在水相中增强,在油相中降低 [28]。
高峰等 [29]证实原花青素可使人血清丙二醛(malondialdehyde,MDA)含量下降4.80%,超氧化物歧化酶(superoxide dismutase,SOD)活力升高2.31%,谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力升高2.45%,并且能显著降低CCl 4中毒小鼠肝脂质过氧化损伤,表明原花青素具有较强的抗氧化活性。
2.2 防治心血管疾病
著名的法国悖论指出红葡萄酒有益健康,能预防心血管疾病,其中发挥作用的主要成分就是原花青素 [5]。原花青素可以清除自由基、降低胆固醇水平、减少血小板黏附、保护血管内皮细胞,从而降低血液的黏度、改善微循环、减轻氧化应激损伤,达到预防心血管疾病的目的 [30]。
2.2.1 抗心肌缺血再灌注损伤
心肌缺血再灌注损伤是在血液循环障碍造成缺血后,又恢复供血时出现微血管和实质器官的损伤,主要是由氧自由基引起的。原花青素强大的自由基清除作用可以减少心肌缺血再灌注损伤。张国霞等 [31]发现原花青素能明显降低血浆中MDA含量、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)和乳酸脱氢酶(lactate dehydrogenase,LDH)的活性,提高SOD活性,减少心肌梗死面积。Zhao Gaixia等 [32]发现葡萄籽原花青素有助于心脏功能的恢复,也有利于降低心肌缺血再灌注性心律失常的发生率,且能显著增加Na +/K +-ATPaseα1亚基的表达。同时,Shao Zouhui等 [33]发现通过激活蛋白激酶Akt和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS),可以提高一氧化氮(nitric oxide, NO)浓度,减少再灌注后的细胞死亡和恢复收缩功能,从而起到保护心血管的作用。
2.2.2 抗动脉粥样硬化
动脉粥样硬化是由于动脉内膜胆固醇、类脂肪等黄色粥样物质积聚而导致的病变。原花青素通过清除自由基、调整脂蛋白代谢紊乱,起到抗动脉粥样硬化的作用。Yamakoshi等 [34]通过建立动脉粥样硬化兔子模型,口服给予葡萄籽原花青素后,兔血清低密度脂蛋白(low density lipoprotein,LDL)氧化产物明显减少,表明葡萄籽原花青素通过降低兔子血浆和动脉壁组织液的自由基,从而抑制LDL氧化,表现出抗动脉粥样硬化的作用。
MDA在动脉粥样硬化的形成过程中有极重要的作用,通过修饰LDL成为MDA-LDL后,能被单核巨噬细胞辨识、内饮,形成泡沫细胞,造成动脉粥样硬化,Sano等 [35]采用61名健康人做为研究对象,在12周内分别给予葡萄籽原花青素药片和安慰剂,采用单盲法测定MDA-LDL水平,结果表明从第6周开始,服用原花青素药片比服用安慰剂的受试者血浆中MDA-LDL明显降低,证实葡萄籽原花青素能有效降低LDL氧化,防治动脉粥样硬化。
马亚兵等 [36]建立新西兰大白兔动脉粥样硬化模型,用1%葡萄籽原花青素颗粒饲料喂食,测定兔血清中各项指标。病理学结果发现兔血清C反应蛋白水平在第1周末期明显下降,作用可持续至实验结束,并且动脉粥样硬化病变程度(主动脉壁厚度和泡沫细胞数量)明显降低,由此认为原花青素抗动脉粥样硬化的作用机制与降低血清C反应蛋白水平有关。
2.2.3 保护血管内皮细胞
内皮细胞结构和功能的改变是多种心血管疾病的共同病理基础,其中NO是内皮细胞最重要的舒血管因子,能抑制血小板聚集,抑制单核细胞黏附于内皮细胞。原花青素可通过增加NO的合成,保护血管内皮细胞,进而保护心血管系统 [37]。吴秀香等 [38]采用两肾一夹法建立肾血管性高血压大鼠模型,采用葡萄籽原花青素治疗6周后发现大鼠尾动脉收缩压显著降低,其作用机制与增强抗氧化活性,增加NO的产生和释放,降低血管内皮细胞中内皮素的蛋白表达有关。Aldini等 [39]研究证实葡萄籽原花青素能够防止过氧亚硝基攻击血管内皮细胞,改善冠状动脉内皮细胞,增加NO的合成,增强人体动脉内皮依赖性舒张反应,从而达到保护心血管系统的目的。
2.3 降血压
高血压是一种以动脉血压持续升高为特征的进行性“心血管综合征”,常伴有其他临床病症,需要患者长期服药,因此需要寻找有效的、低毒性、适合长期使用的药物治疗高血压。Belcaro等 [40]以高血压患者和健康人共计119名作为研究对象,进行4个月饮食干预,高剂量组(每餐给予300mg原花青素)中93%的血压恢复正常,由此认为葡萄籽原花青素可以作为非药物干预方法治疗高血压。张团笑等 [41]建立家兔离体胸主动脉环灌流模型,发现葡萄籽原花青素能减少Ca 2+内流、促进NO的释放、舒张主动脉血管、降低血压,同时葡萄籽原花青素也能降低正常家兔的动脉血压。其他植物中的原花青素也具有抗高血压作用,如博森草莓种子原花青素能明显降低自发性高血压大鼠的收缩压 [42]。
2.4 降血脂
原花青素能够降低血液胆固醇、甘油三酯水平,从而起到降血脂作用。如Serra等 [4]给高胆固醇饮食大鼠喂食苹果,30d后,大鼠血清总胆固醇、甘油三酯和LDL的含量分别降低21.0%、27.2%和20.4%,苹果中所含的原花青素类成分(儿茶素、表儿茶素和原花青素B1)是其降脂主要成分。还有葡萄籽 [43]、可可 [44]、花生种皮 [45]等食材中所含有的原花青素均有降脂作用,表明可以考虑将食源性原花青素作为非药物方法治疗高血脂。
2.5 降血糖
原花青素的降血糖作用机制如下:1)减少肠道的糖吸收,如Zhang Huiwen等 [3]证实花生种皮原花青素能抑制小肠二糖酶活性,从而减少小肠中麦芽糖和蔗糖的吸收,其中3个三聚体(肉桂鞣质D-1、表儿茶素-(2β→O→7,4β→8)-[儿茶素-(6→4β)]-表儿茶素、表儿茶素-(4β→8)-表儿茶素-(2β→O→7,4β→8)-儿茶素)的降血糖活性强于二聚体和儿茶素,并且活性和结构单元有关,如以表儿茶素为单元的低聚物活性大于以儿茶素为单元组成的低聚物;2)作用于胰岛β细胞,促进胰岛素释放 [46],如Castell-Auví等 [47]证实葡萄籽原花青素作用于胰岛β细胞,影响胰岛素的合成、分泌和基因表达,修复受损线粒体超极化,减少三磷酸腺苷合成和改变细胞的膜电位,并且减缓葡萄糖转运蛋白2抗体葡糖激酶和解偶联蛋白基因表达以及改变肝脏降解酶的表达,从而影响胰岛素降解。
不同连接方式的原花青素可能具有不同的降血糖机制,如Chen Liang等 [48]发现在肉桂中A型和B型原花青素均有降血糖作用,但作用机制不同,A型原花青素能提高血液和胰腺中的胰岛素浓度,而B型原花青素提高脂肪组织和肝脏的脂质积累。
2.6 抗肿瘤
原花青素的抗肿瘤作用机制是通过抗氧化、抗炎、调节信号分子(如Bcl-2、c-Fos、c-Jun、Ki67等)的表达、促进肿瘤细胞凋亡、阻滞细胞周期及抑制血管生成等作用达到抗肿瘤目的 [49-50]。Lewandowska等 [51]从月见草脱脂种子中提取的原花青素,用于人乳腺癌细胞株(MDA-MB-231)培养72h后,癌细胞存活率降低50%,侵染力降低65%,原花青素通过调节血管内皮生长因子(vascular endothelial growth factor,VEGF)和转录因子c-Fos、c-Jun的表达水平,加速乳腺癌细胞凋亡、抑制乳腺癌细胞的侵染力。Feng Lili等 [52]采用H22细胞建立小鼠肝癌异种移植模型,连续10d采用不同浓度葡萄原花青素作用后测定VEGF和肿瘤微血管密度,发现两者存在正相关,且都随着原花青素浓度增加而降低。
2.7 其他活性
原花青素还被报道具有其他活性,如抗菌、抗病毒、抗炎,治疗干眼症、白内障等作用 [53-54]。
密罗木中的原花青素被报道具有较强的抗单纯疱疹病毒活性,可直接与病毒包膜相互作用 [55],卫矛科植物中的原花青素被报道具有较强的抗艾滋病病毒活性 [56]。
Ma Li等 [57]发现葡萄籽原花青素通过激活过氧化酶活化增生受体γ抗体和抑制晚期糖基化终末产物受体的表达,抑制炎症因子表达,并保护内皮细胞。
原花青素在眼部疾病治疗中有良好的作用,如缓解干眼症 [58]、抑制白内障发生,还可用于治疗视网膜疾病、角膜疾病等 [59]。
原花青素的吸收代谢已受到越来越多的重视,此方面研究有利于促进原花青素的开发应用。对原花青素的吸收代谢主要集中在体外的Caco-2细胞模型研究和体内代谢研究。
3.1 Caco-2细胞模型
Caco-2细胞模型作为研究表皮细胞药物转运和代谢的体外模型已被广泛应用于口服药物的筛选和研究药物肠吸收过程中,也常用于原花青素的吸收代谢研究。如Hemmersbach等 [60]采用该方法研究可可中原花青素吸收,发现糖蛋白阻碍原花青素的吸收,并检测到原花青素B2产生少量的代谢产物表儿茶素、3’-O-表儿茶素和4’-O-表儿茶素。Kosińska等 [61]使用Caco-2细胞模型测定可可中3种原花青素(儿茶素、表儿茶素和原花青素B2),认为它们通过细胞旁路转运。Zumdick等 [62]利用该方法探讨山楂中不同聚合度原花青素的肠道吸收机制,发现山楂原花青素混合物之间没有促进渗透作用或协同效应。Ou等 [63]使用人类肠道上皮分化Caco-2细胞模型结合液相色谱-质谱联用技术,检测蔓越莓中A型原花青素,发现在蔓越莓所含的A型原花青素二聚体、三聚体和四聚体均可以被人体吸收。
3.2 仪器分析代谢过程
在人或动物给药一定时间后,使用现代仪器检验尿液、粪便、血浆和器官中代谢物结构及含量的变化,可研究药物的代谢转化状况。雷艳红 [64]研究了人体补充葡萄籽原花青素后血浆中代谢成分的变化,发现柠檬酸升高、乳酸降低、LDL降低,并发现在运动应激条件下,预先服用推荐剂量的原花青素可以降低由运动引起的机体氧自由基增多,提高了运动后机体的抗氧化能力。李书艺等 [65]研究大鼠给予荔枝壳原花青素低聚体后的排泄物,发现尿液的总抗氧化能力显著升高,粪便气味响应值明显降低,并证实原花青素的代谢产物有(-)-表儿茶素和m-香豆酸,并且粪便中的苯甲醛、4-甲基苯酚含量增加,吲哚、4-乙基苯酚含量降低。
Goodrich等 [66]研究了大鼠鼻饲法给予葡萄籽原花青素后的代谢产物,采用液相色谱-质谱联用检测到14个原花青素单体化合物和24个微生物代谢物。组织学检测结果显示以单倍体和二聚体为主的原花青素化合物在盲肠和结肠中聚集。Li Shuyi等 [9]给大鼠口服荔枝果皮中A型原花青素低聚体后采用液相色谱-质谱联用分析其代谢产物,发现尿液中的7个芳香酸代谢物明显增加,血浆中只检测到表儿茶素和表儿茶素甲基衍生物。
Serra等 [67]采用可可奶油和榛子皮提取物及两者混合物分别喂食大鼠,用液相色谱-质谱联用检测原花青素代谢物在血浆和器官的分布。血浆主要代谢产物随着食物来源的不同而有所区别,可可奶油的代谢产物是表儿茶素葡糖苷酸,榛子皮的代谢产物是甲基化儿茶素葡糖苷酸,而可可奶油和榛子皮提取物混合物的代谢产物是表儿茶素葡糖苷酸和儿茶素葡糖苷酸。不同器官中的代谢产物不同,肾脏是原花青素代谢的主要器官,含有极高浓度的Ⅱ相代谢产物;在脾脏或心脏中未发现代谢产物,而在所有的组织中均发现酚酸的存在。食用榛子皮提取物和两者混合物后,在大鼠肝脏中发现甲基化儿茶素葡糖苷酸;食用榛子皮提取物后,在大脑中只有甲基化儿茶素硫酸酯。
Engemann等 [68]使用猪盲肠模型模拟肠道微生物群对原花青素A2和肉桂鞣质B1的降解作用,并采用傅里叶变换质谱分析降解产物,发现约80%的原花青素A2和约40%的肉桂鞣质B1被降解为羟基化的多酚类化合物。
原花青素是一类广泛分布于自然界的物质,具有很强的生物活性,现代毒理学研究表明该类成分安全性良好。陈会丛等 [69-70]采用犬和小鼠为观察对象,给予葡萄籽提取物,动物行为、进食量等均未见异常,血液学指标、血液生化指标和尿液指标、病理组织学检查未见异常改变,心血管系统、中枢神经系统和呼吸系统无明显不良影响。急性毒性和长期毒性实验证实葡萄籽原花青素可以安全应用。
在过去的几十年中,关于原花青素的研究在诸多方面已经取得了很大的成绩,总结如下:1)已鉴定出的原花青素化学结构种类和数量日益增多,其结构鉴定方法日趋完善,加快了该类成分的研究步伐。2)自然来源广泛,日常食品、植物、中药中均有分布,美国农业部甚至建立了美国人日常食物中原花青素含量和生物学作用数据库。3)生物活性强,原花青素具有防治心血管疾病、抗高血压、降血脂、降血糖、抗癌等活性。4)毒性低,原花青素是食物中重要的有益健康成分。原花青素作为自然界分布广泛、活性强、食源性和低毒性的化合物,在药品、食品、化妆品等多个领域有潜在的应用前景。
但是在充分探索原花青素价值的过程中还有很多问题亟待解决:首先,许多食品和药材中的原花青素成分并不明确,目前被研究报道的仅是一部分,还有大量的工作需要做。其次,原花青素的结构复杂,结构单元的类型、连接方式、聚合度、空间构型和取代基对其生物活性的影响并不完全明朗,还需要大量的实验数据和总结考证。再次,原花青素的代谢过程研究尚处于起步阶段,还需要进一步深入,但是从文献检索情况可以看出,目前该领域是近几年的研究热点,不断涌现出新的研究成果,相信在不久的将来会有新的突破。最后,原花青素类成分的生物利用度低,尤其是大分子成分(三聚体以上)吸收性差,如何提高该类成分的生物利用度也是今后研究的重点。虽然原花青素的研究还有许多困难需要克服,但我们有理由相信,随着研究的不断深入、提取工艺和鉴定手段的提高,这类天然产物的药效和作用机制有希望得到明确,原花青素的作用一定能得到更好的发挥。
参考文献:
[1]CAPANOGLU E,de VOS R C H,HALL R D,et al.Changes in polyphenol content during production of grape juice concentrate[J].Food Chemistry,2013,139(1):521-526.
[2]姜贵全.落叶松树皮原花青素的分级纯化及催化降解研究[D].哈尔滨:东北林业大学,2013:68-83.
[3]ZHANG Huiwen,YANG Yumei,MA Chaomei,et al.Structures and antioxidant and intestinal disaccharidase inhibitory activities of A-type proanthocyanidins from peanut skin[J].Journal of Agricultural and Food Chemistry,2013,61(37):8814-8820.
[4]SERRA A T,ROCHA J,SEPODES B,et al.Evaluation of cardiovascular protective effect of different apple varieties-correlation of response with composition[J].Food Chemistry,2012,135(4):2378-2386.
[5]NISHIZUKA T,FUJITA Y,SATO Y,et al.Procyanidins are potent inhibitors of LOX-1:a new player in the French Paradox[J].Proceedings of the Japan Academy.Series B,Physical and Biological Sciences,2011,87(3):104-108.
[6]汪金林,赵进,吕卫金,等.原花青素对冷藏养殖大黄鱼鱼片保鲜效果研究[J].中国食品学报,2013,13(2):130-132.
[7]LELONO R A,TACHIBANA S.Bioassay-guided isolation and identification of antioxidative compounds from the bark of Eugenia polyantha[J].Pakistan Journal of Biological Sciences,.2013,16(16):812-818.
[8]赵国玲,卢红兵,杨华武.超高压液相色谱测定茶叶中儿茶素等物质的含量[J].食品工业,2012,33(4):135-137.
[9]LI Shuyi,SUI Yong,XIAO Juan,et al.Absorption and urinary excretion of A-type procyanidin oligomers from Litchi chinensis pericarp in rats by selected ion monitoring liquid chromatographymass spectrometry[J].Food Chemistry,2013,38(2/3):1536-1542.
[10]MA Qing,XIE Haihui,LI Sha,et al.Flavonoids from the pericarps of Litchi chinensis[J].Journal of Agricultural and Food Chemistry,2014,62(5):1073-1078.
[11]INFANTE R,CONTADOR L,RUBIO P,et al.Postharvest sensory and phenolic characterization of ‘Elegant Lady’ and ‘Carson’peaches[J].Chilean Journal of Agricultural Research,2011,71(3):445-450.
[12]SADHU S K,KHATUN A,PHATTANAWASIN P,et al.Lignan glycosides and flavonoids from Saraca asoca with antioxidant activity[J].Journal of Natural Medicines,2007,61(4):480-482.
[13]MA Chaomei,NAKAMURA N,HATTORI M,et al.Inhibitory Effects on HIV-1protease of constituents from the wood of Xanthoceras sorbifolia[J].Journal of Natural Products,2000,63(2):238-242.
[14]KILLDAY K B,DAVEY M H,GLINSKI J A,et al.Bioactive A-type proanthocyanidins from Cinnamomum cassia[J].Journal of Natural Products,2011,74(9):1833-1841.
[15]GONZALEZ A,SANTOFIMIA-CASTANO P,RIVERA-BARRENO R,et al.Cinnamtannin B-1,a natural antioxidant that reduces the effects of H 2O 2on CCK-8-evoked responses in mouse pancreatic acinar cells[J].Journal of Physiology and Biochemistry,2012,68(2):181-191.
[16]LIN Liechwen,KUO Yuhchi,CHOU Chengjen.Immunomodulatory proanthocyanidins from Ecdysanthera utilis[J].Journal of Natural Products,2002,65(4):505-508.
[17]BICKER J,PETERIEIT F,HENSEL A.Proanthocyanidins and a phloroglucinol derivative from Rumex acetosa L.[J].Fitoterapia,2009,80(8):483-495.
[18]ITO C,OKI T,YOSHIDA T,et al.Characterisation of proanthocyanidins from black soybeans:isolationand characterisation of proanthocyanidin oligomers from black soybeanseed coats[J].Food Chemistry,2013,141(3):2507-2512.
[19]LOU Hongxiang,YUAN Huiqing,MA Bin,et al.Polyphenols from peanut skins and their free radical-scavenging effects[J].Phytochemistry,2004,65(16):2391-2399.
[20]KAMIYA K,WATANABE C,ENDANG H,et al.Studies on the constituents of bark of Parameria laevigata Moldenke[J].Chemical and Pharmaceutical Bulletin,2001,49(5):551-557.
[21]CUI Chengbin,TEZUKA Y,YAMASHITA H,et al.Constituents of a fern,Davallia mariesii MOORE.V:isolation and structures of davallin,a new tetrameric proanthocyanidin,and two new phenolic glycosides[J].Chemical and Pharmaceutical Bulletin,1993,41(9):1491-1497.
[22]MORIMOTO S,NONAKA G I,NISHIOKA I.Tannins and related compounds.XXXVIII.Isolation and characterization of flavan-3-ol glucosides and procyanidin oligomers from cassia bark(Cinnamomum cassia Blume)[J].Chemical and Pharmaceutical Bulletin,1986,34(2):633-635.
[23]MORIMOTO S,NONAKA G I,NISHIOKA I.Tannins and related compounds.XXXV.Proanthocyanidins with a doubly linked unit from the root bark of Cinnamomu sieboldii Meisner[J].Chemical and Pharmaceutical Bulletin,1985,33(10):4338-4340.
[24]MALIK A,KULIEV Z A,AKHMEDOV Y A,et al.Proanthocyanidins of Ziziphus jujuba[J].Chemistry of Natural Compounds,1997,33(2):165-168.
[25]LIN Hsiaoching,LEE Shoeisheng.Proanthocyanidins from the leaves of Machilus philippinensis[J].Journal of Natural Products,2010,73(8):1375-1380.
[26]KIM Y,CHOI Y,HAM H,et al.Protective effects of oligomeric and polymeric procyanidin fractions from defatted grape seeds on tertbutyl hydroperoxide-induced oxidative damage in HepG2cells[J].Food Chemistry,2013,137(1/4):136-141.
[27]FRACASSETTI D,COSTA C,MOULAY L,et al.Ellagic acid derivatives,ellagitannins,proanthocyanidins and other phenolics,vitamin C and antioxidant capacity of two powder products from camu-camu fruit(Myrciaria dubia)[J].Food Chemistry,2013,139(1/4):578-583.
[28]LIU Zhiqiang,YANG Qingli,ZHANG Yan,et al.Study on antioxidant activity of proanthocyanidins from peanut skin[J].Advanced Materials Research,2011,197/198(1):1582-1586.
[29]高峰,张琨,宋昕恬,等. 葡萄籽提取物抗氧化作用人体实验研究[J].中国卫生工程学,2010,17(4):757-759.
[30]HOLT R R,HEISS C,KELM M,et al.The potential of flavanol and procyanidin intake to influence age-related vascular disease[J].Journal of Nutrition in Gerontology and Geriatric,.2012,31(3):290-323.
[31]张国霞,武艳,韩冬梅,等.原花青素对大鼠心肌缺血再灌注损伤的保护作用[J].中国生化药物杂志,2010,31(3):170-172.
[32]ZHAO Gaixia,GAO Haiqing,QIU Jie,et al.The molecular mechanism of protective effects of grape seed proanthocyanidin extract on reperfusion arrhythmias in rats in vivo[J].Biological and Pharmaceutical Bulletin,2010,33(5):759-767.
[33]SHAO Zouhui,KIMBERLY R W,ANAR D,et al.Grape seed proanthocyanidins protect cardiomyocytes from ischemia and reperfusion injury via Akt-NOS signaling[J].Journal of Cellular Biochemistry,2009,107(4):697-705.
[34]YAMAKOSHI J,KATAOKA S,KOGA T,et al.Proanthocyanidinrich extract from grape seeds attenuates the development of aortic atherosclerosis in cholesterol-fed rabbits[J].Atherosclerosis,1999,142(1):139-149.
[35]SANO A,UCHIDA R,SAITO M,et al.Beneficial effects of grape seed extract on malondialdehyde-modified LDL[J].Journal of Nutritional Science and Vitaminology’s Latest Table of Contents,2007,53(2):174-182.
[36]马亚兵,高海青,伊永亮,等.葡萄籽原花青素降低动脉粥样硬化兔血清C反应蛋白水平[J].中国动脉硬化杂志,2004,12(5):549-552.
[37]AUGER C,CHAABI M,ANSELM E,et al.The red wine extractinduced activation of endothelial nitric oxide synthase is mediated by a great variety of polyphenolic compounds[J].Molecular Nutrition & Food Research,2010,54(2):171-183.
[38]吴秀香,郭荣年,郭瑞珍,等.葡萄籽原花青素对肾血管性高血压大鼠血压的影响[J].中国病理生理杂志,2011,27(3):593-595.
[39]ALDINI G,CARINI M,PICCOLI A,et al.Procyanidins from grape seeds protect endothelial cells from peroxynitrite damage and enhance endothelium-dependent relaxation in human artery:new evidences for cardio-protection[J].Life Sciences,2003,73(22):2883-2898.
[40]BELCARO G,LEDDA A,HU S,et al.Grape seed procyanidins in pre-and mild hypertension:a registry study[J].Evidence-based Complementary and Alternative Medicine,2013:313142.http:// dx.doi.org/10.1155/2013/313142.
[41]张团笑, 牛彩琴, 胡建民,等.原花青素舒张家兔主动脉和降低动脉血压的研究[J].中国中药杂志,2008,33(14):1720-1723.
[42]FURUUCHI R,SAKAI H,HIROKAWA N,et al.Antihypertensive effect of boysenberry seed polyphenols on spontaneously hypertensive rats and identification of orally absorbable proanthocyanidins with vasorelaxant activity[J].Bioscience, Biotechnology, and Biochemistry,2012,76(9):1694-1701.
[43]薛燕潍,王峰.葡萄籽原花青素预防大鼠动脉粥样硬化作用机制研究[J].中国实用医药,2010,5(13):44-45.
[44]VERSTRAETEN S V,JAGGERS G K,FRAGA C G,et al.Procyanidins can interact with Caco-2cell membrane lipid rafts:involvement of cholesterol[J].Biochimica et Biophysica Acta,2013,1828(11):2646-2653.
[45]TAMURA T,INOUE N,OZAWA M,et al.Peanut-skin polyphenols,procyanidin A1and epicatechin-(4β→6)-epicatechin-(2β→O→7,4β→8)-catechin,exert cholesterol micelle-degrading activity in vitro[J].Bioscience,Biotechnology,and Biochemistry,2013,77(6):1306-1309.
[46]CEDO L,CASTELL-AUVI A,PALLARES V,et al.Grape seed procyanidin extract modulates proliferation and apoptosis of pancreatic beta-cells[J].Food Chemistry,2013,138(1):524-530.
[47]CASTELL-AUV☒A,CED☒L,PALLAR☒S V,et al.Procyanidins modify insulinemia by affecting insulin production and degradation[J].Journal of Nutritional Biochemistry,2012,23(12):1565-1572.
[48]CHEN Liang,SUN Peng,WANG Ting,et al.Diverse mechanisms of antidiabetic effects of the different procyanidin oligomer types of two different cinnamon species on db/db mice[J].Journal of Agricultural and Food Chemistry,2012,60(36):9144-9150.
[49]杨滢滢,王雪青,庞广昌.原花青素抗肿瘤作用机制研究进展[J].食品科学,2008,29(10):694-697.
[50]CONNOR C A,ADRIAENS M,PIERINI R,et al.Procyanidin induces apoptosis of esophageal adenocarcinoma cells via JNK activation of c-Jun[J].Nutrition and Cancer,2014,66(2):335-341.
[51]LEWANDOWSKA U,SZEWCZYK K,OWCZAREK K,et al.Procyanidins from evening primrose(Oenothera paradoxa)defatted seeds inhibit invasiveness of breast cancercells and modulate the expression of selected genes involved in angiogenesis,metastasis,and apoptosis[J].Nutrition and Cancer,2013,65(8):1219-1231.
[52]FENG Lili,LIU Binxia,ZHONG Jiayi,et al.Effect of grape procyanidins on tumor angiogenesis in liver cancer xenograft models[J].Asian Pacifi c Journal of Cancer Prevention,2014,15(2):737-741.
[53]IDOWUA T O,OGUNDAINIA A O,SALAU A O,et al.Doubly linked,A-type proanthocyanidin trimer and other constituents of Ixora coccinea leaves and their antioxidant and antibacterial properties[J].Phytochemistry,2010,71:2092-2098.
[54]HABIB A,SALEH E,SAGER A M,et al.Bactericidal effect of grape seed extract on methicillin[J].Journal of Toxicological Sciences,2010,35(3):357-364.
[55]GESCHER K,K☒HN J,LORENTZEN E,et al.Proanthocyanidinenriched extract from Myrothamnus flabellifolia Welw.extract antiviral activity against herpes simplex virus type1by inhibition of viral adsorption and penetration[J].Journal of Ethnopharmacology,2011,134(2):468-474.
[56]MAREGESI S M,HERMANS N,DHOOGHE L,et al.Phytochemical and biological investigations of Elaeodendron schlechteranum[J].Journal of Ethnopharmacology,2010,129(3):319-326.
[57]MA Li,GAO Haiqing,LI Baoying,et al.Grape seed proanthocyanidin extracts inhibit vascular cell adhesion molecule expression induced by advanced glycation end products through activation of peroxisome proliferators-activated receptor gamma[J].Cardiovascular Pharmacology,2007,49(5):293-298.
[58]孙禹,原慧萍,周欣荣,等.原花青素眼用剂型的临床应用及对干眼症的影响[J].哈尔滨医科大学学报,2009,43(3):268-274.
[59]原慧萍,马春阳,周欣荣,等.原花青素对微波诱导视网膜神经节细胞凋亡的拮抗作用[J].中国病理生理杂志,2008,24(4):812-814.
[60]HEMMERSBACH S,BRAUER S S,HUWEL S,et al.Transepithelial permeability studies of flavan-3-ol-C-glucosides and procyanidin dimers and trimers across the Caco-2cell monolayer[J].Journal of Agricultural and Food Chemistry,2013,61(33):7932-7940.
[61]KOSIŃSKA A,ANDLAUER W.Cocoa polyphenols are absorbed in Caco-2cell model of intestinal epithelium[J].Food Chemistry,2012,135(3):999-1005.
[62]ZUMDICK S,DETERS A,HENSEL A.in vitro intestinal transport of oligomeric procyanidins(DP2to4)across monolayers of Caco-2cells[J].Fitoterapia,2012,83(7):1210-1217.
[63]OU K,PERCIVAL S S,ZOU T,et al.Transport of cranberry A-type procyanidin dimers,trimers,and tetramers across monolayers of human intestinal epithelial Caco-2cells[J].Journal of Agricultural and Food Chemistry,2012,60(6):1390-1396.
[64]雷艳红.原花青素及运动对人体血液代谢指标影响的研究[D].太原:山西大学,2013:20-50.
[65]李书艺,吴茜,汪荣,等.膳食补充剂荔枝壳原花青素对大鼠排泄物的影响[J].食品科学,2013,34(15):267-271.
[66]GOODRICH K M,NEILSON A P.Simultaneous UPLC-MS/MS analysis of native catechins and procyanidins and their microbial metabolites in intestinal contents and tissues of male Wistar Furth inbred rats[J].Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2014,958:63-74.
[67]SERRA A,MACIA A,RUBIO L,et al.Distribution of procyanidins and their metabolites in rat plasma and tissues in relation to ingestion of procyanidin-enriched or procyanidin-rich cocoa creams[J].European Journal of Nutrition,2013,52(3):1029-1038.
[68]ENGEMANN A,HUBNER F,RZEPPA S,et al.Intestinal metabolism of two A-type procyanidins using the pig cecum model:detailed structure elucidation of unknown catabolites with Fourier transform mass spectrometry(FTMS)[J].Journal of Agricultural and Food Chemistry,2012,60(3):749-757.
[69] 陈会丛,翟建英,张广平,等.葡萄籽提取物原花青素一般药理学研究[J].中国中医药信息杂志,2014(3):36-39.
[70]陈会丛,翟建英,张广平,等.葡萄籽原花青素的毒理学研究[J].食品工业科技,2014,35(2):41-43.
Progress in Procyanidins Research
ZHANG Huiwen
1,2,ZHANG Yu
1,MA Chaomei
1,*
(1.School of Life Sciences,Inner Mongolia University,Hohhot010021,China;2.Baotou Medical College,Baotou014040,China)
Abstract:Procyanidins,also known as condensed tannins,are naturally occurring flavan-3-ols,present widely in the plant kingdom.This review compiles the recent reports on the chemical composition,biological activities,absorption,metabolism and toxicology of procyanidins in China and abroad.The chemical structures of procyanidins are classified according to polymerization degree combined with structure units,connection mode,configuration and substituents,with figures to illustrate each type.This paper summarizes the current knowledge on biological activities,such as antioxidant activity,cardiovascular disease prevention and inhibition of cancer,hypertension,hyperlipidemia,diabetes,etc.Meanwhile,this review elucidates the absorption and metabolism of procyanidins,including Caco-2cell model and in vivo metabolic studies.At last,toxicological studies show that procyanidins are safe.Based on the latest studies worldwide,procyanidins are considered as natural food-derived antioxidants with strong antioxidant activity and low toxicity.
Key words:procyanidins;chemical structure;biological activity;absorption;metabolism;toxicology
中图分类号:Q94
文献标志码:A
文章编号:1002-6630(2015)05-0296-09
doi:10.7506/spkx1002-6630-201505052
收稿日期:2014-04-12
作者简介:张慧文(1982—),女,讲师,博士研究生,研究方向为药用植物化学。E-mail:bjlemonzhw@126.com
*通信作者:马超美(1962—),女,教授,博士,研究方向为天然药物与功能食品。E-mail:cmma@imu.edu.cn