表1 响应面试验设计因素水平表
Table1 Factors and levels used in response surface design

因素编码水平—101蒸馏温度/℃X 1115120125刮板转速/(r/min)X 2200220240进料速率/(mL/min)X 31.52.02.5
操丽丽,庞 敏,吴学凤,潘丽军,姜绍通*
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230 009)
摘 要:采用二级分子蒸馏对酶法制备的低热量结构脂质进行纯化研究,考察分子蒸馏工艺参数对低热量结构脂质的酸值和纯度的影响。在单因素试验结果基础上,采用响应面法优化二级分子蒸馏工艺参数。结果表明,当二级分子蒸馏工艺条件为蒸馏温度122 ℃、刮板转速240 r/min、进料速率2.0 mL/min时,低热量结构脂质的酸值降为0.93 mg KOH/g,纯度为60.25%,所得回归模型拟合度良好。
关键词:分子蒸馏;低热量结构脂质;酸值;纯度;纯化
结构脂质(structured lipids,SLs)是指所有经化学或者酶法进行脂肪酸重组的天然脂质,包括脂肪酸在甘油三酯中位置的改变和(或)脂质脂肪 酸组成的变化,而低热量SLs一般是指将短碳链脂肪酸(C 2~C 4)和长碳链 脂肪酸(C 16~C 22)一起与甘油结合形成的新型脂质 [1]。由Nabisco食品公司生产的Salatrim就是在美国市场上深受广大消费者青睐的低热量SLs。低热量SLs具有普通油脂的物化特性和口感,但其热量(5 kcal/g)要比普通油脂热量(9 kcal/g)低,且具有降低胆固醇功效,可用于烤薯片、涂层、蘸酱或可可脂代用品 [2-3]。
低热量SLs可通过化学或酶法催化三乙酸甘油酯、三丙酸甘油酯、三丁酸甘油酯、丁酸等含短链脂肪酸物质与大豆油、菜籽油等天然油脂酯交换或转酯化反应制备 [4-5],但不管是化学法还是酶法,反应体系中都产生副产物,如游离脂肪酸、单甘酯、甘二酯等。结构脂质传统的分离纯化方法主要有精馏或分馏,但在 加工过程中,需要采用高温,会出现酰基转移现象,造成最终 产品的损失或非目标产品含量的增加 [6]。
分子蒸馏是一种新型的液-液分离技术,其原理是在极高真空度条件下,依据混合物中组分中不同分子间运动自由程的不同,在远低于其沸点温度条件下而将其分离,特别适合于高分子质量、高沸点、热敏性物质的分离提纯 [7]。分子蒸馏技术因其操作温度低、受热时间短、分离程度和产品收率高、工艺清洁环保等特点,在油脂工业领域得到广泛应用,如用于芳香油的精制 [8-9],单甘酯 [10-11]、甘油二酯 [12-14]的提纯,植物油脱臭馏出物或油脚中VE的提取 [15-17]、毛油的脱酸 [18-20]、功能性脂肪酸的富集 [21-22]、天然色素的提取 [23]、高碳脂肪醇的精制 [24]等。本研究采用刮膜式分子蒸馏仪对低热量SLs进行分离纯化,确定分子蒸馏法提纯低热量SLs的最佳工艺条件,为其工业化生产提供依据。
1.1 材料与试剂
稻米油(二级油) 安徽省思润谷物油精炼有限公司;Lipozyme TL IM酶(来自Thermomyces lanuginosa) 诺维信生物制药有限公司;三乙酸甘油酯(含量大于98.5%)、正己烷(色谱纯)、乙腈(色谱纯)、丙酮(色谱纯) 国药集团化学试剂有限公司;其他试剂皆为分析纯。
1.2 仪器与设备
SHY-2A型恒温气浴摇床 江苏金坛市金城国胜实验仪器厂;旋转蒸发器 德国Heidolph公司;POPE2#分子蒸馏仪 美国Pope公司;GCMS-QP2010气相色谱-质谱(gas chromatography-mass spectrum,GC-MS)仪(配备四极杆质谱和氢火焰离子化检测器) 日本岛津公司;2695高效液相色谱仪(配备2424蒸发光散射检测器) 美国Waters公司。
1.3 方法
1.3.1 转酯化合成低热量SLs
称取30 g固定化脂肪酶Lipozyme TL IM,装入经烘干的500 mL锥形瓶中,加入300 μL蒸馏水,混匀后将锥形瓶封口后放入冰箱中过夜;再分别称取200 g稻米油、100 g三乙酸甘油酯加入锥形瓶中,用封口膜密封后置于摇床,55 ℃,180 r/min,反应24 h。反应结束后,取出锥形瓶,并静置一段时间使脂肪酶自然沉降,取出上层油样用于分子蒸馏纯化。
1.3.2 分子蒸馏实验
1.3.2.1 一级分子蒸馏条件
将转酯化低热量SLs样品进行分子蒸馏。蒸馏条件为:预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa、蒸馏温度90 ℃、刮板转速200 r/min、进料速率2.0 mL/min。分别收集轻相和重相用于分析和后续实验。
1.3.2.2 二级分子蒸馏单因素试验
在 预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa条件下,分别考察蒸馏温度(110、 115、120、125、 130 ℃)、刮板转速(160、180、200、220、240 r/min)、进料速率(1.0、1.5、2.0、2.5、3.0 mL/min)对低热量SLs的酸值和纯度的影响。
1.3.2.3 二级分子蒸馏响应面法优化试验设计
采用响应面中的Box-Behnken设计方法,以低热量SLs酸值和纯度为响应值,每个因素取3 个水平,综合考察蒸馏温度(X 1)、刮板转速(X 2)、进料速率(X 3) 3 个因素对分子蒸馏效果的影响,设计三因素三水平的响应面优化试验,试验因素及水平如表1所示。利用Design-Expert软件对数据进行二次多元回归方程拟合。
表1 响应面试验设计因素水平表
Table1 Factors and levels used in response surface design

因素编码水平—101蒸馏温度/℃X 1115120125刮板转速/(r/min)X 2200220240进料速率/(mL/min)X 31.52.02.5
1.3.3 高效液相色谱-蒸发光散射(high performance liquid chromatography-evaporative light scattering detector,HPLC-ELSD)法测定低热量SLs纯度
称取约20 mg的油样,用2.0 mL正己烷溶解,过0.45 μm滤膜后进行HPLC-ELSD分析。
色谱条件:Symmetry RP C 18色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈-丙酮(50∶50,V/V);流速:1.0 mL/min;柱温:30 ℃;漂移管温度:60 ℃;N 2压力:25 psi;进样量:10 μL;增益:50。采用面积归一化法计算低热量SLs纯度。
1.3.4 GC-MS分析
样品准备:称取约20 mg的油样,用2.0 mL正己烷溶解,过0.45 μm滤膜后用于GC-MS分析。
色谱条件:DB-17 ht熔融石英毛细管柱(30 m×0.25 mm,0.25 μm),载气为高纯氦气,流速1.5 mL/min,分流比50∶1,进样量1 μL,溶剂延迟3 min。进样口温度350 ℃,接口温度350 ℃,柱温100 ℃,保持1 min,以10 ℃/min速率升至150 ℃,再以20 ℃/min速率升至270 ℃,最后以5 ℃/min速率升至320 ℃,保持8 min。
质谱条件:电子电离源,电子能量70 eV,离子源温度250 ℃,扫描范围m/z 40~1 000,电子倍增器电压1.13 kV。
1.3.5 低热量SLs的脂肪酸组成分析
甲酯化方法:在10 mL离心管中滴入2滴油,加入2.0 mL的正己烷充分溶解后,再加入500 ☒L 1mol/L KOH-CH 3OH溶液,剧烈摇晃5 min。再加4 mL蒸馏水,混合均匀后,静置分层取上层,用无水Na 2SO 4干燥两次备用,进行GC分析。
GC条件:色谱柱为DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm),载气为高纯氦气,流速0.8 mL/min,分流比50∶1,进样量1 μL,溶剂延迟2 min。进样口温度250 ℃,氢火焰离子化检测器温度260 ℃,柱温6 0 ℃,保持2min后以15 ℃/min速率升至200 ℃,再以3 ℃/min 速率升至230 ℃,保持5 min。空气流速400 mL/min,氢气流速50 mL/min。
按照校正峰面积归一化法,以物质的量百分比计算其结果。
2.1 一级分子蒸馏
对转酯化合成的低热量SLs样品进行酸值和纯度的测定,测得其酸值为20.86 mg KOH/g,纯度为58.21%。转酯化反应产物中除了低热量SLs,还含有没有反应完的底物稻米油、三乙酸甘油酯及其在1,3-位特异性脂肪酸Lipozyme TL IM作用下产生的游离脂肪酸、单甘酯和甘油二酯。三乙酸甘油酯在日本、欧洲国家是不允许作为食品添加剂的,一定要除去 [5]。三乙酸甘油酯的沸点比长链脂肪酸如油酸、亚油酸的沸点要低,在分子蒸馏过程中,三乙酸甘油酯大量蒸出时会带走热量影响油酸蒸出,所以分子蒸馏实验进行二级处理。一级分子蒸馏目的是为了除去三乙酸甘油酯及其衍生的乙酸、乙酸单甘酯和二乙酸甘油二酯,以便后续对低热量SLs样品的脱酸工作更容易进行。
按照1.3.2.1节分子蒸馏条件对低热量SLs样品进行一级分子蒸馏,收集得到的轻相与重相分别在1.3.4节色谱条件下进行GC-MS分析,其总离子流图见图1。

图1 一级分子蒸馏轻相(A)和重相(B)的GC-MS总离子色谱图
Fig.1 GC-MS total ion chromatograms of light phase (A and heavy phase (B by primary molecular distillation
图1 显示:保留时间在4~6 min之间的物质分别为乙酸单甘酯、二乙酸甘油二酯和三乙酸甘油酯;在保留时间10.5~12 min之间物质为游离长链脂肪酸;在保留时间13~15 min之间的甘油三酯主要是含有2个乙酸1个长链脂肪酸的短长链甘油三酯(triglycerides with two shortchain and one long-chain fatty acids,SSL);保留时间在24~30 min之间的甘油三酯主要是含有1个乙酸2个长链脂肪酸的短长链甘油三酯(triglycerides with one shortchain and two long-chain fatty acids,SLL),SSL型甘油三酯和SLL型甘油三酯即为所需低热量SLs。从图1可以看出,通过一级分子蒸馏后,可以基本上将乙酸、乙酸单甘酯、二乙酸甘油二酯和三乙酸甘油酯除掉,同时带走了部分游离长链脂肪酸,而低热量SLs则保留在重相中。对重相的酸值和纯度进行测定,测得酸值为13.48 mg KOH/g,纯度为74.25%。食用油国家标准中要求,三级食用油 的酸值要低于1.0 mg KOH/g,说明重相需要进行二级分子蒸馏脱酸。
2.2 二级分子蒸馏单因素试验结果
2.2.1 蒸馏温度对酸值和纯度的影响
在预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa、刮板转速200 r/min、进料速率2 mL/min条件下,考察不同的蒸馏温度对重相中低热量SLs酸值和纯度的影响,结果见图2。
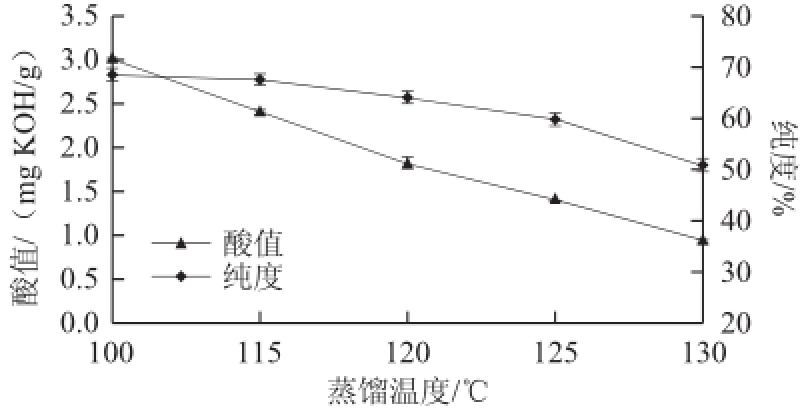
图2 蒸馏温度对低热量SLs酸值和纯度的影响
Fig.2 Effect of distillation temperature on acid value and purity of low-calorie SLs
由图2可以看出,随着蒸馏温度的升高,酸值逐渐降低。当温度高于125 ℃时,重相中低热量SLs纯度降低明显。经GC-MS分析馏出的轻相,发现其主要组分为三乙酸甘油酯、单甘酯、游离长链脂肪酸、1个乙酸和1个长链脂肪酸组成的甘油二酯,还有一些SSL型结构脂质,而且随着温度升高,轻相中SSL型结构脂质含量越高。综合考虑重相中低热量SLs酸值与纯度,选择蒸馏温度为115~125 ℃进行响应面优化试验。
2.2.2 刮板转速对酸值和纯度的影响
在预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa、蒸馏温度120 ℃、进料速率2 mL/min条件下,考察不同的刮板转速对重相中含低热量SLs酸值和纯度的影响,结果见图3。
分子蒸馏仪的刮板转速对分离效果有一定的影响,当刮板转速太慢,蒸发表面上形成液膜厚度大,不利于传质传热;刮板转速太快,部分原料直接被刮膜器甩到中间冷凝器上,导致分离效率的降低。因此,选择合适的刮板转速有利于分子蒸馏过程进行。由图3可以看出,随着刮板转速的加快,酸值降低明显;相对于酸值,而重相中低热量SLs纯度的降低要平缓一些。综合考虑重相中低热量SLs酸值与纯度,选 择刮板转速200~240 r/min进行响应面优化试验。
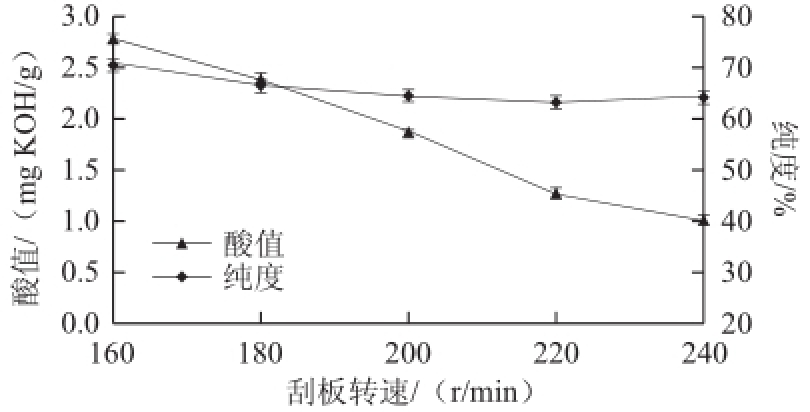
图3 刮板转速对低热量SLs酸值和纯度的影响
Fig.3 Effect of scraper speed on acid value and purity of low calorie SLs
2.2.3 进料速率对酸值和纯度的影响
在预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa、蒸馏温度120 ℃、刮板转速200 r/min条件下,考察不同的进料速率对重相中含低热量SLs酸值和纯度的影响,结果见图4。
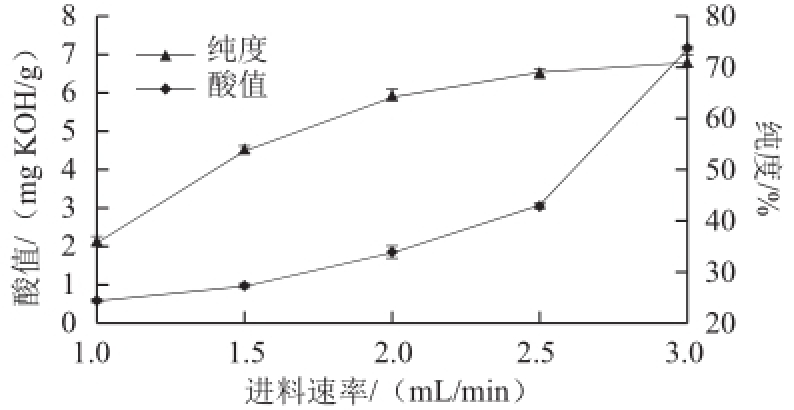
图4 进料速率对低热量SLs酸值和纯度的影响
Fig.4 Effect of feeding rate on acid value and purity of low-calorie SLs
进料速率也是影响分子蒸馏过程的一个重要因素。当进料速率过慢,原料在蒸发面上停留时间过长,受热时间也会延长,得率会降低;而进料速率过快,原料在蒸发面上停留时间则短,受热时间也短,分离不充分。由图4可以看出,随着进料速率的加快,酸值逐渐上升,在2.5 mL/min之前酸值上升相对较缓,在2.5 mL/min之后酸值剧烈上升。在物料流速1.0~2.0 mL/min之间时,低热量SLs纯度随进料速率加快呈线性上升,在高于2.0 mL/min后趋于平缓,故选择进料速率1.5~2.5 mL/min进行响应面优化试验。
2.3 二级分子蒸馏响应面法优化结果
响应面试验结果及方差分析见表2。采用Design Eepert统计软件对模型及回归方程进行显著性检验(表3、4)。经回归拟合后求得Y 1(低热量SLs酸值)和Y 2(低热量SLs纯度)的响应函数,其表达式分别为:
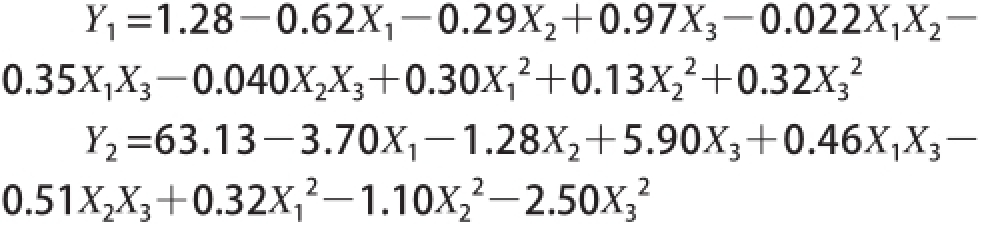
表2 响应面分析试验设计及结果
Table2 Experimental scheme and results of response surface design
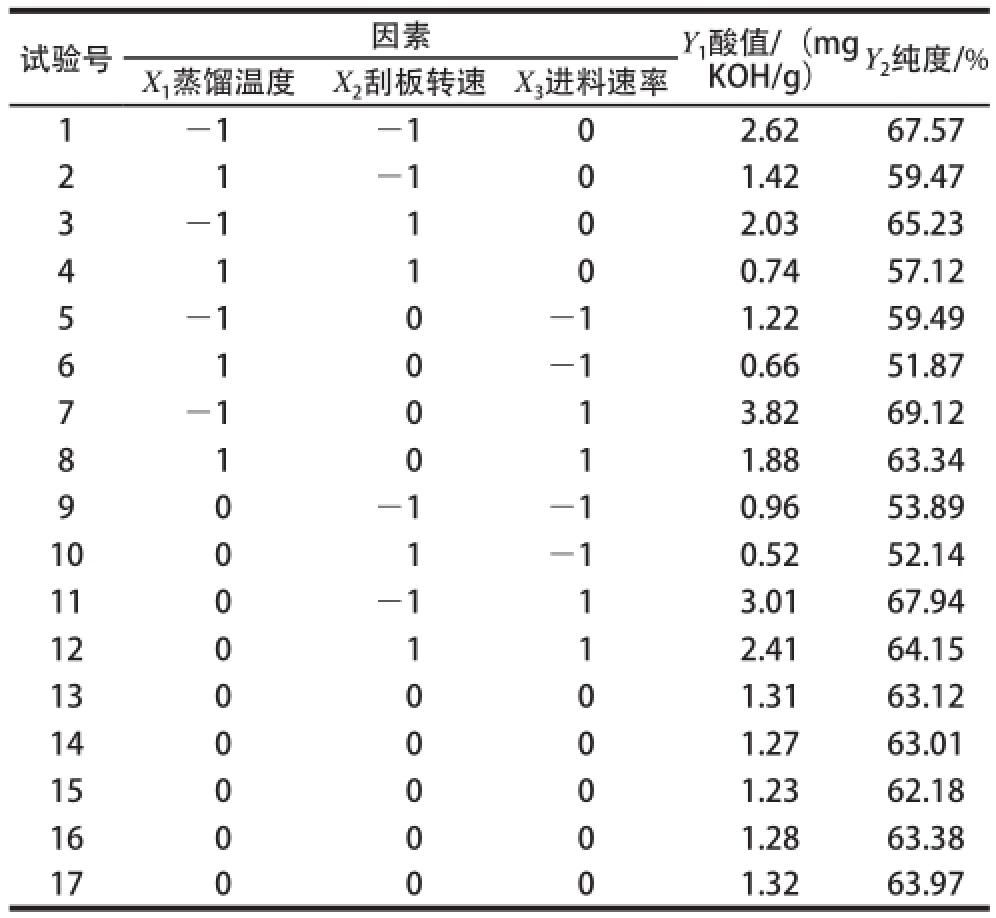
试验号因 素Y 1酸值/(mg KOH/g)Y 2纯度/% X 1蒸馏温度X 2刮板转速X 3进料 速率1—1—102.6267.57 21—101.4259.47 3—1102.0365.23 4 1 1 0 0.7457.12 5—10—11.2259.49 6 1 0—10.6 651.87 7—1013.8269.12 81011.8863.34 9 0—1—10.9653.89 1001—10.5252.14 110—113.01 67.94 120112.4164.15 130001.3163.12 140001.2763.01 150001.2362.18 160001.2863.38 170001.3263.97
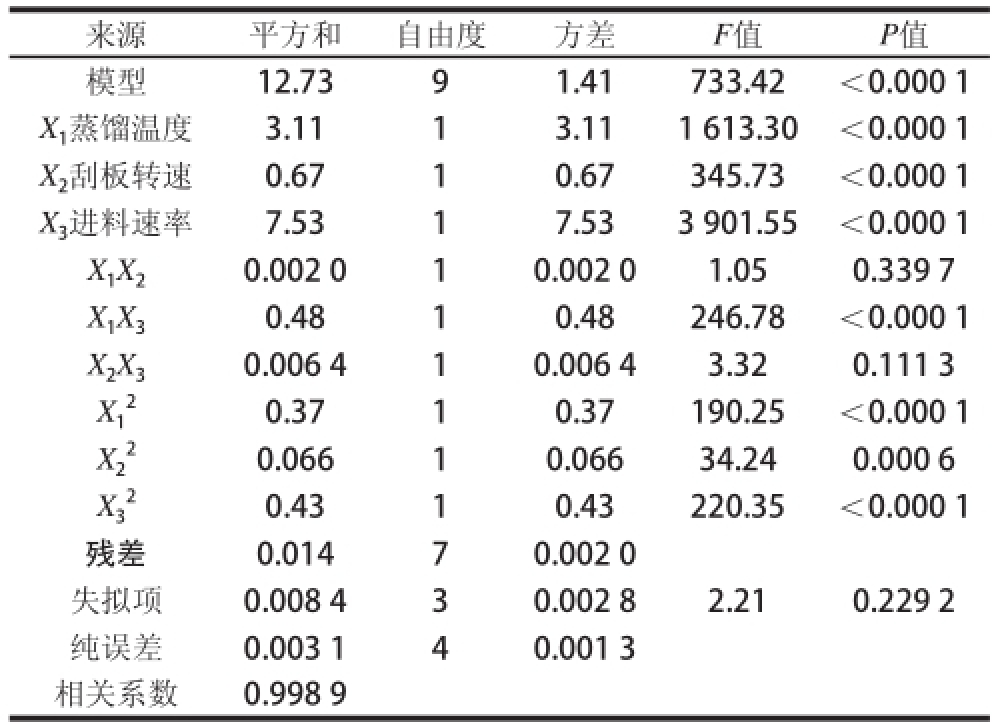
表3 低热量SLs的酸值试验结果方差分析表
Table3 Analysis of variance for acid value of low-calorie SLs
注:P<0.01表示差异极显著;0.01<P<0.05表示差异显著;P>0.05表示差异不显著。下同。
来源平方和自由度方差F值P值模型12.7391.41733.42<0.000 1 X 1蒸馏温度3.1113.111 613.30<0.000 1 X 2刮板转速0.6710.67345.73<0.000 1 X 3进料速率7.5317.533 901.55<0.000 1 X 1X 20.002 010.002 01.050.339 7 X 1X 30.4810.48246.78<0.000 1 X 2X 30.006 410.006 43.320.111 3 X1 2 0.3710.37190.25<0.000 1 X2 2 0.06610.06634.240.000 6 X3 2 0.4310.43220.35<0.000 1残差0.01470.002 0失拟项0.008 430.002 82.210.229 2纯误差0.003 140.001 3相关系数0.998 9
从表3、4的方差分析结果可以看出,所得的Y 1和Y 2的回归模型都极显著,失拟项不显著,说明方程的拟合度好,可用该模型来预测各项分子蒸馏参数对重相中低热量SLs酸值和纯度的影响是可行的。
根据所建立的数学模型进行参数分析,当分子蒸馏参数为蒸馏温度122 ℃、刮板转速240 r/min、进料速率2.0 mL/min,模型预测低热量SLs酸值降为0.90 mg KOH/g,纯度为59.31%,实际得到的酸值为0.93 mg KOH/g,纯度为60.25%,说明模型拟合良好。
表4 低热量SLs的纯度试验结果方差分析表
Table4 Analysis of variance for purity of low-calorie SLs
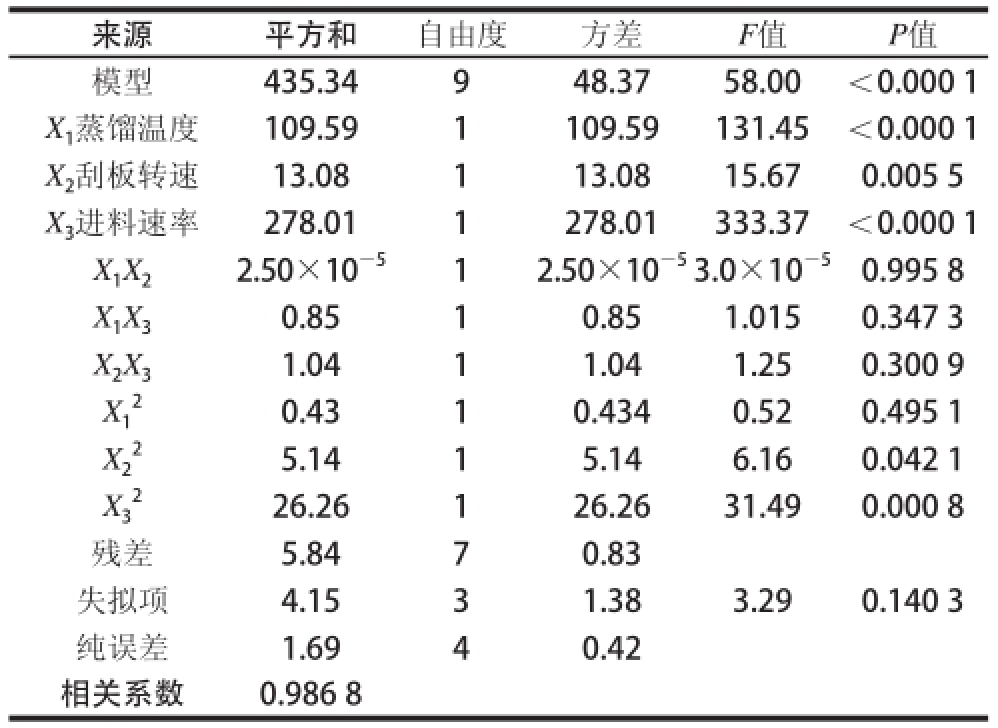
来源平方和自由度方差F值P值模型435.34948.3758.00<0.000 1 X 1蒸馏温度109.591109.59131.45<0.000 1 X 2刮板转速13.08113.0815.670.005 5 X 3进料速率278.011278.01333.37<0.000 1 X 1X 22.50×10 —512.50×10 —53.0×10 —50.995 8 X 1X 30.8510.851.0150.347 3 X 2X 31.0411.041.250.300 9 X1 2 0.4310.4340.520.495 1 X2 2 5.1415.146.160.042 1 X3 2 26.26126.2631.490.000 8残差5.8470.83失拟项4.1531.383.290.140 3纯误差1.6940.42相关系数0.986 8
2.4 低热量SLs产品HPLC分析
在预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa、蒸馏温度122 ℃、刮板转速240 r/min、进料速率2.0 mL/min条件下,分子蒸馏纯化的低热量SLs产品。对低热量SLs 纯化前和纯化后的产品进行HPLC分析,结果见图5。转酯化低热量SLs样品进行分子蒸馏脱酸时,游离脂肪酸大量蒸馏出的同时,会将部分SSL型低热量SLs也蒸馏出来了,故分子蒸馏脱酸时,不是酸值越低越好,要保证低热量SLs纯度。

图5 低热量SLs纯化前(A)和纯化后(B)的HPLC图谱PLC
Fig.5 HPLC chromatograms of low-calorie SLs before (A and after (B purification
2.5 低热量SLs产品脂肪酸组成分析
由表5可知,稻米油营养丰富,不饱和脂肪酸含量达80%以上,且饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸的比例可达到1∶2∶2,接近美国心脏学会和世界卫生组织建议的脂肪酸最佳摄入比例。从表5还可以看出,低热量SLs产品中长链脂肪酸组成比例与原料稻米油长链脂肪酸组成比例相似,也表明合成的低热量SLs不仅降低了热量,同时保留了米糠油长链脂肪酸组成比例。
表5 低热量SLs产品和米糠油脂肪酸组成
Table5 Fatty acid composition of low-calorie SLs product and rice bran oil %
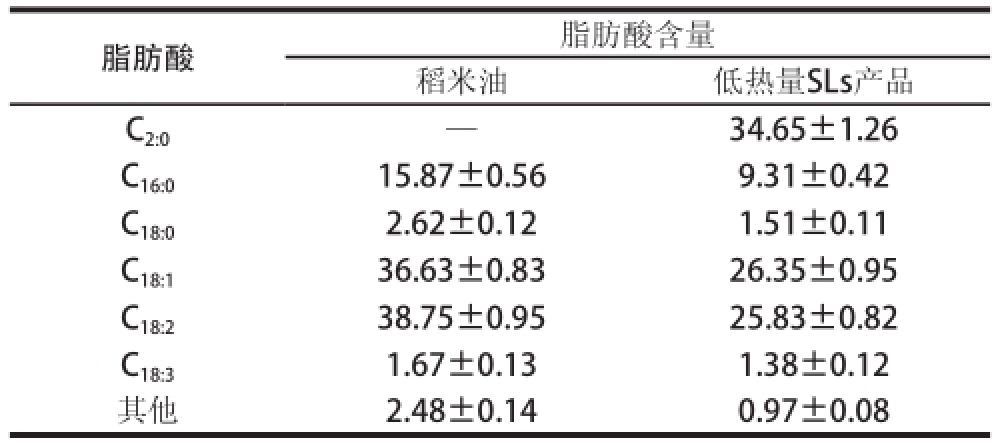
注:—.未检测到。
脂肪酸脂肪酸含量稻米油低热量SLs产品C 2:0—34.65±1.26 C 16:015.87±0.569.31±0.42 C 18:02. 62±0.121.51±0.11 C 18:136.63±0.8326.35±0.95 C 18:238.75±0.9525.83±0.82 C 18:31.67±0.131.38±0.12其他2.48±0.140.97±0.08
本实验采用了二级分子蒸馏技术对酶法催化转酯化合成的低热量SLs进行纯化研究,得到如下结论:1)一级分子蒸馏工艺参数:预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa、蒸馏温度90 ℃、刮板转速200 r/min、进料速率2.0 mL/min,在此条件下,除去了低热量SLs中的乙酸、乙酸单甘酯、乙酸甘油二酯和三乙酸甘油酯。2)为了降低低热量SLs的酸值,在单因素试验基础上,采用响应面法优化二级分子蒸馏工艺参数蒸馏温度、刮板转速和物料流速。以低热量SLs的酸值和纯度作为响应值,所建立的数学回归模型显著,方程拟合度好,可用来预测各项分子蒸馏参数对低热量SLs酸值和纯度的影响。3)当二级分子蒸馏参数为:预热温度50 ℃、冷凝面温度20 ℃、操作压力0.1 Pa、蒸馏温度122 ℃、刮板转速240 r/min、进料速率2.0 mL/min,制备的低热量SLs产品的酸值为0.93 mg KOH/g,纯度为60.25%。对低热量SLs产品的脂肪酸组成进行分析,发现其长链脂肪酸组成比例与原料稻米油相似。
参考文献:
[1] 王瑛瑶. 结构脂质的研究进展[J]. 粮油食品科技′2007′15(2): 25-28.
[2] MANGOS T J JONES K C FOGLIA T A Lipase-catalyzed synthesis of structured low-calorie triacylglycerols[J]. Journal of the American Oil Chemists Society′1999′76(10): 1127-1132.
[3] SMITH R E FINLEY J W LEVEILLE G A Overview of salatrim a family of low-calorie fats[J]. Journal of Agricultural and Food Chemistry′1994′42(2): 432-434.
[4] CAO Yu QI Suijie ZHANG Yang et al Synthesis of structured lipids by lipase-catalyzed interesterification of triacetin with camellia oil methyl esters and preliminary evaluation of their plasma lipid-lowering effect in mice[J]. Molecules′2013′18(4): 3733-3744.
[5] FOMUSO L B AKOH C C Enzymatic modification of triolein incorporation of caproic and butyric acids to produce reduced-calorie structured lipids[J]. Journal of the American Oil Chemists Society′1997′74(3): 269-272.
[6] 乔国平′王兴国. 功能性油脂: 结构脂质[J]. 粮食与油脂′2002′15(9): 33-36.
[7] 李燕′刘军海. 分子蒸馏技术在天然产物分离纯化中应用进展[J] . 粮食与油脂′2011′24(3): 7-11.
[8] XIONG Ying ZHAO Zhimin ZHU Longping et al Removal of three kinds of phthalates from sweet orange oil by molecular distillation[J]. LWT-Food Science and Technology′2013′53(2): 487-491.
[9] 杨颖′施迎春′陆剑兵′等. 分子蒸馏精制对葡萄柚精油理化性质及赋香性能的影响[J]. 中国食品学报′2013′13(3): 208-213.
[10] FREGOLENTE L V FREGOLENTE P B L CHICUTA A M et al Effect of operating conditions on the concentration of monoglycerides using molecular distillation[J]. Chemical Engineering Research and Design′2007′85(A11): 1524-1528.
[11] FREGOLENTE P B L PINTO G M F WOLF-MACIEL M R et al Monoglyceri de and diglyceride production through lipase-catalyzed glycerolysis and molecular distillation[J]. Applied Biochemistry and Biotechnology′2010′160(7): 1879-1887.
[12] COMPTON D L LASZLO J A ELLERF J et al Purification of 1′2-diacylglycerols from vegetable oils comparison of molecular distillation and liquid CO 2extraction[J]. Industrial Crops and Products′2008′28(2): 113-121.
[13] ZHENG Pingyu XU Yang WANG Weifei et al Production of diacylglycerol-mixture of regioisomers with high purity by two-step enzymatic reactions combined with molecular distillation[J]. Journal of the American Oil Chemists Society′2014′91(2): 251-259.
[14] LIU Ning WANG Yong ZHAO Qiangzhong et al Production of palm oil-based diacylglycerol using lecitase ultra-catalyzed glycerolysis and molecular distillation[J]. Food Science and Biotechnology′2014′23(2): 365-371.
[15] POSADA L R SHI J KAKUDA Y et al Extraction of tocotrienols from palm fatty acid distillates using molecular distillation[J]. Separation and Purification Technology′2007′57(2): 220-229.
[16] SH AO Ping JIANG Shaotong YING Yanjie Optimization of molecular distillation for recovery of tocopherol from rapeseed oil deodorizer distillate using response surface and artificial neural network models[J]. Food and Bioproducts Processing′2007′85(C2): 85- 92.
[17] 刘雷′陈星′吴琼′等. 分子蒸馏法提取南瓜籽油脚中VE[J]. 食品科学′2012′33(13): 24-27.
[18] 姜绍通′牛春祥′庞敏′等. 稻米油分子蒸馏脱酸工艺优化[J]. 食品科学′2012′33(18): 1-5.
[19] MARTINELLO M HECKER G PRAMPARO M D Grape seed oil deacidification by molecular distillation analysis of operative variables influence using the response surface methodology[J]. Journal of Food Engineering′2007′81(1): 60-64.
[20] WU Weiliang WANG Chao ZHENG Jianxian Optimizati on of deacidification of low-calorie cocoa butter by molecular distillation[J]. LWT-Food Science and Technology′2012′46(2): 563-570.
[21] ZHANG Guiyu LIU Jing LIU Yuanfa Concentration of omega-3 polyunsaturated fatty acids from oil of Schizochytrium limacinum by molecular distillation optimization of technological conditions[J]. Industrial and Engineering Chemistry Research′2013′52(10): 3918-3925.
[22] LIN W WU F W YUE L et al Combination of urea complexation and molecular distillation to purify DHA and EPA from sardine oil ethyl esters[J]. Journal of the American Oil Chemists’ Society′2014′91(4): 687-695.
[23] BATISTELLA C B WOLF MACIEL M R Recovery of c arotenoids from palm oil by molecular distillation[J]. Computers and Chemical Enginee ring′1998′22(1): 53-60.
[24] CHEN Fang WANG Zhengfu ZHAO Guanghua et al Purification process of octacosanol extracts from rice bran wax by molecular distillation[J]. Journal of Food Engineering′2007′79(1): 63-68.
Purification of Low-Calorie Structured Lipids by Molecular Distillation
CAO Lili PANG Min WU Xuefeng PAN Lijun JIANG Shaotong*
(Anhui Key Laboratory of Intensive Processing of Agricultural Products School of Biotechnology and Food Engineering Hefei University of Technology Hefei 230009′Chi na)
Abstract:Low-calorie structured lipids were synthesized by lipase-catalyzed reaction and purified by secondary molecular distillation The effect of molecular distillation parameters on acid value and purity of low-calorie structured lipids were investigated Th e process parameters of secondary molecular distillation were optimized by the combined use of single factor method and response surface methodology The results showed the degree of fitting of the regression model was good The optimum secondary molecular distillation process was achieved at 122 ℃ with a scraper speed of 240 r/min and a feeding rate of 2.0 mL/min The acid value of the resulting low-calorie structured lipids was reduced to 0.93 mg KOH/g with a purity of 60.25%.
Key words:molecular distillation low-calorie structured lipids acid value purity purification
中图分类号:TS225.6
文献标志码:A
文章编号:1002-6630(2015)06-0006-06
doi:10.7506/spkx1002-6630-201506002
收稿日期:2014-07-18
基金项目:国家自然科学基金面上项目(31371729);“十一五”国家科技支撑计划项目(2010BAD01B07);合肥工业大学青年教师创新项目(2013HGQC0006)
作者简介:操丽丽(1979—),女,讲师,博士研究生,研究方向为油脂加工与分析。E-mail:lilycao504@hotmail.com
*通信作者:姜绍通(1954—),男,教授,学士,研究方向为农产品加工与贮藏。E-mail:jiangshaotong@163.com