施 瑛 1,裴 斐 2,周玲玉 1,杨方美 3,胡秋辉 3,*
(1.南京农业大学理学院,江苏 南京 210095;2.南京财经大学食品科学与工程学院,江苏 南京 210023;3.南京农业大学食品科技学院,江苏 南京 210095)
摘 要:研究复合酶法提取紫菜藻红蛋白的最优工艺,筛选了复合酶的配比,并选取酶解温度、提取时间、加酶量和pH值为自变量,采用响应面法研究各因素及其交互作用对紫菜藻红蛋白得率和纯度的影响。结果表明,紫菜藻红蛋白复合酶法提取的最优酶配比为纤维素酶和果胶酶质量比7∶3,通过响应面优化,确定藻红蛋白最优提取工艺为:pH 6.8、酶解温度39 ℃、提取时间7.2 h、在5 g样品中加酶0.04 g。在此条件下藻红蛋白得率为2.257%,纯度达到1.656。经过验证,所得工艺参数准确,可用于复合酶法生产紫菜藻红蛋白。
关键词:紫菜;藻红蛋白;提取;复合酶法;响应面
紫菜是肉眼可见多细胞的生物,是海中互生藻类生物的统称。紫菜一般生活在距离潮间带数十米的海底,外表通常呈绿色,偶尔呈红色。紫菜中含有丰富的藻红蛋白,是海洋藻类中重要的捕光色素蛋白之一 [1-2]。藻红蛋白具有很高的医疗价值,它经适宜波长的光激发后,可以产生单线态氧及其他的氧自由基,杀伤生物大分子,为癌症等疾病的辅助治疗提供了新的技术手段 [3],具有十分重要的研究价值和应用意义。
藻红蛋白是一种胞内蛋白质,要提取分离,必须先要破碎紫菜细胞的壁和膜,使其以溶解的状态释放出来,并且要保持其活性。目前,提取分离藻红蛋白的细胞破碎方法主要有机械破碎法、反复冻融法 [4]、溶胀法 [5]及超声辅助提取法 [6]等。应用酶法提取藻红蛋白相对较少。酶法辅助提取反应条件温和、能耗低,并且酶催化具有高效性和专一性,可以克服其他提取方式能耗高、提取率低、纯度低等不足 [7-8]。目前,酶法提取已经广泛的应用在多种植物多糖 [7]、蛋白 [9]和其他功能性成分 [10]的提取中。采用复合酶破碎细胞的方法有助于紫菜的细胞壁膜的破碎,能有效提高藻红蛋白的得率,而且,操作过程中可一直保持低温状态,确保其生物活性 [11]。
响应面法是一种应用广泛的试验优化方法,它可以有效快速地确定多因子系统的最佳条件,已应用于多种优化实践中 [12-14]。因此,本实验以紫菜为原料,以藻红蛋白得率和纯度为响应指标,采用复合酶法提取紫菜藻红蛋白,并通过响应面法对藻红蛋白提取工艺进行优化,为藻红蛋白的工业化生产提供理论依据。
1.1 材料与试剂
紫菜,由南通天福海苔有限公司提供。干紫菜经粉碎后,过60 目筛,密封避光保存于—18 ℃冰箱备用。
纤维素酶(酶活力≥15 000 U/g)、果胶酶(酶活力≥500 U/g) 国药集团化学试剂有限公司;硫酸铵(分析纯) 南京化学试剂有限公司。
1.2 仪器与设备
Mikro-ACM空气筛分式粉碎机 日本Hosokawa Micron公司;BS210S电子分析天平 北京赛多利斯仪器系统有限公司;TGL20M离心机 长沙湘智离心机仪器有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;DCTZ-200三频多用途恒温超声提取机弘祥龙生物技术有限公司。
1.3 方法
1.3.1 工艺流程
紫菜粉碎(5.000 g)→按料液比1∶50加入0.1 mol/L PBS缓冲液(pH 6.8),加酶→避光水浴提取8 h→二次纱布过滤(100、200 目)→清液用20% (NH 4) 2SO 4溶液盐析除杂蛋白→离心→取上清液,45% (NH 4) 2SO 4溶液盐析得藻红蛋白→ 透析→定容→检测
1.3.2 紫菜藻红蛋白提取方法
准 确称取5.000 g紫菜干粉于6 个400 mL烧杯中,分别加入250 mL 0.1 mol/L的PBS缓冲溶液(pH值分别为6.6、6.8、7.0),再加入不同量的混合酶(经实验优化后纤维素酶与果胶酶质量比为7∶3),搅拌均匀,分别在不同温度(30、35 ℃和40 ℃)的水浴中避光提取8 h。然后分别用100 目和200 目的纱布过滤,收集清液,逐步加入分析纯的固体(NH 4) 2SO 4至终质量分数为20%,盐析12 h,以8 000 r/min离心10 min,除去杂蛋白,再将清液中逐步加入分析纯的固体(NH 4) 2SO 4至终质量分数为45%,盐析12 h,8 000 r/min离心10 min,去除清液,将沉淀溶解,用相对分子质量为3 000的透析袋流水透析24 h,再用去离子水透析24 h时,每4 h换一次水,将透析袋中的溶液定容到200 mL,进行检测。
1.3.3 藻红蛋白得率与纯度计算方法
藻红蛋白的得率和纯度根据马海乐等 [15]的方法测定。将定容后的溶液稀释10 倍,用1 cm比色皿测定其吸光度(A 560 nm、A 617 nm、A 650 nm及A 280 nm),然后按照式(1)、(2)计算藻红蛋白得率和纯度。
式中:ρ PE为提取液中藻红蛋白的质量浓度/(mg/mL),ρ PE=0. 123A 560 nm—0. 068A 617 nm+0. 015A 650 nm;V PE为提取液的体积/mL;M PE为干紫菜的质量/g。
1.3.4 酶的配比对藻红蛋白得率和纯度的影响
分别研究采用果胶酶、纤维素酶以及不同配比复合酶对藻红蛋白得率和纯度的影响,筛选最优的复合酶配比。根据预实验,纤维素酶含量越高有利于获得更高的藻红蛋白得率,因此,选择纤维素酶质量分数分别为50%、70%和90%进行进一步研究。
1.3.5 单因素试验
诸多研究表明,紫菜藻红蛋白得率和纯度主要受酶解温度、提取时间、pH值等因素影响 [16]。分别以藻红蛋白得率和纯度为指标,分别考察酶解温度(20、25、30、35、40、45、50 ℃)、提取时间(6、7、8、9、10、11、12 h)、加酶量(0.02、0.03、0.04、0.05、0.06 g)和pH值(6.2、6.5、6.8、7.1、7.4)对藻红蛋白得率和纯度的影响。
1.3.6 响应面试验设计
根据单因素试验结果,以酶解温度、提取时间、加酶量和pH值为关键工艺参数,设计四因素三水平Box-Behnken响应面试验,以藻红蛋白得率和纯度为相应指标,共设计5 个中心点和29 个不同组合的试验,试验因素水平如表1所示。
表1 响应面试验的因素水平及编码
Table1 Factors and levels used in response surface experiments
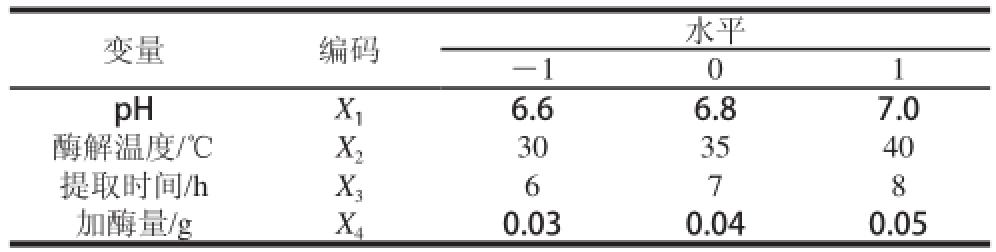
变量编码水平—101 pHX 16.66.87.0酶解温度/℃X 2303540提取时间/hX 3678加酶量/gX 40.030.040.05
1.4 数据分析
实验数据通过PASW statistics 18软件进行分析,ANOVA程序用于方差分析,当P<0.05时认为平均值间有显著性差异。最小显著差异法用于数据多重比较分析。数据以3 次独立样品测定结果的平均值±标准差表示。
2.1 酶的配比对藻红蛋白得率和纯度的影响
由图1可知,当纤维素酶与果胶酶质量比 为0∶10~7∶3时,随着纤维素酶添加比例的上升,藻红蛋白得率显著上升,但当纤维素酶质量分数超过70%后,得率略有下降。从纯度来看,当纤维素酶与果胶酶质量比为0 ∶10~9∶1时,随着纤维素酶添加比例的上升,藻红蛋白纯度逐渐上升,且添加90%的纤维素酶处理组的藻红蛋白纯度与只添加纤维素酶的处理组相比并无显著性差异。综合藻红蛋白得率和纯度考虑,选择纤维素酶和果胶酶质量比为7∶3进行进一步研究。
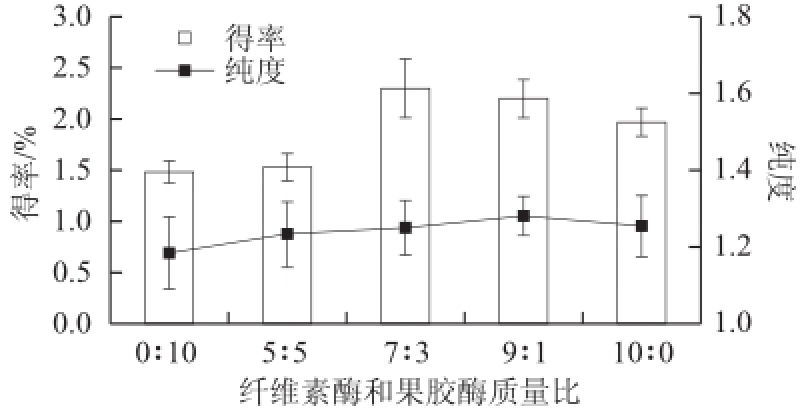
图1 酶的配比对藻红蛋白得率和纯度的影响
Fig.1 Effects of ratio between two enzymes on the extraction rate and purity of phycoerythrin from laver
2.2 复合酶法提取紫菜藻红蛋白的单因素试验结果
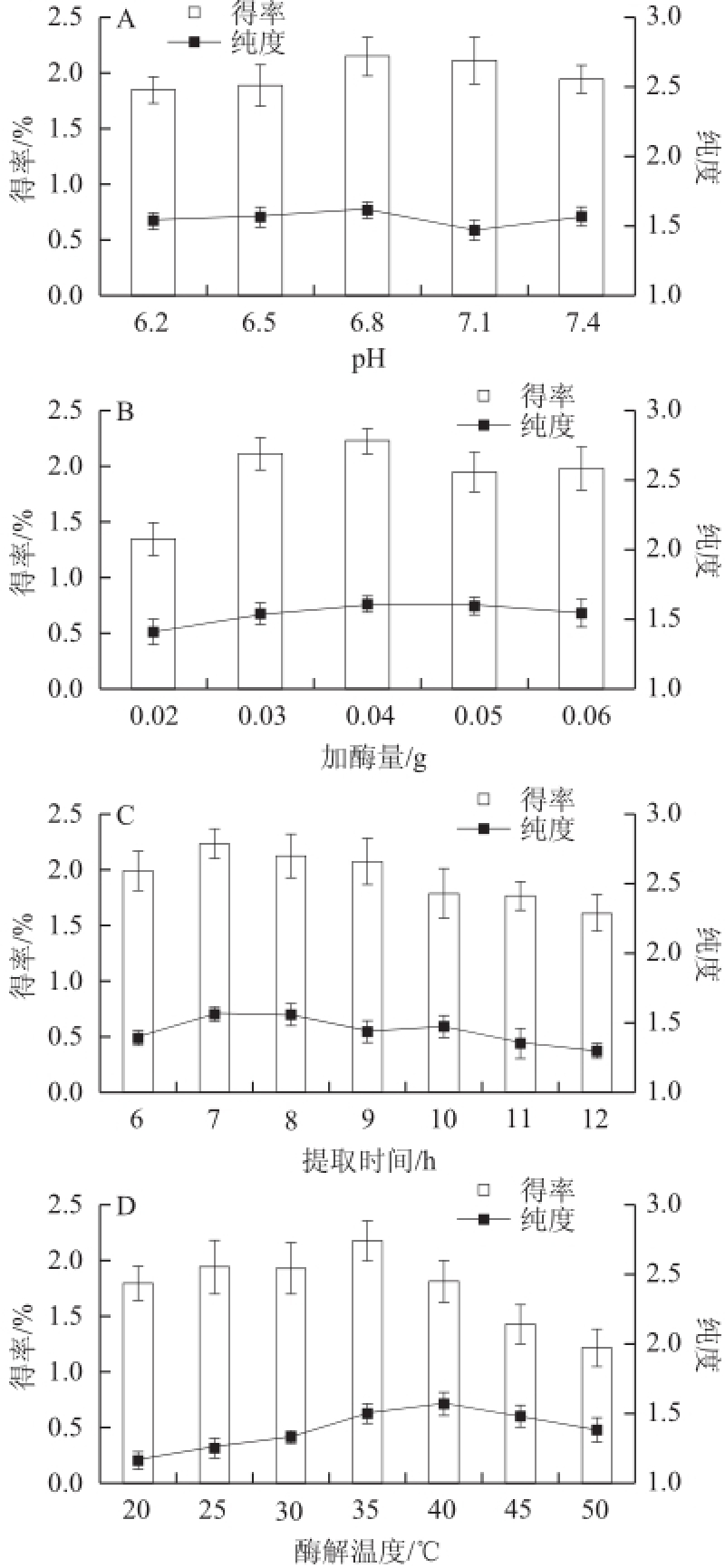
图2 pH值(A)、加酶量(B)、提取时间(C)、酶解温度(D)D对紫菜藻红蛋白得率和纯度的影响
Fig.2 Effect of pH (A)′total enzyme amount (B)′hydrolysis time (C and temperature (D on the extraction rate and purity of phycoerythrin from laver
pH值的高低直接影响着复合酶法提取紫菜藻红蛋白过程中的酶活力 [17],由图2A可知,随着pH值的升高,紫菜藻红蛋白的得率和纯度均呈现出先上升后下降的趋势,当pH值为6.8时,藻红蛋白的得率和纯度均达到最大值,这是因为试验过程所用纤维素酶的最适pH值为6.5~7.0,过低或过高的pH值都会影响纤维素酶的活力,从而导致藻红蛋白得率和纯度下降 [18]。酶反应底物的水解程度直接取决于所加酶量的多少 [19],如图2B所示,紫菜藻红蛋白的得率和纯度随着加酶量的增加呈现出了先上升、后下降,最后保持平稳的趋势。出于工业生产中成本核算的考虑,后续试验中酶添加量以0.04 g为上限。由图2C可以看出,紫菜藻红蛋白的得率随着提取时间的延长而增大,曲线呈先上升后下降,最终趋于平稳的趋势。在紫菜藻红蛋白提取初期,多糖得率相对较高,随着提取时间的进一步延长藻红蛋白得率下降的原因可能是由于过长的提取时间导致藻红蛋白的分解 [20]。而紫菜藻红蛋白的纯度呈现先上升后平稳下降的趋势,这可能是由于过长的催化时间导致反应体系中的酶解速率进一步降低,而此时多糖等较难溶出的物质也随着时间的增加逐渐被提取出来 [21],从而导致藻红蛋白的纯度降低。综合考虑,选择提取时间7 h作为最佳提取时间。温度也是决定酶活力的重要因素,温度过高,酶会变性失活,温度过低,酶活力也会降低 [22]。如图2D所示,当酶解温度在20~35 ℃时,紫菜藻红蛋白的得率和纯度均随着温度的升高而增加,当温度达到35 ℃时,最大得率可达到(2.171±0.169)%,当酶解温度超过35 ℃时,得率和纯度开始下降。温度升高可以提高酶的活性,且随温度的升高,布朗运动速率增加,分子相互碰撞的机会增加,酶催化效率增大,故紫菜藻红蛋白的得率和纯度呈现逐渐增加的趋势。当温度继续升高,超过了酶的最适宜温度时,酶逐渐失活,导致蛋白得率和纯度下降 [23]。
2.3 响应面试验结果
2.3.1 Box-Behnken试验设计及结果
本研究采用复合酶法提取紫菜藻红蛋白,并通过响应面法中的Box-Behnken试验设计优化藻红蛋白提取工艺参数。根据前期单因素试验,结合文献[24-26],确定选择pH值、酶解温度、提取时间、加酶量为自变量,以紫菜藻红蛋白的得率和纯度为响应值,进行四因素三水平Box-Behnken响应面优化试验。在29个试验组合条件下,试验设计方案及数据处理结果如表2所示。
表2 Box-Behnken试验设计及其响应值
Table2 Box-Behnken design matrix and response values for the yield and purity of phycoerythrin from llaavveerr
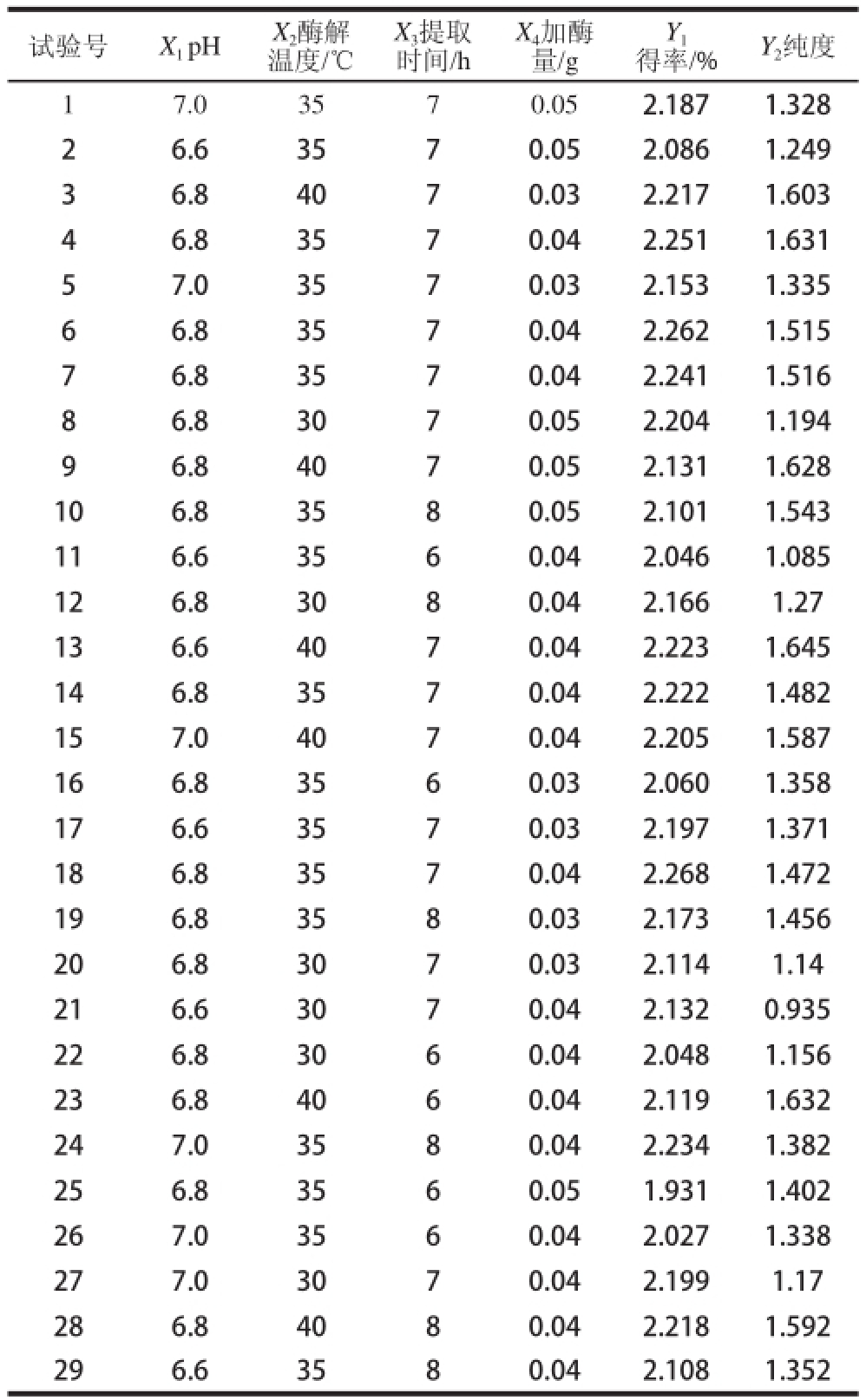
试验号X 1 pHX 2酶解温度/℃得率/%Y 2纯度17.03570.052.1871.328 26.63570.052.0861.249 36.84070.032.2171.603 46.83570.042.2511.631 57.03570.032.1 531.335 66.83570.042.2621.515 76.83570.042.2411.516 86.83070.052.2041.194 96.84070.052.1311.628 106.83580.052.1011.543 116.63560.042.0461.085 126.83080.042.1661.27 136.64070.042.2231.645 146.83570.042.2221.482 157.04070.042.2051.587 166.83560.032.0601.358 176.63570.032.1971.371 186.83570.042.2681.472 196.83580.032.1731.456 206.83070.032.1141.14 216.63070.042.1320.935 226.83060.042.0481.156 236.84060.042.1191.632 247.03580.042.2341.382 256.83560.051.9311.402 267.03560.042.0271.338 277.03070.042.1991.17 286.84080.042.2181.592 296.63580.042.1081.352 X 3提取时间/h X 4加酶量/g Y1
2.3.2 模型的建立及显著性分析
基于参数评估,运用Design-Expert V6.0软件可得出响应值与被检变量之间的逻辑关系。对这些试验数据进行二次多元回归拟合,获得编码应变量(Y 1紫菜藻红蛋白得率与Y 2纯度)对编码自变量(X 1pH值、X 2酶解温度、X 3提取时间和X 4加酶量)的关系为:

为检验方程有效性,利用分析软件进一步对其进行分析,其中复合酶法提取藻红蛋白得率和纯度的系数显著性结果见表3,多元回归模型的方差分析结果见表4。
表3 紫菜藻红蛋白得率和纯度拟合多元二次方程模型的方差分析
Table3 Analysis of variance for each term in the fitted quadratic polynomial models for phycoerythrin yield and purity
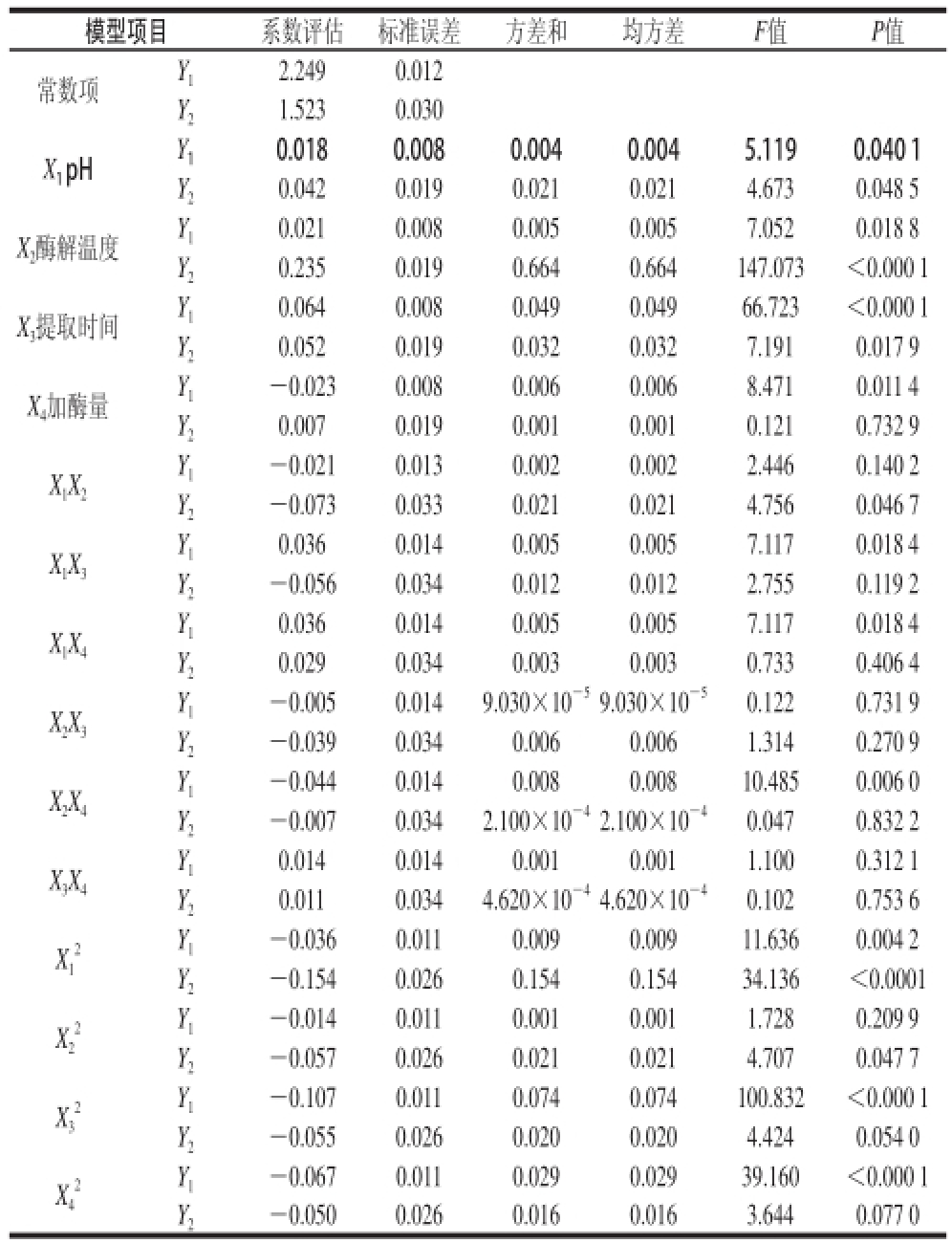
模型项目系数评估标准误差方差和均方差F值P值常数项Y 12.2490.012 Y 21.5230.030 X 1pHY 10.0180.0080.0040.0045.1190.040 1 Y 20.0420.0190.0210.0214.6730.048 5 X 2酶解温度Y 10.0210.0080.0050.0057.0520.018 8 Y 20.2350.0190.6640.664147.073<0.000 1 X 3提取时间Y 10.0640.0080.0490.04966.723<0.000 1 Y 20.0520.0190.0320.0327.1910.017 9 X 4加酶量Y 1—0.0230.0080.0060.0068.4710.011 4 Y 20.0070.0190.0010.0010.1210.732 9 X1X2 Y 1—0.0210.0130.0020.0022.4460.140 2 Y 2—0.0730.0330.0210.0214.7560.046 7 X1X3 Y 10.0360.0140.0050.0057.1170.018 4 Y 2—0.0560.0340.0120.0122.7550.119 2 X1X4 Y 10.0360.0140.0050.0057.1170.018 4 Y 20.0290.0340.0030.0030.7330.406 4 X2X3 Y 1—0.0050.0149.030×10 —59.030×10 —50.1220.731 9 Y 2—0.0390.0340.0060.0061.3140.270 9 X2X4 Y 1—0.0440.0140.0080.00810.4850.006 0 Y 2—0.0070.0342.100×10 —42.100×10 —40.0470.832 2 X3X4 Y 10.0140.0140.0010.0011.1000.312 1 Y 20.0110.0344.620×10 —44.620×10 —40.1020.753 6 X1 2 Y 1—0.0360.0110.0090.00911.6360.004 2 Y 2—0.1540.0260.1540.15434.136<0.0001 X2 2 Y 1—0.0140.0110.0010.0011.7280.209 9 Y 2—0.0570.0260.0210.0214.7070.047 7 X3 2 Y 1—0.1070.0110.0740.074100.832<0.000 1 Y 2—0.0550.0260.0200.0204.4240.054 0 X4 2 Y 1—0.0670.0110.0290.02939.160<0.000 1 Y 2—0.0500.0260.0160.0163.6440.077 0
表4 多元回归模型方差分析表
Table4 Analysis of variance (ANOVA for the quadratic polynomial models
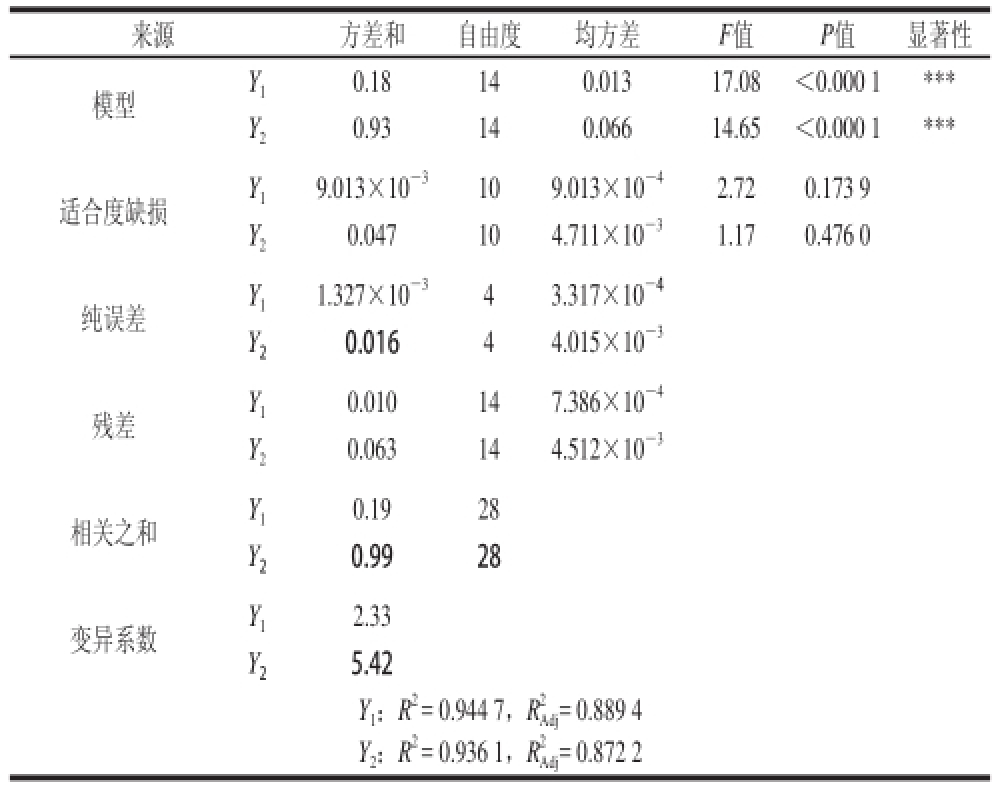
注:***.差异极显著,P<0.01。
来源方差和自由度均方差F值P值显著性模型Y 10.18140.01317.08<0.000 1*** Y 20.93140.06614.65<0.000 1***适合度缺损Y 19.013×10 —3109.013×10 —42.720.173 9 Y 20.047104.711×10 —31.170.476 0纯误差Y 11.327×10 —34 3.317×10 —4Y 20.01644.015×10 —3残差Y 10.010147.386×10 —4Y 20.063144.512×10 —3相关之和Y 10.1928 Y 20.9928变异系数Y 12.33 Y 25.42 Y 1:R 2= 0.944 7,R 2 Adj= 0.889 4 Y 2:R 2= 0.936 1,R 2 Adj= 0.872 2
由表3可知,方程的一次项中X
1、X
2、X
4对响应值Y
1(紫菜藻红蛋白得率)的影响显著(P<0.05),X
3对响应值Y
1的影响极显著(P<0.01),X
1和X
3对响应值Y
2(紫菜藻红蛋白纯度)的影响显著(P<0.05),X
2对响应值Y
2的影响极显著(P<0.01),X
4对Y
2的影响不显著;二次项
![]() 对Y
1的影响极显著(P<0.01),
对Y
1的影响极显著(P<0.01),
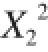 对响应值Y
1的影响不显著,
对响应值Y
1的影响不显著,
 对响应值Y
2的影响显著(P<0.05),
对响应值Y
2的影响显著(P<0.05),
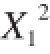 对响应值Y
2的影响极显著(P<0.01),
对响应值Y
2的影响极显著(P<0.01),
 和
和
 对Y
2的影响不显著;交互项X
1X
3和X
1X
4对响应值Y
1的影响显著(P<0.05),X
2X
4对响应值Y
1的影响极显著(P<0.01),X
1X
2、X
2X
3和X
3X
4对Y
1的影响不显著,X
1X
2对响应值Y
2的影响显著(P<0.05),X
1X
3、X
1X
4、X
2X
3、X
2X
4和X
3X
4对Y
2的影响不显著。由此可知,各具体试验因素对响应值的影响并非是简单的线性关系。
对Y
2的影响不显著;交互项X
1X
3和X
1X
4对响应值Y
1的影响显著(P<0.05),X
2X
4对响应值Y
1的影响极显著(P<0.01),X
1X
2、X
2X
3和X
3X
4对Y
1的影响不显著,X
1X
2对响应值Y
2的影响显著(P<0.05),X
1X
3、X
1X
4、X
2X
3、X
2X
4和X
3X
4对Y
2的影响不显著。由此可知,各具体试验因素对响应值的影响并非是简单的线性关系。
由表4可知,回归模型高度显著,响应值Y 1和Y 2的相关系数R 2分别为0.944 7和0.936 1,说明模型的拟合度好,表明紫菜藻红蛋白得率和纯度的试验值和预测值时间有很好的一致性;调整相关系数R 2 Adj分别为0.889 4和0.872 2,说明藻红蛋白得率和纯度的模型分别能够在88.94%和87.22%的程度上解释试验结果,仅分别有11.06%和12.78%不能用这两个回归模型表示。模型失拟项表示模型预测值与实际值不拟合的概率 [27],本试验中Y 1和Y 2模型失拟项的P值分别为0.173 9和0.476 0(都大于0.1),模型失拟项不显著,进一步说明此模型的拟合度良好。离散系数(CV/%)表示试验的精确度,数值越大,表明试验的可靠性越差 [28],本试验中Y 1和Y 2模型的CV值分别为2.33%和5.42%,说明模型方程能够较好地反应真实值。综上所述,回归模型拟合程度良好,试验误差小,能够准确的分析和预测复合酶法提取藻红蛋白的得率和纯度。
2.3.3 交互作用分析
响应面图是回归方程的形象描述,能够直观反映各个因素与响应值之间的关系以及两因素间交互作用的类型,然后进一步优化成生产条件 [29-30]。响应面图曲面坡度陡峭、等高线密集成椭圆形表示两因素交互影响大,而坡度平缓、等高线呈圆形则与之相反 [31]。
运用Design-Expert软件所获得的三维响应面图如图3、4所示。通过试验发现,复合酶法辅助提取过程中的参数变化对藻红蛋白得率和纯度会产生不同的影响。图3A和图4A显示了pH值(X 1)和酶解温度(X 2)对紫菜藻红蛋白得率(Y 1)和纯度(Y 2)的影响,如图可直观的看出,当提取时间7 min、加酶量0.05g时,X 1和X 2对Y 1的交互作用不显著,X 1和X 2对Y 2的交互作用显著。图3B和图4B显示了pH值(X 1)和提取时间(X 3)对紫菜藻红蛋白得率(Y 1)和纯度(Y 2)的影响,由图可知,X 1和X 3对Y 1存在交互作用,随着pH值和提取时间的增加,紫菜藻红蛋白的得率逐渐升高,但当pH值和提取时间增加到一定值后,紫菜藻红蛋白的得率却随着pH值的增加和提取时间的延长而降低。X 1和X 3对Y 2的相应曲面图则较为平缓,说明X 1和X 3对Y 2交互作用不显著。同理,由图3C~F和图4C~F中可以看出,X 1和X 4、X 2和X 4对Y 1的相应曲面图坡度陡峭,等高线排列紧密且趋于椭圆形,表明pH值与加酶量、提取时间与加酶量对紫菜藻红蛋白得率的交互影响相对较大,而X 2和X 3、X 3与X 4对Y 1的响应面图3C~F和X 1与X 4、X 2与X 3、X 2与X 4、X 3与X 4对Y 2的相应曲面图4C~F坡度相对平缓,等高线排列稀疏,表明酶解温度与提取时间、提取时间与加酶量对紫菜藻红蛋白得率,以及pH值与加酶量、酶解温度与提取时间、酶解温度与加酶量、提取时间与加酶量对紫菜藻红蛋白纯度的交互影响相对较弱。
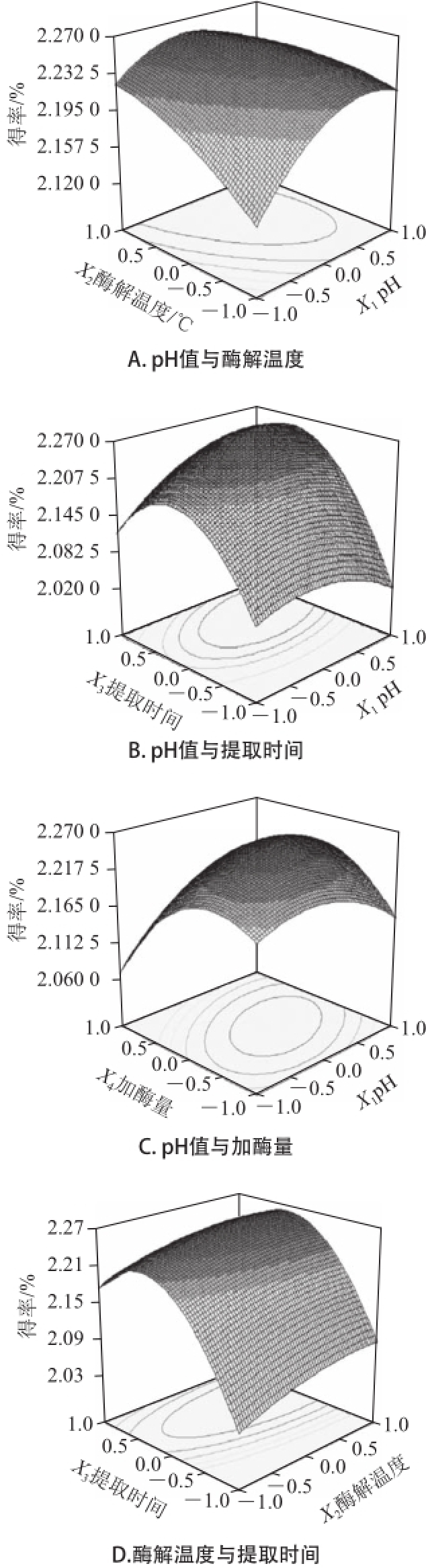
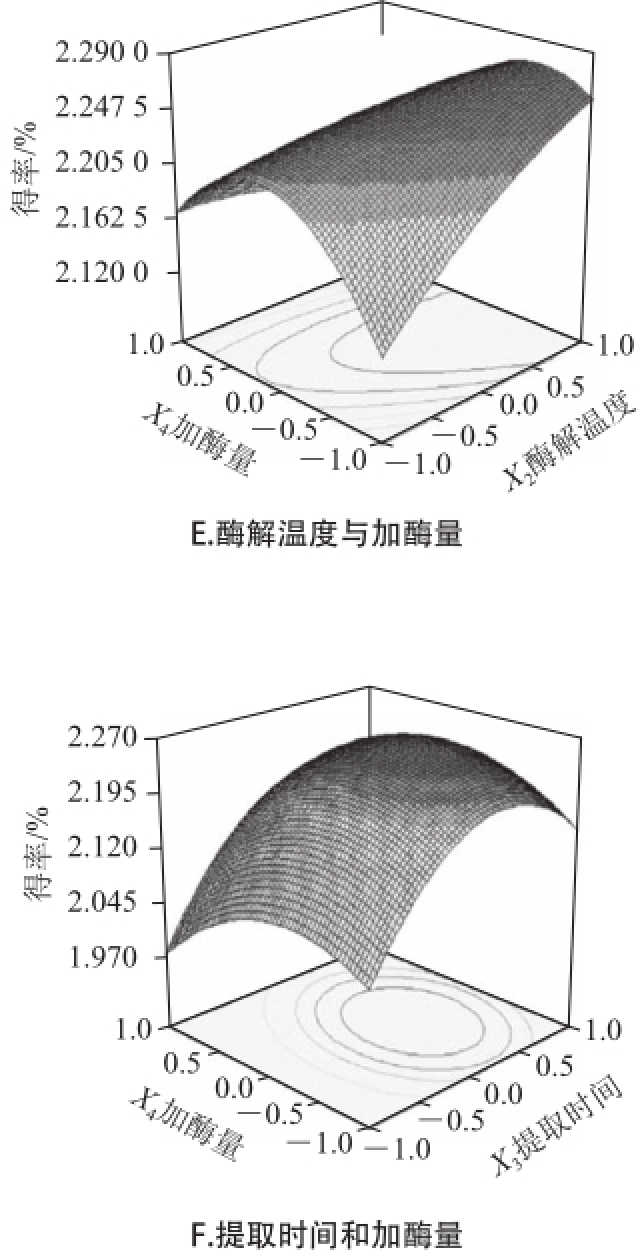
图3 提取条件对紫菜藻红蛋白得率影响的响应面图
Fig.3 Response surface plots showing the effects of extraction conditions on the extraction rate of phycoerythrin
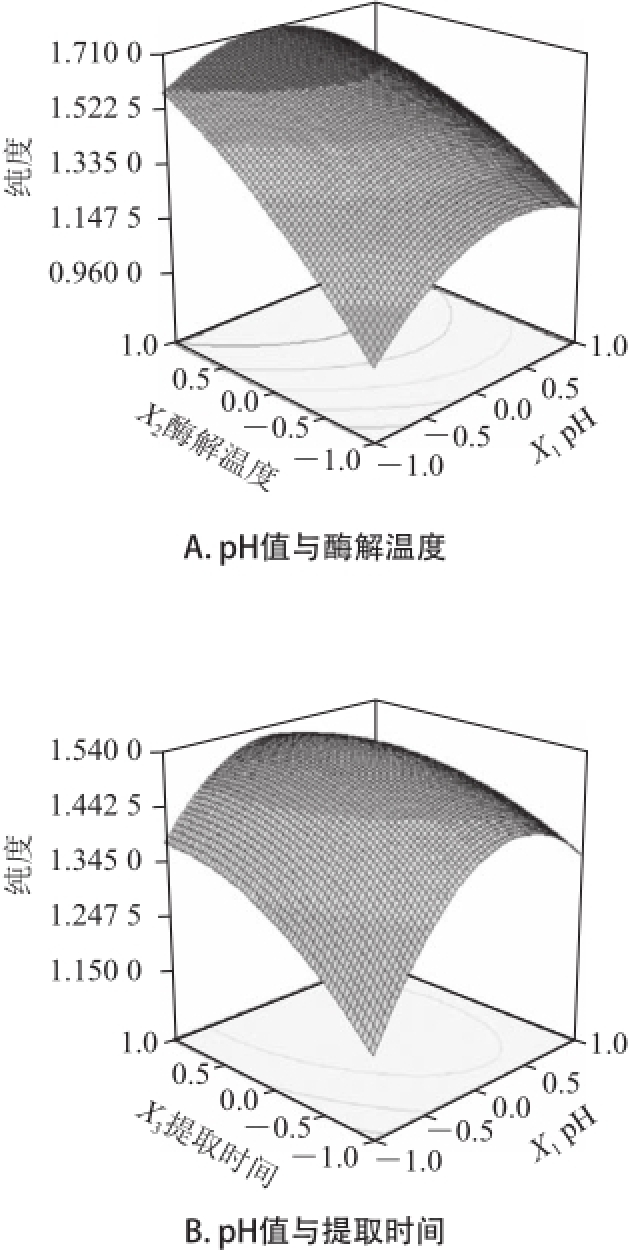
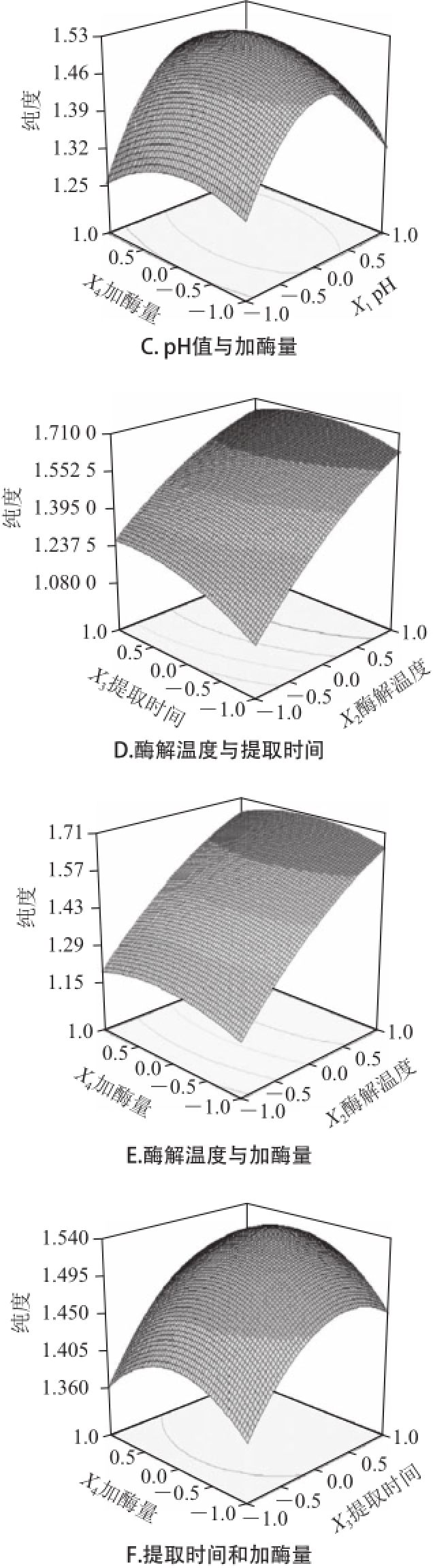
图4 提取条 件对藻红蛋白纯度影响的响应面图
Fig.4 Response surface plots showing the effects of extraction conditions on the purity of phycoerythrin
2.3.4 提取参数优化及模型验证
运用Design-Expert V6.0软件,求出被检变量的最优值。即最优提取工艺为pH 6.79、酶解温度38.76 ℃、提取时间7.24 h、加酶量0.04 g。在此条件下,酶法提取紫菜藻红蛋白得率为2.273%,纯度为1.668。考虑到操作的可行性,最优提取参数调整为pH 6.8、酶解温度39 ℃、提取时间7.2 h、加酶量0.04 g。将这些参数代入拟合方程,计算得出紫菜藻红蛋白得率为2.264%,纯度为1.677。在此条件下通过复合酶法提取紫菜藻红蛋白,3 次平行实验得出紫菜藻红蛋白实际得率为(2.257±0.019)%,实际纯度为1.656±0.024,与理论值非常接近。因此,该多元二次回归方程能够准确的且适合于对复合酶法提取紫菜藻红蛋白得率和纯度的预测。
根据实验分析,确定提取紫菜藻红蛋白所用复合酶配比为纤维素酶和果胶酶质量比7∶3,在单因素试验的基础上,通过Box-Behnken响应面试验设计得到了紫菜藻红蛋白复合酶法提取的最优工艺参数为pH 6.79、酶解温度38.76 ℃、提取时间7.24 h和在5 g样品中加酶0.04 g。考虑到实际操作可行性,最终确定紫菜藻红蛋白复合酶法提取的最优工艺为pH 6.8、酶解温度39 ℃、提取时间7.2 h和在5 g样品中加酶0.04 g。在此条件下,验证实验得紫菜藻红蛋白得率为2.257%,纯度为1.656。通过验证实验所得实际值与模型预测值接近,证明应用响应面法优化复合酶法辅助提取藻红蛋白是准确可行的,并为藻红蛋白的进一步研究和工业化生产提供理论依据。
参考文献:
[1] 陶冉, 位正鹏, 崔蓉, 等. 藻类色素蛋白的资源开发和应用研究[J].食品工业科技, 2010, 31(4): 377-380.
[2] 郭雷, 王淑军, 郝倩, 等. 紫菜多糖和藻红蛋白生物活性的研究进展[J].食品研究与开发, 2010, 31(6): 182-185.
[3] 李冠武, 王广策, 李振刚, 等. 藻红蛋白介导光动力治疗的光化学机制研究[J]. 激光生物学报, 2001, 10(2): 116-119.
[4] BADRISH S, BEENA K, UJJVAL T, et al. Extraction, purifi cation and characterization of phycocyanin from Oscillatoria quadripunctulata—isolated from the rocky shores of Bet-Dwarka, Gujarat, India[J]. Process Biochemistry, 2006, 41: 2017-2023.
[5] SILVEIRA S T, BURKERT J F M, COSTA J A V, et al. Optimization of phycocyanin extraction from S pirulina platensis using factorial design[J]. Bioresource Technology, 2007, 98: 1629-1634.
[6] JORGE B, MARCO R P. Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentum[J]. Journal of Chromatography B, 2006, 844: 39-44.
[7] 赵清秋. 条斑紫菜多糖的提取、纯化及结构分析[D]. 南京: 南京农业大学, 2012.
[8] 贺寅, 王强, 钟葵. 响应面优化酶法提取龙眼多糖工艺[J]. 食品科学, 2011, 32(2): 79-83.
[9] 王章存, 王雷, 董吉林, 等. 酶法预处理对花生蛋白提取效果的影响[J].农业工程学报, 2009, 25(3): 287-290.
[10] 王志慧, 孙智达, 谢笔钧. 响应面法优化双酶法提取莲房原花青素[J].食品科学, 2011, 32(4): 64-68.
[11] 李侠, 马艳梅, 孙慧娟, 等. 超声波-双酶法协同提取玉米须黄酮工艺的优化[J]. 西北农林科技大学学报: 自然科学版, 2014, 42(4): 221-228.
[12] PATIL P D, GUDE V G, MANNERSWAMY A, et al. Optimization of microwave—assisted transesterifi cation of dry algal biomass using response surface methodology[J]. Bioresource Technology, 2011, 102(2): 1399-1405.
[13] 梁彬, 李娟, 余杰, 等. 响应面法优化海蓬子皂苷提取工艺条件与生物活性研究[J]. 食品科学, 2014, 35(2): 102-107. doi: 10.7506/ spkx1002-6630-201402019.
[14] YANG Wenjian, FANG Yong, LIANG Jin, et al. Optimization of ultrasonic extraction of Flammulina velutipes polysaccharides and evaluation of its acetylcholinesterase inhibitory activity[J]. Food Research International, 2011, 44(5): 1269-1275.
[15] 马海乐, 肖海芳, 骆琳. 条斑紫菜藻红蛋白纯化方法的研究[J]. 农业工程学报, 2007, 23(2): 249-253.
[16] 赵殿锋. 条斑紫菜(Porphyra yezoensis)R-藻红蛋白的生物修饰及活性保护研究[D]. 南京: 南京农业大学, 2011.
[17] 田丽君, 刘志伟, 张艳, 等. 酶法辅助提取紫薯花青素研究[J]. 武汉工业学院学报, 2012, 31(6): 1-4.
[18] SIN H N YUSOF S HAMID N S A et al Optimization of enzymatic clarification of sapodilla juice using response surface methodolody[J]. Journal of Food Engineering′2006′73 (4): 313-319.
[19] 张少斌, 依晓楠, 林英, 等. 螺旋藻藻胆蛋白不同提取方法的比较[J].吉林农业大学学报, 2007, 29(4): 381-383.
[20] 王明艳, 周琴, 杨俊, 等. 响应面法同步优化裙带菜中蛋白和多糖的提取工艺[J]. 食品科学, 2012, 33(24): 66-71.
[21] 王婷, 马海乐, 曲文娟, 等. 条斑紫菜蛋白和多糖的逆流脉冲超声辅助提取技术研究[J]. 食品工业科技, 2012, 33(13): 29-33.
[22] 张成武, 曾昭琪, 张媛贞. 纯顶螺旋藻藻胆蛋白的分离纯化及其理化特性[J]. 天然产物研究与开发, 1996, 8(2): 29-33.
[23] 左继红. 微波辅助蛋白酶水解反应工艺和反应器的研究[D]. 无锡:江南大学, 2008.
[24] 郝俊, 王建中, 呼晓姝. 超声波辅助提取螺旋藻藻胆蛋白的工艺探讨[J]. 食品工业科技, 2007, 28(2): 170-172.
[25] 朱晓君, 安辛欣, 顾丽, 等. 超声辅助同时提取条斑紫菜多糖及藻胆蛋白工艺的优化[J]. 食品科学, 2008, 29(5): 241-244.
[26] 何思佳, 王洪新, 王远辉. 条斑紫菜藻红蛋白提取 工艺优化[J]. 食品工业科技, 2011, 32(11): 334-338.
[27] 卢可, 娄永江, 周湘池. 响应面优化杨梅果醋发酵工艺参数研究[ J].中国调味品, 2011, 36(2): 57-60.
[28] 陈书勤, 黄键全, 黄康宁, 等. 响应面法在优化果糖和葡萄糖色谱分离中的应用[J]. 广西轻工业, 2011(10): 20-21.
[29] LIU Yong, GONG Guili, ZHANG Jiao, et al. Response surface optimization of ultrasoun d-assisted enzymatic extraction polysaccharides from Lycium barbarum[J]. Carbohydrate Polymers, 2014, 110: 278-284.
[30] IMEN E, WAFA H, MANEL B T, et al. Development and optimisation of a non conventional extraction process of natural dye from olive solid waste using response surface methodology (RSM)[J]. Food Chemistry, 2014, 161: 345-352.
[31] JIA Junqiang, MA Haile, ZHAO Weirui, et al. The use of ultrasound for enzymatic preparation of ACE inhibitory peptides from wheat germ protein[J]. Food Chemistry, 2010, 119(1): 336-342.
Optimization of Phycoerythrin Extraction from Lavers by Mixed Enzymes Using Response Surface Methodology
SHI Ying
1′PEI Fei
2′ZHOU Lingyu
1′YANG Fangmei
3′HU Qiuhui
3′*
(1. College of Science Nanjing Agricultural Un iversity Nanjing 210095′China; 2. College of Food Science and Engineering Nanjing University of Finance and Economics Nanjing 210023′China; 3. College of Food Science an d Technology Nanjing Agricultural University Nanjing 210095′China)
Abstract:In order to obtain the optimal enzymatic extraction conditions for phycoerythrin from laver with both cellulase and pectinase, the mixing ratio between the two enzymes was selected, and response surface methodology was used to explore the effects of extraction temperature, extraction time, total enzyme amount, and pH as w ell as their interactions on the yield and purity of phycoerythrin. The optim al extraction conditions were determined as follows: a cellulase to pectinase ratio of 7:3 (m/m); pH 6.8, 39 ℃, 7.2 h, and a total enzyme amount of 0.04 g. Under these conditions, the extraction rate of phycoerythrin was 2.257%, and the purity of phycoerythrin was 1.656. The predicted parameters obtained from this work were accurate, and could be applied to extraction and production of phycoerythrin from lavers.
Key words:laver; phycoerythrin; extraction; mixed enzymes; response surface methodology
中图分类号:TS210.4
文献标志码:A
文章编号:1002-6630(2015)06-0051-07
doi:10.7506/spkx1002-6630-201506010
收稿日期:2014-09-23
基金项目:江苏省科技支撑计划项目(BE2009368-2)
作者简介:施瑛(1971—),女,博士研究生,研究方向为食品营养与化学。E-mail:shiying@njau.edu.cn
*通信作者:胡秋辉(1962—),男,教授,博士,研究方向为食品科学与工程。E-mail:qiuhuihu@njau.edu.cn