表1 Box-Behnken试验设计因素及水平
Table1 Factors and levels used in Box-Behnken experimental design
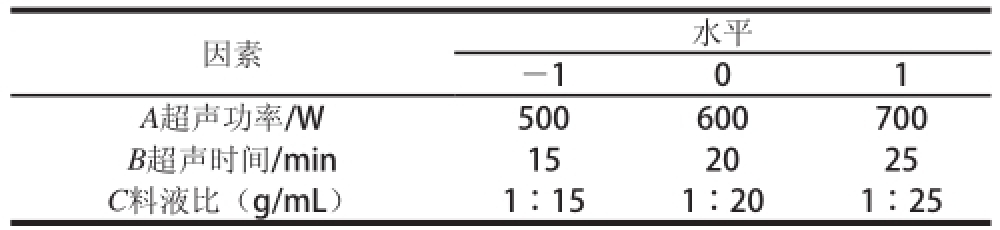
因素水平—101 A超声功率/W 500600700 B超声时间/min152025 C料液比(g/mL)1∶151∶201∶25
周思思 1,王榆元 2,刘 丹 1,张一旻 1,刘思余 1,王晓晴 1′*,曾晓雄 1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.南华大学化学化工学院,湖南 衡阳 421001)
摘 要:以干燥人参花为原料提取多糖,在单因素试验的基础上,利用响应面分析法优化超声波辅助提取人参花多糖工艺,并建立回归模型;同时探究其体外抗氧化活性。结果表明:超声波辅助提取人参花多糖的最佳提取工艺为超声功率586 W、超声时间18.65 min、料液比1∶19.75(g/mL),在此条件下多糖得率为(5.20±0.17)%(n=3)。超声提取的人参花多糖具有较高的抗氧化活性,对1,1-二苯基-2-三硝基苯肼自由基、羟自由基和超氧阴离子自由基清除作用明显,且其质量浓度与抗氧化活性呈现一定的量效关系,是一种良好的天然抗氧化剂。
关键词:人参花多糖;超声波;响应面;工艺优化;抗氧化
人参(Panax ginseng C.A. Meyer)为五加科人参属植物,在我国有着悠久的药用历史,其中主要活性成分为人参皂苷及人参多糖 [1-2]。自古以来,多以根部入药,对人参的地上部分少见研究 [3-5]。有研究表明,人参花富含人参皂苷及其他各种挥发油等有效成分,人参花皂苷含量比人参高出5 倍以上,因此认为人参花的药用价值远远超过人参根 [6-8]。天然的植物多糖具有许多重要的生理活性,如参与生物体的免疫调节功能,降血糖、降血脂、抗肿瘤、抗疲劳、抗衰老等。近几年来对植物多糖的结构、提取工艺和生物功能等方面的研究也越来越多,引起了广泛的关注 [9-10]。目前,对于人参花的研究大多围绕人参皂苷,对人参花多糖的研究鲜见报道 [11-12]。超声提取技术是利用超声波的机械效应、热学效应及空化等物理化学效应造成被破碎物细胞壁及整个生物体破裂,从而加速胞内物质的释放、扩散及溶解,提高提取得率。与常规提取法相比,超声提取法具有提取时间短、产率高、避免高温对中药多糖有效成分影响的优点,是一种高效实用的多糖提取方法,并日益被应用到多种化合物的提取分离过程 [13-16]。
本实验利用超声波辅助提取人参花多糖,并通过响应面法对提取工艺进行优化,同时对人参花多糖体外抗氧化活性进行研究,为进一步开发利用人参花的药用价值提供理论依据。
1.1 材料与试剂
6 a生干燥人参花购买自吉林省长春市抚松县滋身堂土特产有限公司。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazxyl,DPPH)、还原型辅酶Ⅱ(NADPH)、菲洛嗪、氯化硝基四氮唑兰(nitroblue tetrazolium,NBT) 美国Sigma公司;吩嗪硫酸甲酯(phenazine methosulfate,PMS)、邻二氮菲、硫酸亚铁、磷酸氢二钠、磷酸二氢钠、三氯化铁、双氧水、无水乙醇、抗坏血酸均为分析纯。
1.2 仪器与设备
Scientz-ⅡD超声仪 宁波新芝生物科技有限公司;SC-02低速离心机 苏州佳培商贸有限公司;高速离心机 美国赛默飞世尔科技有限公司;UV2501紫外分光光度计 日本岛津公司;RE-52A型旋转蒸发器上海亚荣升华仪器厂;ESJ12024型电子天平 洛阳龙腾电子称量仪器有限公司;RT-6000雷杜酶标分析仪 美国雷杜公司。
1.3 方法
1.3.1 人参花多糖的提取
称取一定量的6 a生干燥人参花,粉碎过100 目筛。超声提取后,将所得提取液在4 000 r/min条件下离心10 min,上清液进行旋转蒸发浓缩,再加入4 倍体积无水乙醇醇沉过夜。次日离心获得提取液,用Sevag法除蛋白5 次,收集所得浓缩液流水透析24 h后经真空冷冻干燥即获得多糖。
1.3.2 人参花多糖的超声提取单因素试验
在其他条件相同的情况下,采用不同超声功率、超声时间以及料液比进行超声波辅助提取试验,以人参花多糖得率为响应值,逐个考察各提取条件对提取效果的影响。1.3.3 响应面优化试验设计
表1 Box-Behnken试验设计因素及水平
Table1 Factors and levels used in Box-Behnken experimental design

因素水平—101 A超声功率/W 500600700 B超声时间/min152025 C料液比(g/mL)1∶151∶201∶25
在单因素试验的基础上,选取料液比、超声功率、超声时间为自变量,多糖得率为响应值,根据Box-Behnken试验设计原理,进行三因素三水平的响应面分析试验,试验因素及水平见表1。以Design-Expert 8.05b软件进行回归分析,并采用多元回归分析方法拟合多元二次方程,从而预测人参花多糖超声提取的最佳工艺 [17-20]。
1.3.4 超声提取人参花多糖体外抗氧化能力的测定
将超声提取的多糖冻干样品分别配制成4 000、2000、1 000、500、250 μg/mL 5 种质量浓度。
1.3.4.1 DPPH自由基清除能力测定
DPPH自由基清除活性的测定参照Luo Anxue等 [21]报道的方法稍作修改:取不同质量浓度的样品溶液50 μL于微孔板中,分别加入15 μL DPPH溶液(0.4 mmol/L)以及100 μL水。混匀后避光保存30 min于分光光度计517 nm波长处测吸光度。以VC 作为阳性对照,以水代替多糖溶液、无水乙醇代替DPPH溶液,做空白实验。按式(1)计算DPPH自由基清除率:
式中:A 0为空白对照实验(水代替多糖溶液)的吸光度;A 1为样品实验的吸光度;A 2为样品干扰实验(无水乙醇代替DPPH溶液)的吸光度。
1.3.4.2 超氧阴离子自由基清除能力测定
超氧阴离子自由基清除活性的测定参照Qiao Deliang等 [22]报道的方法稍作修改:取不同质量浓度的样品溶液50 μL于微孔板中,分别加入50 μL NBT溶液(156 μmol/L)、50μL NADH溶液(468 μmol/L)和50 μL PMS溶液(60 μmol/L)。混匀后于25 ℃水浴5 min,于分光光度计560 nm波长处测吸光度。以水代替多糖溶液、0.2 mol/L pH 7.4磷酸盐缓冲液代替NBT溶液,做空白实验。按式(2)计算超氧阴离子自由基清除率:
式中:A 0为空白对照实验(水代替多糖溶液)的吸光度;A 1为样品实验的吸光度;A 2为样品干扰实验(0.2 mol/L pH 7.4磷酸盐缓冲液代替NBT溶液)的吸光度。
1.3.4.3 羟自由基清除能力的测定
羟自由基清除活性的测定参照金鸣等 [23]报道的方法稍作改进:取不同质量浓度的样品溶液50 μL于微孔板中,分别加入50 μL邻二氮菲(0.75 mmol/L)、100 μL PBS 缓冲液(0.2 mol/L,pH 7.4)、50 μL FeSO 4溶液(0.75 mmol/L)、50 μL 体积分数0.01% H 2O 2溶液。摇匀后于37 ℃条件下保存30 min,在536 nm波长处检测吸光度。以VC作为阳性对照。按式(3)计算羟自由基的清除率:
式中:A 1为样品的吸光度;A 0为空白对照实验(水代替多糖溶液)的吸光度;A 2为水代替H 2O 2和多糖的吸光度。
1.4 数据分析
所有实验均重复3 次,利用统计分析处理软件DPS及Excel程序对实验结果进行分析。采用Design-Expert 8.05b数据处理专家进行响应面试验设计和分析。
2.1 单因素试验结果
2.1.1 超声功率对多糖提取效果的影响
在料液比1∶20(g/mL)、超声时间20 min的条件下,研究超声功率200、400、500、600、700 W对人参花多糖提取效果的影响。

图1 超声功率对人参花多糖得率的影响
Fig.1 Effect of ultrasonic power on the extraction yield of polysaccharides
由图1可知,在200~600 W范围内,人参花多糖得率随着超声功率的增大而提高,当超声功率为600 W时,多糖得率基本达到最大值,当超声功率继续增大时,多糖得率逐渐下降。原因可能是由于超声波功率越大,其产生的空化效应和机械作用越剧烈,使得分子间运动的速率更快,加速粒子间的碰撞及扩散程度,使细胞壁破碎,导致多糖渗透出来的速率加快,但当超声功率达到一定值时,细胞内人参花多糖含量逐渐减少,造成内外渗透压达到平衡,使多糖的渗透率降低 [24-26]。因此,最佳超声功率在600 W附近,选取600 W为自变量超声功率的0水平。
2.1.2 超声时间对人参花多糖提取效果的影响
在超声功率600 W、料液比1∶20(g/mL)的条件下,研究超声时间10、15、20、25、30 min对人参花多糖提取效果的影响。
从图2可知,当超声时间不超过20 min时,随着超声时间的延长,多糖的得率逐渐增大,当超声时间超过20 min后,多糖的得率逐渐降低,这表明人参花多糖的提取过程与时间密切相关,提取时间较短时,产物不充分溶解;时间过长,大分子多糖在超声波的强剪切作用下发生断裂 [27],在后期处理时出现损失现象,影响提取效果。因此最佳提取时间在20 min附近,选取20 min为自变量提取时间的0水平。

图2 超声时间对人参花多糖得率的影响
Fig.2 Effect of ultrasonic treatment time on the extraction yield of polysaccharides
2.1.3 料液比对人参花多糖提取效果的影响
在超声功率600 W、超声时间20 min的条件下,研究料液比1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)对人参花多糖提取效果的影响。

图3 料液比对人参花多糖得率的影响
Fig.3 Effect of material/liquid ratio on the extraction yield of polysaccharides
料液比是影响多糖提取效果的一个重要因素,主要影响固相与液相之间的浓度差。由图3可知,随着溶剂用量的增加,多糖得率逐渐增大,当料液比在1∶20时,多糖得率达到最大值,随后再增大溶剂用量,多糖得率随之降低,故选取1∶20(g/mL)为自变量料液比的0水平。
2.2 响应面分析法对人参花多糖提取工艺的优化
2.2.1 响应面试验设计及结果
表2 Box-Behnken试验设计及结果
Table2 Eperimental design and result for response surface analysis

试验号A超声功率B超声时间C料液比多糖得率/% 1—1—104.90 2 0 0 0 5.11 3 5.27 4 0 0 0 5.20 0 0 0 5 4.13 6 0—114.43 0 1 1 7 5.15 8 0 0 0 5.07 0 0 0 4.45 101014.24 1110—14.64 120—1—14.81 13—1104.54 14—1014.79 151—104.55 16—10—14.49 1701—14.24 9 1 1 0
根据Box-Behnken试验设计的原理,结合单因素试验,响应面试验设计及结果见表2。
根据表2结果,利用Design-Expert 8.05b软件建立人参花多糖得率(Y)对编码自变量超声功率(A)、超声时间(B)、料液比(C)的二次多项回归模型:
Y=5.16—0.10A—0.17B—0.074C+0.065AB—0.17AC+0.067BC—0.21A 2—0.34B 2—0.41C 2
2.2.2 模型的建立与显著性检验
利用Design-Expert 8.05b软件对各试验条件下的数据结果(表2)进行二次多元回归拟合,得到了方差分析结果,如表3所示。
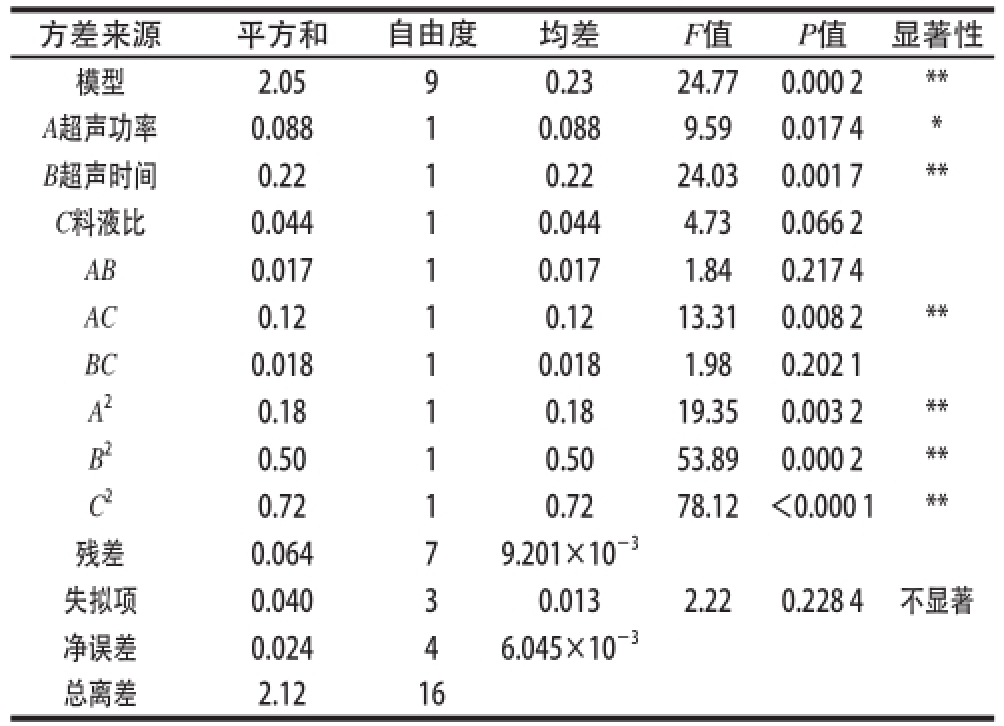
表3 回归方程方差分析表
Table3 Analysis of variance for the fitted regression equation
注:**.P<0.01,差异极显著;*.P<0.05,差异显著。
方差来源平方和自由度均差F值P值显著性模型2.0590.2324.770.000 2** A超声功率0.08810.0889.590.017 4* B超声时间0.2210.2224.030.001 7** C料液比0.04410.0444.730.066 2 AB0.01710.0171.840.217 4 AC0.1210.1213.310.008 2** BC0.01810.0181.980.202 1 A 20.1810.1819.350.003 2** B 20.5010.5053.890.000 2** C 20.7210.7278.12<0.000 1**残差0.06479.201×10 -3失拟项0.04030.0132.220.228 4不显著净误差0.02446.045×10 -3总离差2.1216
回归方程中各变量对响应值(多糖得率)影响的显著性由F值来判定,概率P值越小,则相应变量的显著程度越高。由表3可知,总回归方程F检验P=0.000 2<0.01,达到极显著水平,并且结果表明回归方程失拟检验P=0.228 4>0.05,失拟性的检验结果不显著,说明剩余不可忽略因素对试验影响性较小,此方程较好的拟合了试验。可以用于人参花多糖超声法辅助提取试验的理论预测。此外,A 2、B 2、C 2对多糖得率影响显著,从F值判断,各个因素对多糖得率影响次序是:B>A>C,即3 个因素中,对多糖得率影响大小的因素依次是:超声时间>超声功率>料液比,且这3 个因素对多糖得率的影响达到了显著水平。
2.2.3 各因素交互作用对多糖得率的响应面分析
为考察各个因素交互对人参花多糖得率的影响,在其他因素条件不变的情况下,测定交互项对得率的影响。根据回归模型作出相应的响应面和等高线如图4所示。
由图4可知,3 个因素在所选范围之内均能产生最佳响应,说明3 个因素的选择合理有效,能够很好地反映出3 个因素对响应值的影响趋势。在试验设定的水平范围内,随着每个因素取值的增大,响应面对应值也增大;当响应面增大到极值后,随着因素取值的增大,响应值逐渐减小。

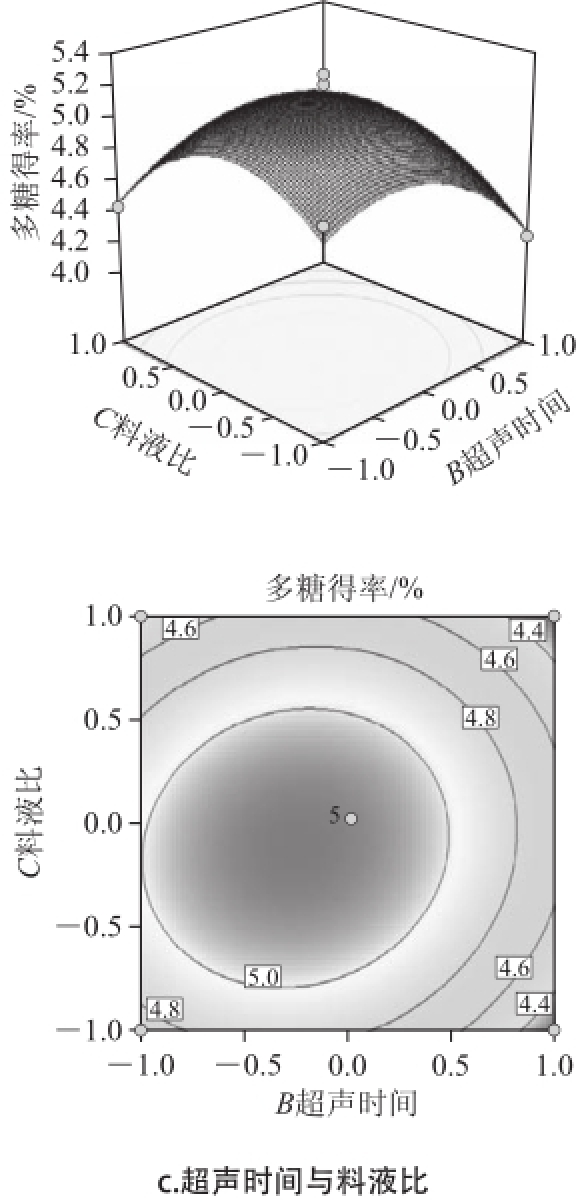
图4 各因素交互作用对人参花多糖得率影响的响应面和等高线图
Fig.4 Response surface and contour plots for the effects of operating parameters on the extraction rate of polysaccharides
由Design-Expert 8.05b软件分析出超声提取人参花多糖的最佳提取条件为超声功率586 W、超声时间18.65 min、料液比1∶19.75(g/mL),在此条件下,人参花多糖的得率为(5.20±0.17)%。
2.3 人参花多糖体外抗氧化活性测定
2.3.1 DPPH自由基清除活性
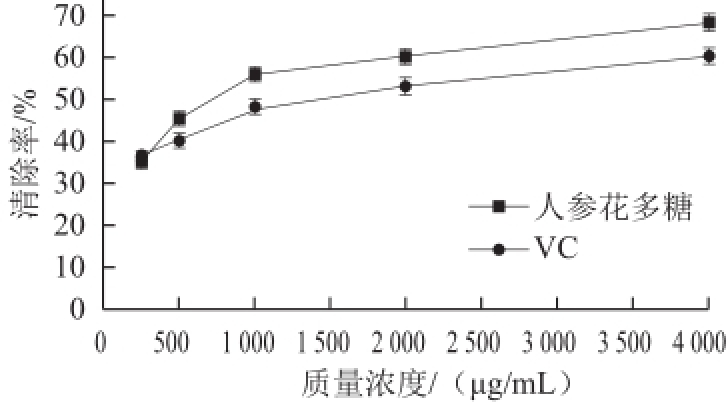
图5 人参花多糖及VC对DPPH自由基的清除活性
Fig.5 Comparison of DPPH radical scavenging capacity between ginseng flower polysaccharides and vitamin C
由图5可知,不同质量浓度的样品对DPPH自由基的清除能力不同,随着样品质量浓度的增加,对DPPH自由基清除率随之增加。且VC对DPPH自由基清除率均低于相同质量浓度条件下人参花多糖对DPPH自由基的清除率。质量浓度超过2 000 μg/mL后,人参花多糖对DPPH自由基的清除能力仍在增加,当质量浓度增加到4 000 μg/mL时,DPPH自由基清除率达到68.29%,已明显高于相同质量浓度条件下VC对DPPH自由基的清除率。
2.3.2 超氧阴离子自由基清除活性

图6 人参花多糖及VC对超氧阴离子自由基的清除活性
Fig.6 Comparison of superoxide anion free radical scavenging capacity between ginseng flower polysaccharides and vitamin C
从图6可知,人参花多糖具有较强的清除超氧阴离子自由基的能力,清除率随着质量浓度的增加而逐步提高,呈现良好的量效关系,且当质量浓度增长到4 000 μg/mL时,人参花多糖对超氧阴离子自由基的清除率高达73.12%。在相同质量浓度条件下,VC对超氧阴离子自由基清除率均高于人参花多糖。
2.3.3 羟自由基清除活性
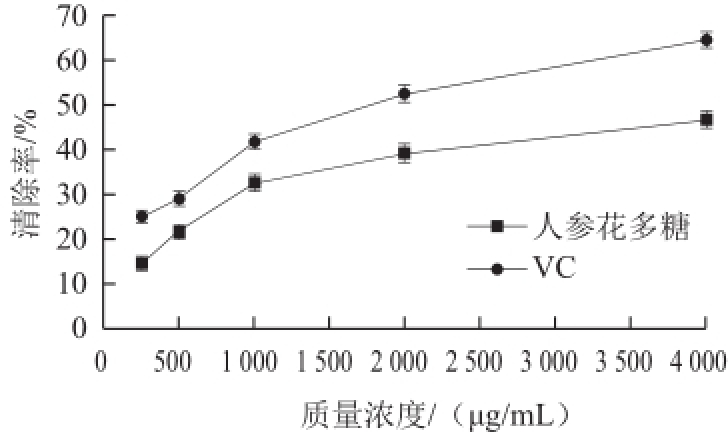
图7 人参花多糖及VC对羟自由基的清除活性
Fig.7 Comparison of hydroxyl radical scavenging capacity between ginseng flower polysaccharides and vitamin C
从图7可知,在相同质量浓度条件下,VC清除羟自由基活性能力强于人参花多糖的清除能力,且随着样品质量浓度的增加,清除羟自由基的能力不断增加。整体来看,VC对羟自由基清除能力要强于人参花多糖。
本研究在单因素试验的基础上,采用响应面软件优化人参花多糖的超声提取工艺后,得出超声提取法最佳工艺为超声功率586 W、超声时间18.65 min、料液比1∶19.75,人参花多糖得率为5.20%。并得到人参花多糖得率与超声处理各因素变量的二次方程模型,该模型回归显著,对试验拟合程度好,表明人参花多糖的超声波辅助提取工艺条件准确可靠,具有很高的应用价值。超声波辅助提取可以提高人参花多糖的利用率,降低生产成本,开发和利用人参花多糖具有良好的应用前景,对于工厂的实际生产有一定的指导意义 [28-30]。另外,体外抗氧化研究结果表明,人参花多糖具有较高的抗氧化活性,对DPPH自由基、羟自由基和超氧阴离子自由基有清除作用。多糖在生物体内的代谢过程较为复杂,其抗氧化作用可能直接参与自由基的猝灭反应,也可能是通过调节机体的内源性抗氧化剂的活性来实现 [31-35]。因此,人参花多糖的体内生物功效仍有待进一步的研究与探讨。
参考文献:
[1] 赵俊, 吴宏, 王亚平. 人参多糖的化学与药理学研究进展[J]. 国外医学: 中医中药分册, 2004, 26(2): 79-81.
[2] 张彬, 林瑞超, 冯芳. 人参多糖的研究概况[J]. 中国药事, 2004, 18(9): 566-569.
[3] SONODA Y, KASAHARA T, MUKAIDA N, et al. Stimulation of interleukin-8 production by acidic polysaccharides from the root of Panax ginseng[J]. Immunopharmacology, 1998, 38: 287-294.
[4] SHIN K, HIROAKI K, TSUKASA M, et al. RhamnogalacturonanⅡ from the leaves of Panax ginseng C.A. Meyer as a macrophage Fc receptor expression-enhancing polysaccharide[J]. Carbohydrate Research, 1997, 300(3): 239-249.
[5] SUN Yongxu Structure and biological activities of the polysaccharides from the leaves roots and fruits of Panax ginseng C.A Meyer an overview[J]. Carbohydrate Polymers′2011′8: 490-499.
[6] 马忠泽, 裴玉萍, 邱峰, 等. 人参花蕾化学成分的研究[J]. 中国药物化学杂志, 1998, 8(3): 205-207.
[7] YOSHIKAWA M, SΜGIMOTO S, NAKAMURA S, et al. Medicinal fl owers. Ⅺ. Structures of new dammarane-type triterpene diglycosides with hydroperoxide group from flower buds of Panax ginseng[J]. Chemical and Pharmaceutical Bulletin, 2007, 55(4): 571-576.
[8] 郭颖, 侯玉兵. 人参花质量标准的研究[J]. 人参研究, 2004(4): 41-43.
[9] 牛广财, 朱丹. 植物多糖的生物活性及其制备技术研究进展[J]. 食品研究与开发, 2005, 26(6): 191-193.
[10] 余慧红, 竺巧玲, 戴飞, 等. 多糖抗氧化作用的研究现状[J]. 食品研究与开发, 2008, 29(3): 172-175.
[11] 王冰清. 人参花多糖的分离纯化、结构分析以及对淋巴细胞增殖的作用[D]. 长春: 东北师范大学, 2008.
[12] 王京滨, 陈壁锋, 谭剑斌, 等. 人参花蕾提取物致畸作用的试验研究[J].中国热带医学, 2006(6): 972-973; 1045.
[13] 刘占文, 赵小亮. 不同提取方法对苦苣菜多糖得率的影响[J]. 安徽农业科学, 2010, 38(17): 8960-8961.
[14] 刘航, 国旭丹, 马雨洁, 等. 超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J]. 食品科学, 2013, 34(14): 45-50. doi: 10.7506/ spkx1002-6630-201314010.
[15] 陈红, 张波, 刘秀奇, 等. 超声波辅助提取水溶性大豆多糖及纯化工艺[J]. 食品科学, 2011, 32(6): 139-142.
[16] 郭守军, 杨永利, 施楚彬, 等. 超声波辅助提取龙须菜多糖的工艺优化[J]. 食品研究与开发, 2006, 27(10): 14-17.
[17] 徐建国, 田呈瑞, 胡青平, 等. 响应面法优化槐花水溶性多糖的超声波辅助提取工艺[J]. 食品科学, 2011, 32(4): 112-116.
[18] 李赓, 徐涛, 王平. 响应面设计法优化超声波辅助提取金针菇多糖的研究[J]. 安徽农学通报, 2010, 16(23): 23-26.
[19] 戴喜末, 熊子文, 罗丽萍. 响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J]. 食品科学, 2011, 32(8): 93-97.
[20] 任丹丹, 陈谷. 响应面法优化黄秋葵多糖超声提取工艺[J]. 食品科学, 2011, 32(8): 143-146.
[21] LUO Anxue, HE Xingjin, ZHOU Songdong, et al. Purification, composition analysis and antioxidant activity of the polysaccharides from Dendrobium nobile Lindl[J]. Carbohydrate Polymers, 2010, 79(4): 1014-1019.
[22] QIAO Deliang, KE Chunling, HU Bing, et al. Antioxidant activities of polysaccharides from Hyriopsis cumingii[J]. Carbohydrate Polymers, 2009, 78: 199-204.
[23] 金鸣, 蔡亚欣, 李金荣, 等. 邻二氮菲-Fe 2+氧化法检测H 2O 2/Fe 2+产生的羟自由基[J]. 生物化学与生物物理进展, 1996, 23(6): 553-555.
[24] 张磊. 食用菌多糖超声浸提工艺及控制系统的研究[D]. 南京: 南京林业大学, 2008.
[25] YANG Bao, ZHAO Mouning, JIANG Yueming. Anti-glycated activity of polysaccharides of longan (Dimocarpus longan Lour.) fruit pericarp treated by ultrasonic wave[J]. Food Chemistry, 2009, l14: 629-633.
[26] 王蓉. 灵芝液态富硒发酵及提高硒多糖产量的研究[D]. 杨凌: 西北农林科技大学, 2007.
[27] ZHANG Zhongshan WANG Xiaomei MO Xiaofang et al Degradation and the antioxidant activity of polysaccharide from Enteromorpha linza[J]. Carbohydrate Polymers′2013′92: 2084-2087.
[28] DECKER E A,WELCH B. Role of ferritin as a lipid oxidation catalyst in muscle food[J]. Journal of Agricultural and Food Chemistry, 1990, 38(3): 674-677.
[29] 陈美珍, 王欣, 余杰. 龙须菜多糖的提取、分离及抗氧化活性的研究[J]. 汕头大学学报, 2005, 20(2): 38-42.
[30] XIE Jingtian, SHAO Zuohui, HOEK V T L, et al. Antioxidant effects of ginsenoside Re in cardiomyocytes[J]. European Journal of Pharmacology, 2006, 523(3): 201-207.
[31] 颜军, 徐光域, 郭晓强, 等. 银耳多糖的纯化及抗氧化活性研究[J].食品科学, 2005, 26(9): 169-172.
[32] ZHAO Zhanyi XU Xiaojiang YE Qingwen et al Ultrasound extraction optimization of acanthopanax senticosus polysaccharides and its antioxidant activity[J]. International Journal of Biological Macromolecules′2013′59: 290-294.
[33] 聂少平, 谢明勇, 罗珍. 茶叶多糖的抗氧化活性研究[J]. 天然产物研究与开发, 2005, 17(5): 549-552.
[34] CHEN Ruizhan MENG Fanlei ZHANG Shouqin et al Effects of ultrahigh pressure extraction conditions on yields and antioxidant activity of ginsenoside from ginseng[J]. Separation and Purification Technology′2009′66: 340-346.
[35] 曾凯宏, 明建, 曾凯芳. 真菌多糖的结构与功能[J]. 食品科技, 2001, 26(4): 66-68.
Ultrasonic-Assisted Extraction of Polysaccharides from Ginseng Flower and Their Antioxidant Activity in vitro
ZHOU Sisi
1, WANG Yuyuan
2, LIU Dan
1, ZHANG Yimin
1, LIU Siyu
1, WANG Xiaoqing
1,*, ZENG Xiaoxiong
1,*
(1. College of Food Science and Technology Nanjing Agricultural University Nanjing 210095′China; 2. College of Chemistry and Chemical Engineering Nanhua University Hengyang 421001′China)
Abstract:Based on single factor experiments, the ultrasonic-assisted extraction process for crude water-soluble polysaccharides (μGFL) from dry ginseng fl ower was optimized with response surface methodology. The in vitro antioxidant activity of polysac charides extracted from ginseng fl ower was determined. The optimal extraction conditions were obtained as follows: ultrasonic power, 586 W; extraction duration, 18.65 min; and material/liquid ratio, 1:19.75. Under these conditions, the extraction yield of polysaccharides from ginseng fl ower was (5.20 ± 0.17)% (n = 3). The ginseng fl ower polysaccharides showed potential scavenging activity against 1,1-diphenyl-2-picrylhydrazxyl (DPPH), hydroxyl and superoxide anionradical in a concentration-dependent manner. This study indicates that ginseng fl ower polysaccharides are a good source of natural antioxidants.
Key words:ginseng flower polysaccharides; ultrasonic treatment; response surface methodology; process optimization; antioxidant activities
中图分类号:Q946.3
文献标志码:A
文章编号:1002-6630(2015)06-0076-06
doi:10.7506/spkx1002-6630-201506014
收稿日期:2014-07-10
基金项目:江苏省优势学科人才引进计划项目(08080900213);南京农业大学SRT计划项目(1318A10)
作者简介:周思思(1994—),女,本科,研究方向为糖生物学。E-mail:18211123@njau.edu.cn
*通信作者:王晓晴(1973—),女,讲师,博士,研究方向为糖生物学。E-mail:wangxq@njau.edu.cn 曾晓雄(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:zengxx@njau.edu.cn