
周永妍
1,2,李 亚
2,余爱农
1′2′*

(1.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.湖北民族学院化学与环境 工程学院,湖北 恩施 445000)
摘 要:采用顶空固相微萃取对Maillard反应体系生成的吡嗪类化合物进行萃取,寻找最佳萃取条件。通过正交试验和单因素试验筛选合适的萃取头,探讨电解质(NaCl)添加量、萃取温度、萃取时间等因素对萃取效率的影响。以吡嗪类化合物的总峰面积为指标,确定顶空固相微萃取最佳条件为:采用75 μm CAR/PDMS萃取头,在7 mL Maillard反应液中加入1.4 g电解质NaCl,体系温度50 ℃条件下萃取30 min,Maillard反应体系中吡嗪类化合物萃取效果最好。该萃取方法相对标准偏差最大值为5.03%,最小值为0.31%,平均值为1.90%,对Maillard反应体系中吡嗪类化合物的测定有良好的重复性,可以用于Maillard反应体系中吡嗪类物质的萃取。
关键词:顶空固相微萃取;正交试验;吡嗪类化合物;Maillard反应;气相色谱
Maillard反应是食品加工和贮藏过程中的羰基化合物(主要是还原糖类)与氨基化合物在一定温度条件下发生的一系列非酶褐变反应,又称为羰氨反应 [1]。Maillard反应是食品在加工和贮藏过程中最常发生的主要反应之一,可生成易挥发的小分子 [2]和棕色的大分子类物质类黑精 [3],从而影响食品的风味和色泽,因此被广泛研究。但Maillard反应是一系列复杂的反应的集合,其反应过程变化较大、挥发性物质含量少、体系稳定性差,体系久置不仅会造成挥发性产物的散逸还可能导致反应继续进行 [4],因此寻找一个能快速萃取同时也适合微量及痕量物质的萃取方法十分必要。常见的挥发性产物萃取法有水蒸气蒸馏法 [5]、同时蒸馏萃取法 [6]、吹扫捕集法 [7]、超临界萃取法 [8]和顶空固相微萃取法等 [9]。顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)具有缩短预处理时间、基本不使用有机溶剂、适用pH值范围大、操作简便、易于自动化等优点,已广泛应用于食品 [10]、医药 [11]、环境监测 [12]等行业。HS-SPME法已广泛用于萃取Maillard反应中的挥发产物,例如钟罗宝等 [13]使用HS-SPME对大豆分离蛋白粉Maillard反应挥发性物质进行萃取,杨继等 [14]将热重分析与固相微萃取技术结合对葡萄糖/天冬酰胺模拟体系非水相Maillard反应进行研究等,但鲜见水溶液体系中Maillard反应形成的挥发性物质最佳萃取条件的研究。
其他对于水溶液体系中Maillard反应挥发性物质的萃取方法较常见有传统的液液萃取法 [15]、同时蒸馏萃取法 [16]等。相较于固相微萃取法的直接萃取,液液萃取法需要消耗大量的有机溶剂并进行浓缩,对环境不够友好,并在浓缩过程中可能造成结果不准。同时蒸馏萃取法是Maillard反应体系检测挥发性物质时常使用的一种方法,该法同时加热样品所在的水相和萃取挥发性物质所需的有机相,使挥发性物质被水蒸气带出并转移到有机相中,此方法萃取耗时长,预处理相对繁琐复杂,每次检测需消耗样品量比固相微萃取大,对于有大批量样品需要检测的场合并不适用。
吡嗪类化合物是Maillard反应形成的主要挥发性化合物,尤其是非含硫氨基酸的Maillard反应形成的最主要的挥发物是吡嗪类化合物 [17],吡嗪类化合物一般具有烧烤、坚果等风味,在食品风味中有重要价值。因此探讨用HS-SPME方法萃取吡嗪类化合物的萃取条件,对于研究Maillard反应形成的风味物质具有重要意义。另外,本实验的Maillard反应体系是水溶液体系,因此探讨用HSSPME方法萃取吡嗪类化合物的萃取条件对其他水溶液体系中的吡嗪类化合物研究也具有重要参考价值。继还原糖之后,抗坏血酸是又一个在Maillard反应中引起广泛注意的具有潜在羰基组分的化合物 [18]。本实验选用抗坏血酸/谷氨酸模型体系形成的吡嗪类化合物能反映常见的Maillard反应所生成的小分子吡嗪化合物 [19]。
1.1 材料与试剂
DVB/CAR/PDMS(50/30 μm)、PDMS/DVB(65 μm)、CAR/PDMS(75 μm)和PDMS(30 μm) 萃取头 美国Supelco公司;P170005厚壁耐压反应瓶 北京欣维尔玻璃仪器有限公司。
抗坏血酸(Vetec™ 纯度≥99%)、谷氨酸(Vetec™ 纯度≥99%)、C 5~C 22正构烷烃标准物 美国Sigma-Aldrich公司;氢氧化钠(分析纯) 国药集团化学试剂有限公司;氯化钠(分析纯) 天津市福晨化学试剂厂;2-甲基吡嗪(纯度98%) 百灵威化学技术有限公司;2′5-二甲基吡嗪(纯度99%) 比利时Acros Organics公司;实验用水皆为二次蒸馏水。
1.2 仪器与设备
6890N-5975I气相色谱-质谱联用仪、6890N气相色谱(带火焰离子化检测器(flame ionization detector,FID)) 美国Agilent科技有限公司;固相微萃取手动进样器 美国Supelco公司;精密电子天平、PB-21型实验室pH计 瑞士Startorius公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司。
1.3 方法
1.3.1 样品制备
样品的制备参考文献[19-21]的方法。称取4.403 0g(25.0 mmol)抗坏血酸和3.678 3g(25.0 mmol)谷氨酸溶于250 mL双层蒸馏水中,适当加热搅拌并用固体NaOH将溶液pH值调至8.00(25 ℃),使其完全溶解。溶液密封于250 mL P170005厚壁耐压反应瓶中,在(140±2)℃的油浴中搅拌加热,反应120 min,冷水快速冷却至室温,冰箱冷藏,待HS-SPME-GC分析。
1.3.2 萃取条件的优化
根据相关文献[22-24]报道以及本课题组前期用顶空固相微萃取对吡嗪类化合物的萃取所做的工作 [19]确定正交试验的因素和水平,如表1所示。
表1 正交试验因素与水平
Table1 Factors and levels used in orthogonal array design

水平因素A萃取头B萃取时间/minC萃取温 度/℃D NaCl添加量/gE空列165 μm PDMS/DVB30300 275 μm CAR/PDMS40400.7 350/30 μm DVB/CAR/PDMS50501.4 4 30 μm PDMS60602.1
1.3.3 HS-SPME采样
取7 mL反应液于15 mL专用萃取瓶中,根据实验需要加入适量的NaCl,在实验选定温度条件下平衡15 min,推出固相微萃取头开始萃取,按照实验安排萃取相应时间。平行萃取3 次。
1.3.4 HS-SPME-GC-MS分析
挥发物用DB-5MS毛细管色谱柱分离。固相微萃取头插入气相色谱(gas chromatography,GC)进样口,在250 ℃条件下解吸4.0 min,采用不分流进样,载气流量0.9 mL/min。柱室温度采用程序升温:40 ℃保温5 min,再以4 ℃/min升温至260 ℃,然后以20 ℃/min 升温至280 ℃。GC-MS接口温度280℃;质谱电子电离(electron ionization,EI)源,电离能70 eV;电子倍增电压1 753 V;质量扫描范围30~400 u;扫描速率1 scan/s。
1.3.5 HS-SPME-GC-FID分析
固相微萃取头插入GC进样口在250 ℃条件下解吸4.0min,采用不分流进样,载气:氮气,载气流量0.9 mL/min。柱室温度采用程序升温:40 ℃保温5 min,再以4 ℃/min升温至260 ℃,然后以20 ℃/min升温至280 ℃。在相同积分参数下积分得到峰面积。
1.4 数据处理
C 5~C 22正构烷烃在相同条件下分析,以计算待测化合物的线性保留指数(linear retention index,LRI)。被分离出来的化合物经计算机检索并与标准谱图库NIST 08谱库和Wiley 275谱库对照,对正反匹配度均大于800(最大值为1 000)的化合物,计算其LRI与单独的GC分析结果以及文献值进行比较,部分组分采用标准物质辅助定性(Co-GC),最终得出GC检测出的峰所代表的物质。
2.1 吡嗪类化合物的鉴定结果
以75 μm CAR/PDMS萃取头,在加入1.4 g NaCl后40 ℃条件下萃取40 min,对Maillard反应挥发性产物中吡嗪类化合物的萃取鉴定结果见表2。
表2 吡嗪类化合物的鉴定结果
Table2 Identification of pyrazine compoundsounds
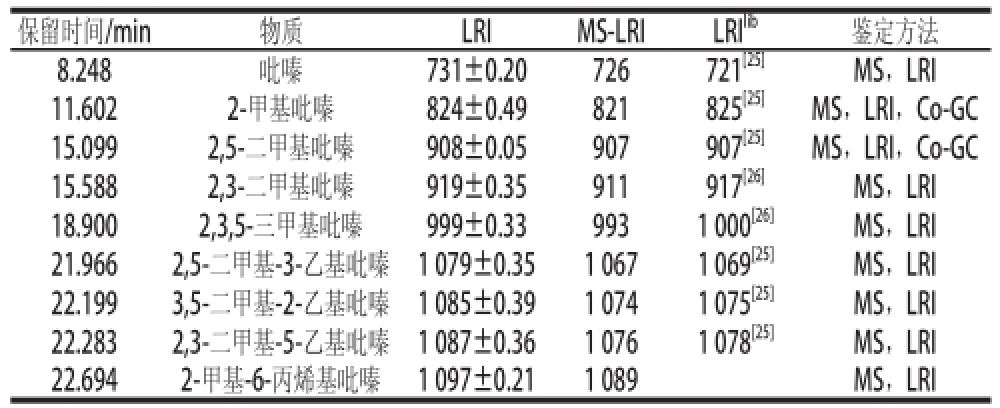
注:LRI GC线性保留指数;MS-LRI GC-MS线性保留指数;LRI lib.文献值;MS.参照谱库检索结果定性;Co-GC.标准物质辅助定性。
保留时间/min物质LRIMS-LRILRI lib鉴定方法8.248吡嗪731±0.20726721 [25]MS,LRI 11.6022-甲基吡嗪824±0.49821825 [25]MS,LRI,Co-GC 15.0992′5-二甲基吡嗪908±0.05907907 [25]MS,LRI,Co-GC 15.5882′3-二甲基吡嗪919±0.35911917 [26]MS,LRI 18.9002′3′5-三甲基吡嗪999±0.339931 000 [26]MS,LRI 21.9662′5-二甲基-3-乙基吡嗪1 079±0.351 0671 069 [25]MS,LRI 22.1993′5-二甲基-2-乙基吡嗪1 085±0.391 0741 075 [25]MS,LRI 22.2832′3-二甲基-5-乙基吡嗪1 087±0.361 0761 078 [25]MS,LRI 22.6942-甲基-6-丙烯基吡嗪1 097±0.211 089MS,LRI
2.2 HS-SPME萃取效果正交试验结果
表3 正交试验设计及结果
Table3 Results of orthogonal array experimentsments

试验号A萃取头B萃取时间C萃取温度D NaCl添加量E空列峰面积111111238.37±6.98 212222438.57±7.72 313333487.05±16.48 414444551.60±24.18 5212342 536.30±219.05 6221432 271.20±122.34 7234122 209.20±37.76 8243212 336.17±44.95 9313421 063.60±65.30 1032431847.57±28.91 1133124555.80±10.49 1234213494.70±24.18 134142368.50±15.75 144231418.23±4.34 1543241263.75±35.43 1644132115.63±21.00 K
11 715.593 906.773 181.002 960.503 685.86 K
29 352.873 575.573 733.323 399.043 827.00 K
32 961.673 515.803 905.053 986.553 321.45 K
4466.113 498.103 676.874 150.153 661.93
 1428.90976.69795.25740.13921.47
1428.90976.69795.25740.13921.47
 22 338.22893.89933.33849.76956.75
22 338.22893.89933.33849.76956.75
 3740.42878.95976.26996.64830.36
3740.42878.95976.26996.64830.36
 4116.53874.53919.221 037.54915.48 R2 221.69102.17181.01297.41126.39
4116.53874.53919.221 037.54915.48 R2 221.69102.17181.01297.41126.39
由表3可知,DVB/CAR/PDMS(50/30 μm)、PDMS/DVB(65 μm)和CAR/PDMS(75 μm)萃取头的峰面积相对标准偏差(relative standard deviation,RSD)均在10%以内,30 μm PDMS萃取头的RSD在25%以内,在一般顶空固相微萃取的误差范围内 [27-28]。各因素的主次顺序为萃取头>NaCl添加量>萃取温度>空列>萃取时间,最佳组合为A 2B 1C 3D 4。根据对各因素的K值分析可知萃取头以75 μm CAR/PDMS最佳,其后依次是50/30 μm DVB/CAR/PDMS和65 μm PDMS/DVB,而30 μm PDMS萃取头几乎无法萃取吡嗪类物质;吡嗪类物质的萃取效率随着溶液中NaCl加入量的增加而提高;萃取温度50 ℃时的萃取效果较优,其次是40 ℃和60 ℃,这两个温度的萃取效率与最佳温度差异较小,30 ℃时最差;萃取时间的极差比误差小,对萃取效果的影响不大,萃取时间30 min时萃取效率较高。因此由正交试验可知,Maillard反应所生成的吡嗪类物质较合适的萃取条件为采用75 μm CAR/PDMS萃取头,每7 mL反应液中加入2.1 g NaCl,在50 ℃萃取30 min。
表4 正交试验结果方差分析
Table4 Variance analysis for the results of orthogonal array experiments

因素偏差平方和自由度均方F值 显著性A萃取头11 718 232.6233 906 077.54339.63显著B萃取时间27 465.5939 155.200.80不显著C萃取温度72 496.05324 165.352.10不显著D NaCl添加量224 778.89374 926.306.51不显著误差34 502.71311 500.90总和12 077 475.8615
查F值表可知F 0.05(3,3)=9.28,F 0.01(3,3)=29.46,因表4中萃取头F>F 0.05(3,3),故萃取头对实验结果有显著影响。
2.3 单因素试验结果
由于萃取时间、萃取温度、NaCl添加量对正交试验结果影响不显著,故由极差从大到小进行单因素试验,验证正交试验中因素水平改变对萃取效率的影响规律,并确定萃取效果最好的条件。因萃取头对实验结果影响显著,75 μm CAR/PDMS萃取头是较好的萃取头,无需验证。
2.3.1 盐效应对萃取效率的影响
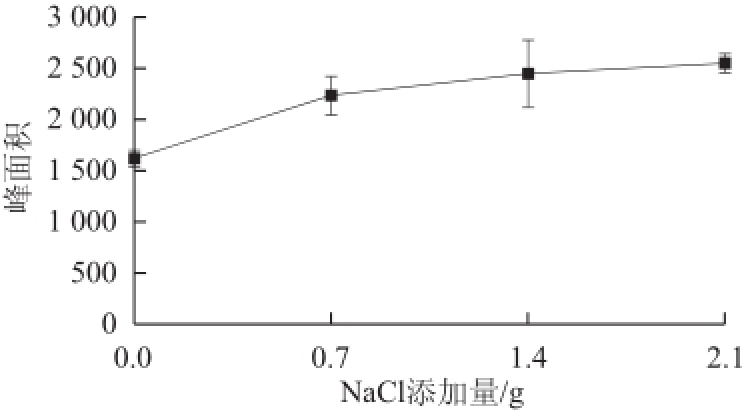
图1 反应液中NaCl添加量与峰面积的关系
Fig.1 Relationship between NaCl concentration and peak area
由图1可知,随着NaCl添加量的增大峰面积逐渐变大,萃取效果逐渐变好,这与正交试验结果一致。这是因为,在液相中加入盐(NaCl)可以减少挥发性成分在水溶液中的溶解,能使更多的挥发性物质挥发至气相从而被萃取头所吸附。但随着溶液中NaCl含量变大峰面积的增加值却在逐步变小,这是由于液相中的挥发性物质大部分都进入气相后,继续添加盐对降低挥发性物质的溶解度影响越来越小。由图1可知,NaCl添加量为1.4 g与2.1 g时对于峰面积的影响不大,但实验操作中加入2.1g固体NaCl可能覆盖磁转子使其无法转动,为了避免此情况以及尽量减少额外添加物对反应液的影响,综合考虑,本实验选取NaCl的最终添加量为1.4 g。
2.3.2 萃取温度对萃取效率的影响

图2 萃取温度与峰面积的关系
Fig.2 Relationship between extraction temperature and peak area
由图2可以看出,在萃取温度达到50 ℃之前,萃取温度升高峰面积逐渐增大,但萃取温度超过50 ℃后峰面积反而减小,这个规律与正交试验一致。这是因为在其他条件一致的情况下,温度的升高有利于吡嗪化合物从溶液中溢出,使气相中吡嗪化合物的量增多,萃取头达到吸附平衡时能吸附更多吡嗪化合物,但过高的温度会导致萃取头上的吸附物解吸,因此继续升温萃取效率反而下降。由图2和正交试验结果可知最佳萃取温度为50 ℃。
2.3.3 萃取时间对萃取效率的影响

图3 萃取时间对峰面积的影响
Fig.3 Relationship between extraction time and peak area
虽然时间对本实验的影响较小,但因正交试验中30 min为最佳萃取时间,为验证萃取时间在30 min以内时是否可能存在最佳萃取效率,依据萃取时间的影响进行单因素试验。由图3可以看出,30 min的萃取效率最佳,这是由于萃取是一个动态过程,30 min前萃取头可能并未达到萃取平衡,而30 min之后由于萃取时间过久造成轻微解吸,也可能是50 ℃条件下长时间萃取导致底物产生变化。
2.4 固相微萃取重复性的考察
由于找出固相微萃取的最佳萃取条件是为了将其应用于具体的Maillard水溶液体系,以研究每种吡嗪类物质对体系风味的贡献,因此用每种吡嗪类物质占总峰面积的百分比来进行重复性的考察。
采用上述的最佳萃取条件,重复3 次实验,考察固相微萃取法在萃取吡嗪类物质时的重复性。实验结果见表5。经计算,各组分相对含量的RSD最大值为5.03%,最小值为0.31%,平均值为1.90%,说明将固相微萃取技术用于抗坏血酸体系中吡嗪类物质的分析重复性良好。
表5 Maillard反应的分析结果
Table5 Contents of pyrazine compounds in Maillard reaction products
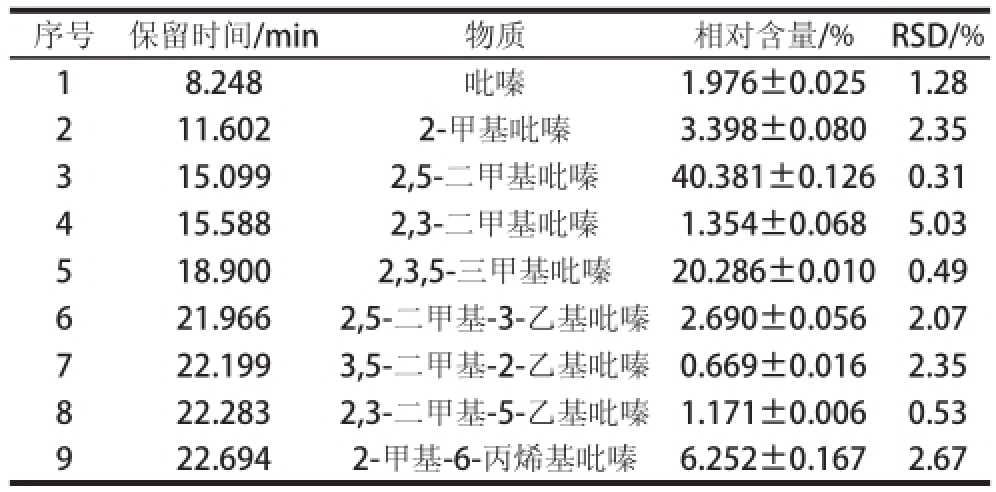
序号保留时间/min物质相对含量/%RSD/% 18.248吡嗪1.976±0.0251.28 211.6022-甲基吡嗪3.398±0.0802.35 315.0992′5-二甲基吡嗪40.381±0.1260.31 415.5882′3-二甲基吡嗪1.354±0.0685.03 518.9002′3′5-三甲基吡嗪20.286±0.0100.49 621.9662′5-二甲基-3-乙基吡嗪2.690±0.0562.07 722.1993′5-二甲基-2-乙基吡嗪0.669±0.0162.35 822.2832′3-二甲基-5-乙基吡嗪1.171±0.0060.53 922.6942-甲基-6-丙烯基吡嗪6.252±0.1672.67
由表5可知,以此谷氨酸与抗坏血酸反应体系为例,Maillard体系在140 ℃、120 min反应后,经检测,吡嗪类物质的相对含量为78.177%,其中2′5-二甲基吡嗪和2′3′5-三甲基吡嗪的相对含量分别为40.381%和20.286%,这些都证明了吡嗪类是非含硫氨基酸Maillard反应生成的主要风味成分,其对Maillard反应风味的形成具有极大的贡献。因此,再次证明了吡嗪类物质的萃取条件优化对Maillard反应风味成分的研究具有参考意义。
与其他萃取方法相比,固相微萃取预处理简单,无需消耗有机溶剂,对环境友好并可以装配自动进样器实现自动化,是一种操作方便结果准确的萃取方法,尤其适用于大批量样品的检测。在Maillard反应体系中检测所生成的吡嗪类物质的量时,其最佳的萃取条件为在7 mL反应液中添加1.4 g NaCl,萃取温度50 ℃的条件下用75 μm CAR/PDMS萃取头萃取30 min。该法的重复性良好,可以用于Maillard反应体系中吡嗪类物质的萃取和其他水溶液体系小分子吡嗪类物质的萃取。
参考文献:
[1] MARTINS S I F S JONGEN W M F BOEKEL M A J S A review of Maillard reaction in food and implications to kinetic modeling[J]. Trends in Food Science amp Technology′2000′11(9): 364-373.
[2] LIMACHER A KERLER J DAVIDEK T et al Formation of furan and methylfuran by Maillard-type reactions in model systems and food[J]. Journal of Agricultural and Food Chemistry′2008′56(10): 3639-3647.
[3] MARTINS S I F S van BOEKEL M A J S Melanoidins extinction coefficient in the glucose/glycine Maillard reaction[J]. Food Chemistry′2003′83(1): 135-142.
[4] ASIKIN Y KAMIYA A MIZU M et al Changes in the physicochemical characteristics including flavour components a nd Maillard reaction products of non-centrifugal cane brown sugar during storage[J]. Food Chemistry′2014′149: 170-177.
[5] KHAJEHA M YAMINI Y SHARIATI S Comparison of essential oils compositions of nepeta persica obtained by supercritical carbon dioxide extraction and steam distillation methods[J]. Food and Bioproducts Processing′2010′88(2): 227-232.
[6] 安红梅′尹建军′张晓磊′等. 同时蒸馏萃取技术在食品分析中的应用[J]. 食品研究与开发′2011′32(12): 216-220.
[7] 张渝′张新申′杨坪′等. 减压吹扫捕集-气相色谱-质谱联用分析水样中的多环芳烃[J]. 分析化学′2011′39(6): 799-803.
[8] 何保江′王玉芳′张文娟′等. 超临界流体萃取葡萄籽油工艺优化[J]. 食品工业′2014′35(2): 112-115.
[9] MARIANI M B GIANNETTI V TESTANI E HS-SPME/GC-MS method to characterise the flavour of italian pasta potential application to assess the quality of the products[J]. Food Analytical Methods′2014′7(1 ): 64-72.
[10] 刘晓慧′ 张丽霞′王日为′等. 顶空固相微萃取-气相色谱-质谱联用法分析黄茶香气成分[J]. 食品科学′2010′31(16): 239-243.
[11] 卢金清′李雨玲′张锐′等. HS-SPME-GC-MS分析香荚兰豆中挥发性成分[J]. 中国实验方剂学杂志′2014′20(3): 79-82.
[12] 马康′张金娜′何雅娟′等. 顶空固相微萃取-气质联用测定环 境水样中7 种痕量土霉味物质[J]. 分析化学′2011′39(12): 1823-1829.
[13] 钟罗宝′陈谷. 顶空进样器在快速检测食品美拉德反应风味物质中的新应用[J]. 现代食品科技′2009′25(9): 1091-1095.
[14] 杨继′杨柳′卢岚′等. 热重-固相微萃取/气相色谱-质谱联用研究葡萄糖/天冬酰胺模拟体系非水相Maillard反应[J]. 分析测试学报′2011′30(3): 233-241.
[15] 张慧丽′田红玉′孙宝国. 三种磷脂对Maillard模型体系产生的主要含硫挥发性化合物的影响[J]. 食品科学′2007′28(5): 81-85.
[16] 刘洪富. 大米蛋白水解物Maillard反应制备肉味香精的研究[D]. 济南: 山东轻工业学院′2008: 37-38.
[17] ADAMS A KIMPE N D Formation of pyrazines from ascorbic acid and amino acids under dry-roasting conditions[J]. Food Chemistry′2009′115(4): 1417-1423.
[18] ROGACHEVA S M KUNTCHEVA M J PANCHEV I N et al L-Ascorbic acid in nonenzymatic reactions[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung′1995′200(1): 52-58.
[19] YU Ainong TAN Zhiwei SHI Boan Influence of the pH on the formation of pyrazine compounds by the Maillard reaction of L-ascorb ic acid with acidic basic and neutral amino acids[J]. Asia-Pacific Journal of Chemical Engineering′2012′7(3): 455-462.
[20] 唐乐攀′周永妍′余爱农. 紫外分光光度法和高效液相色谱法测定Maillard体系中抗坏血酸含量的比较[J]. 食品工业科技′2014′35(10): 79-82.
[21] 邓启辉. L-抗坏血酸/氨基酸模式体系中Maillard反应产物的抗氧化活性研究[D]. 恩施: 湖北民族学院′2011: 11.
[22] 张明霞′赵旭娜′杨天佑′等. 顶空固相微萃取分析白酒香气物质的条件优化[J]. 食品科学′2011′32(12): 49-53.
[23] 严留俊′张艳芳′陶文沂′等. 顶空固相微萃取-气相色谱-质谱法快速测定酱油中的挥发性风味成分[J]. 色谱′2008′26(3): 285-291.
[24] 贾恺′胡小松′廖小军′等. 顶空固相微萃取法测定哈密瓜中挥发性芳香成分研究[J]. 食品科学′2010′31(10): 239-243.
[25] TAN Zhiwei YU Ainong Volatiles from the Maillard reaction of L-ascorbic acid with L-glutamic acid/L-aspartic acid at different reaction times and temperatures[J]. Asia-Pacific Journal of Chemical Engineering′2012′7(4): 563-571.
[26] CHO I H LEE S JUN H R et al Comparison of volatile Maillard reaction products from tagatose and other reducing sugars with amino acids[J]. Food Science and Biotechnology′2010′19(2): 431-438.
[27] TANKIEWICZ M MORRISON C BIZIUK M Application and optimization of headspace solid-phase microextraction (HS-SPME coupled with gas chromatography-flame-ionization detector (GC-FID to determine products of the petroleum industry in aqueous samples[J]. Microchemical Journal′2013′108(3): 117-123.
[28] PAGE B D LACROIX G Application of solid-phase microextraction to the headspace gas chromatographic analysis of semi-volatile organochlorine contaminants in aqueous matrices[J]. Journal of Chromatography A′1997′757(1): 173-182.
Optimum Extraction Conditions for Pyrazine Compounds from Maillard Reaction Mixture by Headspace Solid-Phase Microextraction
ZHOU Yongyan
1′2′LI Ya
2′YU Ainong
1′2′*
(1. Key Laboratory of Biological Resources Protection and Utilization of Hubei Province Enshi 445000′China; 2. School of Chemistry and Environmental Engineering Hubei M inzu University Enshi 445000′China)
Abstract:In order to find optimal conditions for the extraction of pyrazine compounds formed by Maillard reaction by using headspace solid-phase microextraction (HS-SPME)′the appropriate fiber was selected and the effects of electrolyte (NaCl concentration temperature and time on extraction efficiency were investigated by single factor and orthogonal array design methods The best extraction efficiency was achieved by addition of 1.4 g of the electrolyte to 7 mL of the Maillard reaction solution and extraction proceeded for 30 min using 75 μm CAR/PDMS fiber at 50 ℃. The relative standard deviation (RSD of pyrazine compounds extracted by the proposed procedure ranged from 0.31% to 5.03% with an average of 1.90%. The method has a good repeatability and can be used to extract pyrazine compounds formed by Maillard reaction.
Key words:headspace solid-phase microextraction (HS-SPME); orthogonal array design pyrazine compounds Maillard reaction gas chromatography
中图分类号:O658.2
文献标志码:A
文章编号:1002-6630(2015)06-0119-05
doi:10.7506/spkx1002-6630-201506022
收稿日期:2014-05-23
基金项目:国家自然科学基金地区科学基金项目(31360408)
作者简介:周永妍(1989—),女,硕士研究生,研究方向为食品化学。E-mail:530129014@qq.com
*通信作者:余爱农(1963—),男,教授,博士,研究方向为食品化学。E-mail:anyufoodchem@hotmail.com