郑聪聪,苏艳芳*,黄 雄,阙 梦
(天津大学药物科学与技术学院,天津 300072)
摘 要:目的:研究黑豆抗氧化活性成分。方法:采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法筛选黑豆乙醇提取物抗氧化活性部分,并综合运用硅胶柱色谱、聚酰胺柱色谱、D-101大孔吸附树脂柱色谱、凝胶柱色谱等方法对黑豆乙醇提取物具有较强抗氧化活性部分进行分离纯化,并根据理化性质和波谱数据对化合物进行结构鉴定。结果:采用DPPH法筛选表明黑豆乙醇提取物乙酸乙酯萃取部分和正丁醇萃取部分具有较强抗氧化活性,并从黑豆乙酸乙酯萃取部分、正丁醇萃取物经大孔吸附树脂体积分数30%乙醇洗脱部分中分离鉴定了10 个化合物,其中包括7 个黄酮类化合物:染料木素(1)、大豆素(2)、黄豆黄苷(3)、大豆苷(4)、染料木苷(5)、槲皮素-3-O-葡萄糖苷(6)、3’-甲氧基-表儿茶素-7-O-葡萄糖苷(7),以及胡萝卜苷(8),麦芽酚(9)、岩白菜素(10)。结论:化合物6、7、9、10为首次从大豆植物中分离得到,黑豆的抗氧化活性与其含较多酚类化合物有关。
关键词:大豆;黑豆;化学成分;黄酮类;抗氧化活性
黑豆为豆科(Fabaceae)大豆属(Glycine)植物大豆(Glycine max (L.) Merr.)的变种 [ 1]。大豆原产于我国,在全国各地均有栽种,以东北最为出名,并在世界各地广泛栽种。黑豆为具黑色种皮大豆,黑豆为药食两用的物质。文献记载:“黑豆有补肾养血,清热解毒,活血化瘀,乌发明目,延年益寿功效 [2]。”现代药理研究表明,黑豆具有免疫调节、抗癌、抗氧化、降低胆固醇 [3-5]等活性,同时,黑豆作为“黑色食品”,其营养价值也被广泛关注,蛋白质含量居豆类之首,并含有多种不饱和脂肪酸 [6-8]。黑豆较高的药用价值和营养价值与所含化学成分是密切相关的,而对黑豆进行系统成分研究 [9-11]的报道并不多,因此,有必要对其进行深入研究。
因黑豆具有比普通大豆更强的抗氧化性 [12],作为天然抗氧化剂之一,为近年来食品领域研究的热点 [13-15]。研究 [16-17]表明,自由基与很多疾病如癌症、心血管疾病、衰老等有关,而天然 抗氧化剂较人工抗氧化剂更加安全。一般评价体外抗氧化活性方法 [18-19]有1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法、总清除自由基抗氧化力(oxygen radical absorbance capacity,ORAC)法、铁离子还原抗氧化力测定(ferric reducing antioxidant potential assay,FRAP)法等。本实验采用DPPH法对黑豆各萃取部分抗氧化活性进行初评。Yoshida等 [20]研究了大豆中花色苷的抗氧化活性,发现花色苷对脂类自由基有很好的清除能力,通过终止脂类氧化的链式反应,发挥其抗氧化作用。Xu等 [15]利用DPPH法评价了包括2 种黑豆在内的几种大豆的抗氧化活性,研究发现黑豆的抗氧化活性要明显高于普通大豆,但并未明确指出黑豆抗氧化活性部分。本实验对黑豆具有较强抗氧化活性部分进行了系统的成分分析,为明确黑豆活性成分提供了依据。
1.1 材料与试剂
黑豆购于天津市南开区家乐福超市,样品经天津中医药大学李天祥教授鉴定为黑豆。
薄层层析硅胶(GF254,10~40 μm)、柱层层析硅胶(200~300、100~200 目) 青岛海洋化工厂;聚酰胺薄膜、柱层析聚酰胺 浙江省台州市路桥四甲生化塑料厂;D-101大孔吸附树脂 天津海光化工有限公司;Sephadex LH-20 英国Amersham Pharmacia Biotech公司;DPPH试剂 美国Sigma公司;所有分离用试剂均为国产分析纯。
1.2 仪器与设备
XS 105电子天平 瑞士Mettler Toledo公司;N-1100旋转蒸发仪 日本Eyela公司;低温冷却液循环泵 上海豫康科教设备有限公司;ZF-I三用紫外分析仪 上海顾村电光仪器厂;AVANCE 600 MHz液体核磁共振谱仪 瑞士Brüker公司;Finnpipette移液枪芬兰Thermo Labsystems公司;Cary60紫外-可见分光光度计 美国Agilent公司。
1.3 方法
1.3.1 提取与萃取
黑豆干燥种子约9.3 kg,粉碎,用体积分数95%乙醇于室温条件下冷浸10 d,滤过,减压浓缩至无醇味。残渣依次用体积分数95%乙醇、60%乙醇回流提取2 次,每次2 h,滤过,减压浓缩至无醇味。将各部分浓缩液合并,得到乙醇提取物(1 400 g),加入蒸馏水约3.3 L制成混悬液,依次用石油醚、乙酸乙酯、正丁醇多次萃取,分别减压回收溶剂,依次得到石油醚萃取物(petroleum ether extract of Glycine max (L.) Merr.,GMP)327 g、乙酸乙酯萃取物(ethyl acetate extract,GME)29 g、正丁醇萃取物(n-butanol extract,GMB)96 g。正丁醇萃取物经D-101大孔吸附树脂柱色谱分离,依次用水及体积分数30%、50%、70%、95%乙醇溶液洗脱,分别减压回收溶剂,得水部分(GMH)37.5 g、30%乙醇洗脱部分(GMB30)7 g、50%乙醇洗脱部分(GMB50)6 g、70%乙醇洗脱部分(GMB70)4.5 g、95%乙醇洗脱部分(GMB95)1 g。
1.3.2 黑豆乙醇提取物各萃取部分抗氧化活性分析
取120 μmol/L DPPH 2.9 mL,加入不同质量浓度的各萃取液(萃取液分别为GMP、GME、GMB30、GMB50、GMB70、GMB95、GMH)0.1 mL,摇匀后,置于水浴37 ℃,黑暗环境中30 min,待反应完全后,取出,测定其在波长517 nm处的吸光度A 1,同时测定样品溶液的吸光度A 2,DPPH自由基溶液的吸光度A 0,按下式计算其清除率。
1.3.3 分离纯化

图1 黑豆乙酸乙酯部分和正丁醇、体积分数3030%乙醇洗脱部分的主要分离流程图
Fig.1 Scheme for isolation of compounds from ethyl acetate extract and n-butanol 30% EtOH eluate
乙酸乙酯萃取物进行硅胶柱层析,以石油醚-乙酸乙酯进行梯度洗脱,以薄层色谱(thin layerchromatography,TLC)检测,合并得到55 个流分。流分21经甲醇重结晶得到化合物1(24 mg);流分24经甲醇重结晶得到化合物2(22 mg);流分29~36合并后经过反复硅胶柱层析和Sephadex LH-20柱层析分离,得到化合物8(20 mg)和9(7 mg);流分37经Sephadex LH-20柱层析分离,得到化合物4(61 mg)和5(51 mg);流分38~41合并后经过反复聚酰胺柱层析和Sephadex LH-20柱层析分离,得到化合物3(25 mg);流分42~52经反相柱层析和聚酰胺柱层析后得到化合物6(3 mg)。黑豆正丁醇萃取物、体积分数30%乙醇洗脱部分经硅胶柱层析初步分离后取流分11~12,经反复硅胶、Sephadex LH-20柱层析以及重结晶等方法分离纯化,得到化合物10(30 mg);流分16~20,经反复硅胶、Sephadex LH-20柱层析以及重结晶等方法分离纯化,得到化合物7(10 mg)。
1.3.4 核磁分析
根据氢谱中氢信号的化学位移、耦合常数和积分面积,以及碳谱中碳信号的化学位移等信息推断出化合物的结构,再对照文献中对应化合物的核磁共振氢谱及碳谱数据,则可确定该化合物的结构。以下化合物结构的确定均依照该方法。
2.1 黑豆乙醇提取物各萃取部分抗氧化活性分析
按1.3.2节方法分别评价黑豆乙醇提取物各萃取部分对DPPH自由基清除能力,清除自由基的活性常用DPPH自由基50%抑制浓度(the half maximal inhibitory concentration,IC 50)值表示,以清除率为y,样品质量浓度为x拟合方程,将y定为50,计算出所对应x,即得到IC 50值,IC 50值与抗氧化活性呈负相关。
表1 黑豆正丁醇、体积分数3030%乙醇洗脱部分抗氧化活性
Table1 Antioxidant activities of extracts from GMB30
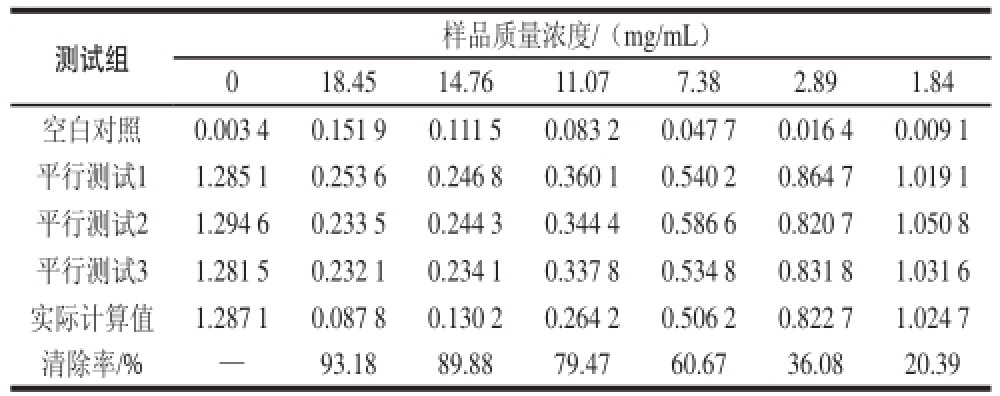
注:—.未见清除。
测试组样品质量浓度/(mg/mL)018.4514.7611.077.382.891.84空白对照0.003 40.151 90.111 50.083 20.047 70.016 40.009 1平行测试11.285 10.253 60.246 80.360 10.540 20.864 71.019 1平行测试21.294 60.233 50.244 30.344 40.586 60.820 71.050 8平行测试31.281 50.232 10.234 10.337 80.534 80.831 81.031 6实际计算值1.287 10.087 80.130 20.264 20.506 20.822 71.024 7清除率/%—93.1889.8879.4760.6736.0820.39
由表1可知,拟合IC 50值的拟合方程:y=—0.251 2x 2+9.297 4x+7.169 5。拟合效果的相关性用相关性系数表示:R 2=0.993 6,IC 50值为5.34 mg/mL。
表2 黑豆正丁醇、体积分数5050%乙醇洗脱部分抗氧化活性
Table2 Antioxidant activities of extracts from GMB50
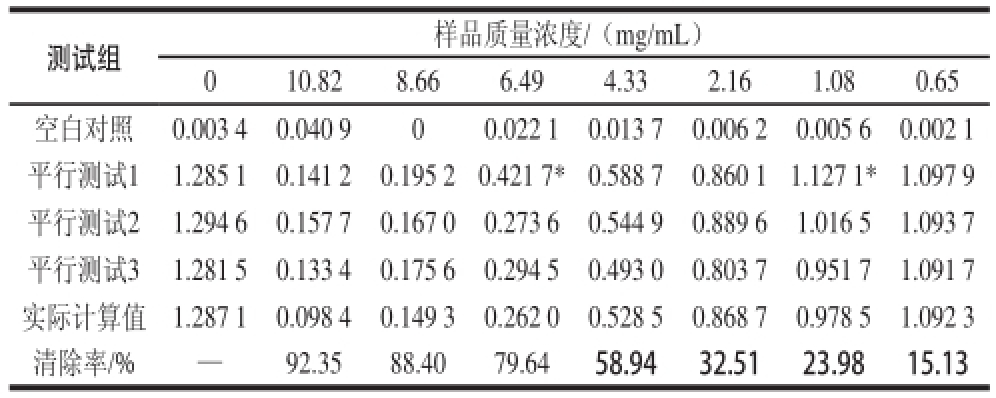
注:*.实验中各种因素导致该平行数据不可信,故舍弃;—.未见清除。下表同。
测试组样品质量浓度/(mg/mL)010.828.666.494.332.161.080.65空白对照0.003 40.040 900.022 10.013 70.006 20.005 60.002 1平行测试11.285 10.141 20.195 20.421 7*0.588 70.860 11.127 1*1.097 9平行测试21.294 60.157 70.167 00.273 60.544 90.889 61.016 51.093 7平行测试31.281 50.133 40.175 60.294 50.493 00.803 70.951 71.091 7实际计算值1.287 10.098 40.149 30.262 00.528 50.868 70.978 51.092 3清除率/%—92.3588.4079.6458.9432.5123.9815.13
由表2可知,拟合IC 50值的拟合方程:y=—0.697 5x 2+15.643x+5.273 5。拟合效果的相关性用相关性系数表示:R 2为0.996 1,IC 50值为3.57 mg/mL。
表3 黑豆正丁醇、体积分数7070%乙醇洗脱部分抗氧化活性
Table3 Antioxidant activities of extracts from GMB70
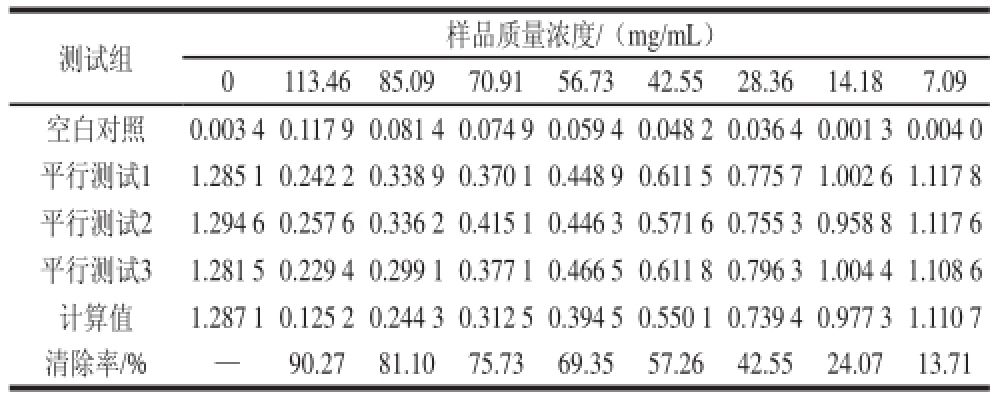
测试组样品质量浓度/(mg/mL)0113.4685.0970.9156.7342.5528.3614.187.09空白对照0.003 40.117 90.081 40.074 90.059 40.048 20.036 40.001 30.004 0平行测试11.285 10.242 20.338 90.370 10.448 90.611 50.775 71.002 61.117 8平行测试21.294 60.257 60.336 20.415 10.446 30.571 60.755 30.958 81.117 6平行测试31.281 50.229 40.299 10.377 10.466 50.611 80.796 31.004 41.108 6计算值1.287 10.125 20.244 30.312 50.394 50.550 10.739 40.977 31.110 7清除率/%—90.2781.1075.7369.3557.2642.5524.0713.71
由表3可知,拟合IC 50值的拟合方程:y=-0.006 6x 2+1.487x+4.566 4。拟合效果的相关性用相关性系数表示:R 2为0.996 9,IC 50值为35.33 mg/mL。
表4 黑豆正丁醇、体积分数9595%乙醇洗脱部分抗氧化活性
Table4 Antioxidant activities of extracts from GMB95
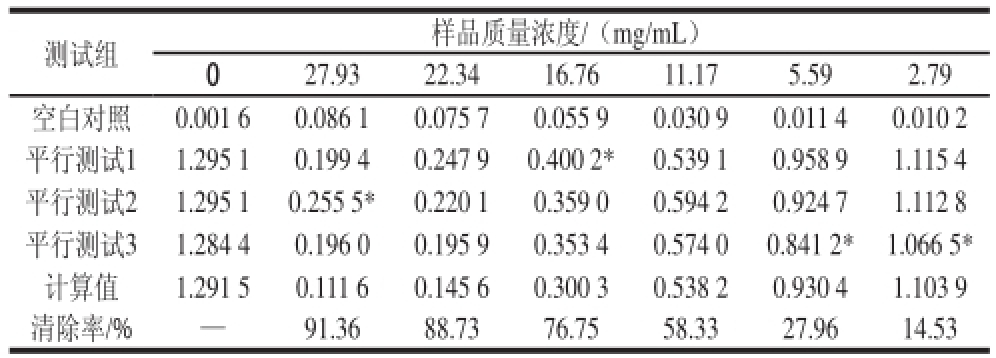
测试组样品质量浓度/(mg/mL)027.9322.3416.7611.175.592.79空白对照0.001 60.086 10.075 70.055 90.030 90.011 40.010 2平行测试11.295 10.199 40.247 90.400 2*0.539 10.958 91.115 4平行测试21.295 10.255 5*0.220 10.359 00.594 20.924 71.112 8平行测试31.284 40.196 00.195 90.353 40.574 00.841 2*1.066 5*计算值1.291 50.111 60.145 60.300 30.538 20.930 41.103 9清除率/%—91.3688.7376.7558.3327.9614.53
由表4可知,拟合IC 50值的拟合方程:y =—0.129 2x 2+7.087x—5.535 4。拟合效果的相关性用相关性系数表示:R 2为0.998 7,IC 50值为9.84 mg/mL。
表5 黑豆乙酸乙酯萃取物抗氧化活性
Table5 Antioxidant activities of extracts from GME
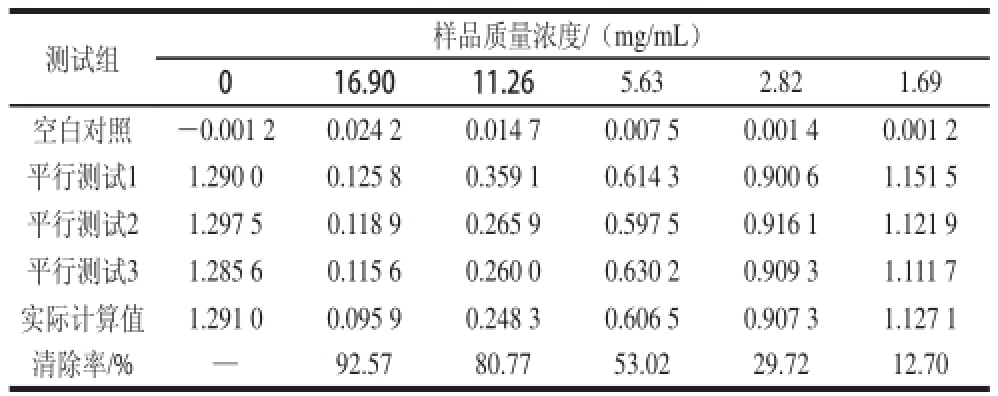
测试组样品质量浓度/(mg/mL)016.9011.265.632.821.69空白对照—0.001 20.024 20.014 70.007 50.001 40.001 2平行测试11.290 00.125 80.359 10.614 30.900 61.151 5平行测试21.297 50.118 90.265 90.597 50.916 11.121 9平行测试31.285 60.115 60.260 00.630 20.909 31.111 7实际计算值1.291 00.095 90.248 30.606 50.907 31.127 1清除率/%—92.5780.7753.0229.7212.70
由表5可知,拟合IC 50值的拟合方程:y =—0.359 1x 2+11.684x—3.075 5。拟合效果的相关性用相关性系数表示:R 2为0.994 6,IC 50值为5.63 mg/mL。
表6 黑豆各萃取部分抗氧化活性
Table6 Antioxidant activities of extracts from black soybean
黑豆各萃取物GMB50GMB30GMEGMB95GMB70 IC 50/(mg/mL)3.575.345.639.8435.33
采用DPPH法筛选结果表明黑豆各萃取物清除DPPH自由基的活性由强到弱依次为:GMB50、GMB30、GME、GMB95、GMB70(表6)。其中,抗氧化活性较强的GMB50、GMB30和GME的IC 50值依次为3.57、5.34、5.63 mg/mL。黑豆乙酸乙酯萃取物和正丁醇萃取物有较强的抗氧化活性,黑豆石油醚萃取物和水部分没有明显的抗氧化活性。黑豆石油醚萃取物、水部分的IC 50值大于100 mg/mL。
2.2 化合物结构解析
化合物1:白色针晶(甲醇), 1H-NMR(400 MHz,DMSO-d 6)δ:12.90(1H,s,5-OH)、10.89(1H,br s,7-OH)、9.59(1H,br s,4’-OH)、8.33(1H,s,H-2)、7.38(2H,d,J=8.0 Hz,H-2’,6’)、6.81(2H,d,J=8.0 Hz,H-3’,5’)、6.39(1H,br s,H-6)、6.23(1H,br s,H-8)。以上数据与文献[21]报道基本一致,故鉴定化合物1为染料木素(图2)。

图2 黑豆中黄酮类化合物1~5的结构5
Fig.2 Structures of flavonoids 1-5 from black soybean
化合物2:白色针晶(甲醇), 1H-NMR(400 MHz,DMSO-d 6)δ:10.79(1H,br s,7-OH)、9.53(1H,br s,4’-OH)、8.33(1H,s,H-2)、7.97(1H,d,J=8.8 Hz,H-5)、7.38(2H,d,J=8.4 Hz,H-2’,6’)、6.94(1H,dd,J=8.8 Hz,2.0 Hz,H-6)、6.86(1H,d,J=2.0Hz,H-8)、6.81(2H,d,J=8.4 Hz,H-3’,5’)。以上数据与文献[22]报道基本一致,故鉴定化合物2为大豆素(图2)。
化合物3:白色粉末(甲醇), 1H-NMR(400 MHz,DMSO-d 6)δ:9.55(1H,s,4’-OH)、8.39(1H,s,H-2)、7.49(1H,s,H-5)、7.40(2H,d,J=8.4 Hz, H-2’,6’)、7.32(1H,s,H-8)、6.82(2H,d,J=8.4 Hz,H-3’,5’)、5.18(1H,d,J=7.2 Hz,H-1’)、3.89(3H,s,’—OCH 3)。以上数据与文献[23]报道基本一致,故鉴定化合物3为黄豆苷(图2)。
化合物4:白色针状结晶(甲醇), 1H-NMR(400 MHz,DMSO-d 6)δ:8.40(1H,s,H-2)、8.05(1H,d,J=8.0 Hz,H-5)、7.41(2H,d,J=8.4 Hz,H-2’,6’)、7.24(1H,d,J=2.0 Hz,H-8)、7.13(1H,dd,J=8.8 Hz,2.0 Hz,H-6)、6.82(2H,d,J=8.4 Hz,H-3’,5’)、5.18(1H,d,J=7.2 Hz,H-1’)。以上数据与文献[24]报道基本一致,故鉴定化合物4为大豆苷(图2)。
化合物5:白色针状结晶(甲醇), 1H-NMR(400 MHz,DMSO-d 6)δ:12.95(1H,s,5-OH)、9.61(1H,s,4’-OH)、8.44 (1H,s,H-2)、7.40(2H,d,J=8.0 Hz,H-2’,6’)、6.83(2H,d,J=8.4 Hz,H-3’,5’)、6.73(1H,br s,H-8)、6.48(1H,br s,H-6)、5.18(1H,overlapped,H-1’)。以上数据与文献[23]报道基本一致,故鉴定化合物5为染料木苷(图2)。
化合物6:黄色粉末(甲醇), 1H-NMR(600 MHz,CD 3OD)δ:7.83(1H,d,J=2.2 Hz,H-2’)、7.58(1H,dd,J=8.5 Hz,2.2 Hz,H-6’)、6.86(1H,d,J=8.5 Hz,H-5’)、6.30(1H,d,J=2.0 Hz,H-8)、6.13(1H,d,J=2.0 Hz,H-6)、5.09(1H,d,J=7.7 Hz,H-1’)。以上数据与文献[25]报道基本一致,故鉴定化合物6为槲皮素-3-O-葡萄糖苷(图3)。
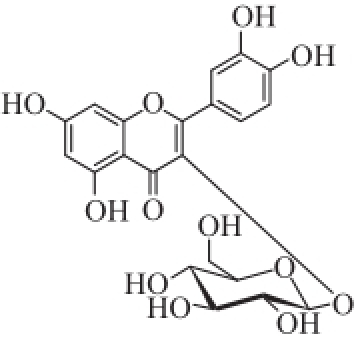
图3 化合物6的结构式
Fig.3 Structure of compound 6
化合物7:白色粉末(甲醇), 1H-NMR(600 MHz,CD 3OD)δ:7.15(1H,br s,H-2’)、6.91(1H,dd,J=8.0 Hz,2.0 Hz,H-6’)、6.80(1H,d,J=8.0 Hz,H-5’)、6.30(1H,d,J=2.0 Hz,H-8)、6.12(1H,d,J=2.0 Hz,H-6)、4.89(2H,overlapped,H-2 and H-1’)、4.21(1H,t-like,H-3)、3.89(3H,s,—OCH 3)。 13C-NMR(125 MHz,CD 3OD)δ:158.44(C-8a)、157.85(C-7)、157.13(C-5)、148.69(C-3’)、147.05(C-4’)、132.14(C-1’)、120.63(C-6’)、115.76(C-5’)、111.92(C-2’)、102.96(C-4a)、102.59(C-1’)、98.63(C-6)、97.40(C-8)、80.14(C-2)、78.18(C-5’)、78.13(C-3’)、74.90(C-2’)、71.33(C-4’)、67.47(C-3)、62.53(C-6’)、56.44(—OCH 3)、29.50(C-4)。以上数据与文献[26]报道基本一致,故鉴定化合物7为3’-甲氧基-表儿茶素-7-O-葡萄糖苷(图4)。

图4 化合物7的结构式
Fig.4 Structure of compound 7
化合物8:无色针晶(甲醇),通过与实验室胡萝卜苷标准品在3个系统条件下共薄层检查,其Rf值及显色行为一致,故鉴定化合物8为胡萝卜苷(图5)。
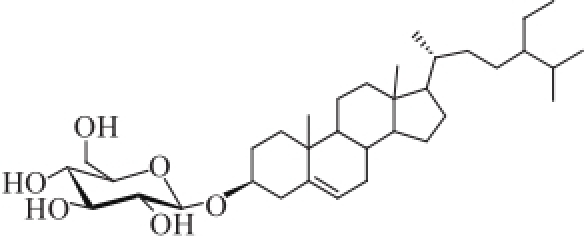
图5 化合物8的结构式
Fig.5 Structure of compound 8
化合物9:白色粉末(甲醇), 1H-NMR(400 MHz,CDCl 3)δ:7.71(1H,d,J=5.0 Hz,H-6)、6.42(1H,d,J=5.4 Hz,H-5)、2.37(3H,s,H-7)。 13C-NMR(125 MHz,CDCl 3)δ:173.1(C-4)、154.3(C-6)、148.8(C-2)、143.2(C-3)、113.0(C-5)、14.3(C-5)。以上数据与文献[27]报道基本一致,故鉴定化合物9为麦芽酚(图6)。

图6 化合物9的结构式
Fig.6 Structure of compound 9
化合物10:无色透明晶体(甲醇), 1H-NMR(600 MHz,C 5D 5N)δ:7.74(3H,br s,H-7)、3.96(3H,s,OCH 3)、δ H5.2~4.2有几个H信号,推测为连氧碳上H信号。 13C-NMR(125 MHz,C 5D 5N)δ:165.2(C-6)、153.5(C-8)、150.1(C-10)、142.7(C-9)、120.2(C-6a)、117.4(C-10a)、111.2(C-7)、84.2(C-4a)、82.0(C-2)、76.3(C-4)、74.6(C-10b)、72.9(C-3)、63.3(C-11)、61.1(—OCH 3)。以上数据与文献[28]报道基本一致,故鉴定化合物10为岩白菜素(图7)。

图7 化合物10的结构式
Fig.7 Structure of compound 10
采用DPPH法筛选结果表明黑豆乙酸乙酯和正丁醇部分具有较强的抗氧化活性,并从黑豆抗氧化活性较强的GME、GMB30部分分离鉴定了10 个化合物,包括8 种酚类化合物,印证了黑豆抗氧化活性与其含较多的酚类化合物有关。另外,分离得到的4 个化合物:槲皮素-3-O-葡萄糖苷(6)、3’-甲氧基-表儿茶素-7-O-葡萄糖苷(7)、麦芽酚(9)、岩白菜素(10)为首次从大豆中分离得到。实验为明确黑豆的抗氧化活性及进一步开发提供了科学依据。
参考文献:
[1] 中国科学院中国植物志编辑委员会. 中国植物志: 第41卷[M]. 北京:科学出版社, 1995: 233-236.
[2] 江苏新医学院. 中药大词典: 下册[M]. 上海: 上海科学技术出版社, 1986: 2382.
[3] GLADYSHEVA I P, MOROZ N A, KARMAKOVA, et al. Immunoconjugates of soybean Bowman-Birk protease inhibitor as targeted antitumor polymeric agents[J]. Journal of Drug Targeting, 2001, 9(5): 303-316.
[4] SUZUKI K, KOIKE H, MATSUI H, et al. Genistein, a soy isoflavone, induces glutathione peroxidase in the human prostate cancer cell lines LNCaP and PC-3[J]. International Journal of Cancer, 2002, 99(6): 846-852.
[5] MINEMOTO Y, FANG X, HAKAMATA K, et al. Oxidation of linoleic acid encapsulated with soluble soybean polysaccharide by spraydrying[J]. Bioscience, Biotechnology and Biochemistry, 2002, 66(9): 1829-1834.
[6] KERCKHOFFS D A, BROUNS F, HORNSTRA G, et al. Effects on the human serum lipoprotein profi le of beta-glucan, soy protein and isofl avones, plant sterols and stanols, garlic and tocotrienols[J]. Journal of Nutrition, 2002, 132(9): 2494-2505.
[7] 王寅, 张坤, 赵晋. 黑豆的营养价值及在食品中的开发应用[J]. 中国食品添加剂, 2007(6): 132-135.
[8] 赵青威, 楼宜嘉. 黑大豆乙醇提取物的雌激素样作用及其机制研究[J].中国中药杂志, 2006, 31(10): 825-828.
[9] 李玉美. 黑豆馏油化学成分气相色谱-质谱联用分析[J]. 食品研究与开发, 2008, 29(7): 122-124.
[10] INAGAKI S MORIMURAK S Isolation of tryptophol as an apoptosis-inducing component of vinegar produced from boiled extract of black soybean in human monoblastic leukemia U937 cells[J]. Bioscience Biotechnology and Biochemistry′2007′71(2): 371-379.
[11] MASKAZU S SHIGEMITSU K MAKOTO S Composition and structure of “Group A Saponin in soybean seed[J]. Agricultural and Biological Chemistry′1991′55(2): 315-322.
[12] YANG C M YANG J S CHAO P Y Gray prediction comparison on the antioxidative capacity of commercial black bean and soybean[J]. Nutrition Science Journal′1999′24(2): 201-214.
[13] AMAROWICZ R ZEGARSKA Z RAFALOWSK I et al Antioxidant activity and free radical-scavenging capacity of ethanolic extracts of thyme oregano and marjoram[J]. European Journal of Lipid Science and Technology′2009′111(11): 1111-1117.
[14] MALECKA M Antioxidant properties of the unsaponifiable matter isolated from tomato seeds oat grains and wheat germ oil[J]. Food Chemistry′2002′79(3): 327-330.
[15] XU B J CHANG S K C Characterization of phenolic substances and antioxidant properties of food soybeans grown in the North Dakota-Minnesota region[J]. Journal of Agricultural and Food Chemistry′2008′56(19): 9102-9113.
[16] SATUE G M HEINONEN M FRANKEL E N Anthocyanins as antioxidants on human low density lipoprotein and lecithin liposome systems[J]. Journal of Agricultural and Food Chemistry′1997′45: 3362-3367.
[17] VINSON J A XUEHYI S ZUBIK L et al Phenol antioxidant quantity and quality in foods fruits[J]. Journal of Agricultural and Food Chemistry′2001′49: 5315-5321.
[18] SCHWARZ K BERTELSEN G NISSEN L R et al Investigation of plant extracts for the protection of processed foods against lipid oxidation Comparison of antioxidant assays based on radical scavenging lipid oxidation and analysis of the principal antioxidant compounds[J]. European Food Research and Technology′2001′212: 319-324.
[19] SHI S Y MA Y J ZHANG Y P Systematic separation and purification of 18 antioxidants from Pueraria lobata flower using HSCCC target-guided by DPPH-HPLC experiment[J]. Separation and Purification Technology′2012′89: 225-233.
[20] YOSHIDA K, SATO Y, OKUNO R, et al. Structural analysis and measurement of anthocyanin from colored seed coats of Vigna, Phaseolus, and Glycine legumes[J]. Biotechnology and Biochemistry, 1996, 60(4): 589-593.
[21] SELEPE M A, DREWES S E, HEERDEN F R, et al. Total synthesis of the pyranoisoflavone Kraussianone 1 and related isoflavones[J]. Journal of Natural Products, 2010, 73(10): 1680-1685.
[22] LI S R, CHEN P Y, CHEN L Y, et al. Synthesis of haginin E, equol, daidzein, and formononetin from resorcinol via an isoflavene intermediate[J]. Tetrahedron Letters, 2009, 50: 2121-2123.
[23] MAHARIK N A, BOTTING N P. An efficient method for the glycosylation of isoflavones[J]. European Journal of Organic Chemistry, 2008, 33: 5622-5629.
[24] FEDOREYEV S A, BULGAKOV V P, GRISHCHENKO O. Isofl avonoid composition of a callus culture of the relict tree Maackia amurensis Rupr. et Maxim[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 7023-7031.
[25] SUGANYA T, FUMIO I. Antioxidant active principles isolated from Psidium guajava grown in Thailand[J]. Scientia Pharmaceutica, 2007, 75(4): 179-193.
[26] LAI Y F, JOSEPH J K. Polyphenolic glycosides from Douglas fi r inner bark[J]. Phytochemistry, 1989, 28(4): 1237-1240.
[27] TSURUMI S, TAKAGI T, HASHIMOTO T. A γ-pyronyl-triterpenoid saponin from Pisum sativum[J]. Phytochemistry, 1992, 31(7): 2435-2438.
[28] 张嫩玲, 胡江苗, 周俊, 等. 百两金的化学成分[J]. 天然产物研究与开发, 2010, 22(4): 587-589.
Chemical Constituents of Antioxidant Species in Black Soybean
ZHENG Congcong SU Yanfang*′HUANG Xiong QUE Meng
(School of Pharmaceutical Science and Technology Tianjin University Tianjin 300072′China)
Abstract:Objective: To investigate the chemical constituents of the antioxidant species present in black soybean. Methods: The antioxidant species were isolated and purified from black soybean via silica gel, polyamide, D-101 macroperous resin and Sephadex LH-20 column chromatography and their antioxidant activity was determined by the 1,1-diphenyl-2-picrylhydrazyl radical (DPPH) scavenging method. Their chemical structures were identifi ed on the basis of spectral analysis and physicochemical properties. Results: Ten compounds including seven fl avonoids were isolated and identifi ed as genistein (1), daidzein (2), glycitin (3), daidzin (4), genistin (5), quercetin-3-O-β-D-glucopyranoside (6), 3’-O-methylepicatechin-7-O-β-D-glucopyranoside (7), daucosterol (8), maltol (9), and bergenin (10). Conclusion: Compounds 6, 7, 9 and 10 were isolated from Glycine max (L.) Merr. for the fi rst time, and the antioxidant activity of black soybean is mainly attributed to the phenolic compounds.
Key words:Glycine max (L.) Merr.; black soybean; chemical constituents; fl avonoids; antioxidant activity
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2015)06-0155-06
doi:10.7506/spkx1002-6630-201506029
收稿日期:2014-07-04
基金项目:新世纪优秀人才支持计划资助项目(NCET-09-0589);天津市科技支撑计划国际科技合作项目(11ZCGHHZ00800)
作者简介:郑聪聪(1987—),女,硕士研究生,研究方向为天然产物化学。E-mail:zhengcongcong2010@163.com
*通信作者:苏艳芳(1972—),女,副教授,博士,研究方向为天然产物化学。E-mail:suyfphd@sina.com