
图1 混合单糖GC图GC
Fig.1 Gas chromatograms of mixed monosaccharide standards
石 浩,王仁才*,庞 立,仇振华,刘吉凯
(湖南农业大学园艺园林学院,湖南 长沙 410128)
摘 要:研究糖枣多糖的单糖组成。以3 a生糖枣为试材,采用糖腈乙酸酯衍生化法,利用气相色谱仪对5 个枣多糖组分进行单糖成分测定。结果表明,在糖枣多糖的单糖组成中,以木糖醇、葡萄糖、半乳糖所含比例较高,分别占单糖总含量的19.4%、18.5%、24.2%(组分DT C中葡萄糖比例高达36.4%);鼠李糖、核糖、阿拉伯糖和甘露糖,所占含量次之,分别为7.1%、6.5%、8.1%、7.9%;岩藻糖、木糖含量较低,分别只占总单糖质量的5.0%、3.4%(组分DT B1中岩藻糖只占0.80%,组分DT B2中木糖只占0.70%)。由此可知,糖枣多糖中单糖组成的差异性大。
关键词:枣;多糖;组分;单糖
枣果又称红枣,具有丰富营养价值,用途范围广,食疗价值高,可应用于保健饮料的开发 [1]。它是当今社会上等的滋补食品,枣不仅是滋补佳品,而且也是一味传统的中药,因富含营养和保健成分而享誉中外,为我国传统药食两用果品 [2-3]。现代研究表明,枣果中主要功能成分有:多糖 [4-6]、环磷酸腺苷 [7]、芦丁 [8]、多酚类 [9]、黄酮类 [10]、三萜酸 [11]、皂苷 [12]等。功能性多糖是指对生物具有一定生理作用的一类较高分子质量的碳水化合物。枣果中含有丰富的枣多糖,现代药理研究表明,其主要生理活性有:抗补体活性、促进淋巴细胞的增殖和抗癌功能 [13],健脾益胃、养心安神、补气养血,提高酶活性 [14]、保肝 [15]、抗氧化 [16-17]、抗疲劳 [18]、抗衰老、提高机体免疫力 [19-20]等重要功效。目前,对多糖中单糖的测定主要方法有:薄层色谱(thin layer chromatography,TLC)法 [21]、高效液相色谱(high performance liquid chromatography,HPLC)法 [22]、气相色谱(gas chromatography,GC)法 [23]、GC-质谱(GC-mass spectrometry,GC-MS)联用法 [24]。TLC法相对于后2 种方法来讲,其分离效果均要低于后者,但对实验条件要求不高,可做简单测定;HPLC法分离效率较低,而且常用的示差折光检测器的灵敏度也较低 [25];GC和GC-MS法两者灵敏度都很高,分析效果好,非常适合单糖的测定。糖枣为湖南乃至南方地区分布及栽培广泛的主要地方枣品种,现已成为当地果树产业的主要发展对象之一,通过对糖枣多糖的分析研究,对于促进糖枣等地方枣树资源的开发利用及其南方枣业的发展提供理论依据。
1.1 材料与试剂
3 a生糖枣 湖南衡阳玖一玉泉实业有限公司。
葡萄糖、甘露糖、木糖、半乳糖、鼠李糖、阿拉伯糖、核糖、岩藻糖、木糖醇 美国Sigma公司;无水乙醇、丙酮、正丁醇、氯仿、98%浓硫酸、苯酚、三氟乙酸、醋酸酐、盐酸羟氨、吡啶、甲醇(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
2010气相色谱仪、色谱柱:RTX-1701毛细管柱(30.0 m×0.25 mm,0.25 μm)、AUW220D电子天平 日本岛津公司;ZW1105051705紫外-可见分光光度计 上海光谱仪器有限公司;SB-3200D超声波发生器 宁波新芝生物科技股份有限公司;DR-1001旋转蒸发仪 郑州长城科工贸有限公司;DHG-9246A电热恒温干燥箱、DK-S24恒温水浴锅 上海精宏实验设备有限公司。
1.3 方法
1.3.1 供试品的制备
1.3.1.1 枣多糖的提取
转红期糖枣经65 ℃干燥至恒质量,粉碎过60 目筛,精确称取枣粉50 g于1 000 mL烧杯中加蒸馏水750 mL,经水浴超声提取,滤液旋转蒸发约15 mL后,用100 mL无水乙醇萃取,静置2 h后过滤。以多糖水溶液1/3体积加入Sevag试剂(氯仿-正丁醇(4∶1,V/V))混合振荡20 min后静置15 min,用分液漏斗除去水层与溶剂交界处的变性蛋白质,取下层多糖水溶液重复多次直至除尽,备用。
1.3.1.2 枣多糖组分的分离
取150 mg/mL的多糖溶液3.0 mL,上样于平衡好的DEAE-纤维素柱(直径2.8 mm×100 mm)中,先用蒸馏水进行洗脱,再用0.05、0.1、0.3、0.5 mol/L NaCl溶液进行分段梯度洗脱,每个浓度的洗脱体积为80 mL,5 mL一管流速为1.5 mL/min,苯酚-硫酸法跟踪检测每管洗脱液A 490 nm,浓缩每个洗脱组分;取上述浓缩组分上SephadexG-100葡聚糖柱(直径2.8 mm×100 mm),以蒸馏水做洗脱液,收集洗脱液,5 mL一管流速为1 mL/min,苯酚-硫酸法跟踪检测每管洗脱液A 490 nm;共分离出5 个多糖组分,分别命名为:DT A、DT B1、DT B2、DT B3、DT C,各组分多糖干燥至恒质量,备用。
1.3.1.3 多糖样品的水解
准确称取分级纯化的枣多糖样品各50.0 mg,分别置于三角瓶中,加入4.0 mol/L三氟乙酸(trifluoroacetic acid,TFA)溶液10.0 mL,摇匀,100 ℃水浴锅中水解10 h,取水解产物减压蒸干,然后向其中加入10.0 mL甲醇,再次减压蒸干,重复多次。
1.3.1.4 样品衍生物的制备
各多糖样品水解产物中依次加入50.0 mg盐酸羟胺,5.0 mL吡啶,然后放入90 ℃水浴中45 min,振荡,再加入5.0 mL乙酸酐,在90 ℃条件下继续反应45 min,进行乙酰化衍生,产物减压蒸干,得到糖腈乙酸酯衍生物,加入4.0 mL氯仿溶液溶解,溶液经0.45 μm滤膜过滤后,上机进行GC分析。
1.3.2 单糖的GC测定
1.3.2.1 GC分析条件的确定
取各标准单糖样品5.0 mg混合,然后按1.3.1.4节衍生化后上机测定,通过寻找最佳仪器参数得到最佳分离效果。
1.3.2.2 不同单糖保留时间的确定
取单一标准单糖5.0 mg,按1.3.1.4节衍生化后上机测定,确定每种单糖的保留时间。
1.3.2.3 不同单糖线性关系考察
标准曲线的绘制:用10 μL气相针分别取已衍生化(鼠李糖、核糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、岩藻糖、木糖醇)溶液1.0、3.0、5.0、7.0、9.0 μL,上机进行GC分析,记录色谱数据。以样品质量浓度为横坐标(x),以单糖标准品色谱峰面积为纵坐标(y)绘制标准曲线。
1.3.2.4 供试品的测定与计算
多糖样品按上述方法水解、衍生化后取4 μL上机测定,根据单糖标准品的保留时间确定多糖中单糖的种类;通过GC测得各单糖峰面积,根据单糖标准品的标准曲线计算多糖中不同单糖质量浓度;通过体积求得相应单糖质量。
2.1 GC分析
2.1.1 GC条件的确定
由图1可知,各峰分离效果较好。实验确定的GC分析条件为:温度180 ℃以3 ℃/min的速率程序升温至230 ℃;氢离子火焰检测器;检测器温度250 ℃;进样口温度270 ℃;分流比50∶1;尾吹流量10.0 mL/min;氢气流速40.0 mL/min;空气流速400.0 mL/min;载气为高纯度氮气;流速1.0 mL/min。

图1 混合单糖GC图GC
Fig.1 Gas chromatograms of mixed monosaccharide standards
2.1.2 不同单糖保留时间的确定
通过1.3.2节确定鼠李糖、核糖、岩藻糖、阿拉伯糖、木糖、木糖醇、甘露糖、葡萄糖、半乳糖保留时间,其出峰时间分别为8.0、8.5、8.9、9.16、9.88、12.2、14.5、15.3、16.0 min。
2.1.3 线性关系考察
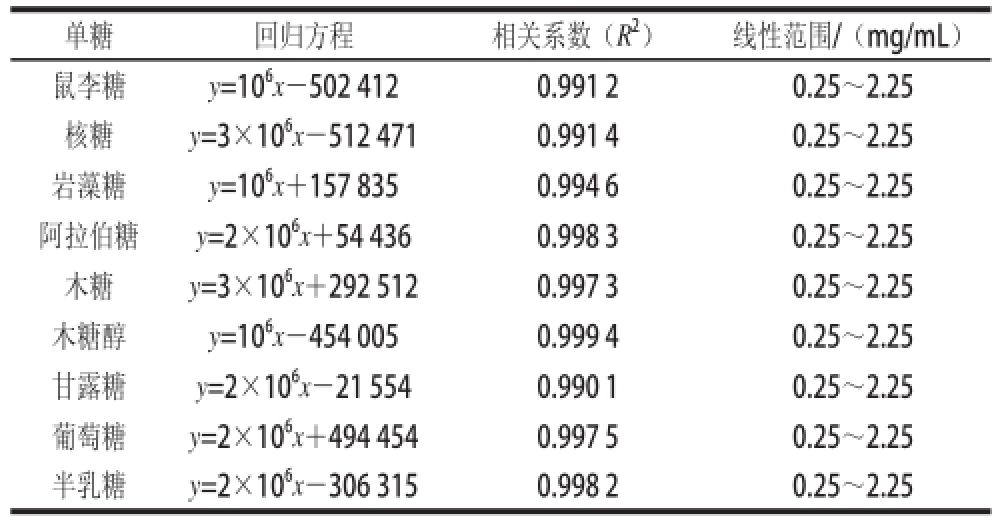
通过1.3.2节做各单糖标准品线性回归实验,得到各单糖线性回归方程、线性范围和相关系数(表1)。由表1可知,各标准单糖在质量浓度0.25~2.25 mg/mL间线性关系良好。
表1 回归方程与线性范围
Table1 Regression equations and linear rangesanges
单糖回归方程相关系数(R 2)线性范围/(mg/mL)鼠李糖y=10 6x—502 4120.991 20.25~2.25核糖y=3×10 6x—512 4710.991 40.25~2.25岩藻糖y=10 6x+157 8350.994 60.25~2.25阿拉伯糖y=2×10 6x+54 4360.998 30.25~2.25木糖y=3×10 6x+292 5120.997 30.25~2.25木糖醇y=10 6x—454 0050.999 40.25~2.25甘露糖y=2×10 6x—21 5540.990 10.25~2.25葡萄糖y=2×10 6x+494 4540.997 50.25~2.25半乳糖y=2×10 6x—306 3150.998 20.25~2.25
2.2 糖枣多糖中单糖分析
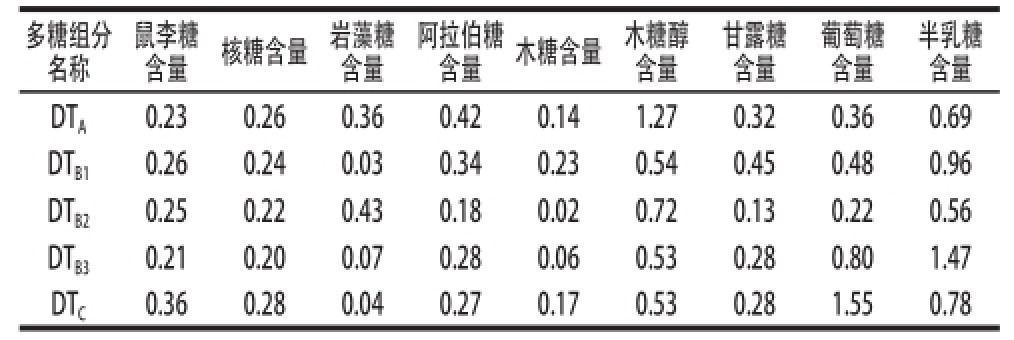
由表2可知,同组分多糖中单糖的含量差异较大。在DT A中木糖醇、半乳糖含量较高分别占31.4%、17.0%,其余单糖所占比例相差较小在3.5%~10.4%之间;在DT B1中半乳糖含量较高占27.2%,岩藻糖含量较低只占0.8%,其余单糖所占比例相差较小在6.5%~15.3%之间;在DT B2木糖醇、半乳糖含量较高分别占26.4%、20.5%,木糖含量较低只占0.7%,其余单糖所占比例相差较小在4.8%~15.8%之间;在DT B3半乳糖、葡萄糖含量较高分别占37.7%、 20.5%,岩藻糖、木糖含量较低只占1.8%、1.5%,其余单糖所占比例相差较小在5.1%~13.6%之间;在DT C中葡萄糖、半乳糖含量较高分别占36.4%、18.3%,岩藻糖含量较低只占0.9%,其余单糖所占比例相差较小在4.0%~12.4%之间;通过SPSS 17.0软件方差分析P<0.01可判断,多糖中各单糖含量具有显著性差异。
不同组分多糖中单糖的总含量也有一定差异(表2)。在已测定的9 种单糖中,5 组多糖其单糖总含量为18.47 mg,其中DT A、DT B1、DT B2、DT B3、DT C的单糖总含量依次为4.05、3.53、2.73、3.90、4.26 mg。
表2 5 组多糖的单糖组成分析结果
Table2 Monosaccharide composition of five polysaccharides from jujubes mg
多糖组分名称甘露糖含量鼠李糖含量核糖含量岩藻糖含量阿拉伯糖含量木糖含量木糖醇含量葡萄糖含量半乳糖含量DT A0.230.260.360.420.141.270.320.360.69 DT B10.260.240.030.340.230.540.450.480.96 DT B20.250.220.430.180.020.720.130.220.56 DT B30.210.200.070.280.060.530.280.801.47 DT C0.360.280.040.270.170.530.281.550.78
通过对5 组多糖中的单糖成分进行GC测定,获得GC图(图2)。由图2可知,样品多糖中单糖的分离效果较好,基本上能完全分开,这进一步说明糖腈乙酸酯衍生化,毛细管色谱柱-GC法以及本实验所采用的仪器参数适合对糖枣多糖组分中单糖的成分分析测定。


图2 样品多糖GC图GC
Fig.2 GC chromatograms of reference samples
多糖属于大分子类化合物,结构复杂,单糖成分差异大。在已测定的9 种单糖中,糖枣多糖其主要单糖成分有木糖醇、葡萄糖、半乳糖占单糖总含量的62.1%,说明糖枣多糖主要是由这3 种单糖组成,而余下的6 种单糖只占单糖总含量的37.9%。
由于通过柱分离所得到多糖的极性大小、质量大小、黏度大小、空间构象等一些物理因素不一样,其主要原因之一就是多糖间单糖的种类和含量不一样 [26]。在DT B2与DT B3中几乎不含有木糖,DT A与DT C中几乎不含有岩藻糖,在糖枣多糖中组分DT C与组分DT B2单糖含量相差达1.6 倍;在DT A中,木糖醇为主要组成单糖,高达31.4%,在DT B1中,半乳糖为主要组成单糖,高达27.2%,在DT B2中,木糖醇为主要组成单糖,高达26.4%,在DT B3中,半乳糖为主要组成单糖,高达37.7%,在DT C中,葡萄糖为主要组成单糖,高达36.4%。这不仅反映了多糖间单糖成分的结构特点,同时也为不同组分多糖在营养保健价值方面的信息提供参考。
多糖是由多个单糖基及糖苷键相连接而成的高聚物,一般是10 个以上的单糖聚合而成,其单糖组成复杂多样 [27]。在色谱图上能看到除上述9 种单糖以外的未知单糖,例如在11.3 min左右能看到有个明显的峰;在13.5、17.8 min左右也能看到一个较小的峰,有待后续进一步分析。
参考文献:
[1] 班甲′陈骏佳. 甘蔗固有多糖提取分离及单糖组成分析[J]. 食品科学′2013′34(20): 182-185. doi: 10.7506/spkx1002-6630-201320038.
[2] YEN G C DUH P D Antioxidative properties of methanolic extracts from peanut hulls[J]. Journal of the American Oil Chemists’ Society′1993′70(4): 383-386.
[3] 王爱蓉. 红枣的营养与药用价值[J]. 科技情报开发与经济′2005′15(23): 143-144.
[4] 赵爱玲′李登科′王永康. 枣树不同品种′发育时期和器官的水溶性多糖含量研究[J]. 山西农业科学′2012′40(10): 1040-1043.
[5] 林勤保′蒋梅峰. 气相色谱-质谱联用法测定大枣低聚糖的单糖组成[J]. 食品科学′2009′30(16): 210-212.
[6] 樊君′吕磊. 大枣的研究与开发进展[J]. 食品科学′2003′24(4): 162-164.
[7] 赵堂′郝凤霞′杨敏丽. 几种红枣中生物活性物质环磷酸腺苷的含量分析[J]. 湖北农业科学′2011′50(23): 4955-4957.
[8] 耿武松′王雨艨′史学礼. 不同来源大枣中有效成分芦丁含量的比较研究[J]. 现代中药研究与实践′2012′25(6): 69-71.
[9] 郭英′贝玉祥′王雪梅. 超声波法提取广枣多酚的研究[J]. 云南中医中药杂志′2008′29(8): 36-37.
[10] 胡迎芬. 冬枣黄酮的提取分离及抗氧化′抑瘤活性研究[D]. 青岛: 青岛大学′2009.
[11] 樊君′高续春′郭璞. 大孔吸附树脂分离纯化枣渣中三萜酸的研究[J]. 离子交换与吸附′2008′24(5): 426-433.
[12] 王旭峰′何计国′陈阳. 酸枣仁皂苷的提取及改善睡眠功效的研究[J]. 食品科学′2006′27(4): 226-228.
[13] 陈绍瑷. 植物活性多糖抗癌活性的研究: 抗自由基作用[J]. 中国药物与临床′2004′4(8): 606-608.
[14] 李小平. 红枣多糖提取工艺研究及其生物功能初探[D]. 西安: 陕西师范大学′2004.
[15] SIVULA N J Research and clinical applications of Ren Shen (ginseng)[J]. American Journal of Traditional Chinese Veterinary Medicine′2012′7(2): 1-4.
[16] 李小平′陈锦屏. 红枣多糖沉淀特性及抗氧化作用[J]. 食品科学′2005′26(10): 214-216.
[17] 陈晋芳. 红枣多糖提取分离纯化及其抗氧化性的研究[D]. 晋中: 山西农业大学′2013.
[18] 丁玉松′王忠. 沙枣多糖抗疲劳作用及其机制的研究[J]. 食品科学′2011′32(11): 255-257.
[19] WANG B Chemical characterization and ameliorating effect of polysaccharide from Chinese jujube on intestine oxidative injury by ischemia and reperfusion[J]. International Journal of Biological Macromolecules′2011′48(3): 386-391.
[20] 姜绍通′汪洪普′潘丽军. 芋头多糖的分离纯化及对细胞免疫的调节作用[J]. 食品科学′2013′34(19): 287-292. doi: 10.7506/spkx1002-6630-201319059.
[21] 付海宁′赵峡′于广利′等. 盐藻多糖单糖组成分析的四种色谱方法比较[J]. 中国海洋药物杂志′2008′27(4): 30-34.
[22] 都蕾蕾′张典瑞. 柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成[J]. 中国生化药物杂志′2012′33(6): 740-743.
[23] 王芝′万金志. 头花蓼多糖组分的GC、GC-MS分析[J]. 中国传统药物研究和临床药理学′2011′22(4): 458-460
[24] 李奇豫′张贵军. 桂蚕沙多糖组分的制备与GC-MS分析[J]. 中国实验方剂学杂志′2012′18(8): 113-115.
[25] 吕明霞′李媛. 气相色谱法分析大枣膳食纤维的单糖组成[J]. 中国食品学报′2012′12(2): 138-140.
[26] 滕利荣′洪水声. 普鲁兰多糖的粘度性质研究[J]. 食品科学′2003′24(10): 32-35.
[27] 何余堂′潘孝明. 植物多糖的结构与活性研究进展[J]. 食品科学′2010′31(17): 493-496.
Analysis of the Monosaccharide Composition of Polysaccharides from “Tangzao” Jujube Fruits a Local Cultivar in Hunan China
SHI Hao WANG Rencai*′PANG Li QIU Zhenhua LIU Jikai
(College of Horticulture and Landscape Hunan Agricultural University Changsha 410128′China)
Abstract:This study aimed to analyze the monosaccharide composition of five polysaccharides (DT A′DT B1′DT B2′DT B3′and DT C) extracted from “Tangzao” jujube fruits a major local cultivar in Hunan China The polysaccharides were extracted from fruits of three-year-old jujube trees and analysis of the monosaccharide composition was performed by gas chromatography following derivatization with aldononitrile acetate The results showed that the most predominant monosaccharides were glucose xylitol glucose galactose which accou nted for 36.4%′19.4% (as high as 36.4% in DT C)′18.5%′and 24.2% of the total monosaccharides respectively followed by rhamnose ribose arabinoseand mannose which accounted for 7.1%′6.5%′8.1% and 7.9% of the total sugars respectively and then fucose and xylose with relative contents of only 5.0% and 3.4%′respectively (only 0.8% fucose was contained in DT B1and only 0.7% xylose in DT B2). It can be seen that the monosaccharide composition of polysaccharides from “Tangzao” jujubes is quite different.
Key words:jujube polysaccharide component monosaccharide
中图分类号:S609.9
文献标志码:A
文章编号:1002-6630(2015)06-0169-04
doi:10.7506/spkx1002-6630-201506031
收稿日期:2014-07-19
基金项目:湖南省自然科学基金委员会与衡阳市政府自然科学联合基金项目(13JJ8010);湖南省2013年学位与研究生教育专项资金项目(CX2013B294)
作者简介:石浩(1988—),男,硕士研究生,研究方向为药用植物资源高值化利用技术。E-mail:411863216@qq.com
*通信作者:王仁才(1962—),男,教授,博士,研究方向为药用植物资源工程。E-mail:409600160@qq.com