表1 梯度洗脱程序
Table1 Gradient elution programogram

时间/min流速/(mL/min)流动相体积分数/%曲线拟合方式A B 1.070306 201.064366 261.045556 411.035656 461.010906 481.02986 541.070306 0
赵英莲 1,牟德华 1,李 艳 1,2,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄 050018)
摘 要:目的:建立一种简单、快速、可同时检测22 种氨基酸的色谱方法,并利用此方法对树莓中的游离氨基酸进行检测和分析,为树莓的开发提供科学依据。方法:以2,4-二硝基氟苯为柱前衍生试剂,Hypersil ODS 2色谱柱,流动相A为40 mmol/L pH 6.4乙酸钠溶液,流动相B为体积分数50%乙腈-水溶液,梯度洗脱,反相高效液相色谱,二极管阵列检测器,检测波长360 nm。结果:22 种氨基酸线性方程的相关系数范围为0.993 1~1.000 0,相对标准偏差在0.95%~4.98%之间,加标回收率为97.10%~103.39%,最低检出限为0.39~2.87 μg/mL,定量限为1.29~9.47 μg/mL。利用所建方法检测出树莓中含有14 种游离氨基酸,其中6 种人体必需氨基酸,占总氨基酸含量的29.36%。结论:所建方法操作简便、重复性好,树莓氨基酸含量丰富,有开发价值。
关键词:树莓;游离氨基酸;高效液相色谱法;柱前衍生;2,4-二硝基氟苯
树莓(Rubus spp.)属蔷薇科(Rasaceae)悬钩子属(Rubus)植物 [1]。在我国树莓的品种有210多种,全国各地均有种植 [2]。树莓是一种酸浆属水果,富含钙、磷、钾和维生素等人体不可缺少的营养物质,VC含量高于其他浆果 [3]。此外,树莓中含有丰富的氨基酸。氨基酸是蛋白质的基本单位,也是生物合成酶的重要组成单位,
对人体健康有重要作用。袁艺 [4]、王文芝 [5]等利用氨基酸分析仪检测研究了不同品种树莓中的氨基酸。目前,对于果蔬食品中氨基酸分析的方法主要有气相色谱法 [6]、毛细管电泳法 [7]、氨基酸分析仪 [8]和液相色谱法 [9]。树莓中氨基酸含量的检测是采用氨基酸分析仪 [4-5]。由于氨基酸分析仪操作复杂,成本较高,在高校和企业中使用并不普遍。而反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)结合柱前衍生检测氨基酸的方法因其运行时间短、设备简单,且成本相对较低而备受关注。Fabiani等 [10]用RP-HPLC以氯甲酸芴甲酯(9-fluorenylmethyl chloroformate,FMOC-Cl)为衍生试剂检测了果汁中16 种氨基酸;戴宏芬等 [11]应用RP-HPLC以2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)为柱前衍生试剂检测了青果中16 种氨基酸;高向阳等 [12]以6-氨基喹啉-N-羟基琥珀酰亚胺基甲酸酯为衍生试剂检测了齿果酸模中17 种氨基酸。徐柏球等 [13]研究了荔枝中的17 种氨基酸。然而在果蔬类食品氨基酸含量检测中,尚未见可同时检测22 种氨基酸的报道,也未见到用RPHPLC对树莓中的氨基酸进行检测的报道。因此,建立一种快速、可靠、准确,并同时检测22 种氨基酸的方法,用于检测分析树莓及同类型浆果的氨基酸含量,可为其开发与利用提供科学依据。
1.1 材料与试剂
树莓 河北赞皇丸京果品有限公司。树莓采摘后将其分装并贮存在-20 ℃冰箱中。
22 种氨基酸标品:天冬氨酸(Asp)、谷氨酸(Glu)、羟基脯氨酸(Hyp)、天冬酰胺(Asn)、谷氨酰胺(Gln)、丝氨酸(Ser)、精氨酸(Arg)、甘氨酸(Gly)、苏氨酸(Thr)、脯氨酸(Pro)、丙氨酸(Ala)、缬氨酸(Val)、蛋氨酸(Met)、胱氨酸(Cys-Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、色氨酸(Trp)、苯丙氨酸(Phe)、组氨酸(His)、半胱氨酸(Cys)、赖氨酸(Lys)、酪氨酸(Tyr)(纯度均≥98%) 美国Sigma公司;甲醇、乙腈(均为色谱纯) 湖北杜文化工科技有限公司;DNFB 艾科化学试剂公司;磷酸二氢钾、无水乙酸钠、冰乙酸、三乙胺、硼砂、硼酸、氢氧化钠均为分析纯;实验用水为娃哈哈纯净水。
1.2 仪器与设备
2695高效液相色谱仪(配有2695分离单元、2996型二极管阵列检测器) 美国Waters公司;Hypersil ODS 2色谱柱(250 mm×4.6 mm,5 μm) 大连依利特分析仪器有限公司。
1.3 方法
1.3.1 溶液的配制
pH 9.0硼酸溶液、pH 7.0磷酸缓冲溶液的配制见参考文献[14]。
流动相A:称取3.56 g无水乙酸钠,溶于1 000 mL水中,加入体积分数0.1%三乙胺,用冰醋酸调节pH 6.4 [15]。
流动相B:体积分数50%乙腈-水溶液。
衍生试剂的配制:取0.5 mL的DNFB,用乙腈定容至50 mL。
氨基酸标品的制备:称取异亮氨酸25 mg、酪氨酸10 mg,其余20 种氨基酸各50 mg,分别用pH 9.0硼酸缓冲溶液溶解,定容至10 mL。取异亮氨酸1 mL,酪氨酸2.5 mL,其余20 种氨基酸各0.5 mL混合,用pH 9.0硼酸定容到25 mL,所得溶液为氨基酸混标,置于4 ℃冰箱避光保存1 个月。
1.3.2 衍生试剂与衍生程序
采用DNFB为柱前衍生试剂。
衍生程序为:取0.5 mL氨基酸混标溶液,加入到5 mL棕色容量瓶中,再分别加入NaHCO 3缓冲溶液和DNFB各0.5 mL,放入60 ℃水浴中,暗处反应60 min。取出,冷却至室温,用平衡缓冲溶液(pH 7.0磷酸缓冲溶液)定容至5.0 mL,静置15 min,取10 μL进样分析 [14]。
1.3.3 色谱条件
流速1 mL/min;检测波长360 nm [14];柱温23 ℃;进样量10 μL;梯度洗脱,程序如表1所示。
表1 梯度洗脱程序
Table1 Gradient elution programogram

时间/min流速/(mL/min)流动相体积分数/%曲线拟合方式A B 1.070306 201.064366 261.045556 411.035656 461.010906 481.02986 541.070306 0
1.3.4 氨基酸检测方法的建立
1.3.4.1 线性方程
取一定量的混标溶液用pH 9.0硼酸进行稀释,得到5 种不同质量浓度的氨基酸混标液。分别取500 μL混标溶液进行衍生和色谱分析。测定的结果以峰面积y对氨基酸质量浓度x作线性方程:y=ax+b,进行线性回归分析。检出限(limit of determination,LOD)为3 倍的信噪比,定量限(limit of quantifi cation,LOQ)为10 倍的信噪比。
1.3.4.2 精密度和准确性
精密度:取衍生后的氨基酸标准溶液连续进样5 次,考察峰面积的相对标准偏差(relative standard deviation,RSD)。
准确性:以树莓汁样品作为空白基质,添加已知质量浓度的氨基酸标准溶液,按照1.3.2节进行衍生后测定其加标回收率,采用外标法计算回收率。
1.3.5 样品的制备
树莓检测时将其解冻、破碎、过滤、4 500 r/min离心15 min,分离上清液置于干净的试管中用pH 9.0硼酸碱化,得到pH 8.2的样品,待测。
1.4 数据处理
色谱分析采用仪器自带Waters-Empower软件。所有线性方程、重复性和准确性实验的数据均由Excel 2007计算得出。样品处理的数据及结果分析采用OriginLab Origin V8.0。
2.1 衍生试剂选择
因大多数氨基酸不含芳香环等紫外或可见光吸收基团,无法直接用紫外和可见光吸收法检测,需先将氨基酸衍生转化成具有较强紫外或者荧光吸收的衍生产物,使其在360 nm波长处紫外光区有吸收峰。氨基酸的衍生有柱前衍生和柱后衍生。本实验采用RP-HPLC结合柱前衍生检测氨基酸含量。一般用于柱前衍生的试剂有邻苯二甲醛(o-phthaldialdelhyde,OPA) [16-20]、FMOCCl [21-22]、异硫氰酸苯酯(phenyl isothiocyanate,PITC) [23]和DNFB [24]等。每种衍生试剂都有各自的优缺点,OPA与氨基酸在室温条件下反应1 min即可形成具有很强荧光的衍生产物,而OPA本身不具有荧光性,不会对色谱分离产生影响。但是它仅与一级氨基酸发生反应,与二级氨基酸(脯氨酸和羟基脯氨酸)不发生反应。PITC和FMOC-Cl均能与一级和二级氨基酸发生反应,形成稳定单一的衍生产物,但是PITC衍生过程比较复杂,需要去除多余的试剂,且痕量的PITC也会缩短分析柱的寿命;FMOC-Cl形成的衍生产物一般适合于荧光检测器。DNFB作为柱前衍生试剂,它能与一级、二级氨基酸反应形成单一稳定的衍生产物 [25],且在紫外、可见光区进行检测。所以本实验采用DNFB作为柱前衍生试剂。
2.2 色谱条件的优化
色谱柱温度对多组分的分离有重要影响,实验考察柱温的变化范围为22~33 ℃,结果发现柱温在23 ℃以上,且随着柱温升高苯丙氨酸和组氨酸重合,其他氨基酸分离度变化不明显。所以本实验采用柱温23 ℃。苯丙氨酸和组氨酸的分离度受温度影响较大的原因可能是由于二者的化学结构极为相似,不易分离。温度降低时,有可能使两者与固定相的相互作用力发生了不同程度的改变,从而使两者分开。
本实验考察了流动相流速为0.5~1.0 mL/min对氨基酸分离的影响,结果发现流速低于1.0 mL/min时,谷氨酰胺和丝氨酸被衍生试剂的水解产物2,4-硝基苯酚(2,4-dinitrophenol,DNP-OH)所覆盖。主要是因为流速太慢,谷氨酰胺和丝氨酸在柱中停留时间变长,而柱中DNP-OH含量相对较高,所以三者容易重叠。通过调整流速为1.0 mL/min,再调整梯度洗脱程序,从而使谷氨酰胺和丝氨酸达到了基线分离。优化后22 种氨基酸实现了分离和同时检测,结果见图1。由图1可知,22 种氨基酸均达到基线分离,可用于氨基酸的定性和定量分析。

图1 优化后的色谱图
Fig.1 Optimized chromatogram
1. Asp;2. Glu;3. Hyp;4. Asn;5. Gln;6. Ser;7. DNP-OH;8. Arg;9. Gly;10. Thr;11. Pro;12. Ala;13. Val;14. Met;15. Cys-Cys;16. Ile;17. Leu;18. Trp;19. Phe;20. His;21. Cys;22. Lys;23. Tyr。
2.3 氨基酸检测方法的建立
2.3.1 线性关系、线性范围、LOD和LOQ
表2 线性方程相关系数、线性范围、线性关系、LOD、LOQQ和RRSSDD
Table2 Linear equations with correlation coefficients and linear ranges detection limit quantification limit and relative standard deviation ((RRSSDD))
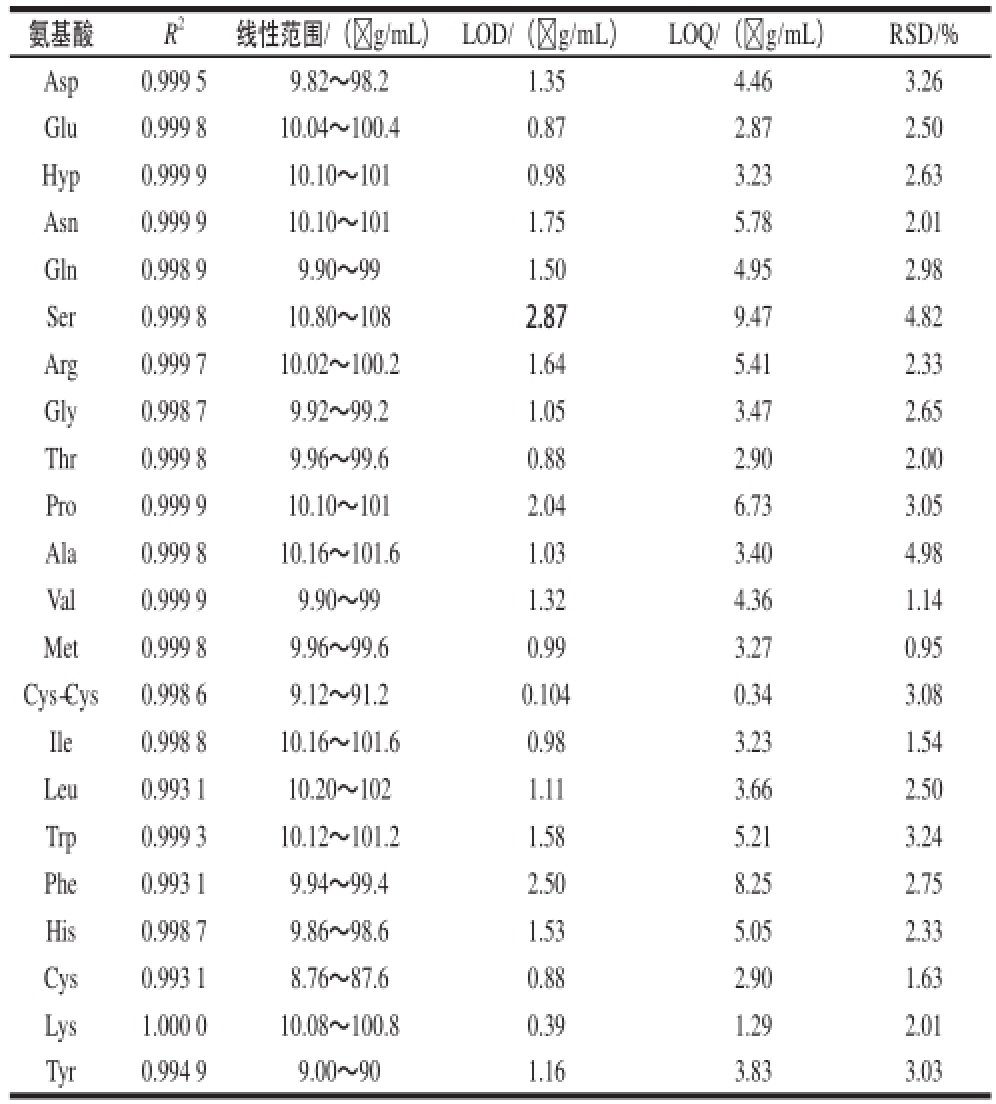
氨基酸R 2线性范围/(☒g/mL)LOD/(☒g/mL)LOQ/(☒g/mL)RSD/% Asp0.999 59.82~98.21.354.463.26 Glu0.999 810.04~100.40.872.872.50 Hyp0.999 910.10~1010.983.232.63 Asn0.999 910.10~1011.755.782.01 Gln0.998 99.90~991.504.952.98 Ser0.999 810.80~1082.879.474.82 Arg0.999 710.02~100.21.645.412.33 Gly0.998 79.92~99.21.053.472.65 Thr0.999 89.96~99.60.882.902.00 Pro0.999 910.10~1012.046.733.05 Ala0.999 810.16~101.61.033.404.98 Val0.999 99.90~991.324.361.14 Met0.999 89.96~99.60.993.270.95 Cys-Cys0.998 69.12~91.20.1040.343.08 Ile0.998 810.16~101.60.983.231.54 Leu0.993 110.20~1021.113.662.50 Trp0.999 310.12~101.21.585.213.24 Phe0.993 19.94~99.42.508.252.75 His0.998 79.86~98.61.535.052.33 Cys0.993 18.76~87.60.882.901.63 Lys1.000 010.08~100.80.391.292.01 Tyr0.994 99.00~901.163.833.03
按优化后的条件,在9~108 ☒g/mL的质量浓度范围内,分别以22 种氨基酸溶液质量浓度为横坐标,峰面积为纵坐标,得到22 种氨基酸的工作曲线、线性范围、LOD和LOQ,结果见表2。相关系数在0.993 1~1.000 0之间,线性关系良好。LOD为0.39~2.87 μg/mL, LOQ为1.29~9.47 μg/mL。
2.3.2 精密度与准确性
以22 种氨基酸峰面积的RSD表示方法的重复性,连续5 次进样检测的RSD在0.95%~4.98%之间,重复性好。向树莓汁中添加3 个不同的已知质量浓度的14 种氨基酸标准溶液,衍生后测定加标回收率表示方法的准确性,回收率在97.10%~103.39%之间。
2.4 样品的处理及氨基酸含量测定
2.4.1 样品处理
氨基酸和衍生试剂反应所需要的环境为弱碱性,而树莓汁pH 3.2,为酸性,故在衍生前需要对样品碱化。为不引进新的干扰离子,选择了硼酸和碳酸氢钠进行比较研究,结果见表3。将2 种试剂处理后的样品分别进行衍生后,过0.45 μm微孔膜过滤,取10 μL进行上机分析。结果发现用碳酸氢钠调碱,除酪氨酸外,所测树莓各种游离氨基酸的含量均少于用硼酸处理测得的结果,见图2。用碳酸氢钠碱化的样品在衍生过程中出现絮状沉淀,可能正是这些不溶物使氨基酸含量下降。
表3 样品处理
Table3 Comparison of two alkalization methods before derivatization

缓冲溶液pH样品体积∶缓冲溶液体积处理后样品pH硼酸9.01∶68.2碳酸氢钠9.01∶38.2
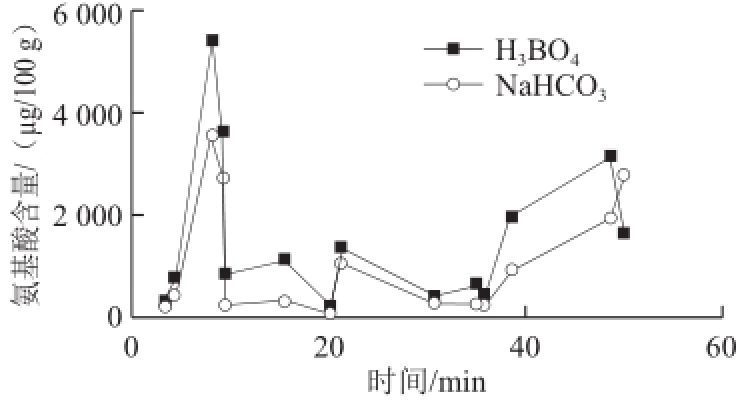
图2 不同处理对氨基酸含量的影响
Fig.2 Effect of different alkalization methods on the contents of amino acids
2.4.2 树莓中氨基酸含量的测定
以DNFB为柱前衍生试剂,采用HPLC法检测石家庄市赞皇地区种植的树莓中游离氨基酸,样品色谱图见图3,具体结果见表4。
由表4可知,树莓中含有14 种游离氨基酸,其中包含6 种人体必需氨基酸。树莓中游离氨基酸的总量为31 377.45 μg/100 g,其中丙氨酸、天冬酰胺和赖氨酸含量较高,分别为8 011.18、6 393.52 μg/100 g和3 705.33 μg/100 g。而且这3 种氨基酸含量的总和占总游离氨基酸含量的55.9%。6 种人体必需氨基酸含量占总游离氨基酸含量的29.36%,体现了树莓的高营养价值。

图3 样品色谱图
Fig.3 Chromatogram of sample
1. Asp;2. Glu;3. Asn;4. Gln;5. Ser;6. DNP-OH;7. Thr;8. Pro;9. Ala;10. Val;11. Ile;12. Leu;13. Phe;14. Lys;15. Tyr。
表4 树莓中氨基酸含量及其RSD、回收率及其RRSSDD
Table4 The contents with RSD and recoveries with RSD of amino acids in raspberrrriieess

注:*. 人体必需氨基酸。
氨基酸氨基酸含量/(☒g/100 g)氨基酸含量RSD/%(n=6)回收率/%回收率RSD/%(n=6)天冬氨酸340.432.15100.753.51谷氨酸951.372.6099.443.29天冬酰胺6 393.522.61100.813.29丝氨酸2 210.342.05101.053.51谷氨酰胺2 100.405.2299.443.29苏氨酸*1 337.962.42100.811.48脯氨酸230.482.27101.053.51丙氨酸8 011.182.37101.022.00缬氨酸*522.705.47100.571.32异亮氨酸*787.710.36103.390.23亮氨酸*534.261.29100.050.24苯丙氨酸*2 324.672.8798.445.45赖氨酸*3 705.331.6097.970.40酪氨酸1 927.101.7597.102.72必需氨基酸9 212.63游离氨基酸总量31 377.45
本实验建立了一种简单、快速、可靠,并能同时检测22 种氨基酸的方法,该方法的R 2大于0.993 1,回收率97.10%~103.39%,RSD不大于4.98%。采用此方法检测到树莓中14 种游离氨基酸,典型的氨基酸为天冬酰胺,丙氨酸和赖氨酸。其中丙氨酸可作为食品调味品、防腐剂;天冬酰胺具有降血压功效;赖氨酸为人体必需氨基酸,可用于食品营养强化剂和除臭剂。证实了树莓的营养价值,可为树莓的开发利用和深加工提供科学依据。
参考文献:
[1] 刘建华, 张志军, 李淑芳. 树莓中功效成分的开发浅论[J]. 食品科学, 2004, 25(10): 370-373.
[2] 韩加, 刘继文. 树莓营养保健功效及开发前景[J]. 中国食物与营养, 2008, 14(8): 54-56.
[3] 韩加, 新华·纳比, 阿里木·帕塔尔, 等. 新疆树莓果实营养成分及其提取物抗氧化性研究[J]. 营养学报, 2008, 30(4): 410-413.
[4] 袁艺, 李纯, 张扬, 等. 不同基因型树莓营养成分比较的研究[J]. 食品工业科技, 2010, 31(10): 356-359.
[5] 王文芝. 树莓果实营养初报[J]. 西北园艺, 2001(2): 13-14.
[6] MUSTAFA A, ÅMAN P, ANDERSSON R, et al. Analysis of free amino acids in cereal products[J]. Food Chemistry, 2007, 105(1): 317-324.
[7] 李笑笑. 毛细管电泳电化学检测含乳饮料中游离的甘氨酸[J]. 广州化工, 2012, 40(8): 127-128.
[8] 姚玉霞, 蔡建, 培杜锐, 等. 梅花鹿三权茸和二杠茸氨基酸含量对比分析[J]. 中国食品学报, 2003, 3(2): 67-71.
[9] PARAMÁS A M G, BÁREZ J, MARCOS C C, et al. HPLC-fl uorimetric method for analysis of amino acids in products of the hive (honey and bee-pollen)[J]. Food Chemistry, 2006, 95(1): 148-156.
[10] FABIANI A, VERSARI A, PARPINELLO G P, et al. Highperformance liquid chromatographic analysis of free amino acids in fruit juices using derivatization with 9-fluorenylmethylchloroformate[J]. Journal of Chromatographic Science, 2002, 40(1): 14-18.
[11] 戴宏芬, 赖志勇, 张超洪, 等. 反相高效液相色谱法测定青果中氨基酸[J]. 食品工业科技, 2010, 31(6): 333-335.
[12] 高向阳, 刘娜. AccQ·Tag柱前衍生反相-高效液相色谱法测定齿果酸模中的氨基酸含量[J]. 食品科学, 2011, 32(20): 160-163.
[13] 徐柏球, 杨剑. 反相高效液相色谱法测定荔枝果实游离氨基酸[J].食品科学, 2004, 25(12): 156-158.
[14] 唐涛. 氨基酸柱前衍生化HPLC方法发展及应用[D]. 南京: 南京理工大学, 2006.
[15] 李东, 孙家义. 2,4-二硝基氟苯柱前衍生高效液相色谱法测定18 种氨基酸[J]. 化学分析计量, 2004, 13(1):18-20.
[16] WANG Lin, XU Renjie, HU Bing, et al. Analysis of free amino acids in Chinese teas and flower of tea plant by high performance liquid chromatography combined with solid-phase extraction[J]. Food Chemistry, 2010, 123(4): 1259-1266.
[17] PEREIRA V, PONTES M, CÂMARA J S, et al. Simultaneous analysis of free amino acids and biogenic amines in honey and wine samples using in loop orthophthalaldeyde derivatization procedure[J]. Journal of Chromatography A, 2008, 1189(1): 435-443.
[18] SOUFLEROS E H, BOULOUMPASI E, TSARCHOPOULOS C, et al. Primary amino acid profiles of Greek white wines and their use in classification according to variety, origin and vintage[J]. Food Chemistry, 2003, 80(2): 261-273.
[19] KELLY M T, BLAISE A, LARROQUE M. Rapid automated high performance liquid chromatography method for simultaneous determination of amino acids and biogenic amines in wine, fruit and honey[J]. Journal of Chromatography A, 2010, 1217(47): 7385-7392.
[20] ARRIETA M P, PRATS-MOYA M S. Free amino acids and biogenic amines in Alicante Monastrell wines[J]. Food Chemistry, 2012, 135(3): 1511-1519.
[21] CARRATÙ B, BONIGLIA C, BELLOMONTE G. Optimization of the determination of amino acids in parenteral solutions by highperformance liquid chromatography with precolumn derivatization using 9-fl uorenylmethyl chloroformate[J]. Journal of Chromatography A, 1995, 708(2): 203-208.
[22] HORANNI R, ENGELHARDT U H. Determination of amino acids in white, green, black, oolong, pu-erh teas and tea products[J]. Journal of Food Composition and Analysis, 2013, 31(1): 94-100.
[23] SHI Zhihong, LI Hui, LI Zhiming, et al. Pre-column derivatization RPHPLC determination of amino acids in asparagi radix before and after heating process[J]. 2013 International Conference on Agricultural and Natural Resources Engineering, 2013, 5: 351-356.
[24] 肖维强, 赖志勇, 戴宏芬, 等. 反相HPLC法测定余甘子果实中的游离氨基酸[J]. 仲恺农业技术学院学报, 2008, 21(2): 9-13.
[25] 周游, 谭亚林, 王晓玲, 等. 氨基酸分析方法[J]. 安徽农业科学, 2012(24): 11939-11941.
High Performance Liquid Chromatographic Analysis of Free Amino Acids in Raspberry Using Pre-Column Derivatization with 2′4-Dinitrofluorobenzene
ZHAO Yinglian
1′MOU Dehua
1′LI Yan
1′2′*
(1. College of Biological Science and Engineering Hebei University of Science and Technology Shijiazhuang 050018′China; 2. R amp D Center for Fermentation Engineering of Hebei Province Shijiazhuang 050018′China)
Abstract:A simple and rapid reversed-phase high-performance liquid chromatographic (RP-HPLC) method for the simultaneous analysis of 22 free amino acids was established and applied to analyze free amino acids in raspberries. The method was based on pre-column derivatization with 2,4-dinitrofl uorobenzene (DNFB). The compounds were separated on a Hypersil ODS 2column. The mobile phase used was a mixture of phase A containing 40 mmol/L sodium acetate buffer (pH 6.4) and phase B containing 50% acetonitrile-water through the gradient elution. Detection was performed using a diode array detector at 360 nm. The method showed good linearity with coeffi cients (R 2) of determination varying between 0.993 1 and 1.000 0 and precision (relative standard deviation, RSD) ranging from 0.95% to 4.98%, and recovery rates were in the range between 97.10% and 103.39% for 22 amino acids. The limits of detection and quantifi cation were 0.39?2.87 μg/mL and 1.29?9.47 μg/mL, respectively. This method proved to be simple and reproducible and was applied to detect 14 free amino acids in raspberries, including 6 essential amino acids (EEAs). The contents of EEAs accounted for 29.36% of the total amino acids. The amino acid content of raspberries is abundant, indicating that this kind of berry has the potential to be developed into functional foods.
Key words:raspberry; free amino acids; high performance liquid chromatography (HPLC); pre-column derivatization; 2,4-dinitrofl uorobenzene
中图分类号:TS262.7
文献标志码:A
文章编号:1002-6630(2015)06-0178-05
doi:10.7506/spkx1002-6630-201506033
收稿日期:2014-07-14
基金项目:河北省科技支撑计划项目(11230604D-5-2)
作者简介:赵英莲(1989—),女,硕士研究生,研究方向为传统发酵工程创新技术。E-mail:1363149012@qq.com
*通信作者:李艳(1958—),女,教授,学士,研究方向为传统发酵工程创新技术。E-mail:lymdh5885@163.com