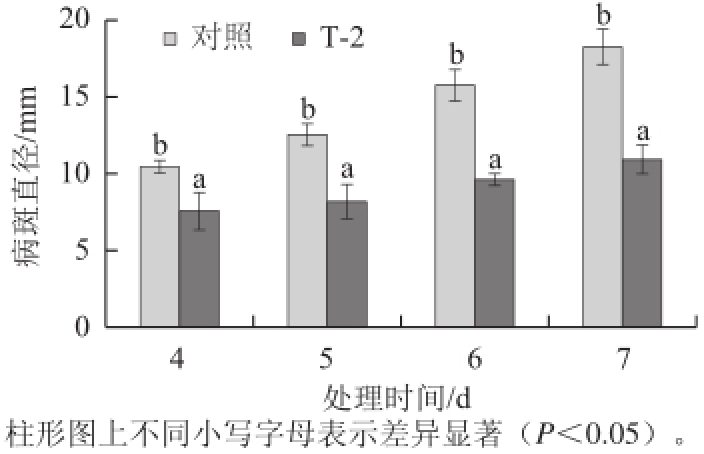
图1 T-2 处理对马铃薯块茎切片接种F. sulphureum病斑直径的影响
Fig.1 Effects of T-2 treatment on the lesion diameter of potato tuber slices inoculated with F. sulphureum
赵 莹,薛华丽,毕 阳*,唐亚梅,沈科萍
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
摘 要:由镰刀菌引起的干腐病是导致甘肃省马铃薯块茎贮藏期间的主要病害。以‘陇薯3号’马铃薯为试材,用1 μg/mL T-2处理马铃薯块茎切片,观察T-2处理对马铃薯块茎切片损伤接种硫色镰刀菌(Fusarium sulphureum)后,其对病斑直径的抑制效果,以及块茎切片苯丙烷代谢关键酶活性及产物积累的影响。结果表明,T-2处理有效降低了块茎切片损伤接种Fusarium sulphureum的病斑直径,提高了切片苯丙氨酸解氨酶和4-香豆酰-辅酶A连接酶的活性,促进了木质素、总酚、类黄酮及花青素的积累。由此表明,低质量浓度T-2处理可通过诱导马铃薯的苯丙烷代谢增强块茎对干腐病的抗性。
关键词:马铃薯;T-2毒素;诱导抗性
马铃薯是我国的重要经济作物,年产量近8 000万 t,大部分马铃薯块茎采收以后都要经过3~6 个月的贮藏,期间腐烂颇为严重 [1-2],其中由镰刀菌引起的干腐病是导致块茎腐烂最重要的病害,西北主产区的发病率可达15%~25% [3]。硫色镰刀菌(Fusarium sulphureum)是导致甘肃省马铃薯块茎干腐病的主要病菌,不仅造成块茎贮藏期间的经济损失,而且会在块茎体内积累对人畜具有潜在危害的单端孢霉烯族毒素 [4-7],其中以3-乙酰基-脱氧雪腐镰刀菌烯醇、4,15-二乙酰氧基-8-异戊酰氧基-12,13-环氧单端孢霉-9-烯-3-醇(epoxytrichothecene,T-2)、蛇形毒素和伏马菌素最为常见 [8],其中T-2是一种主要由三线镰刀菌在特定条件下产生的有毒次级代谢产物,是单端孢霉烯族毒素的重要代表 [9]。现已证明,单端孢酶二烯进过一系列的加氧、异构化、环化、酯化等复杂反应最终形成T-2 [10-11]。一般认为,真菌毒素是重要的致病因子 [12],但Nishiuchi等 [13]发现,低质量浓度T-2可诱导拟南芥对镰刀菌的抗性,由此表明,低质量浓度T-2具有激发子的功能。但尚未见低质量浓度T-2对马铃薯块茎诱导抗性方面的报道。本实验拟研究低质量浓度T-2处理对马铃薯块茎切片损伤接种F. sulphureum病斑直径的影响,及对苯丙烷代谢关键酶及其产物的影响,为完善T-2的功能提供依据。
1.1 材料与试剂
供试马铃薯块茎(‘陇薯3号’)2012年10月采自甘肃省农业科学院一航种业会川试验基地。
T-2(分析纯) 美国Sigma公司。
1.2 仪器与设备
UV-2450型分光光度计 日本Shimadzu公司;H-1850R型台式高速冷冻离心机 湘仪离心机仪器有限公司。
1.3 方法
1.3.1 T-2处理
参照Yin Yan等 [14]方法。选取外观整齐,无明显病虫害的马铃薯块茎,先用0.5%的次氯酸钠表面消毒2 min,无菌水冲洗,过夜晾干,然后用75%的酒精擦洗过的不锈钢刀将马铃薯块茎切成厚1 cm,直径3.5 cm的切片,切片先用无菌水清洗,再用75%的酒精擦洗并在酒精灯火焰上灼烧去除多余酒精,后置于已灭菌的湿滤纸上,在黑暗的恒温恒湿培养箱中放置4 h,取200 μL的T-2溶液,用灭菌的接种环均匀涂布于马铃薯切片上,以无菌水处理为对照。
1.3.2 T-2处理对马铃薯块茎切片损伤接种F. sulphureum病斑直径的影响
参照Yin Yan等 [14]方法。经过T-2处理后,在23~25 ℃条件下黑暗培养3 d接种病原物。接种方法:取PDA上培养7 d的8 mm的F. sulphureum菌饼,倒置接种于处理后的马铃薯切片中央,3 d后用十字交叉法测量病斑直径,记录数据,每个处理用8~10 个切片,实验重复3 次。
1.3.3 取样
参照杨志敏等 [15]方法。第0、1、2、3、4、5、6、7天取未接种的马铃薯块茎1~3 mm处果肉组织3 g,组织用锡箔纸包好,液氮冷冻,在—80 ℃超低温冰箱中保存待测。
1.3.4 苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性的测定
参照杨志敏等 [15]方法。取3.0 g冷冻的马铃薯组织,加入5 mL经4 ℃预冷的0.1 mol/L硼酸缓冲液(pH 8.8,含1%交联聚维酮、1 mmol/L乙二胺四乙酸和50 mmol/L β-巯基乙醇),冰浴中研磨成匀浆后,在4 ℃、11 250×g离心20 min,上清液用来测定酶的活性。取3 支试管分别标记为Ⅰ、Ⅱ和Ⅲ,然后向Ⅰ和Ⅱ2 支试管分别加入3 mL 7 mmol/L L-苯丙氨酸溶液(50 mmol/L硼酸缓冲液配制),再分别向Ⅰ和Ⅲ两只试管中加入500 μL粗酶液后立即于37 ℃保温1 h,保温完后立即在290 nm波长处测其OD值,以Ⅱ和Ⅲ混合后测定的OD值为初始值,Ⅰ中测定值为终止值。另以提取液代替酶液按照上述方法测得的OD值分别作为初始值和终止值的对照,以每分钟OD值变化0.01为1 U,PAL活性表示为U/g。
1.3.5 4-香豆酰-辅酶A连接酶(acid-coenzyme A ligase,4CL)活性测定
参照杨志敏等 [15]方法。取3.0 g马铃薯组织,加入5 mL 0.2 mol/L Tris-HCl缓冲液(含25%甘油、0.1 mol/L二硫苏糖醇、pH 8.0)及少量石英砂,然后于4 ℃、15 000×g离心20 min,收集上清液并立即用于酶活测定。反应液包括0.45 mL 15 μmol/L Mg 2+(硫酸镁或氯化镁),0.15 mL 5 μmol/mL p-香豆酸,0.15 mL 50 μmol/mL ATP,0.15 mL 1 μmol/mL CoA以及0.5 mL酶液。40 ℃条件下反应10 min,在333 nm波长处测定OD值,以每分钟内ΔOD 333 nm变化0.1为1 个活性单位(U)。酶活性单位为U/g,对照不加香豆酸。样品重复测3 次。
1.3.6 总酚、类黄酮含量的测定
参照曹建康等 [16]的方法。取3.0 g马铃薯组织,加入5 mL预冷的1% HCl-甲醇在冰浴条件下充分研磨提取,4 ℃、12 000×g离心10 min。取上清液分别于280 nm和325 nm波长处测定总酚和类黄酮含量。总酚含量表示为ΔOD 280 nm/g;类黄酮含量表示为ΔOD 325 nm/g。样品重复测定3 次。
1.3.7 木质素含量的测定
参照杨志敏等 [15]方法。取3.0 g马铃薯组织与预冷的5 mL 95%乙醇研磨,4 ℃、12 000×g离心10 min,沉淀物用95%乙醇溶液冲洗3 次,再用乙醇-正己烷体积比1∶2冲洗3 次,收集沉淀使其干燥,干燥物溶于1 mL 25%溴化乙酰冰醋酸溶液中,70 ℃恒温水浴30 min,然后加1 mL 2 mol/L NaOH溶液中止反应。再加2 mL冰醋酸和0.1 mL 7.5 mol/L羟胺盐酸,离心,取上清液0.02 mL,用冰醋酸定容至5 mL,280 nm波长处测定样品OD值,木质素含量以ΔOD 280 nm/g表示,样品重复测3 次。
1.3.8 花青素含量的测定
参照曹建康等 [16]的方法。取3.0 g马铃薯组织,加入5 mL预冷的1% HCl-甲醇在冰浴条件下充分研磨提取,4 ℃避光保存20 min,期间摇动数次,12 000×g离心10 min。取上清液分别于600 nm和530 nm测定花青素含量。花青素含量表示为ΔOD 530 nm/g—ΔOD 600 nm/g。样品重复测定3 次。
1.4 数据统计
数据采用Microsoft Excel 2007软件进行分析,并计算标准误差;采用SPPS Statistics 17.0软件进行差异显著性分析。
2.1 T-2处理对马铃薯块茎切片接种F. sulphureum病斑直径的影响

图1 T-2 处理对马铃薯块茎切片接种F. sulphureum病斑直径的影响
Fig.1 Effects of T-2 treatment on the lesion diameter of potato tuber slices inoculated with F. sulphureum
由图1可知,T-2处理能有效抑制F. sulphureum损伤接种块茎切片病斑直径的扩展。随着培养时间的延长,处理和对照的病斑直径均逐渐扩大,但处理切片的病斑直径低于对照,处理后第6天和第7天分别低于对照39.6%和40.7%。
2.2 T-2处理对块茎PAL和4CL活性的影响
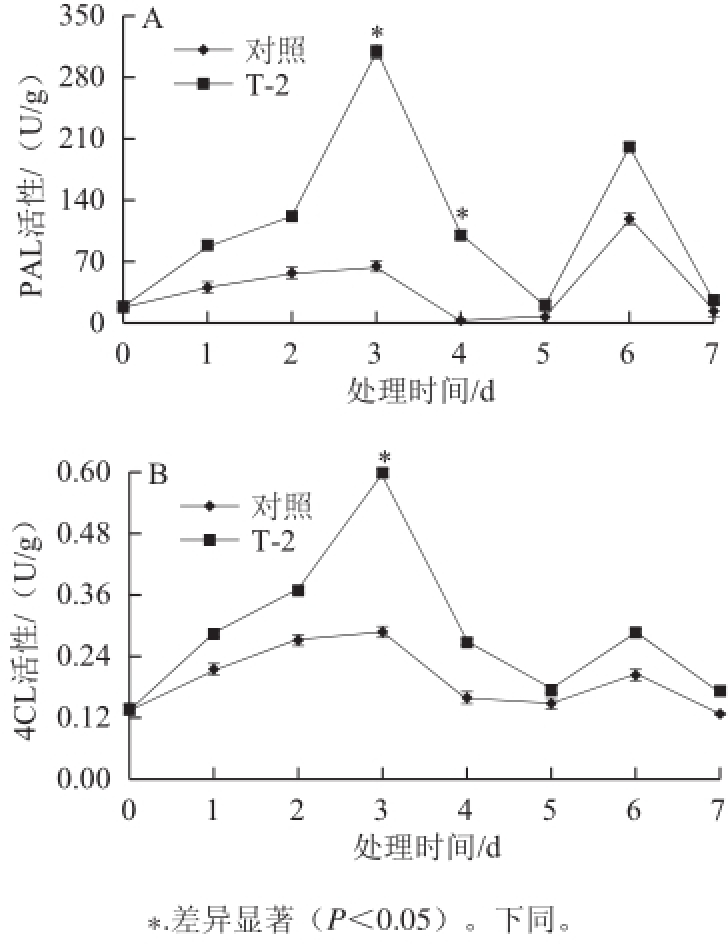
图2 T-2 处理对马铃薯块茎切片 PAL(A)和4CL(B)活性的影响
Fig.2 Effects of T-2 treatment on activities of PAL (A and 4CL (B in potato tubers slices
由图2可知,处理及对照的PAL活性整体呈先升高后降低再小幅升高的趋势,但处理明显高于对照。T-2处理后在第3天出现最高峰并在第6天出现了次高峰,对照组在第3天出现峰值后逐渐下降并在第6天出现最高峰,处理后第3天和第6天分别高于对照79.42%和41.69%(图2A)。随着贮藏时间的延长,对照和处理块茎的4CL活性总体呈现先升高后下降再升高的趋势,且处理组的4CL活性均高于对照。处理和对照组分别在第3天达到最高峰,在第6天达到次高峰,处理后第3天和第6天分别高于对照51.11%和28.23%(图2B)。
2.3 T-2处理对块茎木质素、总酚、类黄酮和花青素含量的影响
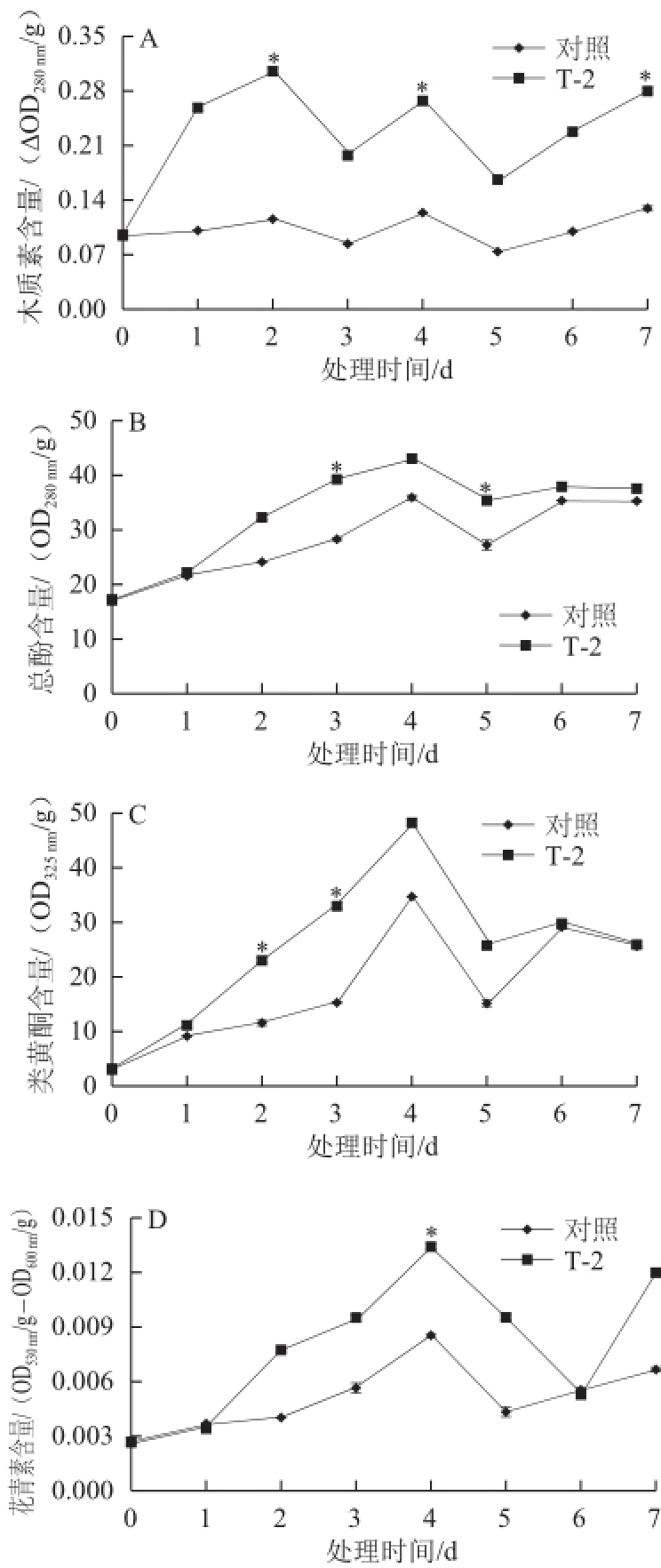
图3 T-2处理对马铃薯块茎切片木质素(A)、总酚(B)、B类黄酮(C)和花青素(D)含量的影响
Fig. 3 Effects of T-2 treatment on contents of lignin total phenolic flavonoids and anthocyanin in potato tuber slices
培养期间对照及处理切片的木质素含量整体呈现先增后降再升高再下降最后升高的趋势,同时在第2天和第4天出现高峰,第5天以后均持续上升。T-2处理者的木质素含量整体高于对照,在第2天高出对照38.1%(图3A)。对照和处理切片总酚和类黄酮含量总体呈现先增后降的趋势并均在第4天达到高峰值,T-2处理者的总酚和类黄酮含量高于对照,第4天时分别高出对照16.31%和28.05%,但在培养的后期(第6天和第7天),对照和处理总酚和类黄酮含量差异不大(图3B、C)。对照和处理切片花青素的含量呈单峰形变化,峰值在第4天出现,在培养后期又有所增高,处理者的花青素含量明显高于对照,在第4天高于对照36.27%(图3D)。
本研究结果表明,低质量浓度T-2处理可以有效抑制马铃薯块茎切片损伤接种F. sulphureum的病斑直径扩展,其作用机理与增强苯丙烷代谢密切相关。由于T-2处理提高了块茎切片的PAL和4CL活性,促进了木质素、总酚、类黄酮以及花青素的积累,表明T-2可作为激发子诱导马铃薯块茎的抗病性。
本课题组前期研究发现,激发子处理具有促进马铃薯块茎愈伤的能力。本研究所观察到的PAL与4CL活性分别在第3天和第6天出现了峰值的结果表明,T-2处理参与了块茎愈伤过程中2 个关键阶段,即封闭层的形成和伤口周皮的形成 [17]。PAL是催化苯丙烷途径的第1个关键酶,生成的反式-肉桂酸经过特定的生物合成途径形成用于组装到软木酯多酚的前体物质 [18]。然而在封闭层的形成和伤口周皮形成初期的过程中,有软木酯多酚和软木酯多聚脂肪族化合物的积累 [19-21]。因此,认为T-2作为一种激发子,能够促进苯丙烷代谢中的木质素,木栓质和胼胝质在细胞内的大量积累 [17],最终形成多酚类化合物 [18]。软木酯多酚以固定的方式进入伤口附近的薄壁细胞 [17],并且作为一种机械屏障促进伤口的愈合,防止病原物的侵入和单端孢霉烯族毒素的渗透和扩散。另外,本课题组前期研究表明,激发子能够明显地提高马铃薯块茎总酚、类黄酮和木质素的含量 [22-23]。马铃薯中存在原花青素,而原花青素是一大类多酚物质的总称,具有强有力的抗氧化,清除自由基的功能 [24]。在植物的次生代谢中,PAL活性是植物合成花青素等次生代谢产物的关键酶,H 2O 2是植物细胞中PAL所必需的信号分子,同时H 2O 2对花青素合成有更为直接的促进作用 [25]。所以当PAL的活性增高后,花青素的含量也随之增高。
综上所述,低质量浓度T-2可作为一种激发子通过激活苯丙烷代谢来诱导马铃薯块茎对干腐病的抗病性,但T-2处理是如何促进块茎愈伤结构形成的尚有待进一步研究。
参考文献:
[1] 杨志敏, 毕阳, 李永才, 等. 马铃薯干腐病菌硫色镰孢的生物学特性[J].菌物学报, 2012, 31(4): 574-583.
[2] 魏周全, 张廷义, 杜玺. 马铃薯块茎干腐病发生危害及防治[J]. 植物保护, 2006, 32(2): 103-105.
[3] 孙晓娟, 李永才, 毕阳, 等. 西北地区马铃薯贮藏期间病害调查分析[J].中国马铃薯, 2009, 23(6): 364-365.
[4] ALI S, RIVERA V V, SECOR G A, et al. First report of Fusarium graminearum causing dry rot of potato in North Dakota[J]. Plant Disease, 2005, 89(1): 105.
[5] PETER J C, LEES A K, CULLEN D W. Characterization of Fusarium spp. responsible for causing dry rot of potato in Grant Britain[J]. Plant Pathology, 2008, 57(2): 262-271.
[6] DELGADO J A, SCHWARZ P B, GILLESPIE J, et al. Trichothecene mycotoxins associated with potato dry rot caused by Fusarium graminearum[J]. Phytopathology, 2010, 100(3): 290-296.
[7] JR R E, GUDMESTAD N C, RIVER V V, et al. Fuasrium sambucinum as a dry rot pathogen of potato in the USA: prevalence, comparison of host isolate aggressiveness and factors affecting aetiology[J]. Plant Pathology, 2010, 59(6): 1114-1120.
[8] XUE Huali, BI Yang, TANG Yamei, et al. Effect of cultivars Fusarium strains and storage temperature on trichothecenes production in inoculated potato tubers[J]. Food Chemistry, 2014, 151(15): 236-242.
[9] 林妮妮, 赵燕华, 郭磊, 等. T-2毒素的分析检测方法及代谢研究进展[J].军事医学, 2012, 36(6): 471-475.
[10] 陈利锋. 镰孢菌单端孢霉烯族毒素的生物合成: 综述[J]. 农业生物技术学报, 1998(1): 85-89.
[11] MCCORMICK S P, STANLEY A M, STOVER N A, et al. Trichothecenes: from simple to complex mycotoxins[J]. Toxins, 2011, 3: 802-814.
[12] MASUDA D, ISHIDA M, YAMAGUCHI K, et al. Phytotoxic effects of trichothecenes on the growth and morphology of Arabidopsis thaliana[J]. Journal of Experimental Botany, 2007, 58(7): 1617-1626.
[13] NISHIUCHI T MASUDA D NAKASHITA H et al Fusarium phytotoxin trichothecenes have an elicitor-like activity in Arabidopsis thaliana but the activity differed significantly among their molecular species[J]. Molecular Plant-Microbe Interactions′2006′19(5): 512-520.
[14] YIN Yan LI Yongcai BI Yang et al Postharvest treatment with β-aminobutyric acid inducesresistance against dry rot caused by Fusarium sulphureum in potato tuber[J]. Agricultural Sciences in China′2010′9(9): 1372-1380.
[15] 杨志敏, 毕阳, 李永才, 等. 马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化[J]. 中国农业科学, 2012, 45(1): 127-134.
[16] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 1-176.
[17] LULAI E C, NEUBAUER J D. Wound-induced suberization genes are differentially expressed, spatially and temporally, during closing layer and wound periderm formation[J]. Postharvest Biology and Technology, 2014, 90: 24-33.
[18] BERNARDS M A. Demystifying suberin[J]. Canadian Journal of Botany, 2002, 80(3): 227-240.
[19] LULAI E C, CORSINI D L. Differential deposition of suberin phenolic andaliphatic domains and their roles in resistance to infection during potato tuber (Solanum tuberosum L.) wound healing[J]. Physiolog ical and Molecular Plant Pathology, 1998, 53(4): 209-222.
[20] LULAI E C, SUTTLE J C, PEDERSON S M. Regulatory involvement of abscisic acid in potato tuber wound-healing[J]. Journal of Experimental Botany, 2008, 59(6): 1175-1186.
[21] NEUBAUER J D, LULAI E C, THOMPSON A L, et al. Wounding coordinately induces cell wall protein, cell cycle and pectin methyl esterase genes involved in tuber closing layer and wound periderm development[J]. Plant Pahtology, 2012, 169(6): 586-595.
[22] 李永才, 孙小娟, 毕阳. 壳聚糖处理对马铃薯块茎活性氧代谢影响[J].食品工业科技, 2010, 31(8): 313-315.
[23] SUN Xiaojuan, BI Yang, LI Yongcai, et al. Postharvest chitosan treatment induces resistance in potato against Fusarium sulphureum[J]. Agricultural Sciences in China, 2008, 7(5): 615-621.
[24] 杨晓辉, 汪岭. 紫外分光光度法分析测定“黑美人”土豆原花青素[J].安徽农业科学, 2010, 38(25): 13634-13644.
[25] 马廷蕊, 张金文, 梁慧光, 等. 外源NO和H 2O 2诱导不同颜色马铃薯花青素积累[J]. 中国蔬菜, 2012(16): 63-67.
T-2 Toxin at Low Concentration Activates Phenylpropanoid Pathway in Potato Tubers
ZHAO Ying XUE Huali BI Yang*′TANG Yamei SHEN Keping
(College of Food Science and Engineering Gansu Agricultural University Lanzhou 730070′China)
Abstract:Dry rot, caused by Fusarium sulphureum spp., is one of the most important postharvest diseases of potato tubers in Gansu province. Potato tuber slices (cv. Long Shu No.3) were treated with T-2 toxin at 1 μg/mL. The effi cacy of T-2 toxin treatment on the lesion diameter of potato tuber slices inoculated with F. sulphureum, the activities of key enzymes involved in phenylpropanoid pathway and metabolites were investigated. The results showed that T-2 toxin treatment signifi cantly decreased lesion diameter of potato tuber slices inoculated with F. sulphureum, and enhanced the activities of phenylalanine ammonia-lyase (PAL) and coumaric acid-coenzyme A ligase (4CL), and also improved the accumulation of lignin, total phenolic compounds, fl avonoids and anthocyanin. It is suggested that T-2 toxin treatment at lower concentration induces resistance against dry rot in harvested potato tubers by activating phenylpropanoid pathway.
Key words:pot ato; T-2 toxin; induced resistance
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2015)06-0232-04
doi:10.7506/spkx1002-6630-201506044
收稿日期:2014-07-10
基金项目:国家高新技术研究发展计划(863计划)项目(2012AA101607);甘肃省自然科学基金项目(1308RJZA280)
作者简介:赵莹(1988—),女,硕士研究生,研究方向为采后生物学与技术。E-mail:15095315053@163.com
*通信作者:毕阳(1962—),男,教授,博士,研究方向为采后生物学与技术。E-mail:biyang@gsau.edu.cn