王 红1,吴启南1,2,*,蒋 征1,樊修和1,谷 巍1,乐 巍1
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中药资源产业化过程协同创新中心,江苏 南京 210023)
摘 要:目的:以芡实中总多糖、总酚、总黄酮、不同构型VE含量及抗氧化活性为指标,考察芡实适宜的干燥方式。方法:以紫外分光光度法测定芡实中的总多糖、总酚、总黄酮含量及抗氧化活性,利用高效液相色谱法测定芡实中不同构型VE含量为质量指标,综合评价6 种不同干燥方法(阴干、晒干、烘干、真 空冷冻干燥、红外干燥、微波干燥)对芡实品质的影响。结果:采用微波干燥能够最大程度地保留样品中总多糖、总酚和总黄酮类物 质;在真空冷冻干燥处理条件下,芡实中不同构型VE含量最高且清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS+·)的能力最强;相关性分 析显示,各不同构型VE含量与抗氧化活性指标具有显著相关性。结论:真空冷冻干燥在最大程度积累VE各类构型成分的基础上,其产品表现出最佳的抗氧化活性,并在一定程度上尽可能地降低了芡实总多糖、总酚及总黄酮类成分的损失,可作为芡实产地加工适宜的干燥方法。
关键词:干燥方法;芡实;功能性成分;抗氧化活性
芡实为睡莲科芡属一年生水生维管植物芡(Euryale ferox Salisb.)的干燥成熟种仁,又名鸡头米、鸡头莲,始载于《神农本草经》,列为上品,后被历版药典所收载。芡实原产于我国和东南亚,广泛分布于我国南方各地,主产于江苏、浙江、广东、黑龙江等地,生长于湖泊、池塘、滩地、水沟中,其外被有深黑色种皮,于秋末冬出打捞后,剥去其坚硬种皮,暴露出带红皮的种仁[1],具有益肾固精、补脾止泻、祛湿、止带的功效[2]。芡实主要含有的不同构型VE、黄酮类、多酚类化合物具有一定的抗衰老与脂质过氧化的作用[3-4],使其在功能性食品的应用方面具有良好的市场前景。
产地加工是药材生产与品质形成的重要环节[5],其间包括了药用部位与非药用部位的分离[6]、功效物质与营养成分的最大保留[7]、有毒有害物质的最小化[8],各化学成分之间的相互转化[9]等物理化学性质的变化,最终的目的是生产出集提高有效性与安全性于一体的品质优良的药材。如有研究者在对银杏叶干燥方法的研究中,最终选择了80 ℃烘干40 min的干燥条件,是由于80 ℃烘干能起到“杀青”的作用,使得分解次生代谢物的胞内酶失活,有效地防止了胞内酶对有效成分的分解,有利于银杏叶中黄酮与内酯类活性成分的保留,且耗时短,有效节约了时间,从而提高生产效率[10]。
传统芡实的加工于每年的11月中旬至次年3月底,在不影响新种繁殖和鱼种投放的原则的前提下,通过抽真空的方法将沉降于湖底的芡实种子吸附后,与抽出的湖水一道排放到挑选筛中,人工净选,除去杂质和非药用部位,洗净后,用编制袋或篾筐运至湖岸上,晒至八、九成干或烘至全干,再利用剥壳机去壳取仁[11]。近年来,带壳芡实干燥方法的研究主要集中于常压干燥与减压干燥中不同温度对芡实的含水量、干燥速率的影响[12],探讨芡实与芡壳水分散发的规律,但致力于干燥方法对芡实功能性成分与抗氧化活性的影响鲜有研究,且干燥方式较为传统、单一。
本实验选取传统干燥技术(阴干、晒干和60 ℃烘干)和现代干燥技术(真空冷冻干燥、红外干燥和微波干燥)处理芡实样品,通过紫外分光光度法测定芡实中总多糖、总酚及总黄酮含量,高效液相色谱(high performance liquid chromatography,HPLC)法测定芡实中不同构型VE含量,体外抗氧化实验探明不同干燥方法处理下芡实有效活性成分与抗氧化能力的相关性,为寻找芡实适宜的产地加工方法提供合理的科学依据。
1.1 材料与试剂
芡实样品于2013年11月底采自扬州高邮湖水下籽,经南京中医药大学吴启南教授鉴定为睡莲科植物芡的干燥成熟种仁,样品标本存放于阴凉干燥处,初始含水量为28.43%。
α、β、γ、δ-生育酚标准品、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 美国Sigma公司;无水葡萄糖、抗坏血酸对照品 北京拜尔迪生物公司;没食子酸、芦丁对照品 中国药品生物制品鉴定所;VC对照品 阿拉丁试剂(上海)有限公司;苯酚、浓H2SO4(分析纯) 国药集团化学试剂有限公司;亚硝酸钠、硝酸铝、氢氧化钠、碳酸钠(分析纯)南京化学试剂有限公司;过硫酸钾(分析纯)上海凌峰化学试剂有限公司;甲醇(色谱纯) 美国Merck公司;无水乙醇(分析纯) 南京奥佳化工有限公司。
1.2 仪器与设备
Waters 2695高效液相色谱仪(配有Waters 2998 PDA检测器、高精度四元梯度泵、自动进样器及Empower色谱工作站)、Waters XBridge色谱柱 美国Waters公司;Sartorius BT 125D型十万分之一电子分析天平 北京赛多利斯仪器系统有限公司;B-490 BUCHI Rotavapor R-205旋转蒸发仪 瑞士步琪有限公司;SHZ-D(Ⅲ)循环真空泵、HH-S电热恒温水浴箱 巩义市英峪华仪器厂;Power-wave X340全波长酶标仪 美国Bio-Tek公司;WH-90A微型漩涡混悬器 上海振苯科学仪器有限公司;SAGA-10TY实验室级超纯水器 南京易普易达科技发展有限公司;LXT-ⅡB低速大容量多管离心机 南京晓晓仪器设备有限公司;BIOHIT微量移液器芬兰百得公司;96 孔板 美国Corning公司。
1.3 方法
1.3.1 样品处理方法
分别称取6 份带壳芡实原料,每份500 g,并分别标号A~F。分别采用以下干燥方法干燥至含水量为<10%即可。
阴干:取标号为A的500 g芡实原料,均匀放入托盘中,在室温条件下阴干1 周,温度为15~20 ℃。
晒干:取标号为B的500 g芡实原料,均匀放入托盘中,白天以太阳光直射,温度为20~25 ℃,晚上将样品放入恒温培养箱中4 d,模拟白天的太阳直射。
烘干:取标号为C的500 g芡实原料,均匀放入托盘中,使用电热鼓风干燥箱烘干2 d,功率为3.3 kW,温度为60 ℃。
真空冷冻干燥:取标号为D的500 g芡实原料,平均放入2 个冷冻样品瓶中,于-80 ℃超低温冰箱中预冻24 h,再于冷冻干燥机干燥样品20 h,功率为3 kW,冷凝温度为-50 ℃,冻干压力为100 Pa;解析阶段温度升至50 ℃,解析压力为45 Pa。
红外干燥:取标号为E的500 g芡实原料,均匀放入托盘置红外干燥箱1 h,加热距离约为20 cm,功率为500 W。
微波干燥:取标号为F的500 g芡实原料,均匀放入托盘并置于微波干燥箱中,温度70 ℃功率320 W,微波干燥10 min,取出至室温冷却,反复操作5 次。
1.3.2 水分含量测定
依据2010版《中华人民共和国药典》[13]一部附录,取不同干燥方法处理过的芡实约2 g,平铺于干燥至恒质量的扁形称量瓶中,厚度不超过5 mm,疏松度不超过10 mm,精密称定质量,打开瓶盖在100~105 ℃条件下干燥5 h,将瓶盖盖好,移置干燥器中,冷却30 min,精密称定质量,再在上述温度干燥1 h,冷却,称质量,至连续两次称质量的差异不超过5 mg为止。根据减失的质量,计算样品中水分含量。
1.3.3 总多糖、总酚、总黄酮提取
1.3.3.1 总多糖提取[14]
取A~F标记的各干燥方法处理的芡实约10 g,于索氏提取器中加入10 倍量的石油醚脱脂2 h,抽滤,滤渣中加入350 mL蒸馏水,超声波辅助(频率25 kHz,功率300 W,温度60 ℃)提取20 min,随后80 ℃热水浸提 5 h,离心,取上清液,用三氯乙酸法除蛋白,离心,滤液用旋转蒸发仪浓缩5 倍,加无水乙醇(使乙醇终体积分数为85%),置冰箱静置过夜,离心,并用无水乙醇、丙酮依次洗涤,得粗多糖,60 ℃条件下烘干,备用待测。
1.3.3.2 总酚、总黄酮提取[15]
取A~F标记的各干燥方法处理的芡实约2 g,置于100 mL具塞锥形瓶中,依次加入60 mL的无水乙醇,超声波提取(频率25 kHz,功率240 W),提取3次,1 h/次,合并提取液,过滤入球形蒸发瓶,用50 mL无水乙醇冲洗锥形瓶及残渣3 次,并入球形蒸发瓶,于旋转蒸发仪减压回收溶剂至干,用无水乙醇定容于10 mL容量瓶中,备用待测。
1.3.4 总多糖、总酚、总黄酮含量测定
1.3.4.1 总多糖含量测定[16]
分别称取干燥至恒质量的各干燥方法芡实粗多糖1 mg,定容于10 mL容量品中,精密吸取样品溶液1 mL于具塞试管中,加去离子水1 mL稀释1 倍,加入体积分数为5%苯酚溶液1 mL,随即沿壁缓缓加入5 mL浓H2SO4,摇匀后,40 ℃水浴放置30 min,于490 nm波长处测定吸光度A。以无水葡萄糖为标准对照品,按上述方法,绘制标准曲线,得到回归方程y=0.042 8x+0.105 9(线性范围1.07~6.43 μg/mL,R2=0.999 3),并根据标准曲线计算总多糖含量。
1.3.4.2 总酚含量测定[17]
分别移取各干燥方法的芡实总酚提取液400 μL,置10 mL容量瓶中,加入去离子水补足至1 mL,加入1 mL 的Folin-酚试剂(使用前用去离子水稀释)和1 mL体积分数7.5% Na2CO3溶液,混匀,避光于50 ℃水浴中10 min,加去离子水定容至10 mL,于760 nm波长处测定吸光度A。以没食子酸为标准对照,按上述方 法,绘制标准曲线,y=0.008 9x-0.012 1(线性范围1.08~10.80 μg/mL,R2=0.999 1),并根据标准曲线计算总酚含量。
1.3.4.3 总黄酮含量测定[18]
分别移取各干燥方法的芡实总黄酮提取液5 mL,置25 mL容量瓶中,用无水乙醇补足至10 mL,加入体积分数为5% NaNO21 mL,摇匀,放置6 min,再加入体积分数为10% Al(NO3)3溶液1 mL,摇匀,放置6 min,最后加入体积分数为4% NaOH溶液10 mL,加水稀释至刻度,摇匀,放置15 min,于510 nm波长处测定吸光度A。以芦丁为标准对照,按上述方法,绘制标准曲线,得到回归方程y=0.000 5x-0.001 0(线性范围13.20~66 μg/mL,R2=0.999 8),并根据标准曲线计算总黄酮含量。
1.3.5 体外抗氧化性评价
分别精密称取不同干燥方法处理过的各芡实样品约1.6 g,置于100 mL具塞锥形瓶中,依次加入48 mL的无水乙醇,超声波提取(频率25 kHz,功率240 W)3 次,1 h/次,合并提取液,过滤入球形蒸发瓶,用50 mL无水乙醇3 次冲洗锥形瓶及残渣,并入球形蒸发瓶,于旋转蒸发仪减压回收溶剂至干,并用无水乙醇定容至25 mL容量瓶中,即得生药量质量浓度为64 mg/mL的各提取液。
1.3.5.1 DPPH自由基清除率测定[19]
在2 mL 0.2 mmol/L DPPH无水乙醇溶液中分别加入2 mL逐级稀释的芡实提取液,混合液在涡旋仪剧烈振摇后,室温下放置45 min,于517 nm波长处测定吸光度A样品。同时取无水乙醇2 mL作为对照溶液,2 mL不同质量浓度VC溶液作为阳性对照,操作同前,测定其吸光度A对照、AVC。每份样品平行测定2次,取平均值。以上操作需在避光条件下进行。DPPH自由基清除率计算公式如下,VC与芡实提取液清除DPPH自由基能力均用IC50值表示。
1.3.5.2 ABTS+·清除率测定[20]
将5 mL 7 mmol/L的ABTS溶液与88 μL 140 mmol/L的过硫酸钾溶液混合反应来制备ABTS+·溶液,使用前将ABTS+·溶液在室温下黑暗中放置12~16 h,测定时将溶液稀释至734 nm波长处吸光度为0.70±0.02。将4.5 mL稀释的ABTS+·溶液与0.5 mL逐级稀释的芡实提取液混合后,室温放置30 min,在734 nm波长处测定吸光度A样品。同时取无水乙醇0.5 mL作为对照溶液,不同质量浓度VC溶液0.5 mL作为阳性对照,操作同前,测定其吸光度A对照、AVC。每份样品平行测定2 次,取平均值。以上操作需在避光条件下进行。ABTS+·清除率计算公式如下,VC与芡实提取液清除ABTS+·能力均用IC50值表示。
1.3.6 芡实种仁VE含量测定[21]
1.3.6.1 色谱条件
色谱柱:Waters XBridge C18柱(4.6 mm×150 mm,5 μm);流动相:V(甲醇)∶V(水)=97∶3;检测波长:295 nm。柱温:30 ℃;流速: 1 mL/min;进样量:10 μL。
1.3.6.2 标准曲线绘制
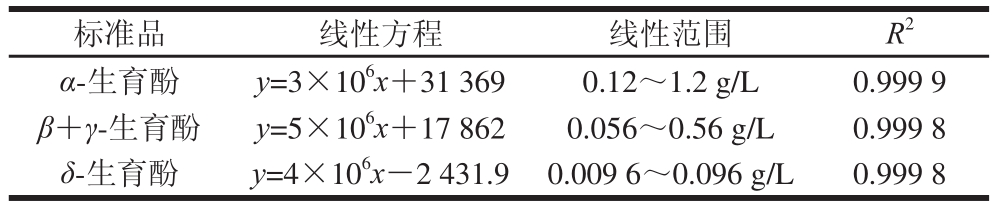
分别精密称取12、5.6、0.96 mg的α-生育酚、β+γ-生育酚、δ-生育酚标准品置于10 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得α-生育酚、β+γ-生育酚、δ-生育酚质量浓度分别为1.2、0.56、0.096 mg/mL的标准品母液。分别精密吸取上述α-生育酚、β+γ-生育酚、δ-生育酚标准品母液100、200、400、600、800 μL至1 mL容量瓶中,用色谱甲醇稀释至刻度,按1.3.6.1节色谱条件进样10 μL,以色谱峰面积为横坐标,以质量浓度为纵坐标绘制标准曲线,线性方程及参数见表1。
表1 VE含量测定的标准品线性方程及参数
Table 1 Linear equations with linear range and correlation coefficient foorr VVEE
1.3.6.3 供试品的制备
精密称取不同干燥条件下的芡实样品2 g,置于100 mL具塞锥形瓶中,依次加入60 mL的无水乙醇,超声波提取(频率25 kHz,功率240 W)3 次,1 h/次,合并提取液,过滤入球形蒸发瓶,用50 mL无水乙醇3 次冲洗锥形瓶及残渣,并入球形蒸发瓶,于旋转蒸发仪减压回收溶剂至干,用色谱甲醇溶解并定容至10 mL,摇匀,过0.45 μm微孔滤膜。
1.3.6.4 VE含量测定
按1.3.6.2节供试品制备方法,制成不同干燥条件下的样品溶液10 mL,平行进样3 次,每次10 μL,测定峰面积,由标准曲线线性方程计算得VE含量。
1.3.6.5 方法学考察
精密度实验:精密吸取α-生育酚、β+γ-生育酚、δ-生育酚标准品混合溶液10 μL,按1.3.6.1节色谱条件连续进样6 次,记录其峰面积并计算相对标准偏差(relative standard deviation,RSD)值。
稳定性实验:取烘干的供试品溶液10 μL,按1.3.6.1节所述色谱条件,分别在0、2、4、8、16、24 h进样,记录其峰面积并计算RSD值。
重现性实验:精密称取烘干样品,按1.3.6.3节供试品制备方法平行制备6 份,按1.3.6.1节所述色谱条件,分别进样10 μL。记录其峰面积并计算RSD值。
加样回收率实验:精密称取已知含量的烘干样品9 份,每份约2 g,分别按已知含量的80%、100%、120% 3 个水平加入对照品,按1.3.6.2节方法制备供试品溶液,测定对照品峰面积,计算平均回收率及RSD值。
2.1 不同干燥方法的芡实水分含量
经测定阴干、晒干、烘干、真空冷冻干燥、红外干燥、微波干燥6 种干燥方法的芡实含水量分别为0.94%、0.88%、0.78%、0.69%、0.68%、0.52%,RSD值均在5%以内。
2.2 不同干燥方法下芡实中总多糖、总酚、总黄酮含量比较
表2 不同干燥方法下芡实总多糖、总酚、总黄酮含量
Table 2 Contents of total polysaccharides, total phenols and total
flavonoidss in Euryale Semen with different drying methodss
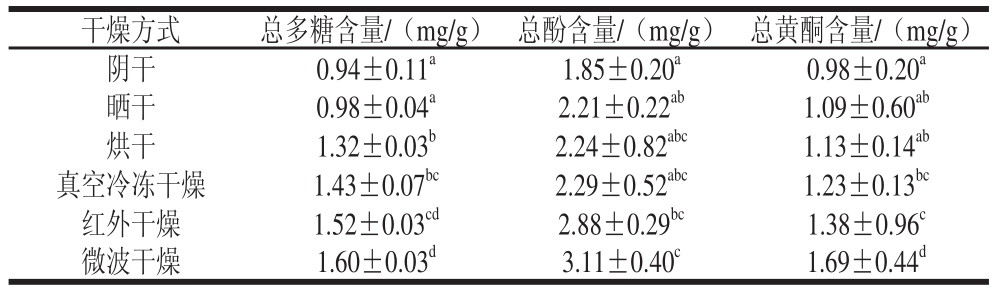
注:同列小写字母不同表示差异显著(P<0.05)。下同。
由表2可知,70 ℃微波干燥10 min条件下,芡实中总多糖、总酚、总黄酮含量积累最高,分别为1.60、3.11、
1.69 mg/g;而在自然阴干1 周的条件下,芡实中总多糖、总酚、总黄酮含量积累最低,分别为0.94、1.85、
0.98 mg/g。由此可见,不同干燥方法对芡实中总多糖、总酚、总黄酮含量影响相差较大,其影响大小趋势为:微波干燥>红外干燥>真空冷冻干燥>烘干>晒干>阴干。其中微波干燥方法既快速又便捷,且使芡实的总多糖、总酚和总黄酮的含量积累最高。
2.3 不同干燥方法下芡实醇提物体外抗氧化能力比较
DPPH自由基法和ABTS+·法为两种常用的评价中药提取物抗氧化能力的方法。本实验比较了阴干、晒干、烘干、真空冷冻干燥、红外干燥、微波干燥6 种不同干燥方法对芡实无水乙醇提取物的抗氧化能力大小的影响,并计算出IC50值(清除率为50%时的芡实提取物质量浓度)。IC50值越小,则对应的芡实提取物抗氧化能力越强,具体结果见表3及图1。-50 ℃真空冷冻干燥20 h,芡实清除DPPH自由基与ABTS+·的IC50值最小,分别为5.69、4.25 mg/mL,表现出较强的抗氧化能力;而70 ℃微波干燥10 min,芡实清除DPPH自由基与ABTS+·的IC50值最大,分别为13.25、9.02 mg/mL,表现出相对较弱的抗氧化能力。具体影响大小的趋势为:真空冷冻干燥>阴干>晒干>烘干>红外干燥>微波干燥。
表3 不同干燥方法下芡实提取物的抗氧化活性
Table 3 Effects of different drying methods on antioxidant activity of Euryale Semen extraaccttss
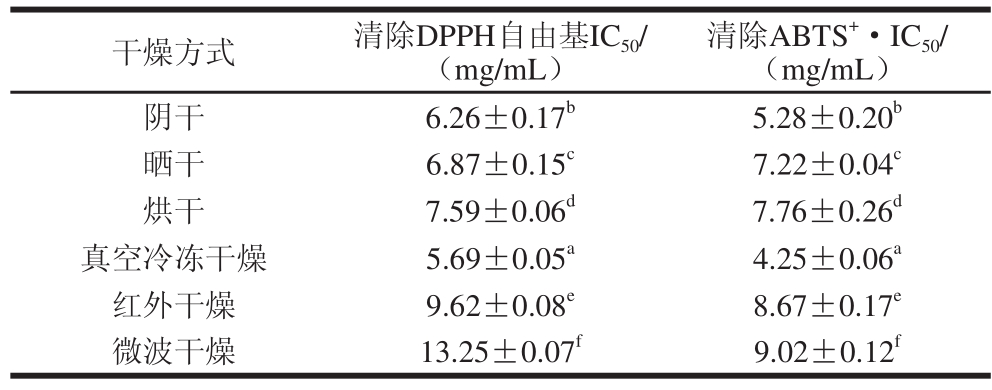
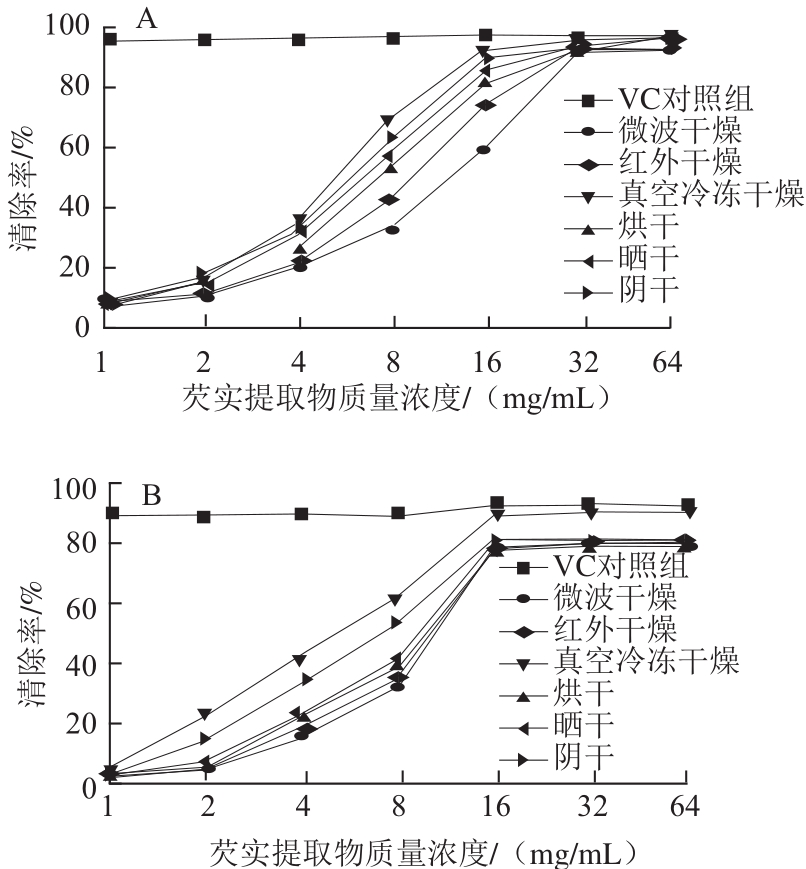
图1 不同干燥方法对芡实提取物总抗氧化能力的影响
Fig.1 Effects of different drying methods on total antioxidant activity of Euryale Semen extracts
A. 芡实提取物清除DPPH自由基的能力;B. 芡实提取物清除ABTS+·的能力。
2.4 不同干燥方法下芡实VE含量测定结果
2.4.1 不同构型VE含量
VE又名生育酚,是一种脂溶性维生素。而芡实中VE类成分含量丰富,既可以作为其中医功效物质基础成分,又可以作为其食用价值中的营养性成分。由图2和表4可知,冷冻干燥20 h,芡实中α-生育酚、β+γ-生育酚和δ-生育酚含量最高,分别为1.97、0.68、0.23 mg/g。而在70 ℃微波干燥10 min条件下,芡实中α-生育酚、β+γ-生育酚和δ-生育酚含量最低,分别为1.01、0.29、0.08 mg/g。具体影响大小趋势为:真空冷冻干燥>阴干>晒干>烘干>红外干燥>微波干燥,与抗氧化活性趋势表现相一致。
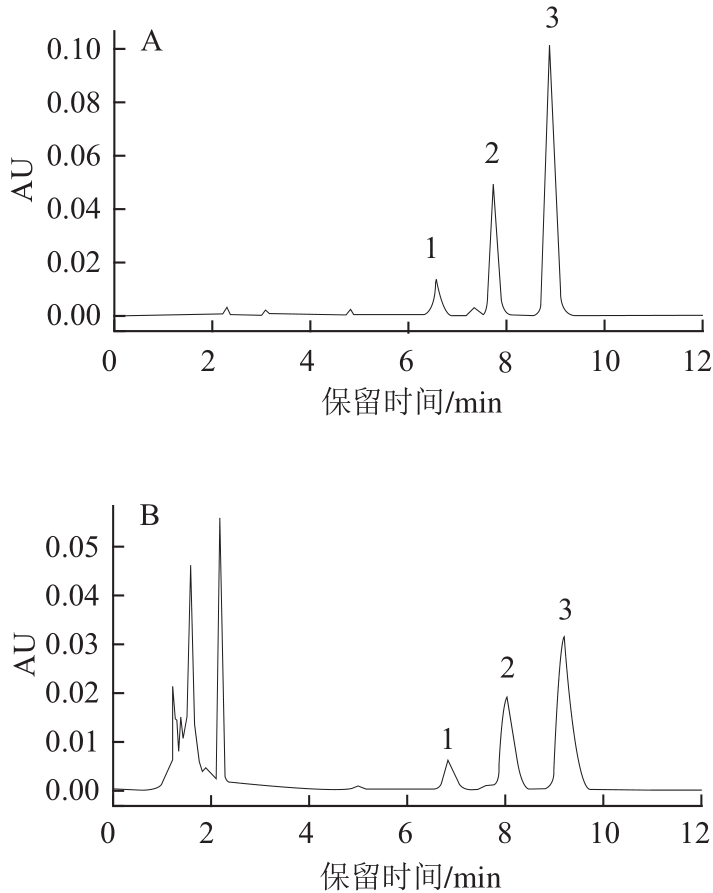
图2 VE标准品及样品的HPLC色谱图
Fig.2 HPLC chromatograms of vitamin E standard and sample
A. VE标准品;B. 芡实样品;1. δ-生育酚;2. β+γ-生育酚;3. α-生育酚。
表4 不同干燥方法下芡实中不同构型VEE含量
Table 4 Contents of different configurations of vitamin Ein Euryale Semen with different drying methoddss
mg/g

2.4.2 VE含量测定方法学考察
表5 不同干燥方法下芡实VE含量测定的方法学考察
Table 5 Methodological evaluation of the determination of vitamin Einn Euryale Semen dried by different methodss
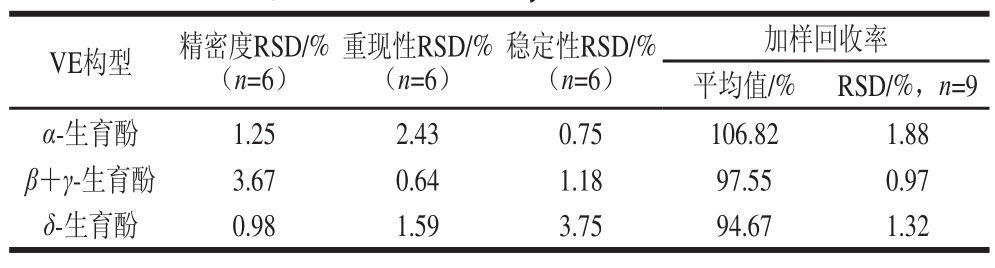
由表5可知,α-生育酚、β+γ-生育酚、δ-生育酚的精密度在0.98%~3.67%之间,表明仪器的精密度良好;重现性在0.64%~2.43%之间,表明本方法的重现性良好;稳定性在0.75%~3.75%之间,表明供试品溶液在24 h内稳定性良好;加样回收率在94.67%~106.82%之间,加样回收率控制在80%~120%,表明该提取方法有效可行,适合于芡实中VE的含量测定。
2.5 不同干燥方法下芡实中各类有效成分与抗氧化活性的相关性分析
前期研究结果显示,芡实水提液的抗氧化活性不及醇提液[4,22],故选择使用醇提液的总酚、总黄酮、不同构型VE含量为指标,比较不同干燥方法下各类活性成分与其抗氧化活性的相关性研究。由表6可知,6 种不同干燥方法下芡实醇提物中总酚与总黄酮含量呈现出极显著相关,相关系数可达0.961。芡实提取物清除DPPH自由基IC50值与δ-生育酚含量呈现极显著负相关,相关系数可达-0.933;芡实提取物清除ABTS+·的IC50值与α-生育酚、β+γ-生育酚、δ-生育酚和总VE含量均呈现极显著负相关,相关系数依次分别为-0.930、-0.982、-0.922、-0.955。由此可见,不同干燥方法下芡实提取物的抗氧化能力与VE含量的高低呈正相关。
表6 不同干燥方法下芡实中总酚、总黄酮、VE及抗氧化活性的相关性分析
TTaabbllee 66 CCoorrrreellaattiion analysis between the contents of total phenols, ttoottaall ffllavonoids and vitamin E and antioxidant activity of Euryale Seemmeenn with different drying methods
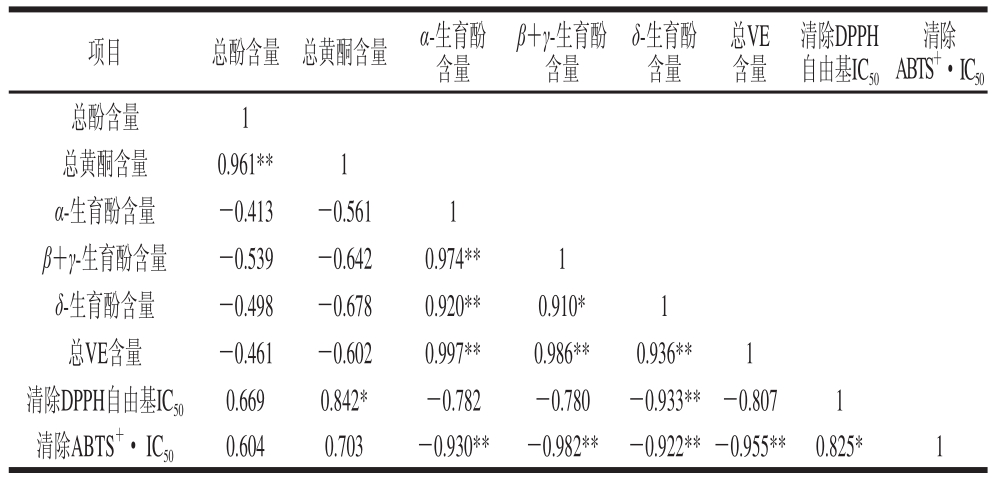
注:*. 显著相关(P<0.05);**. 极显著相关(P<0.01)。
干燥作为保证中草药品质的重要措施,是中草药加工中一个必不可少的工艺过程。传统的干燥方法积累了很多的宝贵经验,设备简单、操作简便、费用低,但干燥周期长,干燥不均匀,热效率低,缺乏系统的、科学的干燥理论和严格的生产控制。现代干燥技术具有很多优点,如红外干燥波长短;微波干燥穿透性较强,干燥产品质量好,速度快,且可以消除皱皮萎缩现象还能有效杀菌;真空冷冻干燥能避免物料的氧化变性,有效成分损失少[23-26]。
本研究表明,芡实中总多糖、总酚及总黄酮含量在70 ℃微波干燥过程中的含量累积最大,分别为1.60、3.11、1.69 mg/g,可能是由于芡实中分解多糖、多酚、黄酮的各类氧化酶[27-28](过氧化氢酶、过氧化物酶、多酚氧化酶)在高温条件下活性受到不可逆的抑制,甚至失活,从而使芡实中总多糖、总酚及总黄酮类物质氧化减少,含量得到积累。而在真空冷冻干燥过程中,虽然酶的活性受到一定程度的抑制,但在冻干结束后解析回温的过程中酶的活性得以增强,从而造成了芡实中总多糖、总酚和总黄酮类物质的在一定程度上的损失,含量分别下降为1.43、2.29、1.23 mg/g。此外,干燥时间[20]亦会对其产生直接影响,相较于现代干燥技术,传统的干燥技术如阴干、晒干、烘干所需的干燥时间较长,促使了芡实与氧气的充分接触,而各类氧化酶对各类成分的氧化也起到了催化作用,干燥时间越长,各类氧化酶作用时间也越长,芡实中的总多糖、总酚及总黄酮损失相对也就越多,综上所述,微波干燥和红外干燥可以很好地避免芡实中各类氧化酶的氧化作用,并且缩短了芡实与氧气的充分接触的时间,故使芡实中总多糖、总酚、总黄酮类物质得到最大的积累。
芡实醇提物抗氧化活性、VE含量均表现为冷冻干燥20 h达到最佳状态,总VE含量可达2.88 mg/g。可能是由于随着温度的不断升高,VE类成分易受到红外线、电磁波的干扰,使得其含量在红外干燥和微波干燥条件下损失较多,分别只有1.52、1.38 mg/g。而真空冷冻干燥则能够以最佳状态维持芡实中VE各类构型成分的稳定。芡实醇提物的抗氧化活性主要取决于其中的总酚、总黄酮及VE类成分,因在真空冷冻干燥条件下不利于芡实中总酚及总黄酮类物质的积累,而相反地促进了芡实中VE各类构型成分的积累,故使得芡实醇提物的抗氧化活性与芡实中VE含量表现出较高的相关性。
综合以上因素,由于冷冻干燥的芡实在最大程度积累VE各类构型成分的基础上,表现出最佳的抗氧化活性,且在一定程度上尽可能地减少了芡实总多糖、总酚及总黄酮类成分的损失。因此,真空冷冻干燥对芡实品质的综合影响相较于其他干燥方法小,可作为芡实产地加工的适宜干燥方法。但在实际生产过程中,干燥时间的长短与能源损耗的多少同样作为经济节约型、环境友好型的和谐社会构建及节约成本的重要因素加以考虑,红外干燥与微波干燥所需的时间短,工作效率高,但同样面临能源的损耗问题,而传统的干燥技术(阴干、晒干、烘干)恰得其反,虽然能够减少能源的损耗,但所需的干燥时间相对较长,故在实际生产中,应结合产品品质、工作效率、能源损耗等多重因素综合选择适宜不同需求的芡实干燥方式。
参考文献:
[1]宋晶, 吴启南. 芡实的本草考证[J]. 现代中药研究与实践, 2010, 24(2): 22-24.
[2]关克俭. 中国植物志[M]. 北京: 科学出版社, 1979: 6-9.
[3]沈蓓, 吴启南, 陈蓉, 等. 芡实提取物对D-半乳糖衰老小鼠学习记忆障碍的改善作用[J]. 中国老年学杂志, 2012, 32(20): 4429-4431.
[4]沈蓓, 袁冬平, 伍城颖, 等. 芡实提取物对SH-SY5Y神经细胞损伤的保护作用及体外抗氧化活性研究[J]. 南京中医药大学学报, 2013, 29(1): 39-43.
[5]段金廒, 宿树兰, 吕洁丽, 等. 药材产地加工传统经验与现代科学认识[J]. 中国中药杂志, 2009, 34(24): 3151-3157.
[6]杜远, 刘文杰, 孙志蓉, 等. 金钗石斛药材初加工方法的比较研究[J].中药材, 2013, 36(3): 374-376.
[7]董宽虎, 王常慧, 牧原. 干燥方法对苜蓿草粉营养价值的影响[J]. 草地学报, 2003, 11(4): 334-338.
[8]晏星, 袁小红, 刘卓, 等. 不同干燥方法对附子提取物中双酯型生物碱的影响[J]. 中药材, 2012, 35(2): 204-205.
[9]郭盛, 段金廒, 吴达维. 干燥方法对何首乌块根中多元功效物质转化的影响[J]. 中草药, 2014, 45(4): 498-504.
[10]管汉亮, 钱大玮, 段金廒, 等. 银杏叶干燥方法的优化及其机制探讨[J].中国中药杂志, 2013, 38(13): 2140-2146.
[11]刘宗华. 芡实产地采制工艺的探讨[J]. 中医药导报, 2006, 12(11): 66-67.
[12]张汆, 薛连海, 孙艳辉, 等. 带壳芡实常压和减压干燥过程的研究[J].食品工业科技, 2011, 32(5): 275-278.
[13]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国中医药科技出版社, 2010: 151.
[14]谢燕娟, 陈晓丹, 王晓波. 超声波辅助提取芡实多糖条件优化[J]. 食品研究与开发, 2010, 31(8): 15-18.
[15]吕爽, 田呈瑞, 石慧. 不同干燥方法对薄荷多酚、总黄酮及抗氧化性的影响[J]. 食品与发酵工业, 2012, 38(5): 112-116.
[16]侯五爱, 岳志劲. 苯酚-硫酸法测定北芪菇多糖的含量[J]. 光谱实验室, 2013, 30(5): 2475-2477.
[17]严小捷, 谷陟欣, 卢凤来, 等. Folin-酚比色法测定裸花紫珠中总酚含量[J]. 中国实验方剂学杂志, 2013, 19(18): 74-78.
[18]刘杰超, 张春岭, 吕 真真, 等. 桃花中总酚和总黄酮的提取及抗氧化活性研究[J]. 食品安全质量检测学报, 2013, 4(6): 1750-1755.
[19]FAN L iuping, LI Jinwei, DENG Kequan, et al. Effects of drying methods on the antioxidant activities of polysaccharides extracted from Ganoderma lucidum[J]. Carbohydrate Polymers, 2012, 87(2): 1849-1854.
[20]SOGI D S, SIDDIQ M, GREIBY I, et al. Total phenolics, antioxidant activity, and functional properties of ‘Tommy Atk ins’ mango peel and kernel as affected by drying methods[J]. Food Chemistry, 2013, 141(3): 2649-2655.
[21]中国预防医学科学院营养与食品卫生研究所. GB/T 12388—1990食品中维生素A和维生素E的测定方法[S]. 北京: 中国标准出版社, 1990.
[22]赵翾, 李红良, 叶倩雯. 芡实多糖的粗提取及其对羟自由基的清除效果[J]. 食品与发酵工业, 2010, 36(11): 177-182.
[23]桑迎迎, 周国燕, 王爱民, 等. 中药材干燥技术研究进展[J]. 中成药, 2010, 32(12): 2140-2144.
[24]张增帅, 张宝善, 罗喻红, 等. 食品微波真空干燥研究进展[J]. 食品工业科技, 2012, 33(23): 393-397.
[25]韩娜. 真空冷冻干燥技术研究进展[J]. 食品工程, 2007(3): 28-29.
[26]高扬, 解铁民, 李哲滨, 等. 红外加热技术在食品加工中的应用及研究进展[J]. 食品与机械, 2013, 29(2): 218-222.
[27]刘静, 钱建亚, 李成良, 等. 芡实多酚氧化酶的酶学性质[J]. 食品科学, 2012, 33(7): 176-181.
[28]郭泽美, 任章成, 陈腾, 等. 干燥方式对葡萄 皮多酚及其抗氧化活性的影响[J]. 食品科学, 2013, 34(11): 117-121. doi: 10.7506/spkx1002-6630-201311026.
WANG Hong1, WU Qinan1,2,*, JIANG Zheng1, FAN Xiuhe1, GU Wei1, YUE Wei1
(1. College of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China; 2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing 210023, China)
Abstract: Objective: The contents of total polysaccharides, total phenols, total flavonoids and different configurations of vitamin E and antioxidant activity were considered as indicators to select a suitable drying method for Euryale Semen. Methods: Ultraviolet (UV) spectroscopy was applied to determine antioxidant activity and the contents of total polysaccharides, total phenols and total flavonoids and different configuration of vitamin E were quantified by high performance liquid chromatography (HPLC). The effects of six different drying methods including shade drying, sun drying, cabinet drying, vacuum-freeze drying, infrared drying and microwave drying on the quality of Euryale Semen were evaluated. Results: Microwave drying could largely retain total polysaccharides, total phenols and total flavonoids in samples. But the highest contents of different configuration of vitamin E were accumulated and the ability to scavenge DPPH free radicals and ABTS+· was the strongest in vacuum freeze-dried samples. Meanwhile, a significant correlation existed between vitamin E and antioxidant activity. Conclusion: Vacuum freeze drying can be regarded as a suitable method for processing Euryale Semen because it not only can largely accumulate the content of vitamin E to result in the best antioxidant activity, but also can reduce the loss of total polysaccharides, total phenols and total flavonoids to the largest extent.
Key words: drying method; Euryale Semen; functional component; antioxidant activity
doi:10.7506/spkx1002-6630-201507004
中图分类号:TS207.7
文献标志码:A
文章编号:1002-6630(2015)07-0019-07
*通信作者:吴启南(1963—),男,教授,博士,研究方向为中药资源生产与品质评价。E-mail:qnwyjs@163.com
作者简介:王红(1989—),女,硕士研究生,研究方向为中药品质评价。E-mail:wanghong198942@126.com
基金项目:“十二五”国家科技支撑计划项目(2011BA04B06);江苏省高校优秀科技创新团队——中药资源化学研究项目(2011);江苏高校优势学科建设工程资助项目
收稿日期:2014-06-08