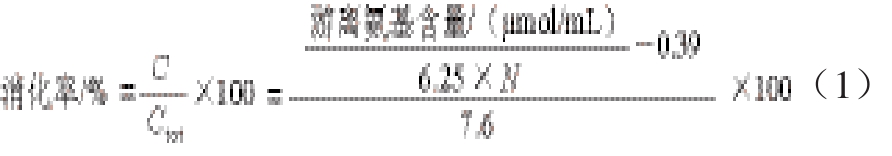
涂宗财1,2,李瑞平1,王 辉1,黄小琴2,常海霞1,包中宇1,傅志丰1
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西 师范大学生命科学学院,江 西 南昌 330022)
摘 要:草鱼鱼肉蛋白经微波处理后,采用胃蛋白酶-胰蛋白酶两步酶解法模拟其在人体胃、肠道的消化过程,以消化率、氨基酸组成、分子质量分布及抗氧化活性为指标,研究微波对鱼肉蛋白的影响。结果表明:功率800 W时,随着微波时间的延长,鱼肉蛋白消化率逐渐降低,消化产物的疏水性氨基酸及低分子质量(≤500 D)组分含量升高;同时,消化产物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率提高了2.35 倍、2,2-联苯-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS+·)清除率降低了44.77%、还原力提高了6.23 倍。高功率的微波处理会降低鱼肉蛋白质的可消化性,并影响其消化产物的抗氧化活性。
关键词:草鱼鱼肉蛋白;微波;消化产物;抗氧化活性
草鱼(Ctenopharyngodon idellus),俗名鲩鱼,蛋白质含量丰富,肉质细嫩,营养丰富,是我国第一大淡水鱼。但因鱼体内组织酶活跃、易腐败而在加工应用中受到限制。目前国外对于草鱼开发利用的研究报道较少[1],而国内主要侧重于草鱼酶解工艺、胶原蛋白提取工艺等的研究;许多蛋白消化酶解产物及其分离出的多肽表现出很好的体外抗氧化活性,如黄色条纹鲹蛋白肽[2]、泥鳅蛋白肽[3]等。未见对草鱼鱼肉蛋白模拟体外消化及其产物抗氧化活性进行系统研究的报道。因此开展草鱼蛋白消化酶解产物抗氧化活性的研究对其在食品中的应用具有重要意义。
微波作为一种新型的加热技术,因其加热时间短、速度快;能保持食品的营养成分和风味;热效率高、节约能源等特点,被广泛应用于食品的各领域,如加热食品、微波辅助水解[4]、微波萃取[5]、微波改性[6]等。研究表明,红薯和芋头制品在微波能的作用下温度迅速升高,导致蛋白酶受热变性凝固而丧失活性,影响制品的品质[7];微波烹调鱼肉过程中,可溶性蛋白通过二硫键构成二聚体或多聚体,出现了两种高分子质量的可溶性蛋白[8],而微波加热后鱼肉蛋白质的消化性及其消化产物的抗氧化活性还不清楚。
本实验通过微波预处理草鱼鱼肉蛋白,采用胃蛋白酶-胰蛋白酶两步酶解法模拟其在人体胃、肠道的消化过程,研究其消化率、氨基酸组成、分子质量分布,并以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、2,2’-联苯-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS+·)清除率、还原力为指标考察其抗氧化活性,旨在为草鱼和微波在鱼制品加工中的应用提供理论基础。
1.1 材料与试剂
草鱼,购于当地超市。
胃蛋白酶(pepsin,≥400 U/mg,EC 3.4.23.1)、胰蛋白酶(pancreatin,P1750-25G,EC 3.4.21.4)、杆菌肽(bacitracin,MW1 422.17 D)、L-氧化型谷胱甘肽(L-glutathione oxidized,MW612.63 D)、L-还原型谷胱甘肽(L-glutathione reduced,MW307.32 D)、马尿酸(hippuric acid,MW179.17 D)、DPPH 美国Sigma公司;ABTS 美国Sigma-Aldrich公司;邻苯二甲醛(1,2-phthalic dicarboxaldehyde,OPA)、二硫苏糖醇(dithiothreitol,DTT)、十水合四硼酸钠、酒石酸钾钠、三氯乙酸、三氯化铁、铁氰化钾等均为分析纯。
1.2 仪器与设备
格兰仕G80F20CN2L-B8(RO)型微波炉 广东格兰仕微波炉电器制造有限公司;Hitachi L-8900氨基酸分析仪、Hitachi D-2000高效液相色谱仪 日本日立公司;UV-3200型紫外-可见分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 草鱼鱼肉基本组成成分的测定
蛋白质含量的测定采用GB/T 5009.5—2010《食品中蛋白质的测定》;水分含量的测定采用GB/T 5009.3—2010《食品中水分的测定》;灰分含量的测定采用GB/T 5009.4—2010《食品中灰分的测定》;脂肪含量的测定采用GB/T 5009.6—2003《食品中脂肪的测定》。
1.3.2 鱼肉的处理
新鲜草鱼宰杀后去皮、去骨,取其背部肌肉,去除红肉,粉碎制成肉泥;置于微波炉中,选取高功率800 W和低功率320 W进行加热,时间分别为2、4、6、 8、10 min,微波前后样品冻干、研磨过80目筛,4 ℃保存待用。
1.3.3 消化产物的制备
体外消化采用胃蛋白酶-胰蛋白酶两步消化法[3],将微波处理的鱼肉蛋白配制成40 mg/mL的溶液,用1 mol/L HCl调pH值至2.0,按酶与底物质量比1∶25加入胃蛋白酶,混匀,于37 ℃摇床中消化1 h。胃蛋白酶消化后,先用0.9 mol/L NaHCO3调pH值至5.3,再用1 mol/L NaOH 调pH值至7.5,按酶与底物质量比1∶25加入胰蛋白酶,于37 ℃摇床中消化2 h。消化完后,沸水浴10 min灭酶,冰浴冷却至室温,5 000×g离心10 min,取上清液冻干,4 ℃保存备用。
1.3.4 消化率的测定
参照Adler-Nissen等[9]的方法,利用消化产物中游离氨基的含量来计算消化率[10]。计算公式如下:
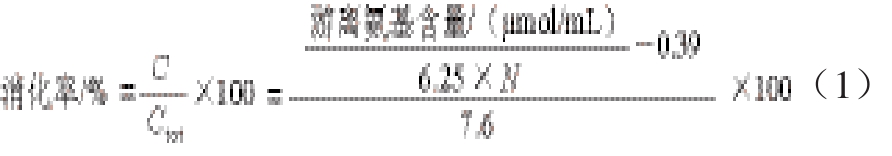
式中:C为水解后每1 g蛋白被裂解的肽键毫摩尔数/(mmol/g);Ctot为每1 g原料蛋白质的肽键毫摩尔数/(mmol/g);N为氮含量/(mg/mL);6.25为蛋白质系数;0.39为鱼肉蛋白中初始—NH2的含量/(mmol/g);7.6为肉类蛋白质的Ctot值/(mmol/g)。
1.3.5 分子质量分布的测定[3]
标准曲线的制作:将标准品杆菌肽(1 422.71 D)、L-氧化型谷胱甘肽(612.63 D)、L-还原型谷胱甘肽(307.32 D)、马尿酸(179.17 D)溶解于流动相中配制成质量浓度为1 mg/mL的溶液,过0.45 µm滤膜。Hitachi D-2000高效液相色谱仪检测标准品保留时间,参数设定:流动相:超纯水;流动相流速:0.6 mL/min;检测波长:200 nm,0~25 min;进样量:10.0 µL;柱温:35 ℃。以不同分子质量标准品的分离保留时间(retention time,RT)与相应的分子质量对数值lnMW绘制标准曲线。
用流动相配制1 mg/mL样品溶液,5 000×g离心10 min,过0.45 µm的滤膜备用;测定方法同标准品,由标准曲线方程可得样品分子质量分布,再将其分为几个组段,并求出该分子质量组段的相对含量。
1.3.6 氨基酸组成的测定[11]
准确称取0.1 g样品于安瓿管中,加入8 mL 6 mol/L HCl溶液,抽真空,维持10 min后,用酒精喷灯封口。110 ℃条件下水解24 h,冷却后双层滤纸过滤浓缩,定容至5 mL,过0.45 µm滤膜后4 ℃保存备用。
用Hitachi L-8900氨基酸分析仪测定氨基酸组成及各氨基酸含量。
1.3.7 抗氧化活性的测定
1.3.7.1 DPPH自由基清除率的测定[12]
DPPH溶液的配制:用无水乙醇溶解配制0.2 mmol/L DPPH溶液。配制10 mg/mL样品溶液,取1.0 mL样品溶液和3.0 mL DPPH溶液,混合均匀后室温下暗处反应30 min,于517 nm波长处测定吸光度。按下式计算DPPH自由基清除率。
式中:Ao为DPPH溶液加样品溶剂的吸光度;Ai为DPPH溶液加样品溶液反应后的吸光度;Aj为样品溶液加DPPH溶液的溶剂的吸光度。
1.3.7.2 ABTS+·清除率的测定[13]
ABTS溶液的配制:7 mmol/L ABTS和2.45 mmol/L过硫酸钾溶于水中,混匀后避光放置12~16 h,用0.2 mol/L pH 7.4的磷酸盐缓冲液将ABTS溶液稀释至734 nm波长处吸光度为0.70±0.02。配制10 mg/mL样品溶液,取20 µL样品溶液和20 µL蒸馏水与4 mL ABTS溶液混匀,暗处反应10 min后,于734 nm波长处测其吸光度。按下式计算ABTS+·清除率。
式中:Ao为ABTS溶液加样品溶剂的吸光度;Ai为ABTS溶液加样品溶液反应后的吸光度;Aj为样品溶液加ABTS溶液的溶剂的吸光度。
1.3.7.3 还原力的测定[14]
配制10 mg/mL样品溶液,将0.5 mL样品溶液、1.5 mL蒸馏水、2.0 mL磷酸盐缓冲溶液(0.2 mol/L, pH 6.6)和2.0 mL 1%的铁氰化钾溶液先后加入10 mL离心管中混合均匀,50 ℃水浴20 min后加入2.0 mL 10%的三氯乙酸溶液,5 000×g离心5 min;取上清液2.0 mL, 加入2.0 mL蒸馏水和0.4 mL 0.1%的三氯化铁溶液,混合均匀,50 ℃水浴10 min,于700 nm波长处测定吸光度。吸光度越高表示样品还原力越强。
1.4 数据处理与统计学分析
每组实验重复3 次,结果表示为![]()
。采用Origin7.5软件作图,SSPS12.0进行数据统计学分析。
2.1 草鱼鱼肉基本组成成分
表1 草鱼鱼肉基本组成成分的含量
Table 1 Basic composition of grass carp meat
鱼的种类和生长时间不同,鱼肉的基本成分含量也会不同;本实验选用体质量1~1.5 kg的本地草鱼作为原料。由表1可知,鱼肉水分含量所占比例最大,为82.36%;蛋白质含量为13.18%,脂肪含量为3.41%,灰分含量为1.01%。
2.2 样品消化率分析
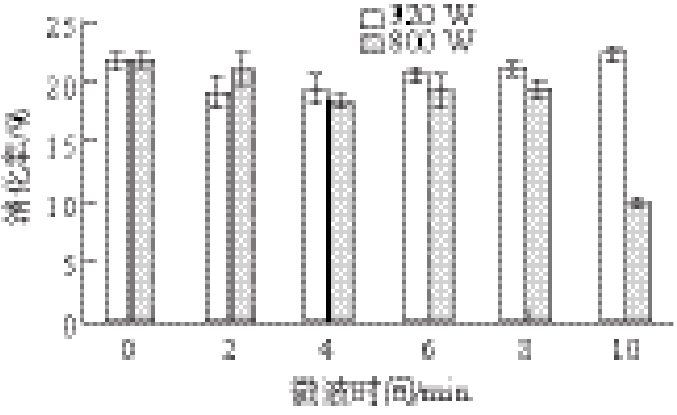
图1 微波处理对鱼肉蛋白消化率的影响
Fig.1 Effect of microwave pretreatment on the digestibility of fish proteins
蛋白质在消化过程中,每有一个肽键断裂,就有一个新的-COOH和-NH2形成,因此,可以通过测定消化产物中游离氨基的含量来推算其消化率。由图1可知,低功率320 W处理鱼肉蛋白,其消化率随处理时间变化不显著;而高功率800 W处理10 min,其消化率从原样的(21.77±0.60)%降低到(9.89±0.08)%,降低了54.57%(P<0.01),说明高功率微波处理的蛋白质其消化性显著降低。这可能是因为微波功率大、时间长使得蛋白质聚集变性,胃蛋白酶及胰蛋白酶中蛋白酶的酶解位点被隐藏[15],使其与蛋白酶的结合变得困难而不容易被消化水解导致游离氨基含量减少,因而消化率降低。窦屾等[16]的研究也表明,高功率长时间微波处理的蛋白质其水解度降低。但是并未找到一定微波功率和时间预处理导致鱼肉蛋白消化率下降的“拐点”。
2.3 消化产物分子质量分析
表2 微波处理对鱼肉蛋白消化产物分子质量分布的影响
Table 2 Effect of microwave pretreatment on the molecular weight distribution of digested products from fish proteins
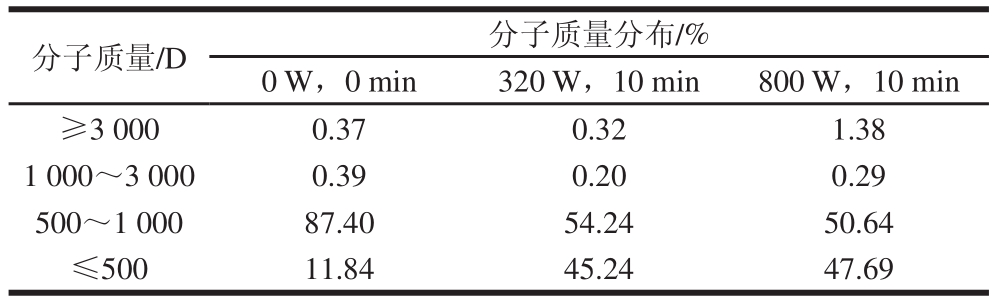
由图2可知,原样消化产物(0 W,0 min)的分子质量主要集中分布在500~1 000 D(87.4%);微波处理后,鱼肉蛋白消化产物分子质量 500~1 000 D组分的相对含量逐渐降低,而低分子质量组分(≤500 D)部分显著增加。微波320 W和800 W处理10 min后,鱼肉蛋白消化产物低分子质量组分的相对含量由11.84%分别增加到45.24%、47.69%,分别增加了2.82、3.03 倍(P<0 . 0 1)。这可能是因为蛋白质固有频率(5×1010Hz)恰好处于微波频率(3×108~3×1011Hz)范围内,蛋白质分子在交变电磁场中振动,每个分子的正负电荷都受到交变电场力的作用,造成蛋白质空间结构改变;同时当酶用量一定时,微波处理后鱼肉蛋白变性,可消化部分减少,酶催化位点与蛋白分子中未变性隐藏的相应位点接触量增多,从而在一定程度上促进酶作用的酶解效率,使消化产物低分子质量组分含量升高[17]。这与王洁昀等[17]研究微波处理后骨胶原蛋白酶解产物小于500 D的分子质量组分增加结果一致。此外,Rufián-Henares[18]和Je[19]等的研究表明消化产物中的低分子质量(≤500 D)组分具有很好的抗氧化活性。
2.4 消化产物氨基酸组成的分析
表3 微波处理后鱼肉蛋白消化产物氨基酸组成的分析
Table 3 Amino acid composition of digested products from fish proteins subjected to microwave pretreatment
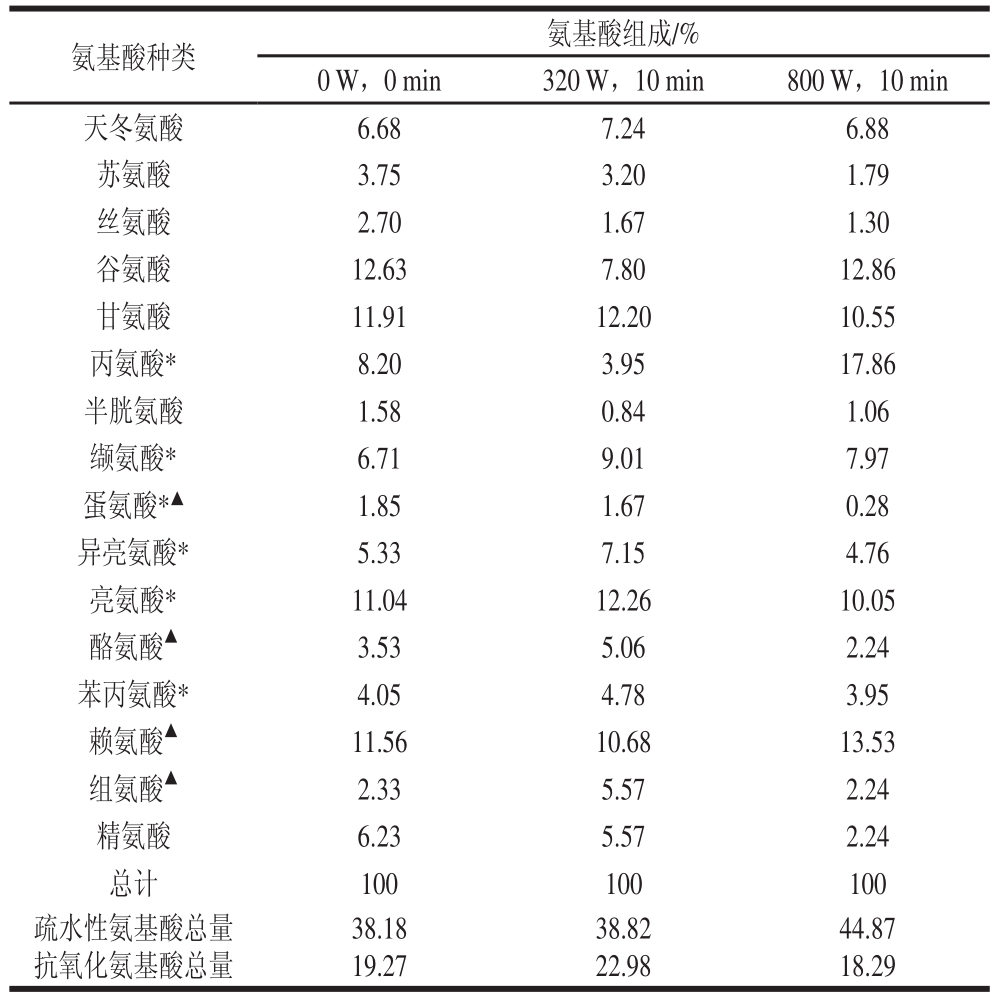
注:*. 疏水性氨基酸;▲. 具有抗氧化活性的氨基酸。
氨基酸的组成对消化产物抗氧化活性具有重要作用[20],酪氨酸、蛋氨酸、组氨酸、赖氨酸等氨基酸具有抗氧化活性[21]。由表3可知,与原样(0 W,0 min)相比,微波处理后鱼肉蛋白消化产物各氨基酸含量百分比有了明显变化,其中具有抗氧化活性氨基酸的含量分别为19.27%(未处理组)、22.98%(320 W)、18.29%(800 W);疏水性氨基酸含量分别为38.18%(未处理组)、38.82% (320 W)、44.87%(800 W),呈现逐渐升高趋势(P<0.05)。这说明微波处理能增加疏水性氨基酸含量,可能是因为微波处理使蛋白变性的同时导致更多的疏水性氨基酸残基暴露[22],消化酶更易与其接触,因而消化产物中疏水性氨基酸含量增加。
2.5 消化产物的抗氧化活性
2.5.1 消化产物的DPPH自由基清除率
DPPH自由基在有机溶剂中是一种比较稳定的自由基,其在517 nm波长处有最大吸收。目前将DPPH自由基清除率作为考察抗氧化活性的重要指标之一,清除率越大,抗氧化活性越强。
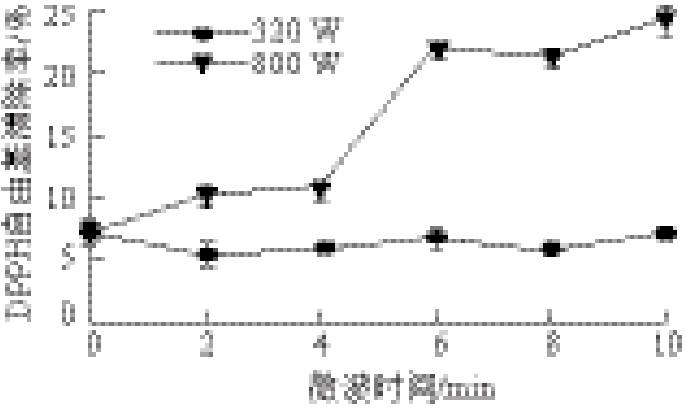
图2 微波处理对鱼肉蛋白消化产物DPPH自由基清除率的影响
Fig.2 Effect of microwave pretreatment on the DPPH radical scavenging activity of digested products from fish proteins
由图2可知,低功率320 W处理不同时间鱼肉蛋白消化产物DPPH自由基清除率变化不大。高功率800 W随着处理时间的延长,鱼肉蛋白消化产物DPPH自由基清除率逐渐提高,从(7.38±0.44)%提高到(24.7±0.53)%,提高了2.35 倍(P<0.01)。说明高功率微波处理可以提高样品消化产物的DPPH自由基清除率。这可能是因为随着微波时间的延长,样品中更多的疏水性基团暴露[23],消化液疏水性增强,使其更易与脂溶性的DPPH自由基反应,从而使DPPH自由基清除率得以提高。
2.5.2 消化产物的ABTS+·清除率
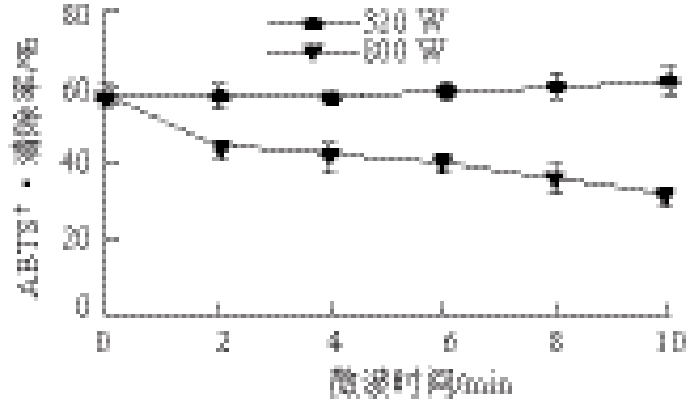
图3 微波处理对鱼肉蛋白消化产物ABTS+·清除率的影响
Fig.3 Effect of microwave pretreatment on the ABTS+· scavenging activity of digested products from fish proteins
ABTS易被过硫酸钾氧化成ABTS+·,ABTS+·是一种稳定的自由基,当加入抗氧化试剂后,ABTS+·被还原成ABTS,从而在最大吸收峰处的吸光度会产生相应的变化。由图3可知,低功率320 W处理不同时间鱼肉蛋白消化产物ABTS+·清除率变化不明显;高功率800 W随着处理时间的延长,鱼肉蛋白消化产物ABTS+·清除率逐渐降低,从(57.05±1.89)%降低到(31.51±1.15)%,降低了44.77%(P<0.01)。ABTS+·清除率的变化趋势与DPPH自由基清除率相比有所不同,这可能是因为ABTS+·为水溶性,高功率800 W微波鱼肉蛋白随着加热时间延长,蛋白质迅速变性,消化率降低,导致消化水解生成的水溶性物质减少所致。由数据可知,尽管微波800 W 10 min处理鱼肉蛋白其消化产物的ABTS+·清除率有所降低,但是仍然比DPPH自由基清除率最高时的(24.7±0.53)%要高。这可能是因为经过胃蛋白酶-胰蛋白酶消化后,其消化产物中积累了大量的小分子肽[23],亲水性增强的缘故。
2.5.3 消化产物的还原力
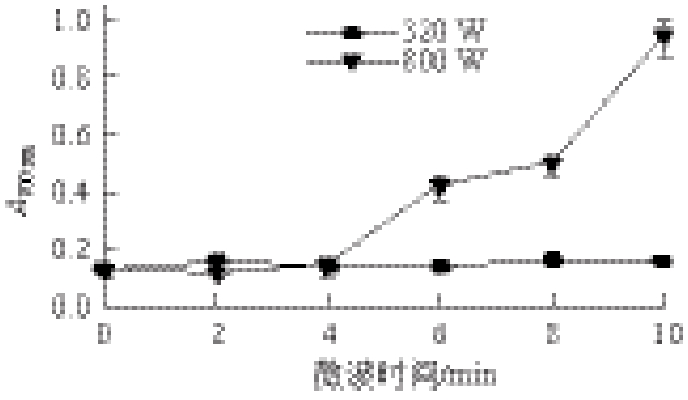
图4 微波处理对鱼肉蛋白消化产物还原力的影响
Fig.4 Effect of microwave pretreatment on the reducing power of digested products from fish proteins
还原力与抗氧化活性在一定程度上存在紧密联系,还原力越强,表明抗氧化活性越好[24]。由图4可知,低功率320 W处理不同时间鱼肉蛋白消化产物的还原力呈现先降低后升高的趋势,但总体上变化不大。高功率800 W随着处理时间的延长,鱼肉蛋白消化产物的还原力逐渐升高,从(0.13±0.01)升高到(0.94±0.04),提高了6.23 倍(P<0.01)。这可能是因为消化产物中的低分子质量多肽组分是很好的氢或电子供应体[23],所以还原力是逐渐增强的。
高功率长时间的微波处理会使草鱼鱼肉蛋白的可消化性降低,消化产物中低分子质量(≤500 D)组分和疏水性氨基酸含量升高。微波处理对鱼肉蛋白消化产物的抗氧化活性产生影响,其中800 W微波处理使DPPH自由基清除能力升高、ABTS+·清除能力降低、还原力增强。因此,研究微波鱼肉蛋白的可消化性及其消化产物的相关性质可以为草鱼和微波在鱼制品加工中的应用提供一定的理论基础。
参考文献:
[1]WASSWA J, TANG Jian, GU Xiaohong, et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp (Ctenopharyngodon idella) skin[J]. Food Chemistry, 2007, 104(4): 1698-1704.
[2]KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1327.
[3]YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al. Changes in the antioxidant activity of loach (Misgurnus anguillicaudatus) protein hydrolysates during a simulated gastrointestinal digestion[J]. Food Chemistry, 2010, 120(3): 810-816.
[4]MESSIA M C, DI FALCO T, PANFILI G, et al. Rapid determination of collagen in meat-based foods by microwave hydrolysis of proteins and HPAEC-PAD analysis of 4-hydroxyproline[J]. Meat Science, 2008, 80(2): 401-409.
[5]CHOI I, CHOI S J, CHUN J K, et al. Extraction yield of soluble protein and microstructure of soybean affected by microwave heating[J]. Journal of Food Processing and Preservation, 2006, 30(4): 407-419.
[6]RIVERO I E, BALSAMO V, MÜLLER A J. Microwave-assisted modification of starch for compati bilizing LLDPE/starch blends[J]. Carbohydrate Polymers, 2009, 75(2): 343-350.
[7]REKHA M R, PADMAJA G. Alpha-amylase inhibitor changes during processing of sweet potato and taro tubers[J]. Plant Foods for Human Nutrition, 2002, 57(3/4): 285-294.
[8]杨文慧, 高昂, 巩江, 等. 微波加工对食品营养成分影响的研究进展[J].宁夏农林科技, 2011, 52(3): 61-62.
[9]ADLER-NISSEN J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J]. Journal of Agricultural and Food Chemistry, 1979, 27(6): 1256- 1262.
[10]NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science, 2001, 66(5): 642-646.
[11]LI Juyi, JU Yan, WANG Xiufang, et al. Analysis of the chemical co mponents of hydatid fluid from Echinococcus granulosus[J]. Revista da Sociedade Brasileira de Medicina Tropical, 2013, 46(5): 605-610.
[12]WU Huichun, CHEN Huaming, SHIAU C Y. Free amino acids and peptides as related t o antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food Research International, 2003, 36(9): 949-957.
[13]SAMANIEGO-SÁNCHEZ C, INURRETA-SALINAS Y, QUESADAGRANADOS J J, et al. The influence of domestic culinary processes on the trolox equivalent antioxidant capacity of green tea infusions[J]. Journal of Food Composition and Analysis, 2011, 24(1): 79-86.
[14]BURSAL E, KÖKSAL E. Evaluation of reducing power and radical scavenging activities of water and ethanol extracts from sumac (Rhus coriaria L.)[J]. Food Resea rch International, 2011, 44(7): 2217-2221.
[15]GUAN Junjun, ZHANG Tongbin, HUI Ming, et al. Mechanism of microwave-accelerated soy protein isolate-saccharide graft reactions[J]. Food Research International, 2011, 44(9): 2647-2654.
[16]窦屾, 廖永红, 杨春霞, 等. 微波预处理对脱脂豆粕蛋白水解度的影响[J]. 食品科学, 2012, 33(2): 119-1 23.
[17]王洁昀, 李亚欣, 乐国伟, 等. 微波酸处理对骨胶原蛋白酶解效果的影响研究[J]. 食品工业科技, 2010, 31(2): 97-100.
[18]RUFIÁN-HENARES J A, MORALES F J. Effect of in vitro enzymatic digesti on on antioxidant activity of coffee melanoidins and fractions[J]. Journal of Agricultural and Food Chemistry, 2007, 55(24): 10016-10021.
[19]JE J Y, PARK P J, KIM S K. Antioxidant activity of a peptide i solated from Alaska pollack (Theragra chalcogramma) frame protein hydrolysate[J]. Food Research International, 2005, 38(1): 45-50.
[20]DONG Shiyuan, ZENG Mingyong, WANG Dongfeng, et al. Antioxidant and biochemical propertie s of protein hydrolysates prepared from Silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2008, 107(4): 1485-1493.
[21]CHEN Huaming, MURAMOTO K, YAMAUCHI F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide iso lated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2619-2623.
[22]CABRA V, VÁZQUEZ-CONTRERAS E, MORENO A, et al. The effect of sulfhydryl groups and disulph ide linkage in the thermal aggregation of Z19 α-zein[J]. Biochimica et Biophysica Acta, 2008, 1784(7/8): 1028-1036.
[23]ZHU Lijuan, CHEN Jie, TANG Xueyan, et al. Reducing, radical scavenging, and chelation properties of in vitro digests of alcalasetreated zein hydrolysate[J]. Journal of Agricultur al and Food Chemistry, 2008, 56(8): 2714-2721.
[24]KONČIĆ M Z, KREMER D, GRUZ J, et al. Antioxidant and antimicro bial properties of Moltkia petraea (Tratt.) Griseb. flower, leaf and stem infusions[J]. Food and Chemical Toxicology, 2010, 48(6): 1537-1542.
TU Zongcai1,2, LI Ruiping1, WANG Hui1, HUANG Xiaoqin2, CHANG Haixia1, BAO Zhongyu1, FU Zhifeng1
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. College of Life Science, Jiangxi Normal Univers ity, Nanchang 330022, China)
Abstract: Grass carp (Ctenopharyngodon idellus) proteins were hydrolyzed sequentially by pepsin and pancreatin in an in vitro digestion model system after microwave pretreatment. The degree of hydrolysis, amino acid composition, molecular weight distribution and antioxidant activity were studied. The results demonstrated that the degree of hydrolysis was significantly decreased at 800 W microwave power with an increase in microwave treatment time. Accordingly, we observed an increase in the contents of hydrophobic amino acids and short chain peptides with molecular weight lower than 500 D. Enzymatic breakdown in the simulated gastrointestinal environment caused a 3.35-fold increase in DPPH radical scavenging activity and a 7.23-fold increase in reducing power but a 44.77% reduction in 2,2’-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt (ABTS+·) scavenging activity compared to the blank samples. In conclusion, high microwave power can decrease the digestibility of the proteins and affectthe antioxidant activity of the digested products.
Key words: grass carp (Ctenopharyngodon idellus) protein; microwave; hydrolysate; antioxidant activity
doi:10.7506/spkx1002-6630-201507011
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2015)07-0056-05
作者简介:涂宗财(1965—),男,教授,博士,研究方向为食物资源开发与高效利用。E-mail:tuzc_mail@aliyun.com
基金项目:江西省重大科技 创新研究项目(20124ACB00600);江西省大宗淡水鱼产业技术体系项目(JXARS-02)
收稿日期:2014-06-30