周慧敏1,刘 琛1,郭宇星1,*,潘道东1,2,曾小群2,孙杨赢2
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.宁波大学海洋学院,浙江 宁波 315211)
摘 要:以乳清浓缩蛋白WPC-80为原料,研究固定化瑞士乳杆菌蛋白酶酶解WPC-80生产血管紧张素转化酶(angiotensinⅠ-converting enzyme,ACE)抑制肽的工艺条件。通过单因素试验和响应面方法研究了酶解温度、酶解pH值、底物与酶质量比([S]/[E])、酶解时间对固定化瑞士乳杆菌蛋白酶制备ACE抑制肽的影响,确定了酶解乳清蛋白制备ACE抑制肽的最佳工艺条件为:温度37 ℃、pH 7.5、[S]/[E]=15%、酶解时间8 h。在此条件下,酶解产物的水解度为(6.05±0.36)%,ACE抑制率为(59.54±0.61)%。
关键词:ACE抑制肽;固定化瑞士乳杆菌蛋白酶;乳清蛋白;响应面法
血管紧张素转化酶(angiotensinⅠ-converting nzyme,ACE)作为一种外肽酶,它可以使血管紧张素Ⅰ转变为有血管收缩调节活性的血管紧张素Ⅱ,并水解缓激肽(有血管舒张作用),使其失去活性,通过这两个作用,ACE可使得人体血压升高[1-3]。ACE抑制肽则可以抑制ACE的活性,达到抗血压升高的作用。ACE抑制肽的制备方法主要包括酶解法、化学合成法、自溶产物提取法及DNA重组法。据调查,目前大多数高血压患者使用合成ACE抑制剂如卡托普斯等药物来治疗高血压,但这类合成药物会引起咳嗽、丧失味觉及血管神经性水肿等副作用[4-6]。而酶解制备ACE抑制肽的方法专一性较强,反应条件温和,易于控制以及副产品少,不会产生毒性方面的问题。目前采用的酶包括胰蛋白酶、碱性蛋白酶、胃蛋白酶等[7-8]。据报道,瑞士乳杆菌(Lactobacillus helveticus)蛋白酶活性较强,能特异性水解乳蛋白产生ACE抑制肽[2]。但在研究中发现,瑞士乳杆菌蛋白酶获得较困难且不能重复利用,不易实现ACE抑制肽的规模化制备。因此,本实验用固定化瑞士乳杆菌蛋白酶水解乳蛋白制备ACE抑制肽,固定化酶可以在较长时间内反复使用,减少生产成本。
本研究通过单因素酶解条件的研究和响应面分析,优化固定化瑞士乳杆菌蛋白酶酶解乳清蛋白生产ACE抑制肽的工艺条件,旨在为ACE抑制肽的规模生产及制备提供参考。
1.1 材料与试剂
瑞士乳杆菌(Lactobacillus helveticus)JCM 1004南京师范大学国家农产品加工技术研发乳制品专业分析中心保存。
MRS液体培养基、考马斯亮蓝G-250 国药集团化学试剂有限公司;WPC-80乳清浓缩蛋白粉 北京润发商贸有限公司;海藻酸钠、氯化钙、戊二醇 南京金庆祥贸易有限公司;血管紧张素转化酶(angiotensinⅠ-converting enzyme,ACE)、Hippuryl-L-histidyl-L-leucine (HHL)、4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES) 美国Sigma公司。
1.2 仪器与设备
JY92-II超声波细胞破碎机 宁波新芝生物科技股份有限公司;LRH-250A生化培养箱 广东省医疗仪器厂;CJ-2S超净工作台 上海上净净化设备有限公司;PHS-3C精密pH计 上海雷磁仪器厂;754紫外-可见分光光度计 上海光谱仪器有限公司;CL-22M高速冷冻离心机 赛特湘仪离心机仪器有限公司;LDZX-30FBS立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.3 方法
1.3.1 瑞士乳杆菌蛋白酶的制备
瑞士乳杆菌活化[9]:取瑞士乳杆菌JCM 1004冻干粉接种于MRS液体培养基,连续活化3 代,制成种子液。按体积分数3%接种量,37 ℃扩大培养至生长对数期取出,收集菌体,用pH 7.1(50 mmol/L)的Tris-HCl缓冲液洗涤菌体后备用。洗涤后菌体在功率300 W,破碎时间为3 s,间隔时间为5 s的超声波破碎条件下破碎200 次提取瑞士乳杆菌蛋白酶[10-11]。
1.3.2 瑞士乳杆菌蛋白酶含量的测定
采用考马斯亮蓝法[12]测定。
1.3.3 海藻酸钠固定瑞士乳杆菌蛋白酶
参考文献按[13-15]方法进行。在30 mL瑞士乳杆菌蛋白酶液中加入0.6 g海藻酸钠,37 ℃水浴搅拌混匀。用10 mL注射器吸取混合液,以15 cm左右高度滴入0.1 mol/L的氯化钙溶液中,立即成球。4 ℃条件下静置4 h,用蒸馏水洗涤小球后加入0.4 g/100 mL的戊二醛溶液交联6 h,洗涤沥干,得到固定化蛋白酶。实验在无菌操作条件下进行。固定化瑞士乳杆菌蛋白酶通过蒸馏水洗涤沥干可以重复利用。 按[16]方法进行。称取固定化瑞士乳杆菌蛋白酶小球1 g,加入浓度为16.4 mmol/L MeOsuc-Arg-Pro-Tyr-pNA(MS-Arg)0.05 mL,Tris-HCl(pH 7.8)缓冲液2.95 mL。混合均匀后,在37 ℃恒温水浴锅反应2 h,以蒸馏水作为对照,取上清液在410 nm波长处测吸光度。固定化瑞士乳杆菌蛋白酶活力定义为37 ℃时,每小时吸光度上升0.01为一个酶活力单位(U)。
1.3.4 固定化酶活力的测定
1.3.5 乳清蛋白的酶解及水解度计算
乳清蛋白的酶解按参考文献[17]方法进行。WPC-80乳清浓缩蛋白粉用蒸馏水配制成6 g/100 mL质量浓度,65 ℃恒温预孵15 min,使其充分溶解,用NaOH和HCl溶液调至实验预设的pH值,降至实验预设的温度,然后加入固定化瑞士乳杆菌蛋白酶进行酶解。每隔一定时间加入NaOH(0.1 mol/L)用以维持酶解pH值,记录滴加的NaOH量,可计算水解度。酶解结束后进行灭酶(90 ℃,20 min),离心(4 500 r/min,20 min)取上清液测定多肽的ACE抑制活性。
乳清蛋白水解度的测定采用pH-Stat法[17]。
式中:V为消耗的NaOH体积/mL;c为NaOH的浓度/(mol/L);α为α-氨基的平均解离度,在pH值为7.0和50 ℃的实验条件下,对乳清浓缩蛋白而言,α为0.44;m为蛋白质的质量/g;htot为每克原料蛋白质中肽键的毫摩尔数,对于乳清浓缩蛋白而言,该值为8.8 mmol/g。
1.3.6 酶解产物ACE抑制活性测定
采用Cushman等[18]的方法适当修改。取200 μL的5 mmol/L HHL溶液(6.7 mmol/L HHL,50 mmol/L HEPES,300 mmol/L NaCl,定容至50 mL,调pH值至 8.3)和 100 μL待测样品,37 ℃条件下保温3 min,然后加入20 μL ACE 溶液(0.1 U/mL),混匀后37 ℃保温60 min,加入250 μL HCl(1.0 mol/L)终止反应,然后加入1.7 mL醋酸乙酯,15 s旋涡混匀,离心(4 000 r/min,15 min)后取1.0 mL的醋酸乙酯层,于烘箱中30 min蒸干,再将其溶于1 mL去离子水,用紫外分光光度计测定吸光度(A228 nm)。
式中:A为加待测样品,ACE和HHL反应的吸光度;A0为不加待测样品,ACE和HHL反应的吸光度。
1.3.7 试验设计及数据处理
单因素酶解条件选择酶解温度、酶解pH值、底物与酶质量比([S]/[E])、酶解时间4 个因素,在单因素试验基础上确定水平,按Box-Behnken原理进行响应面分析,采用Minitab16.0进行数据处理以评价模型的统计学意义。
2.1 固定化瑞士乳杆菌蛋白酶酶解乳清蛋白单因素条件研究
2.1.1 酶解温度的影响

图1 酶解温度对水解度和酶解产物ACE抑制活性的影响
Fig.1 Effect of temperature on the degree of hydrolysis and ACE inhibitory activity of hydrolysate
将酶解温度设置为25、31、37、43、49 ℃,其他酶解条件设置为pH 7.5,[S]/[E]=15%,底物质量浓度6 g/100 mL,酶解时间8 h,考察酶解温度对固定化瑞士乳杆菌蛋白酶酶解乳清蛋白水解度和酶解产物ACE抑制活性的影响,结果见图1。固定化瑞士乳杆菌蛋白酶在酶解温度为35~40℃时酶反应效果较好。在37 ℃时乳清蛋白水解度和酶解产物的ACE抑制率都最高,37 ℃为固定化瑞士乳杆菌蛋白酶最适反应温度;37 ℃之后,温度逐渐超过酶的最适反应温度,酶的活性开始减弱。在本实验中,固定的瑞士乳杆菌蛋白酶的酶活力为(3.80±0.16) U/mg,并且该固定化蛋白酶可以重复使用。由于海藻酸钠载体的保护,固定的酶不像游离酶那样骤然失活,而是缓慢减弱活性[19]。
2.1.2 酶解pH值的影响

图2 酶解pH值对水解度和ACE抑制活性的影响
Fig.2 Effect of pH on the degree of hydrolysis and ACE inhibitory activity
酶解pH值设定5 个条件,分别为pH 5.5、6.5、7.5、8.5和9.5,其他酶解条件设置为温度37 ℃、[S]/[E]=15%、底物质量浓度6 g/100 mL、酶解时间8 h,考察酶解pH值对固定化瑞士乳杆菌蛋白酶酶解乳清蛋白的水解度和酶解产物ACE抑制活性的影响,结果见图2。在pH值为7.5时,固定化瑞士乳杆菌蛋白酶酶解乳清蛋白的水解度和酶解产物的ACE抑制率最高,当pH值进一步升高,水解度和酶解产物的ACE抑制率明显下降。这说明固定化瑞士乳杆菌蛋白酶的最适酶解pH值为7.5。酶的最适酶解pH值会受各种因素的影响,pH值对酶活力产生的影响主要原因是pH值会影响酶分子和底物的带电状态,从而进一步影响了酶与底物的结合[20-21]。
2.1.3 [S]/[E]的影响

图 33 [[S]]//[[E]对水解度和ACE抑制活性的影响
Fig.3 Effect of [S]/[E]ratio on the degree of hydrolysis and ACE inhibitory activity
[S]/[E]设置为5%、10%、15%、20%、25% 5 个条件,其他条件设置为温度37 ℃、酶解pH 7.5、底物质量浓度6 g/100 mL,酶解时间8 h,考察[S]/[E]对固定化瑞士乳杆菌蛋白酶酶解乳清蛋白水解度和酶解产物ACE抑制活性的影响,结果见图3。[S]/[E]达到15%时,水解度最高,酶解产物ACE抑制率最大,随着[S]/[E]进一步增加,水解度和ACE抑制率都有不同程度的下降,这是因为当底物与酶质量比较高时,底物过剩使得酶与底物结合的机率降低,产物对ACE抑制率下降[22-23]。
2.1.4 酶解时间的影响
固定酶解温度37 ℃、酶解pH 7.5、[S]/[E]为15%,底物质量浓度为6 g/100 mL,观察酶解时间0~12 h的水解度和酶解产物ACE抑制活性,考察酶解时间对固定化瑞士乳杆菌蛋白酶酶解乳清蛋白水解度和酶解产物ACE抑制活性的影响,结果见图4。在前8 h内,随着酶解时间的延长,水解度和ACE抑制率都呈上升趋势,这是因为在酶解开始时,底物乳清蛋白较多,但随着酶解过程的进行,乳清蛋白越来越少,当8 h时乳清蛋白的酶解几乎完成,此后水解度增加趋势减缓,而ACE抑制率却有明显的下降,这一结果与Mullally等[1]报道的结果相类似,长时间的酶解会使ACE抑制肽酶解成氨基酸,由此减弱了产物的ACE抑制活性。因此综合考虑,8 h为合适的酶解时间。

图4 酶解时间对水解度和ACE抑制活性的影响
Fig.4 Effect of hydrolysis time on the degree of hydrolysis and ACE inhibitory activity
单因素酶解条件的研究发现,酶解温度、酶解pH值、[S]/[E]、酶解时间都影响固定化瑞士乳杆菌蛋白酶酶解乳清蛋白的酶解程度。其中,酶解时间对水解度和酶解产物的ACE抑制活性的产生很有规律,随着酶解的进行,水解度和酶解产物的ACE抑制活性逐渐升高而后维持在稳定状态。然而,酶解温度、酶解pH值、[S]/[E]对水解度和酶解产物的ACE抑制活性的影响有不确定性,因此在后续实验中选用酶解温度、酶解pH值、[S]/[E]3 个因素,进行响应面分析来优化酶解条件。
2.2 固定化瑞士瑞杆菌蛋白酶酶解乳清蛋白制备ACE抑制肽的响应面分析
以酶解温度(A)、酶解pH值(B)及[S]/[E](C)为变量,水解度和ACE抑制率为响应值。试验结果见表1、回归系数见表2、方差分析见表3。
采用Minitab 16.0对表1结果进行非线性回归的二次多项式拟合,得到响应变量乳清蛋白酶解产物ACE抑制率(Y)的编码二次多项式拟合方程的预测模型方程:
Y=59.430 0-0.893 7A-0.606 2B+0.365 0C-0.070 0AB-0.017 5AC+0.032 5BC-15.225 0A2-10.135 0B2-6.157 5C2 (3)
表1 响应面试验设计方案及结果
Table 1 experimental design and results of response surface methodology

表2 酶解产物ACE抑制活性结果的回归系数
Table 2 Estimated rregression coefficients for ACE inhibitory activity of whey protein hydrolysate

注:**. P<0.01,表示差异极显著;*. P<0.05,表示差异显著。下同。
表3 酶解产物ACE抑制活性结果的方差分析
TTaa bbllee 33 ANOVA for AACE inhibitory activity of whey protein hydrolysate
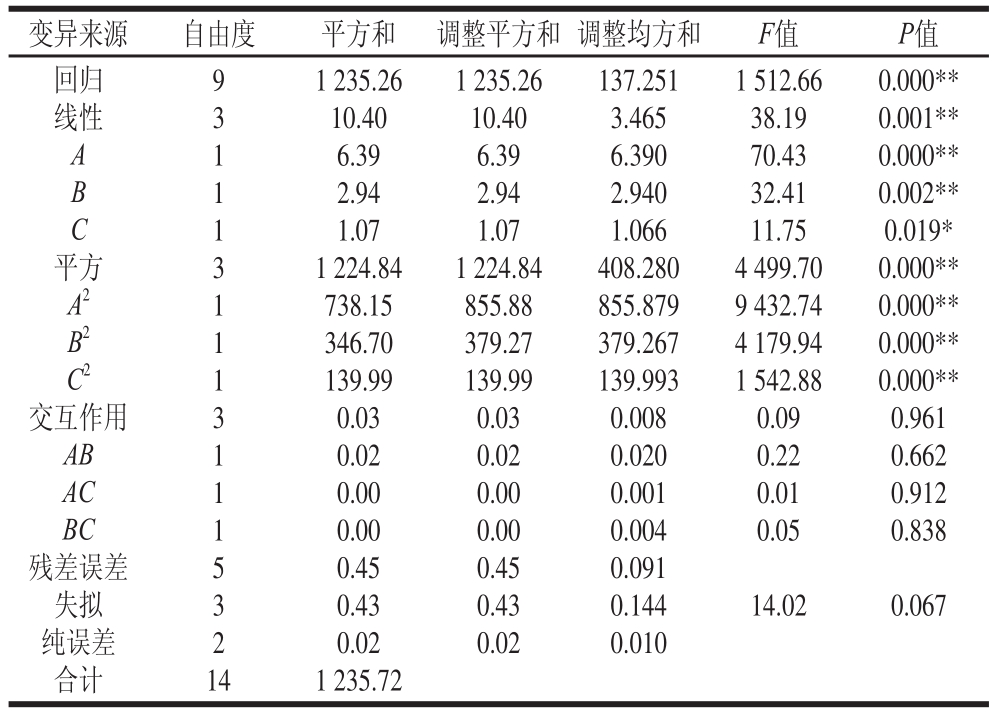
表2为模型方程的回归系数表,其中因素A、B、C 对ACE抑制活性的影响都是极显著的。方程的二次项影响也是极显著的(P<0.01),交互项影响一般(P>0.05),说明响应值的变化较复杂。从表2的回归系数表中可以看出,水解度的调整相关系数R2=99.90%,表3中失拟项P=0.067>0.05,说明二次多
Adj项式回归模型正确,回归效果较好。
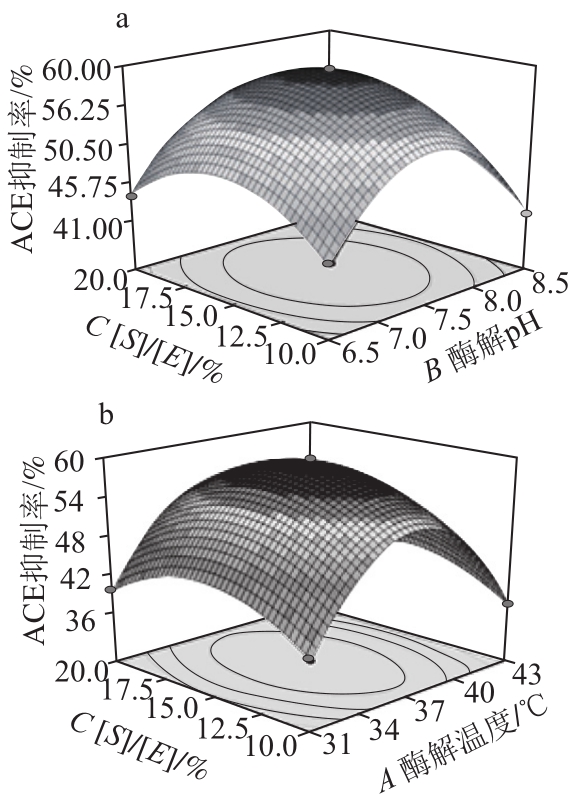

图5 各变量交互作用对ACE抑制活性的响应面图和等高线图
Fig.5 Response surface and contour plots for the effects of three variables on ACE inhibitory activity
图5为各相应变量的响应面曲面和等高线图。各变量的交互作用对ACE抑制活性的影响较复杂。各个具体的试验因素对响应值的影响不是简单的线性关系,而是二次关系[24]。由图5a可知,当温度一定时,在pH 7.0~8.0和[S]/[E]为15%左右时,ACE的抑制率较高,由图5b可知,当pH值一定时,ACE抑制率较好的值落在温度37 ℃左右和[S]/[E]在15%左右的范围内;由图5c可知,当底物与酶的质量比一定时,ACE抑制率较好的值落在pH 7.0~8.0和温度37 ℃的范围内,其中任何两个因素的改变都会引起抑制率的降低。采用Minitab 16.0软件进行分析,可以求得最佳的酶解条件为:温度37 ℃、pH 7.5、[S]/[E]=15%,在此条件下,可得预测值ACE抑制率为59.47%。在此条件下行验证实验,最后得到酶解产物水解度为(6.05±0.36)%,ACE抑制率为(59.54±0.61)%,说明采用响应面法优化得到的酶解工艺条件参数可靠,本实验建立的模型在实践中进行预测是可行的。
通过单因素分析和响应面试验设计,确定了固定化瑞士乳杆菌蛋白酶酶解乳清蛋白的最佳酶解条件为:酶解温度37 ℃、pH 7.5,[S]/[E]=15%,乳清蛋白底物质量浓度6 g/100 mL,酶解时间8 h。在此条件下,理论酶解产物ACE抑制率达到59.47%,经实验验证,酶解产物的水解度为(6.05±0.36)%,ACE抑制率为(59.54±0.61)%,酶解产物经冷冻干燥后为乳白色粉末,有奶香,溶解性良好。本实验对ACE抑制肽的制备做了相对基础的研究,为其大规模投入生产提供理论指导,后续将开展固定化酶解-超滤耦联技术的研究以实现ACE抑制肽的连续制备。
[1]MULLALLY M M, MEISEL H, FITZGERALD R J. Angiotensin-Ⅰ-converting enzyme inhibitory activities of gastric and pancreatic proteinase digests of whey protein[J]. International Dairy Journal, 1997, 7(5): 299-303.
[2]LECLERC P L, GAUTHIER S F, BACHELARDB H, et al. Antihypertensive activity of casein-enriched milk fermented by Lactobacillus helveticus[J]. International Dairy Journal, 2002, 12(12): 995-1004.
[3]陈胜军, 李来好, 曾名勇. 水产品中血管紧张素转换酶抑制肽的研究进展[J]. 南方水产, 2006, 2(5): 69-73.
[4]JUNG K, KIM I H, HAN D. Effect of medicinal plant extracts on forced swimming capacity in mice[J]. Journal of Ethnopharmacology, 2004, 93(10): 75-81.
[5]SUH H J, WHANG J H, BAE S H, et al. Preparation of angiotensinⅠ-converting enzyme inhibitor from corn gluten[J]. Process Biochemistry, 2003, 38(8): 1239-1244.
[6]VALENTINI H, HENTACHELL H. Angiotensin-converting enzyme inhibitors: a clinical toxicological evaluation[J]. Clin Use Germany, 1998, 1(1): 31-34.
[7]姜瞻梅, 田波, 吴刚. 酶解牛乳酪蛋白制备ACE抑制肽的研究[J]. 中国食品学报, 2007, 7(6): 39-43.
[8]刘政, 马丹丹, 孔庆霞. 酶法制备活性肽的讨论[J]. 天津农学院学报, 2005, 12(4): 40-43.
[9]傅绍军, 李微, 朱利民. 瑞士乳酸杆菌摇瓶发酵条件及产酶条件优化[J]. 药物生物技术, 2005, 12(6): 361-365.
[10]郭宇星, 潘道东. 瑞士乳杆菌细胞壁蛋白酶提取研究[J]. 食品科学, 2007, 28(10): 421-424.
[11]郭宇星, 潘道东. 乳酸乳球菌细胞壁蛋白酶的分离纯化[J]. 食品科学, 2008, 29(10): 388-391.
[12]李巧枝, 董淑丽. 生物化学实验技术[M]. 北京: 气象出版社, 2002: 43-44.
[13]孟广震. 固定化微生物细胞的研究与应用[J]. 微生物学通报, 1977(1): 41-45.
[14]王翠翠, 郭宇星, 潘道东. 壳聚糖固定瑞士乳杆菌蛋白酶的条件研究[J]. 食品科学, 2012, 33(3): 110-115.
[15]郭宇星, 潘道东, 王翠翠, 等. 海藻酸钠固定瑞士乳杆菌条件优化[J].食品科学, 2012, 33(5): 188-192.
[16]FERNANDEZ P, PELAEZ C, MARTIN-HERNANDEZ M C. Purification and characterization of the cell wall proteinase of Lactobacillus casein subsp. casein IFPL731 isolated from raw goat’s milk cheese[J]. Journal of Agricultural and Food Chemistry, 1997, 45(9): 3401-3405.
[17]潘道东, 郭宇星. 瑞士乳杆菌蛋白酶水解乳清蛋白制备ACE抑制肽的条件优化[J]. 食品科学, 2009, 30(11): 138-143.
[18]CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[19]ROSALES-HERNONDEZ M C, MENDIETA-WEJEBE J E. Catalytic activity of acetylcholinesterase immobilized on mesoporous molecular sieves[J]. International Journal of Biological Macromolecules, 2007, 40(5): 444-448.
[20]LI Fengyan, YAN Jun, DING Xingxin. Immobilization of papain on cotton fabric by sol-gel method[J]. Enzyme and Microbial Technology, 2007, 40(7): 1692-1697.
[21]BUISSON P, PIERRE A C. Immobilization in quartz fiber felt reinforced silica aerogel improves the activity of Condida rugosa lipase in organic solvents[J]. Journal of Molecular Catalysis B: Enzymatic, 2006, 39(1): 77-82.
[22]杨晓军, 陆剑锋, 林琳. 酶解斑点叉尾鮰内脏制备血管紧张素转化酶抑制产物[J]. 食品科学, 2010, 31(22): 237-241.
[23]CHEN Guanwen, TSAI J, PAN B S. Purification of angiotensinⅠ-converting enzyme inhibitory peptides and antihypertensive effect of milk produced by protease-facilitated lactic fermentation[J]. International Dairy Journal, 2007, 17(6): 641-647.
[24]蔡丽丽, 徐鑫, 刘国艳. 响应曲面法优化小黄鱼ACE抑制肽的酶解条件[J]. 食品科学, 2011, 32(23): 167-171.
ZHOU Huimin1, LIU Chen1, GUO Yuxing1,*, PAN Daodong1,2, ZENG Xiaoqun2, SUN Yangying2
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract: Angiotensin Ⅰ-converting enzyme (ACE) inhibitory peptides from WPC (whey protein concentrate)-80 were prepared by the immobilized proteinase produced by Lactobacillus helveticus. The effects of enzymatic hydrolysis conditions including temperature, pH, substrate to enzyme ([S]/[E]) ratio and hydrolysis time on degree of hydrolysis and ACE inhibitory activity were investigated using single factor method and response surface methodology. The optimum temperature, pH, [S]/[E]ratio and hydrolysis time were found to be 37 ℃, 7.5, 15% and 8 h, respectively. Under these conditions, the degree of hydrolysis was (6.05 ± 0.36)%, and the ACE inhibitory activity of the hydrolysate was (59.54 ± 0.61)%.
Key words: ACE inhibitory peptides; immobilized proteinase of Lactobacillus helveticus; whey prote in; response surface methodology
doi:10.7506/spkx1002-6630-201507012
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2015)07-0061-05
*通信作者:郭宇星(1981—),女,讲师,博士,研究方向为乳品科学。E-mail:guoyuxing1981@163.com
作者简介:周慧敏(1991—),女,硕士研究生,研究方向为乳品科学。E-mail:873093498@qq.com
基金项目:国家自然科学基金青年科学基金项目(31101314);江苏省自然科学基金面上项目(BK2011787);江苏省高校自然科学研究项目(13KJB550013);浙江省自然科学基金项目(LQ12C20003);宁波市科技局自然科学基金项目(2012A610145)
收稿日期:2014-05-25